应用嗜热四膜虫评估苯甲酸钠的生物毒性
2016-08-08潘厚军张銮妫梁慧丽李莹莹王英英石存斌吴淑勤
潘厚军,张銮妫,梁慧丽,李莹莹,王英英,林 强,石存斌,吴淑勤*
(1.中国水产科学研究院 珠江水产研究所,广东 广州 510380;2.农业部渔用药物创制重点实验室,广东 广州510380)
应用嗜热四膜虫评估苯甲酸钠的生物毒性
潘厚军1,2,张銮妫1,2,梁慧丽1,2,李莹莹1,2,王英英1,2,林强1,2,石存斌1,2,吴淑勤*1,2
(1.中国水产科学研究院 珠江水产研究所,广东 广州 510380;2.农业部渔用药物创制重点实验室,广东 广州510380)
应用2株嗜热四膜虫(Tetrahymena thermophila)Cu428.2株和B2086.2株评估了食品防腐剂苯甲酸钠(sodium benzoate,SB)的生物毒性,探讨嗜热四膜虫在食品安全监测中的应用。在SB质量分数为0%,0.01%,0.05%,0.1%,0.25%,0.5%,作用6 h,观察嗜热四膜虫的细胞形态和运动情况。结果表明:SB质量分数为0.01%和0.05%时,两株嗜热四膜虫在Neff培养基中的活动均明显降低,细胞形态发生皱缩,细胞变小;SB质量分数为0.1%~0.5%时,两株嗜热四膜虫细胞形态明显由椭圆形变成圆形,细胞膜出现孔洞,甚至出现破裂死亡细胞,质量分数越高,细胞膜损伤越大,凋亡细胞数量越多。嗜热四膜虫培养于Neff培养基中,分别添加终质量分数为0%,0.000 1%,0.001%,0.005%,0.01%,0.05%的SB,测定添加SB后嗜热四膜虫的生长曲线及SB作用24 h的SOD活力,评估SB对嗜热四膜虫的种群数量和SOD活力的影响。结果表明:随着SB质量分数的增加、嗜热四膜虫的种群增长速度降低,而0.05%SB对嗜热四膜虫具有杀灭作用,但0.000 1%SB对嗜热四膜虫种群的增长有一定的促进作用。嗜热四膜虫的SOD活力基本上随着SB质量分数的增加而降低,然而低质量分数的SB可使SOD活力在一定时间内增强。
嗜热四膜虫;苯甲酸钠;生物毒性;SOD活力
苯甲酸钠(sodium benzoate,SB)加于碳酸饮料、泡菜、酱油、食醋等食品中,有防止变质发酸、延长保质期的效果。多年来世界上大多数国家允许用SB作为食品防腐剂,SB的最大允许质量分数在0.15%~0.25%之间[1],美国规定SB的最大允许量为0.1%;中国2014年的国家标准《GB2760-20114食品安全国家标准 食品添加剂使用标准》,SB可在蜜饯凉果、调味料、胶基糖果等中使用、根据食品种类的不同,最大允许为0.5~2.0 g/kg(以苯甲酸计,相当于0.05%~0.20%[2]。
近年来,随着人们对自身健康和食品安全关注度的提高,食品添加剂SB是否安全也受到了人们的质疑。过去的研究认为SB无毒,但近年的研究表明,SB能致小鼠骨髓细胞变性[4]、精子畸形;大鼠白细胞减少、肝细胞明显损害;血清白蛋白构象变化,血清白蛋白损伤[5];小鼠淋巴细胞形态、细胞膜发生明显变化;碳酸饮料中的SB与其他人工色素共同食用可能会加剧儿童多动症[6]。对SB毒性的顾虑使得它的应用受限,有些国家如日本已经停止生产SB,并对它的使用作出限制。我国《GB2760-2014食品安全国家标准 食品添加剂使用标准》规定:在肉制品中,食品防腐剂苯甲酸和苯甲酸钠不得使用[2]。
嗜热四膜虫(Tetrahymena thermophila),早期也称为 梨型四膜虫的一 个品种(Tetrahymena pyriformi,variety 1)[7],作为单细胞、可运动的、在自然水体中常见、可大量人工纯化培养、个体相对大的纤毛类原生动物[7](约50 μm长,20 μm宽),不仅世代周期短(1.5~3 h繁殖一代),而且对许多毒物的响应比其他高等生物更为敏感、直接,是较理想的生物毒性试验对象。王正方等[8]研究了三聚氰胺对嗜热四膜虫的生长和交配的影响,结果表明三聚氰胺可以对四膜虫细胞产生破坏作用,认为四膜虫生物测定法相对于动物实验具有耗时短、成本低、操作简便的优势,在风险性评估实验中可成为一种优良的替代模型。
作者选用两株不同交配型的嗜热四膜虫Cu428.2株和B2086.2株,通过研究苯甲酸钠(SB)对嗜热四膜虫种群数量、细胞形态、超氧化物歧化酶活性的影响,评估SB对嗜热四膜虫的生物毒性,分析SB作为食品添加剂的安全性,同时为嗜热四膜虫在食品安全监测中的应用提供依据。
1材料与方法
1.1材料与试剂
嗜热四膜虫Cu428.2株和B2086.2株:美国康奈尔大学赠送;Neff培养基:酵母提取物2.5 g,多价蛋白胨2.5 g,D-葡萄糖5.0 g,0.9 g/dL三氯化铁存储液1 mL,蒸馏水1 000 mL,121℃灭菌30 min,4℃保存;苯甲酸钠:分析纯,上海穗试公司广州化学试剂厂;超氧化物歧化酶 (SOD)WST-1法测定试剂盒:南京建成科技有限公司。
1.2仪器与设备
Elipse Ti-S倒置显微镜:日本Nikon公司;ZWY-200D恒温培养振荡器:上海智城分析仪器制造有限公司;IC 1000 Countstar自动细胞计数仪:上海睿钰生物科技有限公司;Infinite M200 PRO多功能酶标仪:瑞士Tecan公司。
1.3方法
1.3.1苯甲酸钠作用下,嗜热四膜虫形态和运动的观察嗜热四膜虫Cu428.2株和B2086.2株以5%的接种体积分数接种于200 mL Neff培养基中,30℃、150 r/min摇床培养,取对数生长期、经IC 1000 Countstar自动细胞计数仪计数、用Neff培养基稀释调整为20×104个/mL的四膜虫细胞500 μL,接种于10 mL已灭菌的Neff培养基,加入终质量分数为0%、0.01%、0.05%、0.1%、0.25%、0.5%的SB,于30℃、150 r/min的摇床中培养6 h,取样 200 μL于24孔板,在倒置显微镜下观察细胞形态和运动情况。
1.3.2苯甲酸钠对嗜热四膜虫种群数量增长的影响参考黄卫红[10]等的检测方法,取对数生长期、且密度为20×104个/mL的四膜虫细胞10 mL,接种于200 mL已灭菌的Neff培养基,30℃、150 r/min摇床培养24 h,四膜虫进入对数期,然后分别加入一定体积的10g/L SB(溶于Neff培养基),使培养体系中SB的质量分数分别为0%、0.000 1%、0.001%、0.005%、0.01%、0.05%,每个质量分数设置3个重复。于30℃、150 r/min摇床培养,0、6、24、30、48、72 h取样,之后间隔24 h,即96、120、144…216 h取样,对四膜虫进行计数。每个时间点各取样3个,计算平均值。两株四膜虫均进行3次重复试验。以取样时间为横座标,四膜虫个数为纵座标,绘制四膜虫的生长曲线图,分析SB对嗜热四膜虫生长的影响。
1.3.3在苯甲酸钠的作用下,嗜热四膜虫超氧化物歧化酶(SOD)活力的测定采用SOD WST-1法测定试剂盒,参考试剂盒说明书中培养细胞SOD的测定方法稍加修改。取对数生长期、且密度为20×104个/mL的四膜虫细胞10 mL,接种于200 mL已灭菌的 Neff培养基,加入终浓度为 0%,0.000 1%,0.001%,0.005%,0.01%,0.05%的SB,30℃、150 r/min摇床培养6 h,以10 000 r/min离心5 min,倒去上清液,加200 μL生理盐水,用玻璃匀浆器研磨3~5 min,取研磨充分的样品20 μL,加入酶工作液20 μL,底物应用液200 μL,混匀,37℃孵育20 min,450 nm处酶标仪读数。同时设置对照孔(不加样本溶液,用双蒸馏水代替),对照空白孔(不加样本溶液、酶工作液,用双蒸水、酶稀释液代替),测定空白孔(不加酶工作液,用酶稀释液代替)。而后按照试剂盒提供的方法进行SOD活力的计算。SOD酶活性以单位蛋白酶活性(U/mg)表示,待测样本蛋白质浓度用考马斯亮兰法测定。
1.4数据处理
实验结果采用Excel 2003和SPSS 18.0求出平均值±标准偏差(Mean±SD),并进行单因素方差分析(ANOVA),各试验组与对照组之间的两两比较采用最小显著差数法(LSD),取显著性水平为 0.05(p<0.05)。每个试验重复3次。
2结果与分析
2.1苯甲酸钠作用下,嗜热四膜虫形态的变化
在24孔板中,倒置显微镜下观察嗜热四膜虫Cu428.2和B2086.2在 0.01%~0.5%SB的Neff培养基中作用6 h后,与未加SB的对照组比较,观察细胞形态变化。
未加SB的对照组嗜热四膜虫细胞呈椭圆长梨状,在Neff培养基中,快速泳动。在SB中,两株嗜热四膜虫细胞均出现不同程度的损伤,SB质量分数越高对嗜热四膜虫的毒性越大,细胞损伤越大,甚至导致细胞直接破裂致死。Cu428.2株(图1)在SB质量分数为0.01%时其结构无明显变化,但在培养基中的运动速率比对照组明显下降。在0.05%时,约30%细胞发生了皱缩,运动速率进一步下降。在0.1%~0.5%SB中,Cu428.2株细胞停止了游动和纤毛的摆动,只能见无规则的布朗运动;且细胞明显变圆且发生了不同程度的损害,细胞内部结构模糊,严重时细胞破裂。B2086.2株(图2)在SB质量分数为0.01%和0.05%时,约10%的细胞形态和大小发生了轻微的变化,其运动速率较对照组有所下降。当SB质量分数为0.1%时,约80%细胞明显变小皱缩,质量分数为0.25%和0.5%时,细胞变圆破裂,活力丧失。SB质量分数越高,对嗜热四膜虫的结构损害越大。表明SB已经透过嗜热四膜虫的细胞膜作用于其细胞内容物,使其失去原有的结构和功能。

图1 嗜热四膜虫Cu428.2株在不同质量分数SB中作用6 h的细胞形态Fig.1 Cell morphology of Tetrahymena thermophila Cu428.2 in different concentration of SB
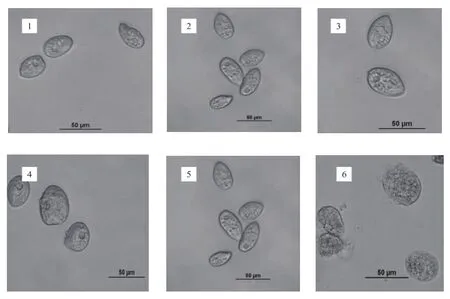
图2 嗜热四膜虫B2086.2株在不同质量分数SB中作用6 h的细胞形态Fig.2 Cell morphology of Tetrahymena thermophila B2086.2 in different concentration of SB
2.2苯甲酸钠对嗜热四膜虫Cu428.2株和B2086.2株数量的影响
嗜热四膜虫Cu428.2株和B2086.2株在0%,0.000 1%,0.001%,0.005%,0.01%,0.05%SB中的Neff培养基生长情况见图3-4。SB质量分数为0.05%时,对这两株嗜热四膜虫均有一定的抑制甚至杀灭作用,其他质量分数对种群数量无杀灭作用。虽然B2086.2株在0.05%种群数量在短时间内有所增长,由6h的0.53×104个/mL增长到24 h的2.33×104个/mL,但随后下降,144 h死亡;在同样质量分数和时间内,Cu428.2株种群数量无增长,且明显减少,72 h死亡。其中0.001%、0.005%和0.01% SB,两株嗜热四膜虫的种群增长速度低于对照组,且衰亡时间比对照组的短。而0.000 1%SB组,在78~144 h间,Cu428.2株和B2086.2株增长速度均超过对照组,其他时间与对照组相比无显著性差异。结果表明:一定质量分数的SB对嗜热四膜虫的生长繁殖有一定的抑制甚至杀灭作用,而低质量分数的SB对四膜虫种群的增长有一定的促进作用。
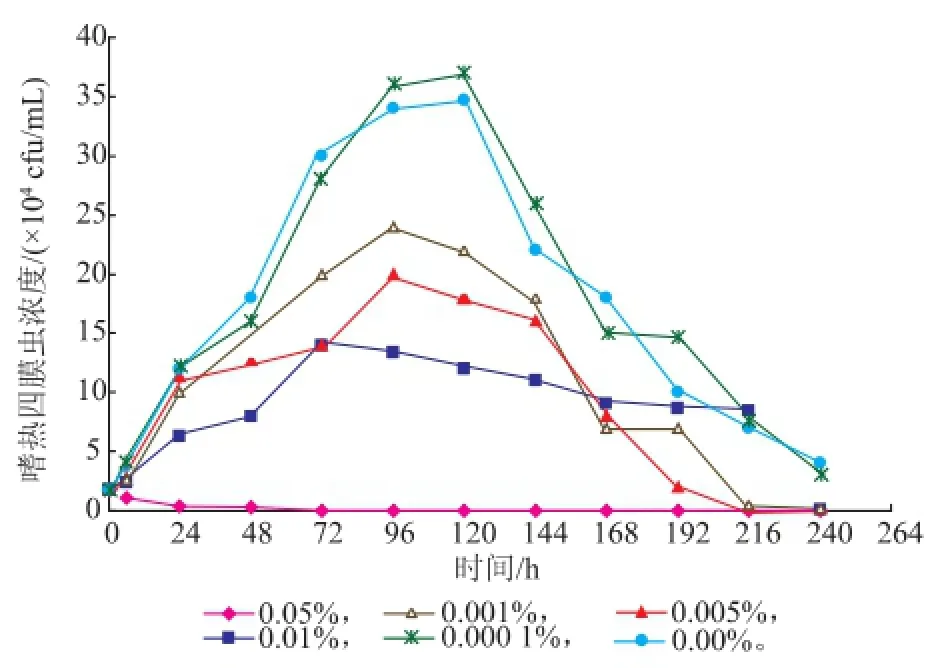
图3 嗜热四膜虫Cu428.2株在不同质量分数的苯甲酸钠下的生长曲线Fig.3 Growth curve of Tetrahymena thermophila Cu428.2 in different concentration of SB
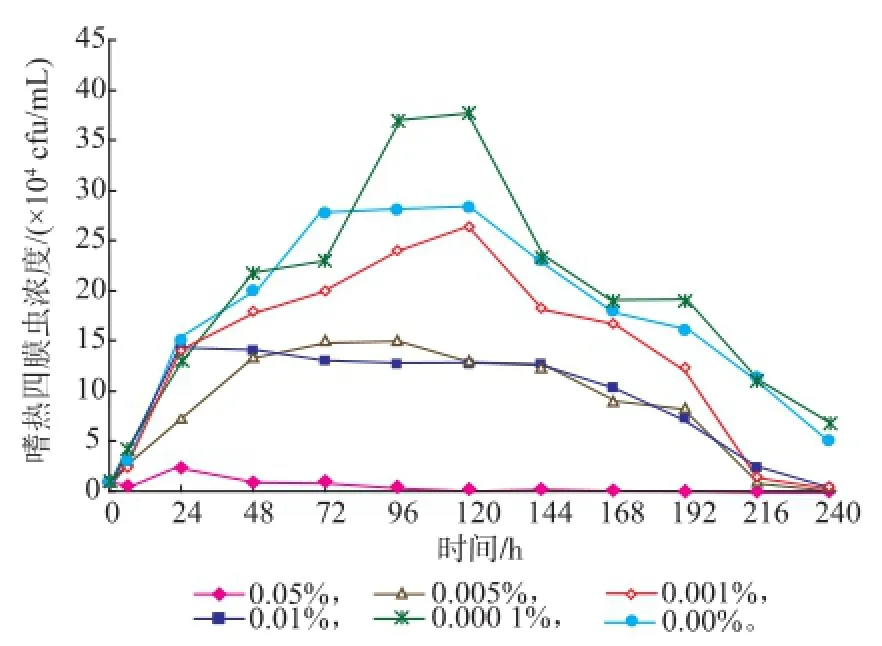
图4 嗜热四膜虫B2086.2株在不同质量分数的苯甲酸钠下的生长曲线Fig.4 Growth curve of Tetrahymena thermophila B2086.2 in different concentration of SB
2.3苯甲酸钠对嗜热四膜虫超氧化物歧化酶(SOD)的影响
嗜热四膜虫Cu428.2株和B2086.2株在各质量分数组SB中SOD活力结果见图3-4。随着SB质量分数的增加,SOD活力均为先增加后降低,然而两株嗜热四膜虫SOD活力最高的浓度组有所差异,Cu428.2株达到最高的质量分数为 0.005%,而B2086.2株达到最高的质量分数组为 0.001%。Cu428.2株的SOD活力最高组比对照组多95.44%,B2086.2株的 SOD活力最高组比对照多 38%,Cu428.2株0.01%和0.05%与对照组无显著性差异,而B2086.2株0.01%和0.05%与对照组SOD活力显著降低。
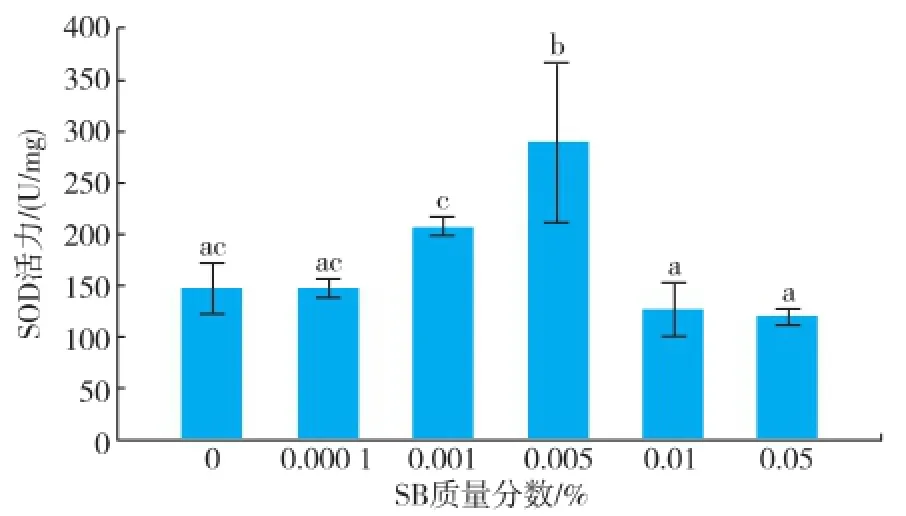
图3 不同质量分数苯甲酸钠下温育24 h后四膜虫Cu428.2的SOD活力Fig.3 SOD activity of Tetrahymena thermophila Cu428.2 in different concentrations of sodium benzoate after incubation 24 h
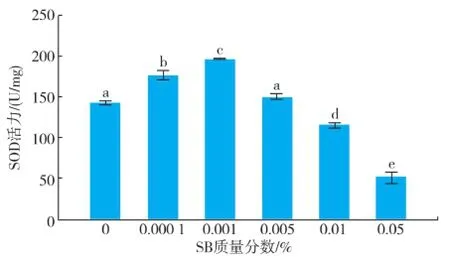
图4 不同质量分数苯甲酸钠孵育24 h后四膜虫B2086.2 的SOD活力Fig.4 SOD activity of Tetrahymena thermophila B2086.2 in different concentrations of sodium benzoate after incubation 24 h
3结语
3.1采用嗜热四膜虫评估苯甲酸钠生物毒性的可行性
苯甲酸钠对污染食品细菌的杀灭、抑制效应是其防腐作用的基础,但研究表明其对其他动植物细胞亦具有损伤作用。前人如吕娜等[11]进行了SB的毒理学研究,认为SB可引起小鼠骨髓细胞染色体断裂[4]和精子畸形[12];陈刚等[13]证明了SB对蚕豆根尖细胞有明显的遗传毒性;Khasnavis等[14]认为SB能上调在星形胶质细胞和神经元中的主导柏金森病的DJ-1蛋白(缺乏DJ-1蛋白的突变体能引起家族式的柏金森病);刘俊等[15]进行的苯甲酸钠对草履虫的急性毒性作用。作者应用嗜热四膜虫评估SB的生物毒性,结果表明SB质量分数越高,对嗜热四膜虫的毒性越大。在国际和国内食品卫生标准中,0.1% 是果汁、酱油等食品中准许使用的用量[2],本试验结果表明,0.1%SB对嗜热四膜虫Cu428.2株具有杀灭作用,引起约80%的B2086.2株嗜热四膜虫细胞皱缩。刘俊等[15]进行的苯甲酸钠对草履虫的急性毒性作用,1 h最小致死剂量为8 g/L(相当于0.8%)。刘俊等[15]和本研究结果分别表明:SB对单细胞原生动物草履虫和嗜热四膜虫毒性较大。结果虽有差异,但在考虑物种的不同、作用时间、培养液等不同因素的情况下,具有可比性。
在高质量分数下,SB对嗜热四膜虫具有可视的毒性效应。在倒置显微镜下,可清楚地观察到随着SB质量分数的增加,嗜热四膜虫运动减少甚至停止、形态发生改变甚至破裂,质量分数越大,细胞损伤越大。但在低质量分数的SB中(SB质量分数小于0.05%)基本上观察不到改变,这并不排除SB对嗜热四膜虫细胞有肉眼观察不到的影响,有待借助于更精密的仪器如电子显微镜、流式细胞仪等进行分析。胡明铅等[1]采用原子力显微镜分析了SB对小鼠淋巴细胞形态及膜结构的影响,发现在SB作用下,淋巴细胞膜表面粗糙度增加,甚至整体细胞破坏性断裂,对其细胞结构造成不可逆转的损坏。作者和胡明铅等[1]分别试验了SB对嗜热四膜虫和小鼠淋巴细胞的影响,采用的细胞分别属于原生动物和哺乳动物细胞,在本研究中,SB对嗜热四膜虫的作用与胡明铅等实验的SB对小鼠淋巴细胞的结果相似。
作者还探讨了SD对嗜热四膜虫超氧化物歧化酶(SOD)的影响。SOD是生物体内极其重要的抗氧化酶,能清除超氧阴离子自由基(O2-),O2-具有非常大的破坏作用,能够引起细胞的死亡和器官的衰老,SOD被认为是防卫O2-伤害的第一步,它可以将O2-转化为毒性较低的H2O2,并在其他酶的作用下最终转化为H2O和O2,保护细胞免受损伤[16]。姚莹等[17]研究纳米ZnO对嗜热四膜虫的生态毒性,认为SOD活力下降,则对超氧阴离子自由基的清除能力下降,SOD活性降低是纳米ZnO对嗜热四膜虫产生毒性的重要原因。研究结果显示,SB质量分数为0.01%及0.05%组,嗜热四膜虫B2086.2株SOD活力有一定的抑制作用,但Cu 428.2株SOD活力无显著的抑制作用,表明SB对嗜热四膜虫B2086.2 株SOD活力影响更大。在低质量分数的SB作用下,SOD活性比对照组高,分析原因是因为低质量分数的SB对嗜热四膜虫的应激作用,在短时间内激发了细胞的SOD酶活性。当SB达到一定的质量分数,则SOD活性降低。与李双菁等[18]pb2+对水丝蚓,王朝晖等[19]氯氰菊酯对斜生栅藻的作用,吴红松等[20]检测三聚氰胺对鲤鱼组织的影响,SOD活性结果均为低质量分数促进、高质量分数抑制相似。
综上所述,在高质量分数下,SB对嗜热四膜虫细胞具有显微镜下可视的毒性效应,高于0.001%质量分数的SB对嗜热四膜虫的种群生长具有显著影响,SB质量分数为0.01%及0.05%组对嗜热四膜虫B2086.2株SOD活力有一定的抑制作用,实验结果与前人采用小鼠骨髓细胞、淋巴细胞、草履虫等具有一定的可比性,表明采用嗜热四膜虫评估SB的生物毒性是可行的。
3.2应用嗜热四膜虫建立SD生物毒性评估体系的前景
嗜热四膜虫遗传背景清晰,大核基因组已全部获悉[22],为研究遗传代谢提供了基础,不仅在细胞和分子生物学上应用获得重要成果,在形态结构学、行为学、生态毒理方面也获得了大量研究数据。作为一种淡水中常见的单细胞真核原生动物,实验室培养成熟、经济,具有细胞大、利于观察、生化指标研究成熟等许多优良的特征,使其成为环境和药学研究领域毒性实验的理想材料[23]。目前使用嗜热四膜虫为材料研究的对象包括六氯笨、含氮杂环化合物、有机磷杀虫剂、重金属、纳米ZnO等大量特定单一成份的有机物、无机物[10,17,24],及江河水质等混合物[25-26],嗜热四膜虫在食品卫生安全、药物使用安全、生态环境污染中作为检测生物,发挥或即将发挥重要作用。本研究结果表明,采用嗜热四膜虫进行SD毒性的评估,可从细胞形态变化、种群生长影响、SOD活性变化等多方面进行,与采用小鼠淋巴细胞相比,生物毒性评估的结果具有可比性,而操作更为经济、简便。
嗜热四膜虫具有不同的交配型,1953年Nanney教授首次对嗜热四膜虫的交配型进行描述,鉴定出了7种交配型[27]。不同交配型的嗜热四膜虫细胞可以进行有性繁殖,本研究所用的Cu428.2和B2086.2属于两株不同交配型的虫株,采用两株不同交配型嗜热四膜虫进行研究,有利于更多了解SB作用的普遍性,为将来研究SB对嗜热四膜虫有性繁殖的影响提供研究基础。SB质量分数0.1%作用6 h后,两株嗜热四膜虫细胞均发生了明显的形态学变化,0.05%SB对两株嗜热四膜虫均具有抑制甚至杀灭作用,但B2086.2株更明显,SOD活力的变化因而评估SB对SOD活力的影响,选择嗜热四膜虫B2086.2株更为敏感。
本研究表明:苯甲酸钠对嗜热四膜虫具有较明显的生物毒性,体现在细胞形态的变化和种群生长和SOD的影响。与胡明铅等[1]应用原子力显微镜,从可视化角度分析的苯甲酸钠对小鼠淋巴细胞的膜形态和超微结构的影响相似。吕娜[4]、陈刚等[13]分别进行了小鼠骨髓细胞和蚕豆根尖细胞的微核试验,从染色体变化的角度分析SD对动植物细胞的影响。作者结果与胡明铅等SB对小鼠淋巴细胞的形态改变作用相似,而对染色体的作用仍将进行进一步研究。苯甲酸钠(化学式:C6H5COONa)是苯甲酸的钠盐,亲油性较大,易穿透细胞膜进入细胞内。相关研究显示,除了SOD影响胞内代谢外,还有过氧化物酶[20]、脱氢酶、谷草转氨酶和谷氨酸脱氢酶等[21],SB对嗜热四膜虫这些酶活性是否有影响,仍待进一步试验探讨。
[1]胡明铅,王炯坤,蔡继业,等.应用原子力显微镜分析苯甲酸钠生物毒性[J].生物工程学报,2008,24(8):1428-1432. HU Mingqian,WANG Jiongkun,CAI Jiye,et al.Analysis of sodium benzoate biotoxicity by atomic force microscope[J]. Chinese Journal of Biotechnology,2008,24(8):1428-1432.(in Chinese)
[2]中华人民共和国国家标准GB2760-2014.食品安全国家标准食品添加剂使用标准[S].
[3]王思文,巩江,高昂,等.防腐剂苯甲酸钠的药理及毒理学研究[J].安徽农业科学报,2010,38(30):16724-16846. WANG Siwen,GONG Jiang,GAO Ang,et al.Pharmaco-toxicological study of preservative:sodium benzoate[J].Journal of Anhui Agri Sci,2010,38(30):16724-16846.(in Chinese)
[4]吕娜,沈明浩.苯甲酸钠对小鼠骨髓细胞的致突变作用研究[J].吉林农业大学学报,2006,28(4):466-468. Lu Na,SHEN Minghao.Research on mutagenicity of sodium benzoate in born marrow cells[J].Journal of Jilin Agricultural University,2006,28(4):466-468.(in Chinese)
[5]王亚俐,王海芳.光谱法研究苯甲酸钠与牛血清白蛋白的作用[J].北京大学学报(自然科学版),2002,38(2):159-163. WANGYali,WANG Haifang.Interaction of bovine serum albumin with benzoate[J]. Universitatis Pekinensis:Acta Scientiarum Naturalium,2002,38(2):159-163.(in Chinese)
[6]Mccann D,Barrett A,Cooper A,et al.Food additives and hyperactice behaviour in 3-year-old and 8/9-year-old children in the commuity:a randomized double-blinded,placebo-controlled trival[J]. Lancet,2007,370(9598):1560-1567.
[7]Asai D J,Forney J D,editors.Tetrahymena thermophila,Methods in Cell Biology[M].San Diego:Academic Press,2000:4,32.
[8]Wang Z F,Qi X H,Zou M Q,et al.Cytotoxicity assessment of melamine using the ciliated protozoan Tetrahymena pyriformis[J]. Asian Journal of Ecotoxicolog,2009,4(1):35-39.
[9]Júlia L,László K,Effects of the aquatic contaminant human pharmaceuticals and their mixtures on the proliferation and migratory responses of the bioindicator freshwater ciliate Tetrahymena[J]. Chemosphere,2012,89(5):592-601.
[10]黄卫红,赵天珍,赵柳青,等.六氯苯对原生动物四膜虫的生物毒性实验室研究[J].环境科学与技术报,2006,12(29):11-13. HUANG Weihong,ZHAO Tianzhen,ZHAO Liuqing,et al.Biological toxicity of hexachlorobenzene to the protozoa Tetrahymena thermophila BF5[J].Environmental Science and Technology,2006,12(29):11-13.(in Chinese)
[11]吕娜.食品防腐剂苯甲酸钠的急性毒性及致畸性试验[J].毒理学杂志,2006,20(5):326-327. Lu Na.Study on acute toxicity and Malformation test of sodium benzoate,a kind of food preservative[J].J Toxicol,2006,20(5):326-327.(in Chinese)
[12]吕娜,沈明浩.食品防腐剂苯甲酸钠的蓄积毒性及精子毒性研究[J].毒理学杂志,2011,25(3):241-242. Lu Na,SHEN Minghao.Study on accumulation toxicity and sperm toxicity of sodium benzoate,a kind of food preservative[J].J Toxicol,2011,25(3):241-242.(in Chinese)
[13]陈刚,高鉴,韩燕,等.防腐剂苯甲酸钠的致突变作用研究[J].癌变·畸变·突变,2003,15(3):178-179. CHEN Gang,GAO Jian,HAN Yan,et al.Study on mutagenicity of sodium benzoate in preservative[J].Carcinogenesis,Teratogenesis and Mutagenesis,2003,15(3):178-179.(in Chinese)
[14]Saurabh K,Kalipada P,Sodium Benzoate.A metabolite of cinnamon and a food additive,upregulates neuroprotective parkinson disease protein DJ-1 in Astrocytes and Neurons[J].J Neuroimmune Pharmacol,2012,7(2):424-435.
[15]刘俊,李霖,张晓燕.苯甲酸钠对草履虫的毒性作用研究[J].扬州职业大学学报,2011,15(4):45-48. LIU Jun,LI Lin,ZHANG Xiaoyan.Research on the toxicity of sodium benzoate against paramecium[J].Journal of Yangzhou Polytechnic College,2011,15(4):45-48.(in Chinese)
[16]Farber J L.Mechisms of cell injury by activated oxygen.[J].Environmental Health Perspectives,1994,102(10):17-24.
[17]姚莹,杨柳燕,陈军,等.纳米ZnO对嗜热四膜虫的生态毒性研究[J].环境科学研究,2009,7(7):833-837. YAO Ying,YANG Liuyan,CHEN Jun,et al.Ecological toxicity of Nano-ZnO on Tetrahymena thermophila[J].Research of Environmental Sciences,2009,22(7):833-837.(in Chinese)
[18]赵双菁,李艳秋,柳郁滨,等.Pb2+对水丝蚓的急性毒性及超氧化物歧化酶活性的影响[J].中国农学通报,2012,28(8):87-89. ZHAO Shuanjing,LI Yanqiu,LIU Yubin,et al.Effect of Pb2+on Limnodilus claparedianu acute toxicity and superoxide dismutase activity[J].Chinese Agricultural Science Bulletin,2012,28(8):87-89.(in Chinese)
[19]王朝晖,谢骏,姜珊,等.商品氯氰菊酯对斜生栅藻生长的影响及其生理生化效应[J].中国环境科学,2012,32(4):659-665. WANG Zhaohui,XIE Jun,JIANG Shan,et al.Effects of commercial cypermethrin on the growth of Scenedesmus obliquus and its physiochemical responses[J].China Environmental Science,2012,32(4):659-665.(in Chinese)
[20]吴红松.三聚氰胺对鲤鱼组织SOD、POD和MDA含量的影响[J].动物医学进展,2012,33(5):74-77. WU Hongsong.Effects of melamine on activities of superoxide dismutase peroxidase and content of maleic dialdehyde in Cyprinus carpio[J].Progress in Veternary Medicine,2012,33(5):74-77.(in Chinese)
[21]叶寒青,杨祥良,徐辉碧.梨形四膜虫在环境毒理学研究中的应用[J].生物学杂志,2001,10(5):31-33. YE Hanqing,YANG Xiangliang,XU Bihui.Application of Tetrahymena pyriformis in environtoxicology[J].Journal of Biology,2001,18(5):31-33.(in Chinese)
[22]Eisen J A,Coyne R S,Wu M,et al.Macronuclear genome sequence of the ciliate Tetrahymena thermophila,a model eukaryote [J].PLoS Biology,2006,4(9):1620-1642.
[23]缪炜.原生动物四膜虫“小材”有“大用”[J].生物学通报,2010,45(12):1-5. MIU Wei.Tetrahymena thermophila,a kind of protozoan,the little material is very useful[J].Bulletin of Biology,2010,45(12):1-5.(in Chinese)
[24]李伟,杨桂文.四膜虫在科研上的应用研究进展[J].高校理科研究,2011,111(8):126-127. LIWei,YANGGuiwen.ProgressofapplicationofTetrahymena thermophile inscientificresearch[J]. University Science Research:Science and Technology Information,2011,111(8):126-127.(in Chinese)
[25]张玉军,王清路,孔浩.淄博市孝妇河不同区段水质对四膜虫有性生殖的影响[J].安徽农学通报,2010,16(1):58-59,216. ZHANG Yujun,WANG Qinglu,KONG Hao.Sexual reproduction influence on different section water of Tetrahymena thermophile of Xiaofu-river in Zibo city[J].Anhui Agri Sci Bull,2010,16(11):58-59,216.(in Chinese)
[26]马正学,孙小萍.用四膜虫评价黄河兰州段水质的研究[J].西北师范大学学报(自然科学版),1997,33(1):50-53. MA Zhengxue,SUN Xiaoping.Water quality assessment of Lanzhou reaches of the Yellow River by means of Tetrahymena shanghaiensis[J].Journal of Northwest Normal University:Nature Science,1997,33(1):50-53.(in Chinese)
[27]Nanney D L,Caughey P A.Mating type determination in Tetrahymena pyriformis[J].Proc Natl Acad Sci U S A,1953,39:1057-1063.
Application Tetrahymena thermophila for Assessment Biotoxicity of Sodium Benzoate
PAN Houjun1,2,ZHANG Luangui1,2,LIANG Huili1,2,LI Yingying1,2,WANG Yingying1,2,LIN Qiang1,2,SHI Cunbin1,2,WU Shuqin1,2*
(1.Pearl River Fisheries Research Institute of Chinese Academy of Fishery Sciences,Guangzhou 510380,China;2.Key Laboratory of Fishery Drug Development,Ministry of Agriculture,Guangzhou 510380,China)
For investigation the application of protozoan Tetrahymena thermophila on food safety detection,two strains of protozoan T.thermophila Cu428.2 and B2086.2 were used as substrate tostudy the biotoxicity of food preservative sodium benzoate(SB).Effect of SB on T.thermophila was assessed from changes in cell shape,movement style,population growth and superoxide dismutase (SOD)activity after adding SB to the culture of T.thermophila in Neff medium.Cell morphology and movement of T.thermophila were observed under inverted microscope at 6 h after adding 0%,0.01%,0.05%,0.1%,0.25%,0.5%SB to the culture.The results showed that in 0.01%and 0.05% SB,both strains of T.thermophila cells became shrunken and smaller,the speed of cell movement in the media was significantly slower than the control group.While in 0.1%~0.5%SB,cells morphology turned round from oval,holes appeared in the cell membrane,rupture and death cells were found.The higher the concentration of SB was,the greater damage of the cell membrane and the more the apoptotic cells appeared.Population growth curve and 24 h SOD activity of the two strains of T.thermophila cultured in Neff medium were determined in 0.000 1%,0.001%,0.005%,0.01%,0.05%SB compared to the control group.The results suggested with the increase of SB concentration,population growth rate of T.thermophila decreased and 0.05%SB even killed the original seeded cells,however 0.000 1%SB promoted the population growth.While as the SB concentration increased,the activity of T.thermophila SOD basically decreased,however,lower concentration of SB could enhanced the activity of SOD in a certain period of time.
Tetrahymena thermophila,sodium benzoate,biotoxicity,SOD activity
TS 207
A
1673—1689(2016)05—0517—08
2014-09-05
农业部引进国际先进农业科学技术948项目(2011-Z11;2008-G4),广东省2013年鱼病防治专项;广东医学院科研基金面上培育项目(M2014015)。
潘厚军(1968—),女,湖南宁乡人,农学硕士,研究员,主要从事水产动物疾病方面的研究。E-mail:phj001@126.com
*
吴淑勤(1956—),女,福建厦门人,研究员,博士研究生导师,主要从事水产动物疾病与水生实验动物方面的研究。E-mail:gzwushuqin@163.com
