产酸克雷伯氏菌基因组文库的构建及鉴定
2016-08-08江绍锋黄金清于晓宇李云飞陆祖军
江绍锋,黄金清,于晓宇,李云飞,陆祖军
(1.广西师范大学生命科学学院,广西桂林541006;2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541006;3.华南农业大学农学院,广东广州510462)
产酸克雷伯氏菌基因组文库的构建及鉴定
江绍锋1,2,3,黄金清1,2,于晓宇1,2,李云飞1,2,陆祖军1,2
(1.广西师范大学生命科学学院,广西桂林541006;2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541006;3.华南农业大学农学院,广东广州510462)
摘要:为了给基因功能研究提供基础,以pWEBTM质粒构建产酸克雷伯氏菌KO108基因组文库,克隆数目为1 329个。通过EcoR Ⅰ酶切分析随机挑取的20个文库克隆的重组质粒,结果显示所有质粒均有8.2 kb载体条带同时含有外源DNA,且外源DNA的带型并不相同,这表明所构建的KO108基因组文库中插入的外源DNA随机性较好。分析外源DNA电泳条带的大小,结果显示克隆的外源DNA片段最小约为25 kb,最大约为50 kb,平均大小估算为40 kb,文库克隆容量约52 Mb,证明该基因组文库包含基因组任意一个基因的概率为99.8%,是KO108基因组覆盖率的5倍。该文库的构建为产酸克雷伯氏菌功能基因克隆和比较基因组学研究奠定了基础。
关键词:产酸克雷伯氏菌;基因组文库;pWEBTM质粒;覆盖率;库容
0引言
产酸克雷伯氏菌Klebsiella oxytoca属于克雷伯氏菌属,为革兰氏阴性杆菌。它不仅能自生固氮,而且不少菌株具有高效的2,3-丁二醇合成特性而成为重要的工业菌株[1-2]。分离和鉴定生产2,3-丁二醇性能最佳的工业用菌株的工作仍在不断进行[3]。该菌的耐氧产氢特性逐渐被人们重视[4],另外其有望成为降解少见工业污染物的环保用菌株[5]。产酸克雷伯氏菌与植物根系联合固氮、促进植物生长及增强植物抗性的特性,在农林业领域也得到应用[6]。本实验室从桉树林土壤分离筛选到一株高固氮酶活性的产酸克雷伯氏菌KO108,通过纸片扩散法发现其对多粘菌素、青霉素G、四环素、红霉素耐药[7]。我们将对该菌株的固氮、代谢和免疫等相关功能基因作深入研究。
基因组文库是指含有某种生物体全部基因的随机片段的重组DNA的克隆集合[8]。构建重要物种的基因组文库是物种全部遗传基因组信息得到长期有效保存的重要途径。基因组文库构建后的文库质量检测至关重要,文库质量参数包括克隆数目、插入DNA片段的平均大小、载体的空载率、对基因组的覆盖率等[8]。本研究用大小为8.2kbpWEBTM的克隆载体,以Sma Ⅰ在单一位点切割线性化并去磷酸化和纯化处理,可直接高效连接大片段进行克隆,该载体具有如下特性:(1)在Sma Ⅰ位点两侧有成对的BamHⅠ、EcoRⅠ、Not Ⅰ位点,用于切除并插入DNA片段;(2)具有大肠杆菌ColE1复制起点;(3)氨苄青霉素抗性用于筛选细菌目标克隆;(4)具有在真核细胞中复制的SV40复制起点;(5)新霉素抗性用于筛选真核细胞克隆;(6)噬菌体cos位点用于λ的包装和λ末端酶的裂解;(7)在多克隆位点两侧有M13正向引物和T7启动子引物,可用于未知序列的扩增测序;(8)噬菌体T7RNA聚合酶启动子位于克隆位点侧翼。用于侵染的菌株为大肠杆菌EPI100TM-T1R,它既缺乏重组系统又缺乏限制系统,从而使体内克隆的丢失最小化[9]。为了开展产酸克雷伯氏菌基因组、功能基因组及蛋白组研究做准备,本实验以上述质粒建立产酸克雷伯氏菌高效稳定的基因组文库,以期为今后产酸克雷伯氏菌功能基因定位及菌落原位杂交、染色体步移等打下必要的基础。
1材料与方法
1.1实验材料
本研究所使用的菌株与质粒列于表1。

表1 本研究用到的菌株与质粒
1.2主要试剂
氨苄青霉素(Amp)和基因组DNA提取试剂盒购自天根生化科技公司,限制性内切酶EcoRⅠ等购自Takara公司,pWEBTMCosmidCloningKit购自Epicentre公司。
1.3培养基
LB培养基:Tryptone10g、YeastExtract5g、NaCl10g,蒸馏水定容至1L,pH7.0~7.2;LA固体培养基为每升LB液体培养基加入15g琼脂。
1.4实验方法
1.4.1插入DNA片段的准备及其优化
以cosmid为载体建立基因组文库获得每个外源片段唯一克隆的效果很大程度上取决于外源DNA的平均分子大小和连接时的浓度,40kb的大小最合适。以4个1.5mL离心管每管40μL体系溶解4μg基因组DNA溶液,用100μL小截面枪头按150、200、250、300次梯度吹打,使其成40kb左右的片段(可取4μL进行电泳同时以EPI100TM-T1R试剂盒提供的36kbMarker对照确定)。电泳条件是琼脂糖含量为8g/L的电泳胶(20cm长)35V电压过夜电泳,100ng36kb的MarkerDNA作为对照。如果大于10%的基因组DNA与对照DNA同步迁移,证明基因组DNA片段大小适合(40kb左右),如果基因组DNA迁移过慢,即相对分子质量过大,则需再吹打50次。如果大于10%基因组DNA迁移速度大于对照,即相对分子质量过小,需要重新操作。
1.4.2目的DNA末端补平方法
补平反应体系为:8μL10×end-repairbuffer,8μL2.5mmol/LdNTPmix,8μL10mmol/LATP,约20μg打碎的DNA,4μLEnd-repairEnzymeMix,加ddH2O至80μL(冰上配制体系,使用前需彻底解冻和混匀)。反应体系室温放置45min反应,之后70 ℃水浴锅加热10min灭活End-repair酶终止补平反应,保存于-20 ℃备用。
1.4.3DNA大小筛选
(1)溶胶:100mL1×TAE加0.8g低熔点琼脂,微波炉中加热3min,加热过程中每隔1min震荡1次以使琼脂糖充分溶解。
(2)制胶:室温下冷却至胶溶液不烫手时倒胶(选用梳齿薄而宽的梳子,样品孔以干净的标签纸包封2~4个梳齿形成),待胶室温条件下完全冷却凝固后(约30min)再于4 ℃冰箱内冷却2~3h(连同梳子)。
(3)电泳:拔出梳子,点加末端补平的DNA(以36kbMarker和λ-HindⅢMarker作为Marker)35V电压低温过夜电泳约14h,染色观察。
(5)目标DNA片段的回收(事先准备好70 ℃和45 ℃的水浴锅)。
①确定凝胶块的质量(一般1mg凝胶溶化后产生1μL溶液)。
②将胶块置70 ℃水浴锅10~15min使其完全溶解,同时在45 ℃水浴锅内保温GELase50×Buffer5min。
③将完全溶解的胶液快速转移至新的离心管并在45 ℃保温,加入适量的GELase50×Buffer到终浓度1×,同时小心地加入3μL(3U)的GELase酶轻柔混匀,45 ℃下温育至少1h(过夜也不会有影响)。
④混合液移回70 ℃水浴锅水浴 10min以灭活GELase酶终止反应。
⑤每500μL溶液为1份移入2mL离心管。
预算编制结果将直接影响预算执行情况。因为在进行预算编制过程中,没有从企业各个环节入手,导致预算活动参与度相对不高。并且因为预算编制自身不具备严谨性和规范性,在执行预算工作时,时常和实际情况相背离,使得预算监管存在盲区,管理人员不能发挥自身担具的监管作用,从而使得预算编制结果差强人意。
⑥冰浴5min后10 000r/min离心20min沉淀不溶的凝胶,小心地吸取含DNA的上清液(90%~95%)放入1个干净的离心管中(注意避免吸入凝胶块)。
⑦DNA回收通过如下操作完成:a.加入1/10体积的3mol/L乙酸钠(pH7.0)并轻柔混匀;b.再加入2.5倍的无水乙醇,轻柔混匀;c.室温下沉淀10min后4 ℃ 12 000r/min离心20min,小心除去上清;d.用体积分数为70%的冷乙醇洗涤2次(4 ℃ 12 000r/min离心20min,小心除去上清,如果沉淀离开原位,需再次离心复位);e.小心地倒置离心管,干燥5~10min(注意时间过长会使DNA难以再溶);f.ddH2O重新溶解沉淀以备用,同时取少量电泳估计浓度。
1.4.4连接反应
参考Epicentre公司提供的方法。按顺序加入下列试剂并在每次加入试剂后混匀。载体和插入DNA摩尔浓度比按10∶1加入。10μL连接体系为:1μL10×Fast-LinkBuffer,1μL10mmol/LATP,0.5μgpWEBVector(0.5g/L),0.25μg插入DNA,1μLFast-LinkLigase,加ddH2O至10μL。充分混合后,室温下反应2h,然后70 ℃水浴10min灭活连接酶,-20 ℃保存备用。
1.4.5体外包装反应
采用Epicentre公司pWEBTMCosmidCloningKit蛋白包装。
①从-80 ℃取出1管新鲜的包装提取物(每管50μL)置冰水混合物上解冻10min,吸取25μL蛋白转移到另外1个1.5mL预冷的离心管中,置于冰上;剩下的25μL包装提取物可放回-80 ℃冰箱保存备用,也可继续放于冰上用于后续的包装。
②向1个管中加入10μL连接好的cosmidDNA,用小型移液枪轻轻混合均匀,吹打时最好不要让枪头离开液相,目的是避免引入气泡(气泡会影响包装效率),万一有气泡形成则需离心几秒钟以驱走产生的气泡。
③30 ℃水浴温育反应90min后,再次向离心管加入25μL解冻的包装提取物,30 ℃水浴再温育90min。
④向离心管加入500μL噬菌体稀释缓冲液(PDB,10mmol/LTris-HClpH8.3,100mmol/LNaCl,10mmol/LMgCl2)轻柔漩涡混匀。
⑤加入25μL三氯甲烷轻柔漩涡混匀,保存于4 ℃冰箱备用。
1.4.6转染反应
转染前的菌体准备:在转染的前一天,以含10mmol/LMgSO4和2g/L麦芽糖的50mLLB培养基接种单一菌落的大肠杆菌EPI100TM-T1R并37 ℃震荡过夜;转染的当天,以50mL上述培养基接种5mL过夜培养的EPI100TM-T1R并37 ℃培养至OD600值为0.8~1.0后(储存于4 ℃备用,最多72h)。
转染反应操作步骤:①取1.5mL菌液于无菌离心管中,10 000r/min离心去掉上清,再吸取1.5mL菌液于同一个离心管中,混合均匀;②取不同体积的包装产物(5、10、15、20μL)加入到准备好的100μL细胞中;③37 ℃水浴30min,间隔15min轻柔摇动1次;④5 000r/min离心1min,去上清后加入200μLLB重悬;⑤各处理取100μL悬浮液涂布于含100mg/L的Amp平板上(尽量不要涂到平板边缘,便于挑菌保存),37 ℃培养12~18h长出的菌落即为文库的克隆;⑥确定当菌落数为100个左右时所需包装产物的量,根据此用量再次进行包装产物转染,方法同上;⑦最终得到的所有单菌落的数量即构成KO108的基因组文库。
1.4.7文库保存
采用甘油保藏法保存单克隆文库,共2份,1份存于1.5mL离心管,另1份存于无菌96孔板,具体操作如下:
从平板上挑取单克隆子转接于含有Amp的LB培养基中,37 ℃过夜培养,菌株生长到OD600为0.8~1.2,分别吸取500μL菌液转移到事先准备好的1.5mL离心管中,再加入500μL体积分数为50%的无菌甘油,混合均匀,并做好编号;取混匀菌液另存于96孔平板,每个孔200μL(编号与离心管保存的文库一一对应),2个文库均-80 ℃冰箱长期保存。
1.4.8基因组文库质量检测
从KO108基因组文库中随机选取20个克隆子,以含有Amp的LB培养基37 ℃过夜振荡培养后分别以碱裂解法提取质粒[10],EcoRⅠ限制性内切酶消化(一般需要在37 ℃下酶切3~4h,根据质粒的浓度和质量而定)并电泳检验酶切结果。
2结果与分析
2.1细菌DNA的提取及优化
以天根公司的试剂盒提取KO108基因组DNA,取1μLDNA溶液用10g/L琼脂糖凝胶电泳检测质量,可以看到清晰的DNA条带如图1。以超微量分光光度计检测OD260/OD280比值为1.84,DNA含量为487.8mg/L,可见所获得的DNA符合下一步实验的质量要求。

M: λ-Hind Ⅲ Marker;泳道1-3: 菌株KO108基因组DNA图1 菌株KO108基因组DNAFig.1 The genomic DNA of stain KO108

M1:36 kb Marker;M2:λ-Hind Ⅲ Marker; 泳道1-4分别为150、200、250、300次打断图2 菌株KO108基因组 DNA不同吹打次数优化Fig.2 Optimization of interrupted frequency for genomic DNA of strain KO108
2.2KO108基因文库的质量检测
pWEBTM载体的相对分子质量为8.2kb,对外源DNA片段长度的要求接近于40kb,以之构建基因组文库有相当大的优势,因此本工作以pWEBTM质粒构建KO108基因组文库。
对符合质量要求的KO108基因组总DNA优化吹打次数(如图2),根据优化的结果选择经300次吹打进行下一步实验。将吹打后的DNA进行末端补平,经8g/L低熔点琼脂糖凝胶电泳回收片段长度约为40kb的高纯度外源DNA(如图3),以约2μg的DNA与pWEBTM载体连接,再用包装蛋白提取物体外包装重组DNA,之后转染大肠杆菌EPI100TM-T1R得到KO108基因组文库(如图4)。该文库由1 329个克隆组成。文库分2份保存于-80 ℃冰箱,第一份为每个克隆装于一个1.5mL离心管,第二份用96孔平板保存。
为检测所构建的KO108基因组文库的质量,随机从文库中挑取20个克隆,以碱裂解法分别提取质粒,电泳检测显示均出现大于pWEBTM空载体(8.2kb)的条带(图5),表明每个克隆子都包含外源DNA。重组质粒经EcoRⅠ限制性内切酶完全酶切的电泳检测如图6。由图6可见,所有质粒均有pWEBTM载体条带和载体以外的外源DNA,各质粒的酶切带型并不相同,表明所构建的KO108基因组文库中插入的外源DNA随机性较好。
由图6同时可见KO108基因组文库中克隆的外源DNA片段最小为25kb,最大约为50kb,估算平均大小约为40kb,由此推断该文库的容量约为52Mb。在NCBI数据库上选择同属的几个克雷伯氏菌(Klebsiella oxytocaE718、Klebsiella oxytocaKCTC1686和Klebsiella oxytoca 10-5242)计算它们的基因组全长的平均值为6.1Mb。按照公式N=Ln(1-P)/Ln(1-f)推算P=1-(1-f)N值,本文所构建的文库中包含基因组中任一个基因的概率(公式中的N表示重组质粒克隆的数量,P表示从文库中得到一个基因的概率,f表示文库克隆平均大小/基因组大小)[11],证实所构建的KO108基因组文库是该菌株基因组5倍的覆盖率,包含该菌株任何一个基因的概率为99.8%。

M1:36 kb Marker;M2:λ-Hind Ⅲ Marker;泳道1:回收DNA图3 菌株KO108基因组 DNA回收Fig.3 Recovery of genomic DNA of strain KO108

图4 重组载体转染结果Fig.4 Transfection results of recombinant vector
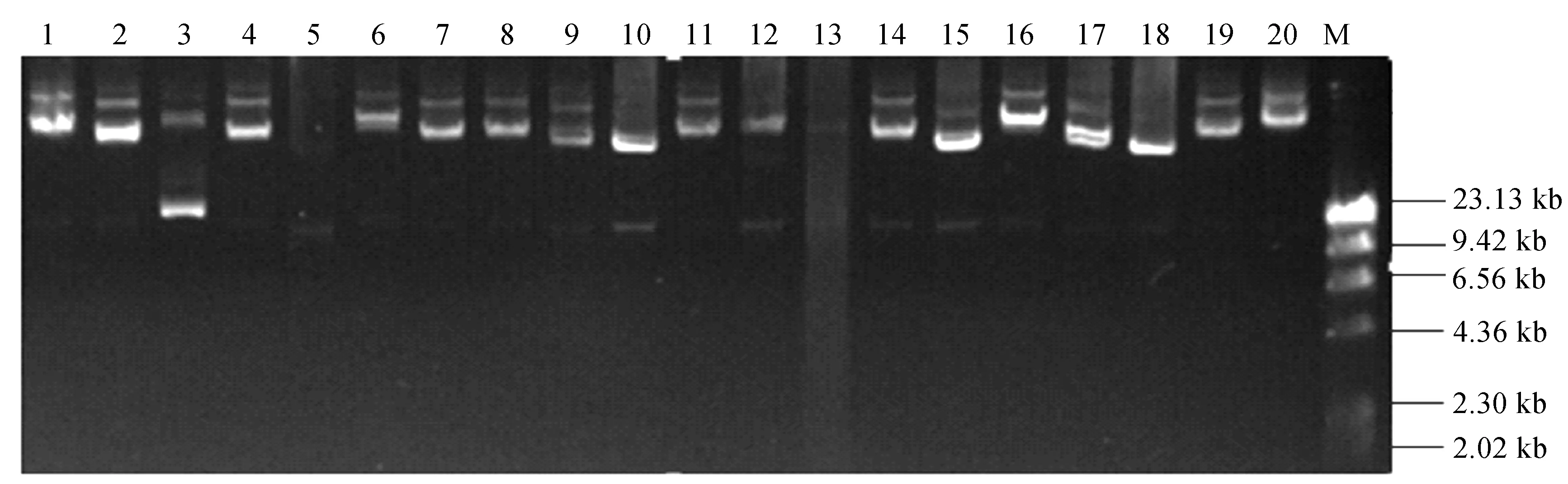
M:λ-Hind Ⅲ Marker;泳道1-20:克隆子质粒DNA图5 菌株KO108基因组文库克隆重组质粒DNAFig.5 The recombinant plasmid DNA from the genomic library of stain KO108

M:λ-Hind Ⅲ Marker;泳道1-20:EcoR Ⅰ酶切后的克隆子质粒图6 菌株KO108基因组文库克隆中重组质粒的EcoR Ⅰ酶切分析Fig.6 EcoR Ⅰ enzymes restriction digestion analysis on the recombinant plasmid from the genomic library of strain KO108
3结论与讨论
产酸克雷伯氏菌K.oxytoca属于肠杆菌科克雷伯氏菌属的一个种,在临床上发现其是一种条件性致病菌,发现较少与人类疾病有关[12]。全基因组测序结果表明同种不同菌株基因组上具有多重耐药基因,或存在由质粒介导的多重耐药基因[12-13]。以基因敲除技术获得充分利用氧、高效生产2,3-丁二醇的突变株成为分析该菌代谢产物的重要手段[14]。
由于pWEBTM质粒具有插入外源DNA片段大、操作灵活等优点,因此使用pWEBTM质粒构建基因组文库的研究不断增多。优质的基因组DNA制备是成功构建pWEBTM基因组文库的关键,DNA必须是高纯度同时不能过度断碎。齐冬梅等通过酶切基因组片段,电转化大肠杆菌,成功构建鸭疫里默氏杆菌的基因组文库[15]。本实验采用机械物理随机打断基因组DNA再分离回收目标片段的方法进行,既方便又准确,同时避免因基因组酶切位点过少而造成外源随机片段过少的弊端,检测结果表明平均插入片段达到40kb。打断的DNA通过末端修复酶修复,可以有效提高DNA与载体连接的效率。在转染过程中,适量蛋白包装提取物和高质量的感受态大肠杆菌EPI100可以大大提高文库的克隆数量。本文库的克隆数目为1 329个,随机挑选20个克隆子提取质粒检测显示都包含有外源片段;对重组质粒EcoRⅠ酶切检测显示均有pWEBTM载体条带和载体以外的外源DNA,各质粒的酶切带型并不相同,表明文库中的重组质粒为不同大小的外源DNA与pWEBTM载体随机连接所得。所构建的基因组文库中的克隆的外源DNA片段最小为25kb,最大约为50kb,估算平均大小约为40kb,由此推断本文库的容量约为52Mb,包含KO108菌株任一个基因的概率为99.8%,是该菌基因组5倍的覆盖率。本文库的构建为产酸克雷伯氏菌功能基因和比较基因组学研究奠定了基础。
参考文献:
[1]YANGTH,RATHNASINGHC,LEEHJ,etal.Identificationofacetoinreductasesinvolvedin2, 3-butanediolpathwayinKlebsiella oxytoca[J].JournalofBiotechnology, 2014, 172:59-66.
[2]KIMD-K,RATHNASINGHC,SONGH,etal.MetabolicengineeringofanovelKlebsiella oxytocastrainforenhanced2, 3-butanediolproduction[J].JournalofBioscienceandBioengineering, 2013, 116(2): 186-192.
[3]JIXJ,HUANGH,ZHUJG,etal.EngineeringKlebsiella oxytocaforefficient2, 3-butanediolproductionthroughinsertionalinactivationofacetaldehydedehydrogenasegene[J].AppliedMicrobiologyandBiotechnology, 2010, 85(6): 1751-1758.
[4]BAIL,WUX,JIANGL,etal.Hydrogenproductionbyover-expressionofhydrogenasesubunitinoxygen-tolerantKlebsiella oxytocaHP1[J].InternationalJournalofHydrogenEnergy, 2012, 37(17): 13227-13233.
[5]CHENC,CHENS,FINGASM,etal.BiodegradationofpropionitrilebyKlebsiella oxytocaimmobilizedinalginateandcellulosetriacetategel[J].JournalofHazardousMaterials, 2010, 177(1): 856-863.
[6]WUZ,PENGY,GUOL,etal.RootcolonizationofencapsulatedKlebsiella oxytocaRs-5oncottonplantsanditspromotinggrowthperformanceundersalinitystress[J].EuropeanJournalofSoilBiology, 2014, 60:81-87.
[7]江绍锋, 李云飞,蓝运华, 等. 一株产酸克雷伯氏菌的分离鉴定及其药敏检测[J]. 广西师范大学学报(自然科学版), 2015, 33(4): 137-143.
[8]陈献伟, 娜日苏, 朱超, 等. 基因组文库的构建和池化筛选[J]. 生物技术通报, 2010(5): 11-15.
[9]SIVASUBRAMANIK,SINGHJR,JAYALAKSHMID.IsolationofmetagenomicDNAfrommangroovesoilandconstructionofconsmidlibrary[J].InternationalJournalofPharma&BioSciences, 2012, 3(2):253-258.
[10]SAMBROOKJ, 萨姆布鲁克,RUSSELLDW, 等. 分子克隆实验指南[M]. 北京:科学出版社, 2002.
[11]SHINSH,KIMS,KIMJY,etal.CompletegenomesequenceofKlebsiella oxytocaKCTC1686,usedinproductionof2, 3-butanediol[J].JournalofBacteriology, 2012, 194(9): 2371-2372.
[12]HAZENTH,ROBINSONGL,HARRISAD,etal.GenomesequenceofKlebsiella oxytoca 11492-1,anosocomialisolatepossessingafox-5AmpCβ-lactamase[J].JournalofBacteriology, 2012, 194(11): 3028-3029.
[13]LIAOTL,LINAC,CHENE,etal.CompletegenomesequenceofKlebsiella oxytocaE718,aNewDelhimetallo-β-lactamase-1-producingnosocomialstrain[J].JournalofBacteriology, 2012, 194(19): 5454-5454.
[14]PARKJM,SONGH,LEEHJ,etal.Genome-scalereconstructionandinsilicoanalysisofKlebsiella oxytocafor2, 3-butanediolproduction[J].MicrobCellFact, 2013, 12(1):20-20.
[15]齐冬梅, 袁建丰, 覃宗华, 等. 1型鸭疫里默氏杆菌的分离鉴定及基因组文库的构建[J]. 中国兽药杂志, 2014, 48(1): 11-14.
(责任编辑马殷华)
doi:10.16088/j.issn.1001-6600.2016.02.023
收稿日期:2015-07-18
基金项目:国家自然科学基金资助项目(31060120);广西自然科学基金资助项目(2013GXNSFAA019059);广西研究生教育创新计划项目基金资助(YCSZ2014090)
中图分类号:Q933
文献标志码:A
文章编号:1001-6600(2016)02-0151-07
ConstructionandCharacterizationoftheGenomicLibraryofKlebsiella oxytoca
JIANGShaofeng1,2,3,HUANGJinqing1,2,YUXiaoyu1,2,LIYunfei1,2,LUZujun1,2
(1.CollegeofLifeScience,GuangxiNormalUniversity,GuilinGuangxi541006,China;2.KeyLaboratoryofEcologyofRareandEndangeredSpeciesandEnvironmentalProtection(MinistryofEducation),GuilinGuangxi541006,China;3.CollegeofAgriculture,SouthChinaAgricultureUniversity,GuangzhouGuangdong510462,China)
Abstract:The 1 329-clones genomic library of Klebsiella oxytoca KO108 was constructed by pWEBTMCosmid. Its coverage and randomness was confirmed by the electrophoresis profiles of 20 recombination plasmids digestion with EcoR Ⅰ,which were randomly selected from the library. The results showed that all tested plasmids contained the 8.2 kb cosmid fragment and an exogenous one diverse in size from 25 to 50 kb(about 40 kb in average), this suggested that the total capacity of this library was about 52 Mb, 5 times of KO108 genome, 99.8% theoretical possibility including any gene in this strain. The library lays a foundation for functional gene cloning and comparative genomics research for Klebsiella oxytoca.
Keywords:Klebsiella oxytoca; genomic library;pWEBTMCosmid; coverage; library capacity
通信联系人:陆祖军(1963—),男(壮族),广西百色人,广西师范大学教授,博士。E-mail:luzujun2002@aliyun.com
