一段式厌氧氨氧化工艺亚硝酸盐氧化菌抑制方法研究进展
2016-08-06尹志轩王悦超
谢 丽,殷 紫,尹志轩,王悦超,周 琪
一段式厌氧氨氧化工艺亚硝酸盐氧化菌抑制方法研究进展
谢丽,殷紫,尹志轩,王悦超,周琪
(同济大学环境科学与工程学院,上海 200092)
摘要:近年来,厌氧氨氧化工艺(anaerobic ammonium oxidation, Anammox)作为一种新型的脱氮技术,由于其耗能少、效率高而被应用于高氨氮废水的处理中。然而,实际运行的厌氧氨氧化工程中有时会出现亚硝酸盐氧化菌(nitrite oxidizing bacteria, NOB)大量繁殖的情况,导致硝酸盐积累,脱氮效率下降。在一段式Anammox反应器中,通过控制某些影响因素,如调节体系中的溶解氧,控制游离氨和游离亚硝酸的浓度,调控碳源浓度以及外加中间产物(N2H4、NO和NH2OH)等方式,能够在维持Anammox工艺脱氮效率的同时有效抑制NOB。除了系统地综述一段式Anammox工艺中NOB抑制手段以外,将进一步讨论实际Anammox工程应用中抑制NOB大量繁殖行之有效的手段。
关键词:一段式厌氧氨氧化;亚硝酸盐氧化菌抑制;溶解氧;游离氨和游离亚硝酸;碳源;中间产物
引 言
20世纪90年代,一种新型的脱氮微生物厌氧氨氧化菌(anaerobic ammonium oxidation bacteria, AnAOB)被发现,从而产生了新型的脱氮技术——厌氧氨氧化(anaerobic ammonium oxidation,Anammox)[1]。如式(1)所示,Anammox过程中AnAOB在严格厌氧的条件下,以无机碳为碳源,以亚硝氮作为电子受体将氨氮氧化为氮气,从而实现自养脱氮[2]
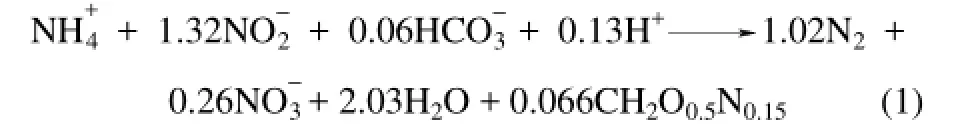
与传统生物脱氮工艺相比,Anammox技术在理论上可以节省60%的曝气能耗,减少90%的污泥产量,且无须外加有机碳源,在降低脱氮成本的基础上仍可以维持较高的脱氮效率,尤其适用于多种高浓度氨氮废水的脱氮处理[3]。
在Anammox的实际应用过程中,短程硝化常常和厌氧氨氧化耦合在一起。短程硝化将高氨氮废水中约一半的氧化为,从而满足厌氧氨氧化工艺的进水要求。基于此原理的工艺形式有一段式(one-stage)和两段式(two-stage)两种,两者区别在于短程硝化与厌氧氨氧化反应是否在同一反应器中发生。一段式工艺也可以被称作CANON (completely autotrophic nitrogen removal over nitrite)[4]、DEMON (DEamMONification)[5]或 OLAND (oxygen limited autotrophic nitrification and denitrification)[6],它们的区别在于起初命名时对在厌氧条件下氧化氨氮的菌种的认知不同。DEMON和OLAND认为微好氧条件下氧化氨氮的是硝化菌,而CANON则已经确认了AnAOB菌的存在并明确了其厌氧氨氧化的作用[7];两段工艺包括SHARON (single high activity ammonium removal over nitrite)-ANAMMOX[8]、NAS®[3]等。在荷兰鹿特丹污水厂、奥地利斯特拉斯污水厂等均有Anammox工艺的工程化应用[3]。据报道Anammox工程在长期运行过程中常出现亚硝酸盐氧化菌(nitrite oxidation bacteria, NOB)大量繁殖的现象,导致脱氮效果恶化,硝态氮浓度升高,甚至最终反应系统崩溃[3]。例如,由于曝气过度等因素,在两段式工艺的短程硝化阶段NOB容易大量繁殖,导致短程硝化变为完全硝化,从而无法达到Anammox工艺对进水基质的要求[3]。而过量曝气也会对一段式Anammox过程产生抑制,如图1所示[9]。
虽然有国外学者指出,解决NOB大量繁殖的唯一途径是对反应器进行重新接种不含 NOB的污泥[9],但也有实例表明再次接种后,NOB仍然会在系统中大量繁殖,导致脱氮系统再次崩溃[10]。鉴于在两段式反应器中,Anammox与短程硝化分别在两个反应器中运行,而短程硝化作为独立的工艺阶段,其NOB生长控制方法已有很多报道(如控制温度、溶解氧、pH等)[7],因此本文将着重综述一段式Anammox工艺中NOB抑制手段。
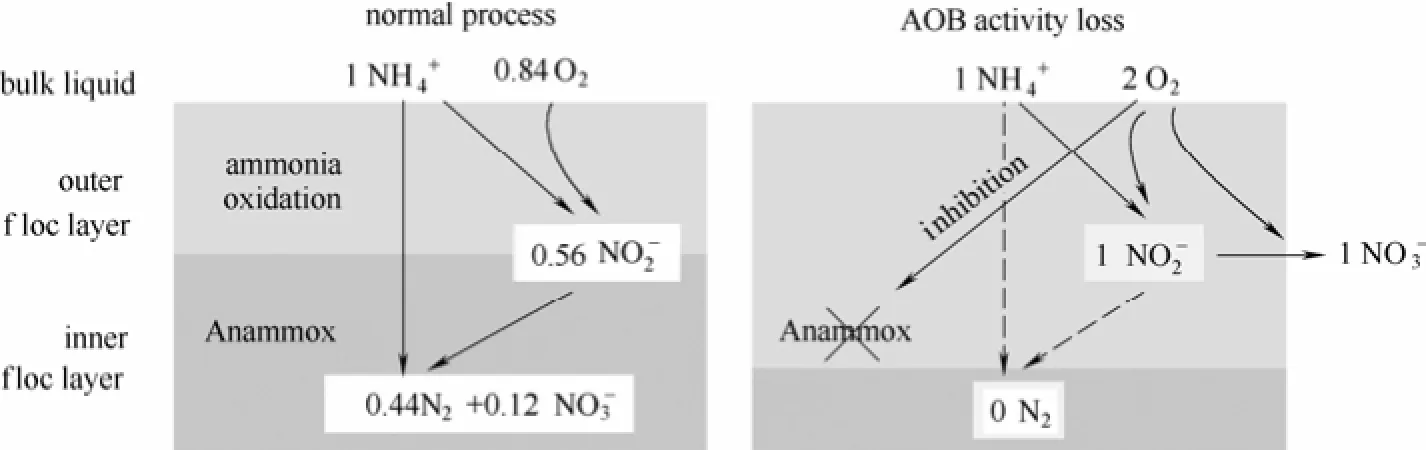
图1 过量曝气导致NOB积聚破坏Anammox系统[9]Fig. 1 Anammox system deterioration caused from NOB accumulation by excess oxygen[9]
1 一段式Anammox脱氮工艺中可能存在的共生菌种
一段式 Anammox脱氮工艺中可能同时存在AnAOB、好氧氨氧化细菌(ammonium oxidation bacteria, AOB)、NOB以及反硝化菌等。AnAOB是严格厌氧菌,其倍增时间长达11 d[11],0.5%空气饱和度的溶解氧[12]就可以对其产生可逆抑制。反硝化菌是兼性异养菌,它能够利用有机碳源实现反硝化脱氮,在一段式Anammox反应器中将与AnAOB竞争基质。但在主流Anammox工艺中,由于进水中仍然含有大量的有机碳,反硝化菌的存在反而可以解除有机碳源对 AnAOB的抑制,实现SNAD (simultaneous nitrification, Anammox and denitrification processes)[13]过程。
AOB和NOB统称为硝化细菌,是一类具有硝化功能的革兰阴性菌,属于好氧自养型菌。两者以CO2作为唯一碳源,分别以和作为唯一能源。如图2所示,Anammox脱氮工艺中的AnAOB通常需要与AOB协同作用,首先依赖AOB将废水中约一半的短程硝化为,以满足AnAOB特定的基质比例要求。虽然AOB会与AnAOB争夺共同的底物,但AOB也给AnAOB提供了必要的反应基质。此外,AOB的代谢过程消耗了体系中的溶解氧,从而在一定程度上缓解了氧气对AnAOB的抑制。

图2 Anammox脱氮系统中的菌种关系[14]Fig. 2 Relationship between different functional bacteria in Anammox system[14]
2 一段式Anammox工艺中NOB的影响因素及抑制方法
影响NOB生长的因素有很多,如温度、溶解氧、pH、游离氨(free ammonia, FA)和游离亚硝酸(free nitrous acid, FNA)、碳源浓度等。而控制一段式Anammox体系中的NOB,必须以Anammox系统和脱氮效果的稳定以及功能菌之间的平衡为前提。例如,已有研究表明,升高温度不仅能加快AOB的生长速率,也能扩大AOB和NOB在生长速率上的差距,可以同时维持AnAOB和AOB的生长活性。因此本文主要从溶解氧、FA/FNA浓度、碳源以及中间产物等方面综述其对一段式Anammox中NOB的抑制作用。
2.1 溶解氧
溶解氧的控制是保证Anammox工艺稳定运行的重要因素。在一段式工艺中溶解氧会抑制AnAOB的活性,无法消耗的和溶解氧的存在会给NOB的生长提供有利条件。Hunik等[17]研究发现,Nitrosomonas(AOB)的耗氧速率为10.5 μg·g-1·s-1,溶解氧的半饱和速率 Ks(O2)为 0.16 mg·L-1;Nitrobacter(NOB)的耗氧速率为 1.2 μg·g-1·s-1,Ks(O2)为 0.54 mg·L-1。说明在低溶解氧状态下,AOB对氧气的亲和力和耗氧速率高于NOB。因此控制体系中溶解氧浓度在较低水平能够使 AOB比NOB生长更占优势。此外,由于是AOB的产物,也是NOB生长的基质,氧化总是滞后于氧化过程[18]。因此,可以通过控制曝气时间,当系统中开始积累时停止曝气,使环境趋于厌氧条件,此时生成的更容易被AnAOB菌利用。也有研究表明,在间歇曝气体系中,AOB受好氧模式和厌氧模式不断切换的负面影响比NOB要小[19]。通过控制溶解氧浓度、调节曝气时间以及改变曝气方式(如间歇曝气)等方法能够有效地控制体系中的溶解氧[20],达到抑制 NOB生长的目的。
表1总结了不同曝气策略下一段式Anammox反应器运行效果。与连续曝气相比,间歇曝气能够降低NOB的生长速率,从而使AOB成为优势菌群,实现短程硝化[18]。Carles等[21]采用曝气膜生物反应器作为一段式 Anammox反应器,发现反应器中NOB大量繁殖。为了抑制NOB生长,Carles等将连续曝气改为间歇曝气,并优化氧气负荷与氨氮负荷的比例,以提高Anammox工艺的脱氮效果。Hyungseok等[24]也发现间歇曝气能够抑制 NOB的生长,阻止生成。
间歇曝气除了能有效抑制NOB生长,提高总氮去除率外,还可以减少工艺所需曝气量,从而节省能耗以及工艺运行成本。但也有报道称,间歇曝气虽然具有以上优点,但实现NOB的稳定抑制至少要6个月[10]。综上所述,在低溶解氧浓度的体系中,通过控制曝气时间实现间歇曝气能够抑制NOB的生长。在实际的Anammox工艺过程中,研究者需要不断调试并优化曝气时间及曝气量等参数,实现Anammox工艺稳定、高效且经济的运行。
2.2 游离氨(FA)和游离亚硝酸(FNA)
少量浓度的FA和FNA即对AOB和NOB产生抑制作用,对 AnAOB也有一定的抑制作用。Fernandez等[25]发现38 mg NH3-N·L-1的FA能够使比厌氧氨氧化活性(specific Anammox activity, SAA)降低一半,100 mg NH3-N·L-1的FA则能降低 80%的 SAA;当 FNA 浓度小于 6.6 μg HNO2-N·L-1时,SAA不受影响,而将FNA浓度提高到11 μg HNO2-N·L-1时,SAA将降低50%。表2总结了不同文献中FA及FNA对AOB、NOB及AnAOB的抑制浓度阈值。从表中可以看出,FA 及FNA对NOB的抑制作用要强于AOB和AnAOB。
影响FA/FNA浓度的因素主要有pH、温度和基质浓度,如式(2)、式(3)所示[30]。3个因素对FA浓度影响的程度为pH>温度>基质浓度,其中pH的影响远远大于其他两个因素[31]。由于一段式Anammox工艺主要在中温下运行,此处主要讨论基质浓度和pH的影响。pH的大小和基质浓度的高低除了直接影响NOB的生长外,还能够通过引起FA/FNA变化,间接影响 NOB的生长。因此,本文分别讨论pH和基质浓度与FA/FNA的关系,以及在抑制过程中起主导作用的因素。另外,反应器类型也可能对FA/FNA造成影响。
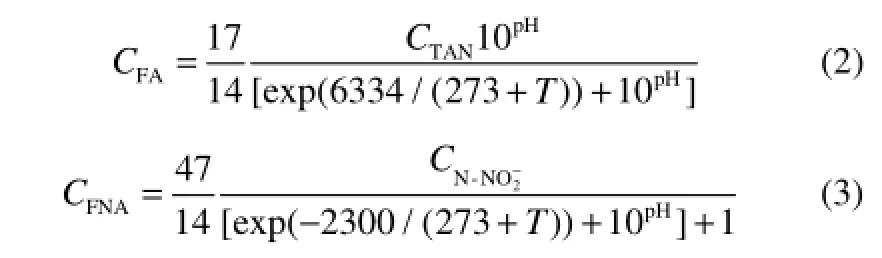

表3 FA和FNA对AOB、NOB和AnAOB的抑制浓度Table 2 Inhibitary concentrations against AOB,NOB and AnAOB by FA and FNA
然而据报道,在高基质浓度条件下,真正起抑制作用的可能是基质解离产生的 FA和 FNA[28]。Liang等[15]在一段式 CANON 反应器中发现为6.7,小于理论值8(据Anammox反应方程式计算可得),推测可能发生了NOB的积聚现象。投加后,FA浓度从7 mg·L-1增大到85.7 mg·L-1增大到了11.3,总氮去除率缓慢上升,反应器中Nitrobacter及Nitrospira种群数量明显减少,NOB的生物多样性减小。但不管FA浓度多高,脱氮系统中都能检测到Nitrobacter 及Nitrospira的存在,这说明NOB不能被完全去除,但NOB的生长能被FA有效地抑制。然而,随着运行时间的延长,当NOB逐渐适应FA毒性,NOB会重新占优势。委燕等[36]考察缺氧条件下 FNA对NOB的抑制作用时发现,当投加高浓度(340 mg·L-1)的时,FNA浓度达到0.27mg,此时NOB的活性降低了83.57%,而 AOB的活性却仅下降 22.34%,表明高浓度的FNA成功抑制了NOB的生长。因此,改变基质浓度能够影响FA及FNA浓度,达到选择性抑制NOB的目的。
(2)pH
适合AnAOB生长的最适pH为7.5~8.3[37],AOB生长的最适宜pH为7.0~8.5,而NOB的最适生长pH稍低一些(6.0~7.5)[38]。因此,当pH大于7.0时,AOB的生长速率显著高于NOB。另一方面,当系统pH改变时,和解离产生FA及FNA的量也会发生相应变化[39]。如式(2)、式(3)所示,系统pH高时FA浓度增加,pH低时FNA的浓度增加。由于pH和FA/FNA两者相互关联,大多数研究者认为FA/FNA起到更主要的NOB抑制作用,然而也有研究表明在弱碱性条件下,pH对Anammox工艺的影响相比于FA/FNA而言更大[40]。关于pH和FA/FNA两者对NOB抑制作用的主次问题至今还未有定论,需要进一步的研究和探讨。
(3)其他
另外,反应器类型也可能对反应器中的FA及FNA浓度造成影响。在序批式间歇反应器(sequencing batch reactor,SBR)中,反应初期的基质浓度等于进水浓度,随着反应的进行,基质浓度逐渐降低;而在完全混合反应器如 CSTR (continuous stirred tank reactor)中,进水浓度被反应器中原有的废水稀释,从而使实际反应初始浓度降低。Fux等[41]认为SBR比CSTR更易实现NOB的选择性抑制。Svehla等[42]发现由于SBR采用间歇进水方式,随着部分硝化反应的进行,体系中的pH不断减小,FA和FNA浓度也随之变化:每个反应期开始时的FA(浓度约为38 mg·L-1)和反应结束后的FNA[(5.6±2.7) mg·L-1]都会对NOB产生抑制效果;而连续进水的CSTR使进水FA和FNA浓度得到稀释,减轻了其对 NOB的抑制,同时,CSTR稳定的操作参数则为NOB提供了充足的毒性适应时间。当Svehla等将运行方式由CSTR改变为SBR后,NOB受到明显抑制。
以上研究都表明,高浓度的 FA/FNA对Anammox体系中的NOB有抑制作用。通过调节基质浓度,控制pH以及改变反应器类型等都能影响FA/FNA的浓度。因此,在最优pH条件下,应该适当提高基质浓度,在尽量保持Anammox脱氮效率的同时抑制NOB的生长。
2.3 碳源
(1)有机碳源
AOB、NOB和AnAOB 3种菌种均为自养菌,有机碳的存在会抑制其活性。Joss等[9]在SBR反应器中监测到消耗速率突降,浓度大大升高。通过研究发现,造成这一现象的原因是进水中含有的有机物烯丙基硫脲抑制了AOB的活性,导致对及DO消耗速率降低。过量的溶解氧抑制AnAOB活性使积累,从而为NOB的生长提供了有利的条件。此外,有机物的引入也会促进反硝化菌和好氧异养菌等杂菌的生长。异养型细菌的生长速率比自养型细菌更快,也能在一定程度上实现对NOB的抑制。Liang等[15]在CANON反应器中外加葡萄糖以考察有机物对NOB的影响,发现投加葡萄糖后,变性梯度凝胶电泳图谱中Nitrobacter和 Nitrospira的条带数(种群数量)均有减少,同时多样性也有所降低。这一研究结果表明,由于葡萄糖的引入,反硝化菌和好氧异养菌生长得到促进,从而与NOB竞争及DO,使得 NOB生长受到抑制。但值得注意的是,有机物引入带来的异氧菌的生长同样也会对AnAOB产生不利影响。有学者认为低浓度有机物存在时AnAOB和反硝化菌能共存并相互促进,但有机物浓度高时,厌氧氨氧化菌活性大大降低[43];另外一种观点认为,有机物存在下,厌氧氨氧化菌仍然占据主导地位,与反硝化菌竞争并优先利用有机碳源,代谢途径表现多样化[44]。
因此,有机物虽然能够抑制Anammox体系中NOB的生长,但同时也会引起反硝化菌和好氧异养菌等杂菌的繁殖。这些杂菌对Anammox体系的影响值得进一步探讨。
(2)无机碳源
重庆市2009—2015年共规划治理148条中小河流中的345个重点河段,规划治理河长1 737km,治理任务很重。重庆市“三江”的河道管理工作体制及日常管理基本理顺,但中小河流中还存在4种河道违法违规现象,即采砂业主夜间作业,噪音扰民;部分建设单位超审批规模违规建设;部分沿河居民或其他建设单位对河道管理法规认识不足,擅自临河建房,不履行河道管理审批手续。
AOB、NOB和AnAOB 3种菌种都以无机碳为同化碳源。当体系中无机碳浓度较低时,3种菌群会产生竞争。据报道,在无机碳浓度低时,AOB和AnAOB的生长都受到限制,但却对NOB影响不大[45]。Guisasola等[46]发现当无机碳浓度低于36 mg C·L-1时AOB生长受到抑制,而NOB抑制在无机碳浓度小于1.2 mg C·L-1才会发生。Ma等[47]减少了短程硝化-厌氧氨氧化体系中约 90%的无机碳[从(90±3.4) mg C·L-1降低至(9.6±5) mg C·L-1],发现总氮去除率从78%±2%下降至46%±2.9%,此时AnAOB活性降低,而AOB活性基本不变,NOB活性却呈现上升趋势,从而导致累积,分子生物学结果表明Nitrospira量升高,AOB和AnAOB量均减少;当恢复无机碳浓度到初始水平后,总氮去除率恢复至71%±2.6%,AnAOB活性也明显恢复,但NOB活性仅略有下降。此时,AOB和AnAOB的量得到了回升,NOB量虽略有下降,但仍高于初始水平。这表明了无机碳浓度不能过低,否则将影响体系中AOB和AnAOB的活性,使得NOB成为优势菌种。Tokutomi等[48]利用气提流化床反应器运行一段式Anammox工艺时,采用NaOH作为碱源,无机碳浓度低于5 mg·L-1。一段时间后发现NOB大量繁殖,出水中浓度逐渐升高;用NaHCO3替代NaOH作为碱源,提高无机碳浓度至50~150 mg·L-1,发现重新开始累积,(生成)/(减少)达到90%,说明高浓度无机碳存在的情况下更易实现短程硝化过程。为了进一步验证无机碳浓度对 NOB的抑制作用,再次将碱源更换为NaOH后,浓度重新升高,AOB的氨氧化率减小。这表明当无机碳浓度不足时,NOB的生长速率高于AOB,而高浓度时AOB占优势,在供氧有限的条件下可以达到选择性抑制NOB的目的。由此可见,为了维持短程硝化-厌氧氨氧化体系的稳定运行,必须满足AOB和AnAOB对无机碳的需求。
2.4 中间产物抑制
Anammox反应的机理用方程式表示如下[49]

其中,式(4)~式(6)为分步反应方程式,式(7)为总反应。在Anammox脱氮反应过程中,会生成中间产物NO和N2H4。据报道,向Anammox体系中投加这两种中间产物可以抑制NOB的生长[50-51]。此外,Anammox过程产生的N2H4能够发生歧化反应生成NH2OH[52],而AnAOB中的羟铵氧化还原酶(hydroxylamine oxidoreductase)又能够将NH2OH转化为 N2H4,因此,研究者也考察了 NH2OH对Anammox体系中NOB的抑制作用,具体分析如下。
2.4.1 N2H4抑制 N2H4是一种有毒的强还原剂,它对AOB和NOB都有毒害作用,但它也能强化Anammox过程,提高总氮去除率[50]。Yao等[53]向SBR-CANON反应器进水中投加14.77 mg·L-1的N2H4时,TN去除速率和去除效率均有提高(分别从0.188升高到0.214 kg N·m-3·d-1,从51.6%升高到 67.3%),(生成)/(减少)也从 0.2下降到0.12(接近理论值0.11),表明N2H4能够有效抑制NOB的生长。
Xiao等[54]在SBR中接种成熟的CANON工艺的污泥,不投加 N2H4时,脱氮速率较低为(0.108±0.054) kg N·L-1·d-1,总氮去除率为43%±13%;当向反应器中加入4 mg·L-1N2H4后,尽管进水氨氮浓度从150 mg N·L-1升高至240 mg N·L-1,脱氮速率和总氮去除率却分别提升到70%±7%和(0.33±0.06) kg N·L-1·d-1;持续投加4 mg·L-1N2H4,驯化形成了Anammox颗粒污泥,脱氮速率和总氮去除率皆趋于稳定。通过分子生物学手段检测发现,异养菌和NOB受到N2H4的抑制比功能菌(AOB和AnAOB)更大。从反应机理角度考察,外部投加的少量N2H4在抑制NOB的生长速率的同时,经联氨氧还酶(hydrazine oxidoreductase)催化氧化变成N2,释放出的电子更容易被 AnAOB合成代谢利用,因此能够替代被氧化为途径对电子进行补充,因此可减少的产生,降低NOB的生长速率[53]。
2.4.2 NO抑制 NO是 Anammox反应的中间产物,同时也是硝化及反硝化过程的中间产物。NO对细菌具有普遍的毒性抑制。在好氧条件下,NO 对AOB的毒害作用与生境中的氨浓度有关:缺氨时NO对AOB产生毒害;富氨时,NO不但不会毒害AOB,反而会刺激AOB的生长[55]。
NO能够抑制NOB的生长,微克级别的NO就能对Nitrobacter spp.产生抑制作用[51]。Courtens等[56]采用4种不同类型的硝化污泥,其Nitrobacter/Nitrospira浓度比及半饱和常数各不相同(由Nitrospira主导的硝化污泥Ks较小,对亲和力强)。对于Ks为1.50 mg的硝化污泥,Nitrobacter量高于 Nitrospira,2 μg N·L-1的NO就能使其中NOB活性降低24%;另外 3种污泥都是接种于实际脱氮过程,Nitrospira的量远高于Nitrobacter,其半饱和常数Ks分别为0.70,0.36和0.06 mg,而NO对其抑制程度分别为0%、30%~50%和60%~80%。表明当体系中Nitrospira为NOB主要菌种时,NO对其抑制作用与污泥的Ks密切相关,Ks越小,NO的抑制作用越明显。
笔者认为,外部添加N2H4、NO及NH2OH等中间产物能够实现对NOB的原位(in-situ)抑制,是一种方便快捷的抑制手段。但这些中间产物试剂价格高,故此类抑制手段多在实验室中使用,工程应用未见报道。另外,这些中间产物大多对生命体具有极强的毒性,在使用过程中必须严格控制规范操作,保证人员安全。
3 结 论
NOB的大量繁殖致使Anammox反应系统崩溃的现象已经引发研究者及工程师愈来愈多的关注。通过调节溶解氧、提高FA/FNA浓度、调控碳源浓度以及外加中间产物等方式,能够在维持Anammox工艺脱氮效率的同时有效抑制NOB。在文中提到的几种 NOB抑制手段中,调节溶解氧的间歇曝气法能够减少工艺所需曝气量,节省能耗以降低工艺运行成本,是实际工程应用中经济且行之有效的方法;通过提高FA、FNA浓度和碳源浓度的调控手段与工艺进水水质关系密切,需要根据实际进水情况考虑是否可行;外加中间产物的调控方式方便快捷,但由于药剂的使用成本较高、药剂毒性大,目前大多在实验室小试规模使用。
另一方面,抑制手段并不是单一化的,实际运行过程中常常可以采取多种手段联用的方法。比如: FA抑制手段联合基质浓度调控和pH调控手段,三者相互关联,彼此影响[26, 40];同时采取FA抑制(抑制NOB生长)与增大无机碳浓度(促进AOB生长)的方法,能优化NOB抑制效果[48];在常规抑制方法的基础上联合其他方法如污泥淘洗,调整SRT以实现 NOB不可逆抑制[59];向两段式反应器的部分硝化阶段补充AOB占优势的硝化污泥[60],或直接在一段式反应器中接种不含NOB的Anammox污泥[9],实现生物强化。然而,随着 Anammox工艺在国内外的广泛应用,其运行工况各不相同,一旦发生 NOB大量繁殖的情况,则需根据具体工况选择经济高效的 NOB抑制方式。例如,寒冷地区的温度控制比热带地区耗费更多的能量,则采用外加中间产物的原位抑制更加高效;又如,进水水质常常影响着基质浓度,当进水水质波动引起氮源或无机碳源不足时,需要人为补充基质。
总之,当Anammox工艺中NOB大量繁殖时,必须结合具体工况,在考虑体系的稳定性、氨氮去除率及功能菌的生长情况的基础上,灵活地选择最佳的NOB抑制方案。
References
[1] MULDER A, VANDEGRAAF A A, ROBERTSON L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor [J]. FEMS Microbiol. Ecol., 1995, 16(3): 177-183.
[2] HU Z, LOTTI T, VAN LOOSDRECHT M, et al. Nitrogen removal with the anaerobic ammonium oxidation process [J]. Biotechnology Letters, 2013, 35(8): 1145-1154.
[3] LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/Anammox experiences--an application survey [J]. Water Research, 2014, 55: 292-303.
[4] THIRD K A, SLIEKERS A O, KUENEN J G, et al. The CANONsystem (completely autotrophic nitrogen-removal over nitrite) under ammonium limitation: interaction and competition between three groups of bacteria [J]. Syst. Appl. Microbiol., 2001, 24(4): 588-596.
[5] WETT B. Solved upscaling problems for implementing deammonification of rejection water [J]. Water Science & Technology, 2006, 53(12): 121-128.
[6] VLAEMINCK S E, TERADA A, SMETS B F, et al. Nitrogen removal from digested black water by one-stage partial nitritation and Anammox [J]. Environ. Sci. Technol., 2009, 43(13): 5035-5041.
[7] VAN HULLE S W H, VANDEWEYER H J P, MEESSCHAERT B D, et al. Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams [J]. Chemical Engineering Journal, 2010, 162(1): 1-20.
[8] ABMA W R, SCHULTZ C E, MULDER J W, et al. Full-scale granular sludge Anammox process [J]. Water Science & Technology, 2007, 55(8/9): 27-33.
[9] JOSS A, DERLON N, CYPRIEN C, et al. Combined nitritation-Anammox: advances in understanding process stability [J]. Environ. Sci. Technol., 2011, 45(22): 9735-9742.
[10] JARDIN N, HENNERKES J. Full-scale experience with the deammonification process to treat high strength sludge water - a case study [J]. Water Science and Technology, 2012, 65(3): 447-455.
[11] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Appl. Microbiol. Biot., 1998, 50(5): 589-596.
[12] STROUS M, VANGERVEN E, KUENEN J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (Anammox) sludge [J]. Appl. Environ. Microbiol., 1997, 63(6): 2446-2448.
[13] WANG H L, JI G D, BAI X Y. Enhanced long-term ammonium removal and its ranked contribution of microbial genes associated with nitrogen cycling in a lab-scale multimedia biofilter [J]. Bioresource Technol., 2015, 196: 57-64.
[14] NI S Q, ZHANG J. Anaerobic ammonium oxidation: from laboratory to full-scale application [J]. Biomed. Res. Int., 2013, 2013(2): 469360.
[15] LIANG Y, LI D, ZHANG X, et al. Stability and nitrite-oxidizing bacteria community structure in different high-rate CANON reactors [J]. Bioresource Technol., 2014, 175: 189-194.
[16] ISANTA E, REINO C, CARRERA J, et al. Stable partial nitritation for low-strength wastewater at low temperature in an aerobic granular reactor [J]. Water Res., 2015, 80: 149-158.
[17] HUNIK J H, TRAMPER J, WIJFFELS R H. A strategy to scale-up nitrification processes with immobilized cells of Nitrosomonas europaea and Nitrobacter agilis [J]. Bioprocess Engineering, 1994, 11(2): 73-82.
[18] MA B, BAO P, WEI Y, et al. Suppressing nitrite-oxidizing bacteria growth to achieve nitrogen removal from domestic wastewater via Anammox using intermittent aeration with low dissolved oxygen [J]. Sci. Rep., 2015, 5. doi:10.1038/srep13048.
[19] PELLICER-NACHER C, FRANCK S, GULAY A, et al. Sequentially aerated membrane biofilm reactors for autotrophic nitrogen removal: microbial community composition and dynamics [J]. Microb. Biotechnol., 2014, 7(1): 32-43.
[20] MA B, WANG S, CAO S, et al. Biological nitrogen removal from sewage via Anammox: recent advances [J]. Bioresource Technol., 2016, 200: 981-990.
[21] PELLICER-NACHER C, SUN S, LACKNER S, et al. Sequential aeration of membrane-aerated biofilm reactors for high-rate autotrophic nitrogen removal: experimental demonstration [J]. Environ. Sci. Technol., 2010, 44(19): 7628-7634.
[22] SOBOTKA D, CZERWIONKA K, MAKINIA J. The effects of different aeration modes on ammonia removal from sludge digester liquors in the nitritation-Anammox process [J]. Water Sci. Technol., 2015, 71(7): 986-995.
[23] YANG J, TRELA J, ZUBROWSKA-SUDOL M, et al. Intermittent aeration in one-stage partial nitritation/Anammox process [J]. Ecol. Eng., 2015, 75: 413-420.
[24] YOO H, AHN K H, LEE H J, et al. Nitrogen removal from synthetic wastewater by simultaneous nitrification and denitrification (SND) via nitrite in an intermittently-aerated reactor [J]. Water Res., 1999, 33(1): 145-154.
[25] FERNANDEZ I, DOSTA J, FAJARDO C, et al. Short- and long-term effects of ammonium and nitrite on the Anammox process [J]. J. Environ. Manage., 2012, 95 (Suppl): 170-174.
[26] ANTHONISEN A C, LOEHR R C, PRAKASAM T B, et al. Inhibition of nitrification by ammonia and nitrous acid [J]. Water Pollution Control Federation, 1976, 48(5): 835-852.
[27] VADIVELU V M, KELLER J, YUAN Z. Effect of free ammonia on the respiration and growth processes of an enriched Nitrobacter culture [J]. Water Res., 2007, 41(4): 826 - 834.
[28] STUVEN R, BOCK E. Nitrification and denitrification as a source for NO and NO2production in high-strength wastewater [J]. Water Res., 2001, 35(8): 1905-1914.
[29] LI S, CHEN Y P, LI C, et al. Influence of free ammonia on completely autotrophic nitrogen removal over nitrite (CANON) process [J]. Appl. Biochem. Biotechnol., 2012, 167(4): 694-704.
[30] PARK S, BAE W. Modeling kinetics of ammonium oxidation and nitrite oxidation under simultaneous inhibition by free ammonia and free nitrous acid [J]. Process Biochemistry, 2009, 44(6): 631-640.
[31] 郑平, 胡宝兰, 徐向阳. 新型生物脱氮理论与技术[M]. 北京: 科学出版社, 2004.
ZHENG P, HU B L, XU X Y. Novel Biological Nitrogen Removal: Theory and Technology[M]. Beijing: Science Press,2004.
[32] ZHANG X, LI D, LIANG Y, et al. Performance and microbial community of completely autotrophic nitrogen removal over nitrite (CANON) process in two membrane bioreactors (MBR) fed with different substrate levels [J]. Bioresource Technol., 2014, 152: 185-191.
[33] 王亚宜, 黎力, 马骁, 等. 厌氧氨氧化菌的生物特性及CANON厌氧氨氧化工艺[J]. 环境科学学报, 2014, 34(6): 1362-1374.
WANG Y Y, LI L, MA X, et al. Biocharacteristics of Anammox bacterai and CANON Anammox process[J]. Acta Scientiae Circumstantaie, 2014, 34(6): 1362-1374.
[34] DAPENA-MORA A, FERNANDEZ I, CAMPOS J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007, 40(4): 859-865.
[35] STROUS M, KUENEN J G, JETTEN M S M. Key physiology of anaerobic ammonium oxidation [J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250.
[36] 委燕, 王淑莹, 马斌, 等. 缺氧 FNA对氨氧化菌和亚硝酸盐氧化菌的选择性抑菌效应[J]. 化工学报, 2014, 65(10): 4145-4149.
WEI Y, WANG S Y, MA B, et al. Selective inhibition effect of free nitrous acid on ammonium oxidizing bacteria and nitrite oxidizing bacteria under anoxic condition[J]. CIESC Journal, 2014, 65(10): 4145-4149.
[37] 杨洋, 左剑恶, 沈平,等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J]. 环境科学, 2006, 27(4): 692-695.
YANG Y, ZUO J E, SHEN P, et al. Influence of temperature, pH value and organic substance on activity of ANAMMOX sludge[J]. Environmental Science, 2006, 27(4): 692-695.
[38] 高大文, 彭永臻, 王淑莹. 控制pH实现短程硝化反硝化生物脱氮技术[J]. 哈尔滨工业大学学报, 2005, 37(12): 1664-1666.
GAO D W, PENG Y Z, WANG S Y. Nitrogen removal from wastewater via shortcut nitrification – denitrification achieved by controlling pH[J]. Journal of Harbin Institute of Technology, 2005, 37(12): 1664-1666.
[39] LANGONE M, YAN J, HAAIJER S C, et al. Coexistence of nitrifying, Anammox and denitrifying bacteria in a sequencing batch reactor [J]. Frontiers in Microbiology, 2014, 5: 28.
[40] PUYOL D, CARVAJAL-ARROYO J M, LI G B, et al. High pH (and not free ammonia) is responsible for Anammox inhibition in mildly alkaline solutions with excess of ammonium [J]. Biotechnology Letters, 2014, 36(10): 1981-1986.
[41] FUX C, BOEHLER M, HUBER P, et al. Biological treatment of ammonium-rich wastewater by partial nitritation and subsequent anaerobic ammonium oxidation (Anammox) in a pilot plant [J]. Journal of Biotechnology, 2002, 99(3): 295-306.
[42] SVEHLA P, BARTACEK J, PACEK L, et al. Inhibition effect of free ammonia and free nitrous acid on nitrite-oxidising bacteria during sludge liquor treatment: influence of feeding strategy [J]. Chemical Papers, 2014, 68(7): 871-878.
[43] 胡勇有, 梁辉强, 朱静平, 等. 有机碳源环境下的厌氧氨氧化批式实验[J]. 华南理工大学学报(自然科学版), 2007, 35(6): 116-119.
HU Y Y, LIANG H Q, ZHU J P, et al. Batch expermients of anaerobic ammonium oxidation process with organic carbon[J]. Journal of South China University of Technology (Natural Science Edition), 2007, 35(6): 116-119.
[44] 操沈彬, 王淑莹, 吴程程, 等. 有机物对厌氧氨氧化系统的冲击影响[J]. 中国环境科学, 2013, 33(12): 2164-2169.
CAO S B, WANG S Y, WU C C, et al. Shock effect of organic matters on anaerobic ammonia oxidation system[J]. China Environmental Science, 2013, 33(12): 2164-2169.
[45] DENECKE M, LIEBIG T. Effect of carbon dioxide on nitrification rates [J]. Bioprocess and Biosystems Engineering, 2003, 25(4): 249-253.
[46] GUISASOLA A, PETZET S, BAEZA J A, et al. Inorganic carbon limitations on nitrification: experimental assessment and modelling [J]. Water Res., 2007, 41(2): 277- 286.
[47] MA Y, SUNDAR S, PARK H, et al. The effect of inorganic carbon on microbial interactions in a biofilm nitritation-Anammox process [J]. Water Res., 2015, 70: 246-254.
[48] TOKUTOMI T, SHIBAYAMA C, SODA S, et al. A novel control method for nitritation: the domination of ammonia-oxidizing bacteria by high concentrations of inorganic carbon in an airlift-fluidized bed reactor [J]. Water Res., 2010, 44(14): 4195-4203.
[49] KARTAL B, MAALCKE W J, DE ALMEIDA N M, et al. Molecular mechanism of anaerobic ammonium oxidation [J]. Nature, 2011, 479(7371): 127-130.
[50] 蔡庆, 丁佳佳. N2H4强化厌氧氨氧化机理及动力学特性[J]. 水处理技术, 2015, 41(5): 73-77.
CAI Q, DING J J. The mechanism and dynamic characteristic of enhancing anaerobic ammonium oxidation (Anammox) process[J]. Technology of Water Treatment, 2015, 41(5): 73-77.
[51] STARKENBURG S R, ARP D J, BOTTOMLEY P J. Expression of a putative nitrite reductase and the reversible inhibition of nitrite-dependent respiration by nitric oxide in Nitrobacter winogradskyi Nb-255 [J]. Environmental Microbiology, 2008, 10(11): 3036-3042.
[52] ZEKKER I, KROON K, RIKMANN E, et al. Accelerating effect of hydroxylamine and hydrazine on nitrogen removal rate in moving bed biofilm reactor [J]. Biodegradation, 2012, 23(5): 739-749.
[53] YAO Z B, CAI Q, ZHANG D J, et al. The enhancement of completely autotrophic nitrogen removal over nitrite (CANON) by N2H4addition [J]. Bioresource Technol., 2013, 146: 591-596.
[54] XIAO P, LU P, ZHANG D, et al. Effect of trace hydrazine addition on the functional bacterial community of a sequencing batch reactor performing completely autotrophic nitrogen removal over nitrite [J]. Bioresource Technol., 2014, 175: 216-223.
[55] DIRK ZART I S E B. Significance of gaseous NO for ammonia oxidation by Nitrosomonas eutropha [J]. International Journal of General and Molecular Microbiology, 2000, 77(1): 49-55.
[56] COURTENS E N, DE CLIPPELEIR H, VLAEMINCK S E, et al. Nitric oxide preferentially inhibits nitrite oxidizing communities with high affinity for nitrite [J]. J. Biotechnol., 2015, 193: 120-122.
[57] HAO O J, CHEN J M. Factors affecting nitrite buildup in submerged filter system [J]. Journal of Environmental Engineering-ASCE, 1994, 120(5): 1298-1307.
[58] KINDAICHI T, OKABE S, SATOH H, et al. Effects of hydroxylamine on microbial community structure and function of autotrophic nitrifying biofilms determined by in situ hybridization and the use of microelectrodes [J]. Water Science and Technology, 2004, 49(11/12): 61-68.
[59] WANG Y, WANG Y, WEI Y, et al. In-situ restoring nitrogen removal for the combined partial nitritation-Anammox process deteriorated by nitrate build-up [J]. Biochemical Engineering Journal, 2015, 98: 127-136.
[60] WETT B, OMARI A, PODMIRSEG S, et al. Going for mainstream deammonification from bench to full scale for maximized resource efficiency [J]. Water Sci. Technol., 2013, 68(2): 283-289.
2016-03-14收到初稿,2016-04-22收到修改稿。
联系人及第一作者:谢丽(1976—),女,教授。
Received date: 2016-03-14.
中图分类号:X 703.1
文献标志码:A
文章编号:0438—1157(2016)07—2647—09
DOI:10.11949/j.issn.0438-1157.20160294
基金项目:国家自然科学基金项目(51378373,51178326)。
Corresponding author:Prof. XIE Li, sally.xieli@tongji.edu.cn supported by the National Natural Science Foundation of China (51378373,51178326).
A review on regulation methods of nitrite oxidizing bacteria in one-stage anaerobic ammonia oxidation process
XIE Li, YIN Zi, YIN Zhixuan, WANG Yuechao, ZHOU Qi
(College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China)
Abstract:In recent years,anaerobic ammonium oxidation (Anammox), a new technology for nitrogen removal, has been used in the treatment of high-strength ammonia wastewater due to its low energy consumption and high treatment efficiency. Whereas, the accumulation of nitrite oxidizing bacteria (NOB) often occurs in full-scale Anammox process, leading to the accumulation of nitrate and deterioration of nitrogen removal effectiveness. In two-stage Anammox processes, NOB accumulation often occurs in partial nitritation stage, the inhibition of which has been discussed in details. While in one-stage Anammox process, NOB accumulation is more common and fatal due to the complexity brought by the coexistence of functional bacteria like ammonium oxidizing bacteria (AOB), NOB, anaerobic ammonia oxidizing bacteria (AnAOB) and denitrifiers. It has been reported that NOB could be effectively suppressed in the one-stage Anammox process by some methods, e.g. regulating dissolved oxygen, altering the free ammonia and free nitrous acid concentration, adjusting carbon source and adding externally intermediate products (N2H4, NO, NH2OH), etc. The regulation methods mentioned above are systematically introduced on the basis of previous reports. Moreover, in practical Anammox crafts, the inhibitory methods should be conducted according to the specific operational conditions, and thus the available methods are further discussed.
Key words:one-stage Anammox; inhibition on NOB; dissolved oxygen; free ammonia and free nitrous acid;carbon source; intermediate products
