PKM2在喉鳞状细胞癌中的表达及临床意义
2016-08-05赵旭东季文樾
宋 辉,赵旭东,季文樾
(中国医科大学附属盛京医院耳鼻咽喉科,沈阳 110004)
PKM2在喉鳞状细胞癌中的表达及临床意义
宋辉,赵旭东,季文樾△
(中国医科大学附属盛京医院耳鼻咽喉科,沈阳 110004)
[摘要]目的为了明确喉癌组织中是否有M2型丙酮酸激酶(PKM2) mRNA和蛋白表达,进一步探讨喉癌组织中PKM2表达的临床意义。方法应用实时定量荧光PCR(Real-time PCR)和Western blot检测PKM2在93例喉癌组织和55例癌旁正常组织中的表达。分析PKM2蛋白是否和性别、年龄、细胞分化、肿瘤位置及T分期相关,以及喉癌组织中PKM2表达和临床病理参数的关系。结果喉癌中PKM2的mRNA表达水平是喉癌旁正常黏膜的4.32倍,差异具有统计学意义(P<0.05)。喉癌组织中PKM2 mRNA表达水平是喉癌旁正常黏膜的1.74倍,差异有统计学意义(P<0.05)。不同的性别、年龄及肿瘤位置之间的PKM2 mRNA表达水平差异无统计学意义(P>0.05)。T分期Ⅲ期和Ⅳ期及细胞分化为中低分化的病例PKM2蛋白水平分别显著高于T分期为Ⅱ期及细胞分化为高分化的病例(P<0.05)。结论PKM2在喉癌的发生、发展中起到一定的促进作用,可能是治疗喉癌的新靶点。
[关键词]喉肿瘤;丙酮酸激酶;M2型丙酮酸激酶;无氧糖酵解
喉癌是常见的头颈部恶性肿瘤,占全身肿瘤的第11位,约占新发恶性肿瘤的1%。世界的大多数地区喉癌的发病率继续呈上升趋势[1]。喉鳞状细胞癌占所有喉恶性肿瘤的85%~90%[2]。尽管外科治疗和放、化疗广泛地应用于喉癌的治疗,但是喉癌患者的5年生存率并没有提高[3]。因此,喉癌的分子生物学机制的研究十分重要,对于确定喉癌治疗的新靶点有重要意义。许多肿瘤细胞葡萄糖摄取能力很高但是氧化、磷酸化能力很低。肿瘤的这种在氧气的存在下持续大量产生乳酸的过程叫做“有氧糖酵解”。经大量研究发现丙酮酸激酶(pyruvate kinase,PK)在无氧糖酵解的生理过程中起到了关键作用。PK共有5种亚型,其中M2型丙酮酸激酶(PKM2)亚型在肿瘤细胞中比例明显升高,提示其有可能在肿瘤细胞的有氧糖酵解中起到关键作用。迄今尚少见关喉鳞状细胞癌与PKM2相关性方面的报道,本研究将通过实时定量荧光PCR(Real-time PCR)、Western blot来检测人喉鳞状细胞癌中PKM2表达水平并探讨其临床意义。
1资料与方法
1.1一般资料经患者知情同意,选择2011年1月至2013年12月于本院耳鼻喉科93例行手术的喉鳞状细胞癌患者,具有其完整临床资料。其中男87例,女6例;按照病理分级,高分化43例,中分化21例,低分化29例;按照国际抗癌协会2002年的喉癌分期标准分期,Ⅰ~Ⅱ期39例,Ⅲ~Ⅳ期54例。所有标本离体后迅速放入液氮中,-80 ℃深冻冰箱保存。所有上述患者术前均未接受放、化疗,标本为手术切除1 h内获得的癌组织93例(经病理证实为喉鳞状细胞癌组织)及癌旁正常组织55例(距肿瘤组织至少2.0 cm,病理证实未发现癌细胞)。
1.2方法
1.2.1主要试剂Trizol试剂、Real-time PCR试剂盒、商品化的甘油醛-3-磷酸脱氢酶(GAPDH)引物及PKM2引物合成购自大连宝生物公司;PKM2兔抗人多克隆抗体(工作浓度1∶1 000),购自美国Cell Signaling公司。
1.2.2Real-time PCR 方法检测PKM2 mRNA
1.2.2.1总RNA提取取-80 ℃深冻冰箱保存喉癌组织标本100 mg,加入1 mL Trizol和喉癌组织混合剪碎,使用匀浆机使样品充分裂解。再于匀浆后的标本混合液中加入200 uL氯仿,充分振荡、摇匀后于室温静置5 min,直至其完全分层。4 ℃低温离心机12 000 r/min离心15 min。提取上述离心后液体的上层无色液体,之后与500 μL异丙醇充分摇晃直至混匀,室温静置10 min,4 ℃低温离心机12 000 r/min离心15 min。移液器吸除上层无色液体,无水乙醇反复洗涤3次,4 ℃低温离心机12 000 r/min离心15 min,移液器吸除上层无色液体,室温晾干后每个样品中加入20 μL焦碳酸二乙酯(DEPC)水,使RNA样品充分溶解后,取1 μL样品再加79 μL DEPC水进行RNA测定。用分光光度计检测A260/A280吸光度比值,比值大于1.8为合格。
1.2.2.2Real-time PCR检测应用逆转录试剂盒逆转录成cDNA(大连宝生物公司),按照试剂加样。反应条件:37 ℃ 15 min,85 ℃ 5 s,1个循环。逆转录反应后取1 μL反应生成产物再加入9 μL灭菌蒸馏水,稀释为原生成物的10倍作为Real-time PCR反应的工作液。反转录反应体系按如下药品和剂量加样。5×PrimescriptTMbuffer 2.0 μL,RNase Free dH2O 5.5 μL,Random 6 mers 0.5 μL,PrimescriptTMRT Enzyme Mix 0.5 μL,Oligo dT Primer 0.5 μL,样品RNA 1.0 μL;合计每个样品10.0 μL。对93例喉癌及55例癌旁正常组织采用Real-time PCR方法检测GAPDH及PKM2的表达情况。PKM2引物设计及合成如下,上游:5′-CGA GCC TCA AGT CAC TCC ACA G-3′;下游:5′-GAT TCC GGG TCA CAG CAA TG-3′。反应条件:95 ℃ 10 s,1个循环;95 ℃ 5 s,61 ℃ 20 s,45个循环;95 ℃ 0 s,65 ℃ 15 s,95 ℃ 0 s。Real-time PCR反应体系按如下药品和剂量加样:SYBR premix Ex TaqTM5.0 μL,灭菌蒸馏水 3.0 μL,上游引物 0.5 μL,下游引物 0.5 μL,cDNA 1.0 μL;合计每个样品10.0 μL。
1.2.2.3Western blot检测取-80 ℃深冻冰箱保存喉癌组织标本100 mg,组织剪充分剪碎,加入0.6 mL蛋白裂解液,充分混匀。使用匀浆机充分匀浆(注意冰下操作,慎防工作温度过高使蛋白溶解),使充分裂解。4 ℃低温离心机12 000 r/min离心15 min,离心后,取出沉淀,吸取上层无色透明液体。提取的喉癌组织蛋白样品应用Larry法蛋白定量,并稀释成3 mg/mL。取稀释后蛋白样品0.1 mL,加入5×上样缓冲液,100 ℃沸水煮5 min后,室温静置,-20 ℃冰箱保存。取20 μL蛋白样品上样到10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,40 mA恒压电泳,待溴酚蓝进入凝胶底部后,进行蛋白转印,100 V,1.5 h条件下把蛋白质再印迹到硝酸纤维素膜上。充分洗膜后,用5%脱脂奶粉室温封闭硝酸纤维素膜1 h。再次TBST充分洗膜后,用抗PKM2和抗β-actin一抗4 ℃孵育过夜。再次TBST充分洗膜后,碱性磷酸酶标记的相应二抗室温孵育2 h。再次洗膜,应用ECL显色剂进行显色,置于凝胶成像仪成像,灰度值计算蛋白表达相对值。
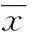
2结果
2.1PKM2在喉鳞状细胞癌中转录水平上调喉癌中PKM2 mRNA表达的相对值是4.32±1.97;喉癌旁正常黏膜中PKM2 mRNA表达的相对值是1.00±0.57。喉癌中PKM2 mRNA表达水平是喉癌旁正常黏膜的4.32倍,差异具有统计学意义(P<0.05),见图1。
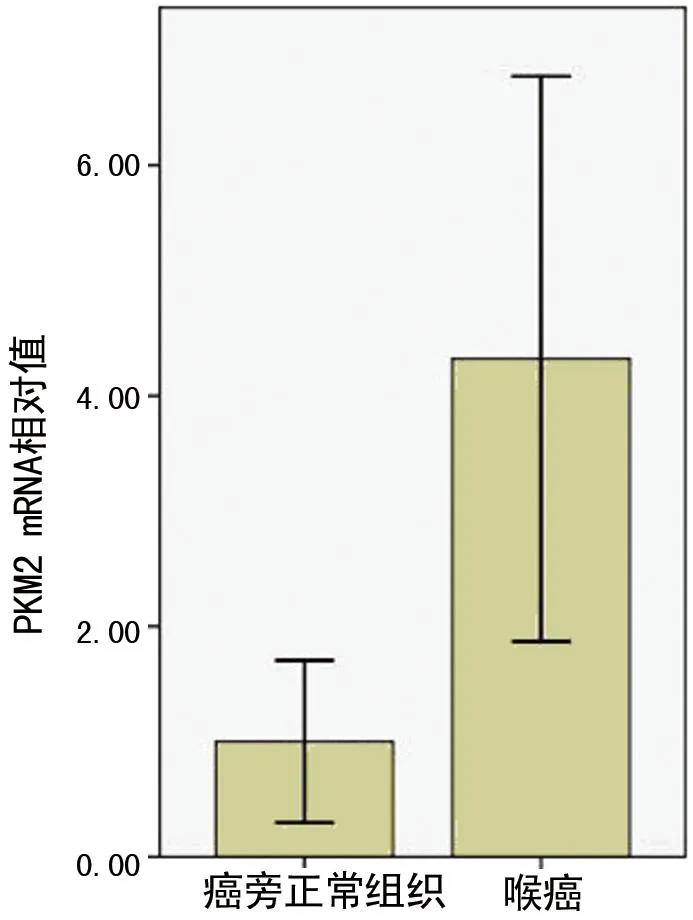
图1 Real-time PCR检测PKM2 mRNA表达水平
2.2PKM2蛋白在喉鳞状细胞癌中表达上调喉癌中PKM2 蛋白表达的相对值是71.26±44.12;喉癌旁正常黏膜中PKM2 蛋白表达的相对值是41.03±30.69。喉癌组织中PKM2的蛋白表达水平是喉癌旁正常黏膜的1.74倍,差异有统计学意义(P<0.05),见图2。
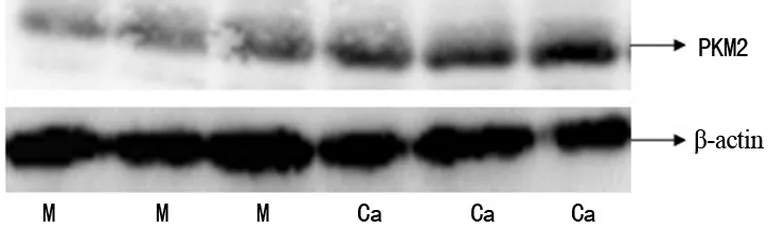
M:正常喉黏膜组织;Ca:喉癌组织。
图2Western blot检测PKM2蛋白表达水平
2.3PKM2 mRNA表达和临床病理学参数的关系不同的性别、年龄及肿瘤位置之间的PKM2 mRNA表达水平差异无统计学意义(P>0.05)。T分期Ⅲ期和Ⅳ期的病例PKM2 mRNA水平显著高于T分期为Ⅱ期的病例(P<0.05)。细胞分化为中低分化的病例PKM2蛋白水平显著高于细胞分化为高分化的病例(P<0.05),见表1。
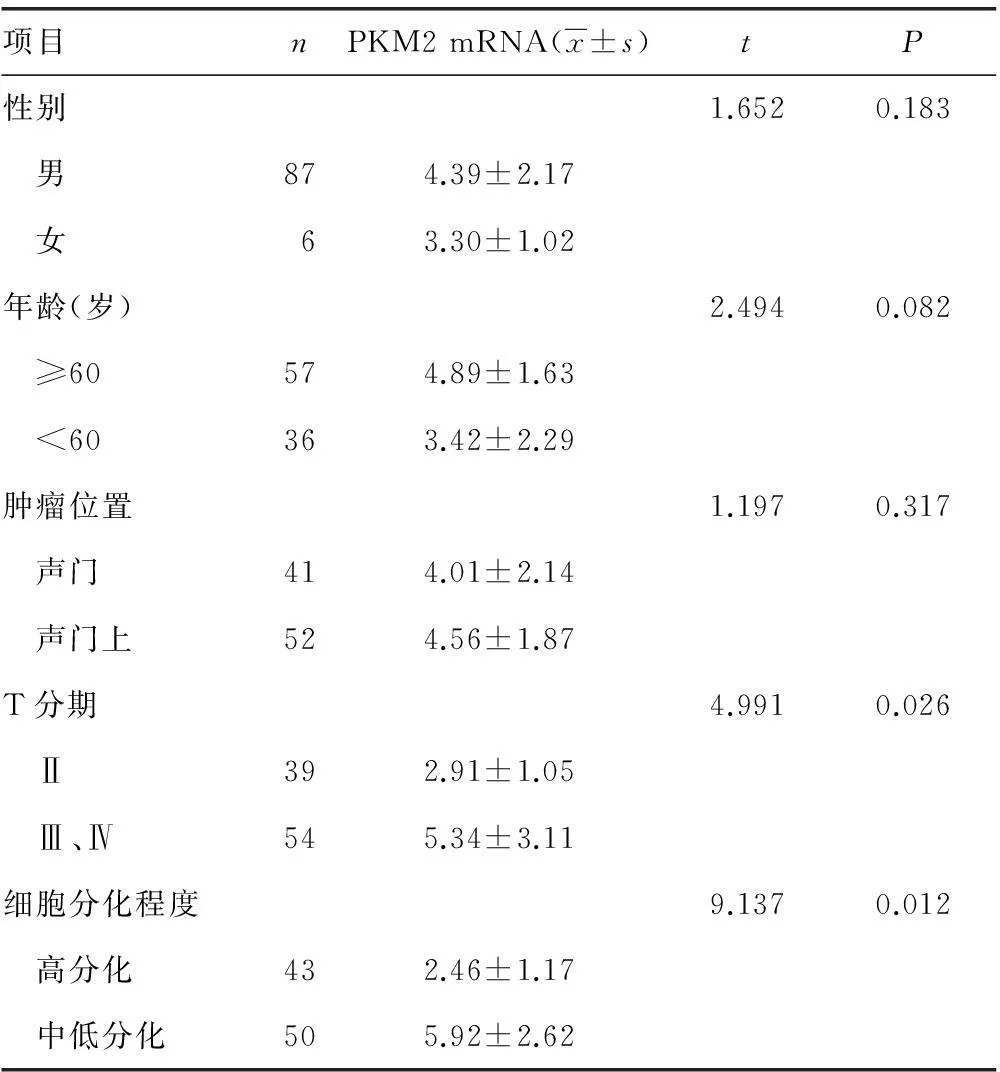
表1 PKM2 mRNA 和临床病理参数的关系
3讨论
目前很多的研究提出了肿瘤细胞可能存在一种新的代谢方式,其命名为有氧糖酵解。有氧糖酵解即在氧气充足的情况下肿瘤细胞不依靠线粒体进行氧化磷酸化供能,而是通过葡萄糖酵解产生能量,这种现象最早被Warburg发现并且提出。此后大量研究提示该种供能方式是肿瘤细胞的主要代谢方式之一,该现象被称作“瓦博格效应”(Warburg Effect)[4-5]。大量研究证实了瓦博格效应在肿瘤细胞的代谢中提供了大量的增殖使用的能量,为肿瘤细胞的无限制增殖提供了可能[6]。
PK有5种不同的同工酶,分别为L型、R 型、M1型、M2型和肿瘤M2型,这5种同工酶的表达具有组织特异性[7]。肾、小肠、近曲小管和肝脏主要表达L型PK。而R型主要见于红细胞主。PKM1主要存在于心脏、脑组织和骨骼肌组织。PKM2主要常见于肺、肾脏、胚胎和未分化或增生的组织、成人干细胞及肿瘤组织。以上5种亚型多数以四聚体形式存在,但是肿瘤细胞中的PKM2多数是二聚体,其功能表现为肿瘤细胞的特异性高代谢。在肿瘤形成过程中,PK同工酶之间的转化一直在发生中,例如,脑组织中的PKM1的消失,肝组织中L型PK的消失,同时被PKM2取代[8-19]。由于核酸的高速代谢与合成,肿瘤细胞被分类为核糖基因型和核酸基因型[9,20-21]。PKM2与有氧糖酵解的关系的研究一直都是肿瘤研究的热点,Christofk等[21]和Nix等[22]研究发现PKM2亚型可能是有氧糖酵解的关键酶,在肿瘤的新陈代谢和生长发育中发挥重要作用。PKM2蛋白表达上调和丙酮酸mRNA是正相关的,这些表达是由ras基因及其下游转录因子缺氧诱导因子-1(HIF-1)、刺激蛋白(SP)1和SP3调控的[23-25]。PKM2由四聚体分离成二聚体存在的过程与多种肿瘤原癌基因相互作用。人类乳头状瘤病毒E7原癌基因和PKM2密切相关。更有进一步研究提示使肿瘤细胞中的PKM2基因表达沉默,瓦博格效应逆转。这提示PKM2蛋白表达是有氧糖酵解所必需的,这种有氧糖酵解的代谢方式使肿瘤具有生长优势[26]。更有研究表明PKM2的二聚体和四聚体之间的相互转换的动态平衡,是正常细胞增殖的代谢调节方式[27-31]。
PKM2蛋白的过表达和口腔癌的不良愈合和临床病理参数成正相关[32]。Shikonin通过抑制PKM2抑制细胞增殖来抑制皮肤癌的发生、发展[33]。PKM2在HT29结肠癌细胞的发生、发展中起到了关键的促进作用,促进了结肠癌细胞的增生转移[34]。PKM2的过表达和宫颈癌的不良愈合和放疗抵抗明显相关。
本研究证明了喉鳞状细胞癌中存在PKM2 mRNA和蛋白的表达。和正常癌旁组织相比,PKM2 mRNA和蛋白在喉鳞状细胞癌组织中表达显著上调。这提示PKM2 mRNA和蛋白可能在人喉鳞状细胞癌的发生、发展中起到了一定的促进作用。同时本研究证明了不同的性别、年龄及肿瘤位置之间的PKM2 mRNA表达水平差异无统计学意义。而T分期Ⅲ期和Ⅳ期的病例PKM2 mRNA水平显著高于T分期为Ⅱ期的病例;细胞分化为中低分化的病例PKM2蛋白水平显著高于细胞分化为高分化的病例。这提示PKM2 mRNA和肿瘤的进展和分化程度密切相关。本研究结果表明PKM2促进喉鳞状细胞癌的侵袭性和生长,它的高表达可能是喉鳞状细胞癌发生和发展的关键因子。本研究没有包括临床分期Ⅰ期的喉鳞状细胞癌,因为Ⅰ期的喉鳞状细胞癌都通过激光手术治疗不能留存标本。对于PKM2在喉癌的代谢及肿瘤进展中的作用机制还需要进一步的研究。
综上,PKM2可能在喉癌的发生、发展中起到一定的促进作用,针对PKM2的治疗可能成为喉癌治疗新的方向。
参考文献
[1]Genden EM,Ferlito A,Silver CE,et al.Evolution of the management of laryngeal cancer[J].Oral Oncol,2007,43(5):431-439.
[2] Li P,Hu W,Zhu Y,et al.Treatment and predictive factors in patients with recurrent laryngeal carcinoma:a retrospective study[J].Oncol Lett,2015,10(5):3145-3152.
[3]Marioni G,Marchese-Ragona R,Cartei G,et al.Current opinion in diagnosis and treatment of laryngeal carcinoma[J].Cancer Treat Rev,2006,32(7):504-515.
[4]Tsuchihara K,Fujii S,Esumi H.Autophagy and cancer:dynamism of the metabolism of tumor cells and tissues[J].Cancer Lett,2009,278(2):130-138.
[5] Li J,Zhu S,Tong J,et al.Suppression of lactate dehydrogenase A compromises tumor progression by downregulation of the Warburg effect in glioblastoma[J].Neuroreport,2016,27(2):110-115.
[6]Yeh CS,Wang JY,Chung FY,et al.Significance of the glycolytic pathway and glycolysis related-genes in tumorigenesis of human colorectal cancers[J].Oncol Rep,2008,19(1):81-91.
[7]Christofk HR,Vander Heiden MG,Harris MH,et al.The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth[J].Nature,2008,452(7184):230-233.
[8] Czub E,Nowak JK,Moczko J,et al.Fecal pyruvate kinase is not suitable for discrimination between inflammatory bowel disease exacerbation and acute gastroenteritis[J].Dev Period Med,2015,19(2):167-173.
[9] Zhou X,Chen J,Wu W,et al.Role of adenosine 5′-monophosphate-activated protein kinase in α-linolenic acid-induced intestinal lipid metabolism[J].Br J Nutr,2015,114(6):866-872.
[10] Lockney NA,Zhang M,Lu Y,et al.Pyruvate kinase muscle isoenzyme 2 (PKM2) expression is associated with overall survival in pancreatic ductal adenocarcinoma[J].J Gastrointest Cancer,2015,46(4):390-398.
[11] Fu Y,Zhao D,Pan B,et al.Proteomic analysis of protein expression throughout disease progression in a mouse model of alzheimer′s disease[J].J Alzheimers Dis,2015,47(4):915-926.
[12] Kachel P,Trojanowicz B,Sekulla C,et al.Phosphorylation of pyruvate kinase M2 and lactate dehydrogenase A by fibroblast growth factor receptor 1 in benign and malignant thyroid tissue[J].BMC Cancer,2015,15:140.
[13] Zhan C,Yan L,Wang L,et al.Isoform switch of pyruvate kinase M1 indeed occurs but not to pyruvate kinase M2 in human tumorigenesis[J].PLoS One,2015,10(3):e0118663.
[14] Kim SR,Kim JO,Lim KH,et al.Regulation of pyruvate kinase isozyme M2 is mediated by the ubiquitin-specific protease 20[J].Int J Oncol,2015,46(5):2116-2124.
[15] Shinohara H,Taniguchi K,Kumazaki M,et al.Anti-cancer fatty-acid derivative induces autophagic cell death through modulation of PKM isoform expression profile mediated by bcr-abl in chronic myeloid leukemia[J].Cancer Lett,2015,360(1):28-38.
[16] Wei SN,Zhao WJ,Zeng XJ,et al.Microarray and co-expression network analysis of genes associated with acute doxorubicin cardiomyopathy in mice[J].Cardiovasc Toxicol,2015,15(4):377-393.
[17]Lobo C,Ruiz-Bellido MA,Aledo JC,et al.Inhibition of glutaminase expression by antisense mRNA decreases growth and tumourigenicity of tumour cells[J].Biochem J,2000,348(Pt 2):257-261.
[18] Shi J,Yang X,Yang D,et al.Pyruvate kinase isoenzyme M2 expression correlates with survival of cardiomyocytes after allogeneic rat heterotopic heart transplantation[J].Pathol Res Pract,2015,211(1):12-19.
[19] Wang F,Yang Y.Inhibition of PKM2 sensitizes triple-negative breast cancer cells to doxorubicin[J].Biochem Biophys Res Commun,2014,454(3):465-470.
[20] Aslan E,Adem S.In vitro effects of some flavones on human pyruvate kinase isoenzyme M2[J].J Biochem Mol Toxicol,2015,29(3):109-113.
[21]Christofk HR,Vander Heiden MG,Wu NA,et al.Pyruvate kinase M2 is a phosphotyrosine-binding protein[J].Nature,2008,452(7184):U27-181.
[22]Nix P,Nicolaides A,Coatesworth AP.Thyroid cancer review 1:presentation and investigation of thyroid cancer[J].Int J Clin Pract,2005,59(11):1340-1344.
[23] Mazurek S,Zwerschke W,Jansen-Dürr P,et al.Metabolic cooperation between different oncogenes during cell transformation:interaction between activated ras and HPV-16 E7[J].Oncogene,2001,20(47):6891-6898.
[24]Liu Z,Chen X,Wang Y,et al.PDK4 protein promotes tumorigenesis through activation of cAMP-response element-binding protein (CREB)-Ras homolog enriched in brain (RHEB)-mTORC1 signaling cascade[J].J Biol Chem,2014,289(43):29739-29749.
[25] Mazurek S,Zwerschke W,Jansen-Dürr P,et al.Metabolic cooperation between different oncogenes during cell transformation:interaction between activated ras and HPV-16 E7[J].Oncogene,2001,20(47):6891-6898.
[26]Mazurek S.Pyruvate kinase type M2:a key regulator of the metabolic budget system in tumor cells[J].Int J Biochem Cell Biol,2011,43(7):969-980.
[27]Luo W,Hu H,Chang R,et al.Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1[J].Cell,2011,145(5):732-744.
[28]Luo W,Semenza GL.Emerging roles of PKM2 in cell metabolism and cancer progression[J].Trends Endocrinol Metab,2012,23(11):560-566.
[29]David CJ,Chen M,Assanah M,et al.HnRNP proteins controlled by c-Myc deregulate pyruvate kinase mRNA splicing in cancer[J].Nature,2010,463(7279):364-368.
[30]Miller DM,Thomas SD,Islam A,et al.c-Myc and cancer metabolism[J].Clin Cancer Res,2012,18(20):5546-5553.
[31]Garcia-Cao I,Song MS,Hobbs RM,et al.Systemic elevation of PTEN induces a tumor-suppressive metabolic state[J].Cell,2012,149(1):49-62.
[32]Wang Y,Zhang X,Zhang Y,et al.Overexpression of pyruvate kinase M2 associates with aggressive clinicopathological features and unfavorable prognosis in oral squamous cell carcinoma[J].Cancer Biol Ther,2015,16(6):839-845.
[33]Li W,Zhang C,Ren A,et al.Shikonin suppresses skin carcinogenesis via inhibiting cell proliferation[J].PLoS One,2015,10(5):e0126459.
[34]Ginés A,Bystrup S,Ruiz De Porras V,et al.PKM2 subcellular localization is involved in oxaliplatin resistance acquisition in HT29 human colorectal cancer cell lines[J].PLoS One,2015,10(5):e0123830.
作者简介:宋辉(1970-),讲师,硕士,主要从事喉癌的病因学研究。 △通讯作者,E-mail:Jiwy@sj-hospital.org。
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.15.016
[中图分类号]R767.1
[文献标识码]A
[文章编号]1671-8348(2016)15-2080-04
(收稿日期:2015-11-15修回日期:2016-02-02)
The expression and clinical significance of PKM2 in laryngeal squamous cell carcinoma
Song Hui,Zhao Xudong,Ji Wenyue△
(OtolaryngologyDepartment,ShengjingHospitalAffiliatedtoChinaMedicalUniversity,Shenyang,Liaoning110004,China)
[Abstract]ObjectiveTo evaluate the expression of PKM2 mRNA and protein in laryngeal carcinoma and to further explore the clinical significance of PKM2 expression in laryngeal carcinoma.MethodsWe used Real-time PCR and Western blot to detect the expression of PKM2 in 93 cases of laryngeal carcinoma tissues and 55 cases of adjacent normal tissues.Then we analysed the relationship between PKM2 mRNA and gender,age,cell differentiation,tumor location,T stage in laryngeal carcinoma and the clinical pathological parameters.ResultsThe expression level of PKM2 mRNA in laryngeal carcinoma was 4.32 times higher than that of adjacent normal mucosa,and the difference had statistical significance(P<0.05).The expression level of PKM2 protein in laryngeal carcinoma was 1.74 times higher than that of adjacent normal mucosa,and the difference had statistical significance(P<0.05).There was no statistical significant difference among different gender,age and primary tumor tissue(P>0.05).The expression of PKM2 mRNA in patients of T3,T4 patients and lower pathological differentiation were significant elevated(P<0.05).ConclusionPKM2 might play a certain role in promoting development of the occurrence of laryngeal carcinoma.
[Key words]laryngeal neoplasms;pyruvate kinase;PKM2;anaerobic glycolysis
