心肌细胞传感器优化设计及其药物分析
2016-08-01方佳如曹端喜苏凯麒黎洪波
王 琴, 方佳如, 曹端喜, 周 洁, 苏凯麒, 黎洪波, 王 平
(浙江大学 生物传感器国家专业实验室 生物医学工程教育部重点实验室生物医学工程与仪器科学学院,浙江 杭州 310027)
心肌细胞传感器优化设计及其药物分析
王琴, 方佳如, 曹端喜, 周洁, 苏凯麒, 黎洪波, 王平
(浙江大学 生物传感器国家专业实验室 生物医学工程教育部重点实验室生物医学工程与仪器科学学院,浙江 杭州 310027)
摘要:为了构建高度稳定性和一致性的心肌细胞电位传感器,从微电极阵列表面亲水性和细胞培养密度两方面对心肌细胞和微电极阵列(MEA)的耦合性进行研究.通过对MEA表面进行高分子蛋白明胶的修饰来提高MEA表面的亲水性,并重点分析不同细胞密度下构建的心肌细胞电位传感器的胞外场电位信号(EFP)信号特征.研究结果表明:心肌细胞按优化密度12 万/cm2培养在经明胶修饰的MEA表面上,可促使心肌细胞和MEA形成高度紧密的耦合.在此条件下构建的心肌细胞传感器,能稳定输出一致性良好的EFP信号,电位幅值可达到约1.2 mV,发放频率可达到约180 次/min,信号稳定期可维持3~4 d.通过选择2种典型的工具药物异丙肾上腺素和利多卡因对优化后的心肌细胞电位传感器进行分析性能的测试,实验结果表明:20 μM的异丙肾上腺素和利多卡因分别大幅度增强和抑制了电位幅值和发放频率,结果与文献报导的结果相一致.该心肌细胞传感器对2种测试药物作出了快速而灵敏的响应,有望成为药物检测和分析的有效平台.
关键词:微电极阵列(MEA);心肌细胞;亲水性;细胞密度;细胞传感器;胞外场电位信号
近年来,许多药物因导致心律失常致使心脏骤然性停搏而从市场上撤回[1-4].这不仅给人类健康造成巨大的威胁,也给制药工业带来严重的经济损失.在生物技术和制药工业领域中急需有效的药物早期筛选测试方法,用以评价药物引起的心脏毒性,以减少药物诱发的心律失常和后期的药物损耗[5-7].大多数药物引起的心律失常表现为尖端扭转室性心动过速(Tdp),其诱发机制为QT间期(即心电图ECG中心室动作电位的时程)的延长[8-9].目前,用于QT间期分析的方法主要有在体检测法和离体检测法,其中离体检测法因其成本低、检测时间较短、药物损耗少而越发受到研究者的关注[10-13].
在细胞水平上,传统的QT间期检测法为膜片钳记录法,虽然膜片钳为金标准的检测手段,但该方法存在操作繁琐、通量低、无法检测动作电位传播等缺点[14].近年来,随着微电子技术的发展,微电极阵列(microelectrodearray,MEA)记录法已成为细胞电生理信号检测的常用手段.该方法操作简单,通量高,可以同时检测几十甚至上百个通道的电生理信号[15-17].更重要的是,MEA记录法能长时无损地检测细胞的放电活动,目前在心脏研究、突触可塑性研究、高通量药物筛选等研究领域发挥着越来越重要的作用[18-20].MEA不仅能分析心肌细胞的放电活动,更能实现不同药物的心脏安全性评价[16].MEA制作简单,易于检测心肌细胞网络的多种参数,可以探测心肌细胞层的动作电位传播[21-22].虽然MEA记录法具有以上的诸多优点,但相较于传统的膜片钳记录法,MEA所检测到的胞外场电位(extracellularfieldpotential,EFP)信号幅度偏低、信噪比不高,这和微电极与待测兴奋性细胞耦合不够紧密有关.因此,提高细胞和MEA的耦合性是构建高性能心肌细胞电位传感器的关键.
本文旨在研究MEA表面亲水性和细胞培养密度对细胞和MEA耦合的影响,同时分析不同细胞密度下构建的心肌细胞电位传感器的EFP信号特征,并对改善后的心肌细胞电位传感器进行性能测试.
1材料与方法
1.1MEA芯片的设计与心肌细胞电位传感器的构建
鉴于以往实验室自行设计的MEA芯片表面积
过小,培养在上面的细胞难以生长均匀,导致各个通道记录到的信号幅度小且一致性差.本研究设计的MEA芯片表面积为2×2cm2,比以往增大了4倍.如图1所示为MEA芯片设计图,MEA呈6×6阵列排布,32个电极作为记录电极,单个电极大小为30μm,电极间距为300μm.MEA的基本结构包括绝缘基底、金属层电极阵列以及钝化层.MEA的制作采用标准的微电子加工技术.首先,将一层30nm钛层和一层300nm金层分别沉积到玻璃基底上,作为黏附层和电极层;接着,采用光刻技术刻蚀出电极位点和引线布局,除去光刻胶后沉积一层1μm的Si3N4作为钝化层,并用KOH湿法刻蚀技术暴露出电极和焊盘;最后,用金线将芯片上的焊盘和PCB上的焊盘点焊连接.实验前将电极表面电镀铂黑,减小电极阻抗而提高信噪比.如图2所示为心肌细胞电位传感器的工作原理图.图中,Uref代表参考电势,Za代表前置放大器的输入阻抗,Uout代表输出电压,SAM(self-assembledmonolayers)代表自组装分子修饰层.心肌细胞培养在MEA芯片上,通过一层薄的电解液同芯片的电极相耦合.心肌细胞和MEA耦合在一起后,具有电生理特性的心肌细胞会产生动作电位,细胞膜上离子通道的选择性开启和闭合导致细胞内外离子浓度发生变化,因此,通过检测细胞外和离子浓度相关的场电位变化,可有效地记录细胞的电生理信号.

图1 32 通道 MEA 芯片设计图Fig.1 Design drawing of MEA pattern with 32 channels
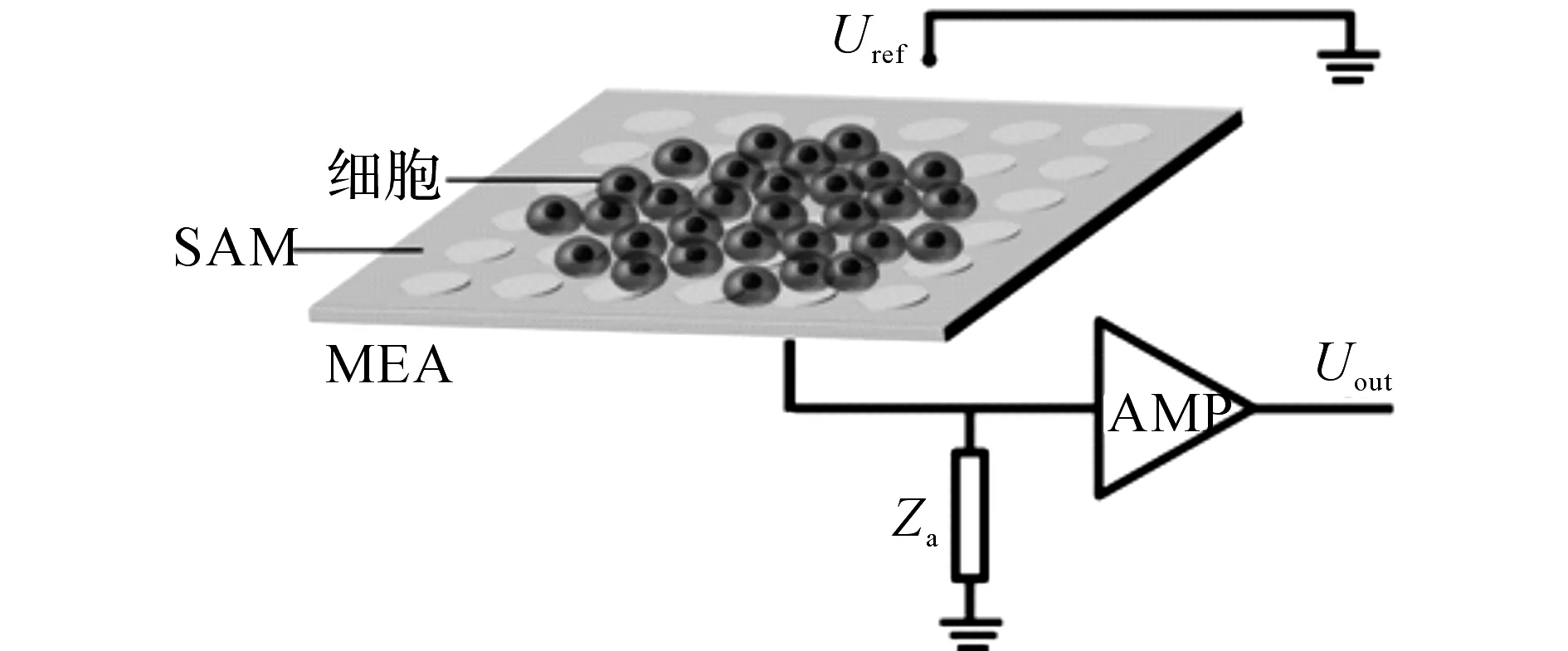
图2 心肌细胞电位传感器工作原理图Fig.2 Working principle of cardiomyocyte-based potential biosensor
1.2MEA芯片的封腔与清洗
刚加工完的MEA芯片,经划片、贴片、点焊后,及时置于真空泵中保存.封装细胞培养腔之前,用硅胶(Dowcorning184)将两排焊盘之间裸露的金线绝缘封闭,待硅胶固化后,紧接着用同种硅胶封装培养腔.如图2所示为封装好的MEA芯片.本研究用的细胞培养腔是一次性塑料针管经等距离电切割后的圆形腔体(孔的内径为1.8cm,高度为2.0cm).此种腔体对细胞无毒害作用,可高压灭菌,且便于封装.封腔后的MEA芯片先用普通的去污剂浸泡数分钟,接着用医用棉签轻轻擦拭其表面,之后用大量清水冲洗,最后用双蒸水涮洗数遍.将MEA芯片进行50 ℃烘干后即可置于超净台进行紫外灭菌.MEA芯片可重复使用,培养过细胞的芯片须先用含酶去污剂(1%Terg-A-Zyme)浸泡30~60min,剩余步骤同上.
1.3MEA芯片的表面修饰与保存
MEA芯片经紫外灭菌30min后,为了增强其表面的亲水性,用高分子蛋白对其进行表面修饰.实验组用0.1%明胶(粉剂购自Sigma公司,货号:G9391,用PBS缓冲液配制而成)包被MEA表面,置于温度为4 ℃的冰箱过夜(修饰时间约16h).第二天弃去明胶,并用无菌水清洗2遍.对照组不做任何表面修饰.明胶修饰后的MEA芯片即可用于心肌细胞的培养,暂时不用的芯片加满无菌水,用封口膜封闭培养腔口,置于温度为4 ℃的冰箱保存,以维持表面的亲水性.
1.4原代心肌细胞的培养
选取清洁级健康新生SD大鼠(出生24h内), 使用75%(体积分数)的酒精消毒,打开胸腔,取心脏心尖部,置于预冷的高糖培养基(Dulbecco’smodifiedeaglemedium,DMEM)中,漂洗3次,去除心房和血管等组织.转移心肌组织于平衡盐溶液(Hanksbalancedsaltsolution,HBSS)中,剪成约1mm3的小块,弃上清,加入消化液(含0.07% 胰蛋白酶和 0.05%II型胶原酶),置于培养箱8min,隔4min后轻轻晃动玻璃瓶.8min后弃上清,重复消化12次,直至心肌组织呈现疏松状态.向心肌组织加入5mL含10%的胎牛血清(fetalbovineserum,FBS)的DMEM培养基,轻轻吹打组织,收集单细胞悬浮液.以800r/min的速度离心细胞悬浮液5min,重悬细胞,用70μm的细胞筛过滤,收集细胞悬液到培养瓶中进行差速贴壁2次,每次45min,以去除纤维细胞和其他细胞.差速贴壁后,进行活细胞计数,并将细胞按不同细胞密度接种在MEA芯片上.之后,每隔1d用含10%胎牛血清(fetalbovineserum,FBS)的高糖培养基全量换液,培养2d后,开始检测记录心肌细胞的胞外场电位(Extracellularfieldpotential,EFP)信号.
1.5心肌细胞EFP信号的检测
EFP信号的检测与记录采用MEA-1060(MultichannelSystems,Germany)检测系统.该系统能实时长时程记录EFP信号,采样率为10kHz.检测时,系统置于屏蔽箱以防止外界电磁的干扰,噪声水平维持在20μV左右.MEA上的心肌细胞培养2d后,开始进行EFP信号检测,每隔12h检测一次,每次检测5min.待信号稳定后,开始对心肌细胞进行药物干预.药物干预前,首先记录10min的自发放EFP信号,然后弃去培养液,分别加入不同物质的量浓度的异丙肾上腺素(isoprenaline,ISO)和利多卡因(lidocaine,LID)工作液(用细胞培养液稀释),实时检测心肌细胞电位传感器对这2种药物的响应.
1.6数据处理
用MC_Rack软件显示和分析记录到的EFP信号,观察心肌细胞EFP信号的发放情况.采用Matlab对EFP信号进行特征参数峰电位幅值(spikeamplitude,SA)和发放频率(firingrate,FR)的提取和分析.
2实验结果
2.1MEA亲水性对细胞和MEA耦合的影响
为了提高MEA表面的亲水性,加强其表面和细胞的耦合程度,用高分子蛋白明胶对MEA表面进行修饰.明胶是一种常用的材料表面修饰蛋白,具有丰富的亲水基团,能大幅度提高材料表面的亲水性.实验发现,经明胶修饰的MEA表面亲水性很强,向其表面滴加一滴水,可见水滴迅速铺展,形成一层水膜;而未经明胶修饰的MEA表面亲水性较差,向其表面滴加一滴水,水滴则难以铺展开来.
心肌细胞按高细胞密度(18 万/cm2)分别培养在未经明胶修饰和经明胶修饰的MEA上.如图3为对照组和处理组的MEA上培养四天后的原代心肌细胞.很显然,对照组MEA芯片表面对细胞的贴附性远不如处理组的MEA.处理组MEA上的心肌细胞生长状态良好,培养至第四天时已形成一片分布致密、状态成熟、呈岛屿状同步搏动的细胞层.对照组MEA上的心肌细胞分布稀疏,形态畸形,每一次换液后,都会有大量细胞从MEA表面脱落.以上实验结果表明:经高分子蛋白明胶修饰的MEA,其表面的亲水性大幅度提高,从而促使细胞和MEA形成紧密的耦合.
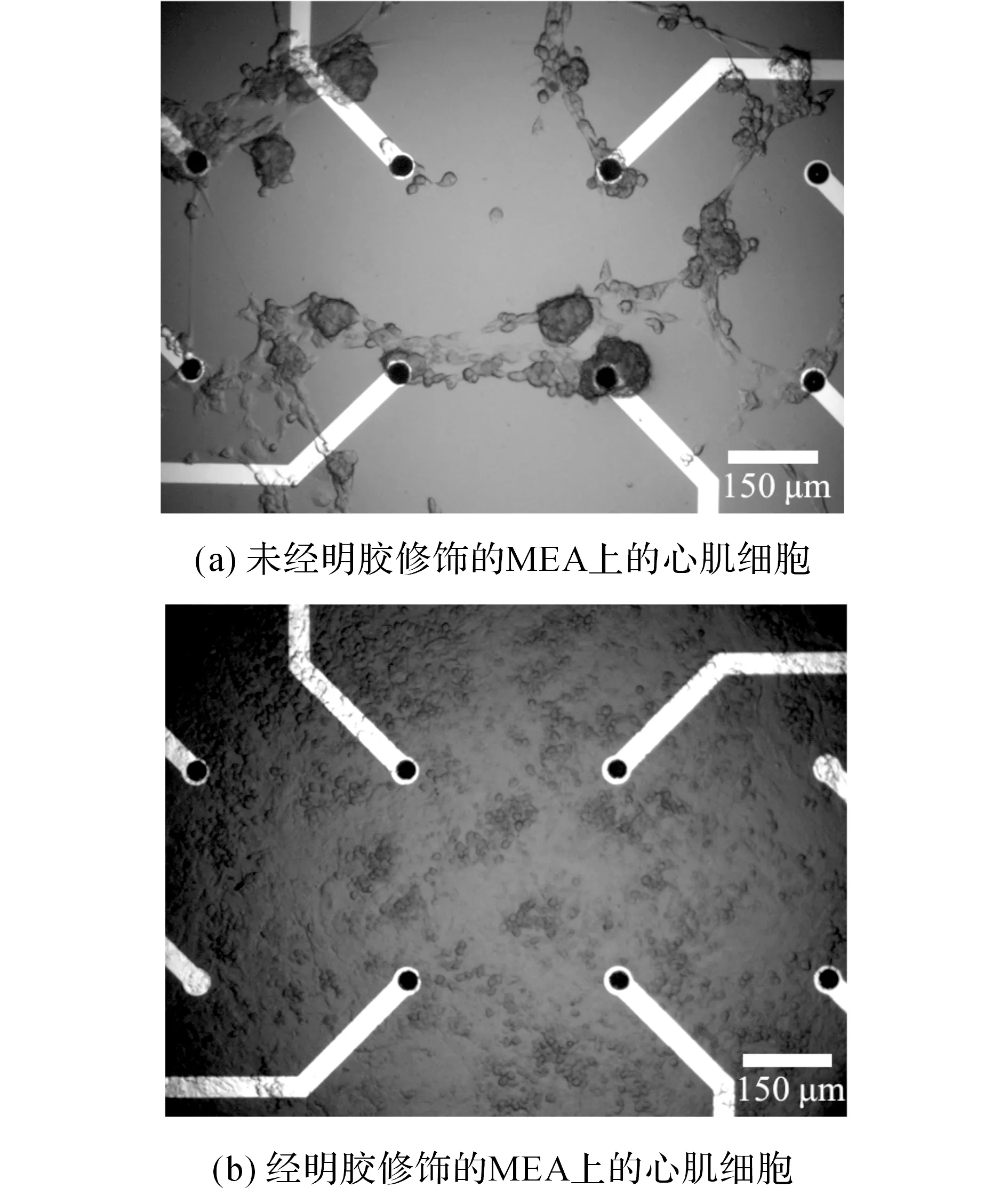
图3 明胶修饰对MEA和心肌细胞耦合的影响Fig.3 Effect on coupling of MEA and cardiomyocytes by gelatin modification
2.2细胞密度对细胞和MEA耦合的影响
合适的细胞密度是MEA和细胞耦合紧密的一个重要前提.为此,研究不同细胞密度下构建的心肌细胞电位传感器的EFP信号特征.
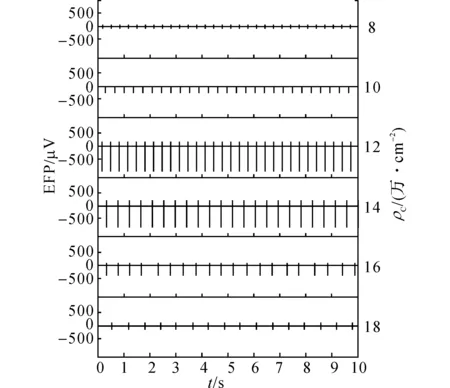
图4 第5天不同细胞密度下心肌细胞电位传感器记录到的典型的单通道EFP信号(时程为10 s)Fig. 4 10 s of representative EFP signals on single channel recorded by cardiomyocyte-based potential biosensor under diffirent cell densities on 5th day
心肌细胞按不同细胞密度ρC(8~18 万/cm2)接种在预先用明胶进行表面修饰的MEA芯片上,培养二天后开始检测EFP信号,每隔12h检测一次,每次检测5min,持续检测1周.如图4所示为第五天不同细胞密度下记录到的EFP信号.当细胞密度为12 万/cm2时,心肌细胞传感器输出的EFP信号一致性最好,峰电位幅值最大(>1mV);而当细胞密度过低,只有8 万/cm2时,心肌细胞传感器输出的EFP信号峰电位幅值大幅度下降,不到200μV;当细胞密度过大,达到18 万/cm2时,心肌细胞传感器输出的EFP信号峰电位幅值也大幅度下降,不到300μV.

图5 第五天不同细胞密度下心肌细胞电位传感器记录到的EFP信号 (Mean±SD, n=6)Fig.5 EFP signals recorded by the cardiomyocyte-based potential biosensor under diffirent cell densities on 5th day. (Mean±SD, n=6)
从原始EFP信号中提取2个典型的特征参数峰电位幅值和发放频率进行统计分析(6个平行组,即n=6).如图5(a)和(b)所示分别为不同细胞密度下EFP信号的SA和FR的统计结果,其中,SA(spikeamplitude)表示胞外场电位的峰电位幅值,FR(firingrate)表示胞外场电位发放频率.结果表明:当ρC为12万/cm2时,心肌细胞传感器输出的EFP信号的SA最大,FR最高,且信号的重复性(SDSA<40μV, SDFR<10次/min)最好,其中,SD代表标准差.按细胞密度12 万/cm2构建的心肌细胞传感器从第三天开始能检测到微弱的EFP信号,之后信号幅度快速增强,直至第五天信号幅度达到最大,且维持3~4d的信号平台期(SA: 1~1.2mV;FR: 160~180 次/min),该平台期是进行药物检测的最佳时期.按细胞密度8 万/cm2和10 万/cm2构建的心肌细胞传感器到第五天才能检测到微弱的EFP信号,之后信号幅度缓慢增强但始终小于400μV.按细胞密度为14、16和18万/cm2构建的心肌细胞传感器从第三天开始能检测到微弱的EFP信号,之后信号幅度快速增强,其中按细胞密度18 万/cm2构建的心肌细胞传感器到第四天信号幅度达到最大,但仅维持不到1d的信号平台期,随后信号幅度便快速下降.按细胞密度为14万/cm2和16万/cm2构建的心肌细胞传感器均在第五天信号幅度达到最大,并维持1~2d的信号平台期.
以上结果均表明:合适的细胞密度可促使MEA和心肌细胞形成高度紧密的耦合,从而使MEA所检测到的EFP信号大幅度增强.按合适的细胞密度12 万/cm2构建的心肌细胞电位传感器能长时间稳定输出高幅度的EFP信号.
2.3心肌细胞电位传感器的性能测试
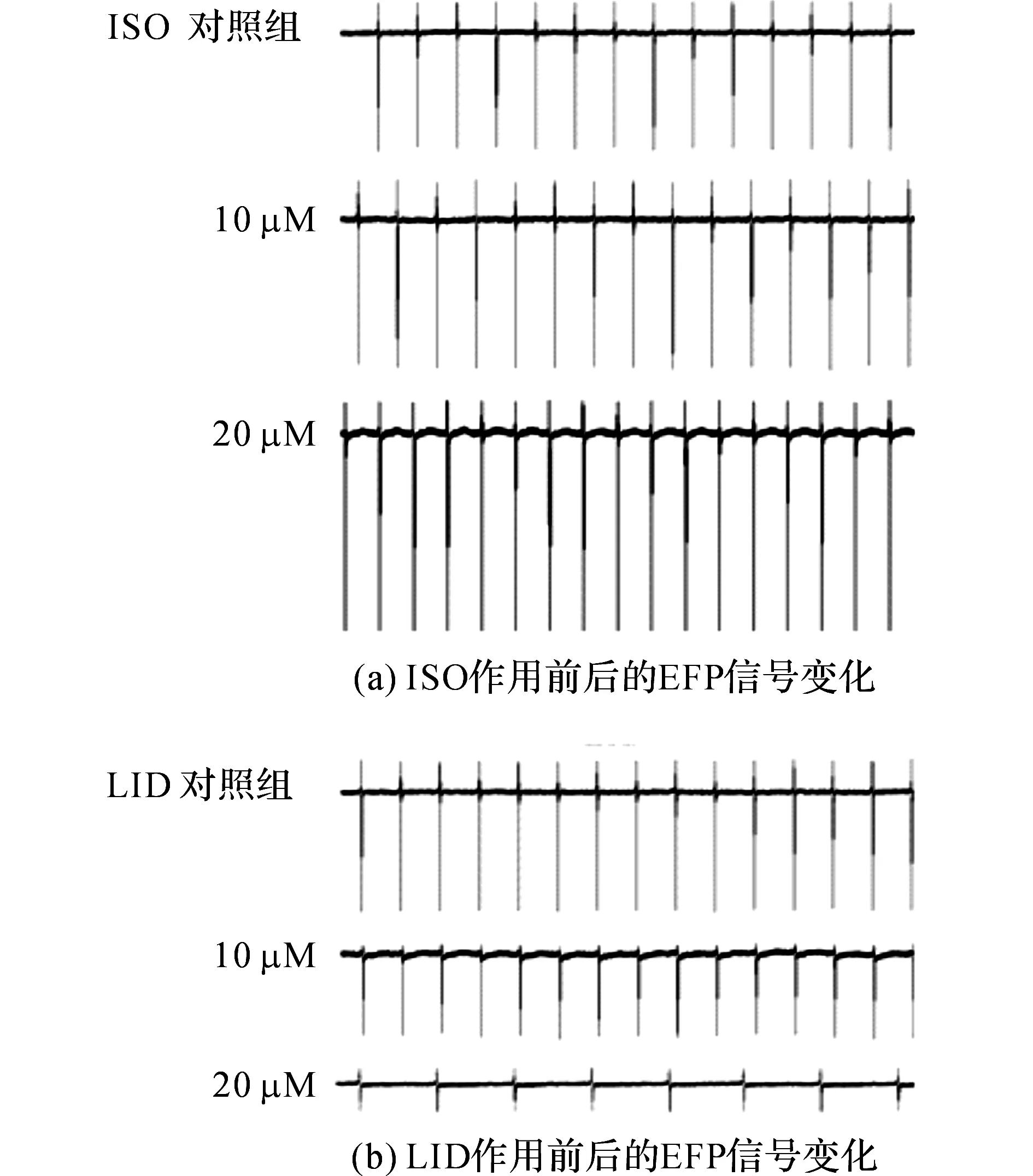
图6 药物作用5 min后心肌细胞电位传感器记录到的EFP信号 Fig.6 EFP signals recorded by cardiomyocyte-based potential biosensor under drugs treatment after 5 min.
为了测试我们构建的心肌细胞电位传感器是否适用于药物的检测和分析,选取2种典型的工具药物异丙肾上腺素(ISO)和利多卡因(LID)对其进行了性能测试,分析该传感器对不同浓度下ISO和LID的响应特征.ISO是一种β受体激动剂,许多文献报导ISO会加快心肌细胞的搏动频率和增强心肌细胞的搏动幅度[24-25].如图6(a)所示为不同浓度LID作用前后心肌细胞电位传感器记录到的EFP信号.20μM的异丙肾上腺素(ISO)大幅度增强了心肌细胞的放电活动.如图7(a)和(b)所示分别为ISO作用5min后EFP信号参数SA和FR的变化特征图.10μMISO组的EFP信号的峰电位幅值与对照组相比有提高(p<0.05),20μMISO组的EFP信号的峰电位幅值与10μMISO组相比有显著性提高(p<0.01).如图7(b)所示,10μMISO组的EFP信号的发放频率与对照组相比没有差异(p>0.05),而20μMISO组的EFP信号的发放频率与对照组相比有显著性提高(p<0.01).以上结果表明:ISO会增强心肌细胞的放电活动,而且这种增强作用呈现浓度依赖性,该结果与文献[24]的研究结果相一致.
LID是一种典型的心脏钠离子通道抑制剂,常被用来研究心肌细胞的电生理活动.如图6(b)所示为不同物质的量浓度LID作用前后心肌细胞电位传感器记录到的EFP信号.20μM的利多卡因(LID)大幅度抑制了心肌细胞的放电活动.如图7(c)和(d)所示分别为ISO作用5min后EFP信号参数电位幅值和发放频率的变化特征图.如图7(c)所示,10μMLID组的EFP信号的电位幅值与对照组相比有显著性下降(p<0.01),20μMLID组的EFP信号的电位幅值与10μMLID组相比有显著性下降(p>0.01).如图7(d)所示,10μMLID组的EFP信号的发放频率与对照组相比没有差异(p<0.05),而20μMLID组的EFP信号的发放频率与对照组相比有显著性下降(p>0.01).以上结果表明:LID会抑制心肌细胞的放电活动,而且这种抑制作用呈现浓度依赖性,该结果与文献[8]的研究结果相一致.

图7 药物作用5 min后,心肌细胞电位传感器的响应特征图(Mean±SD, n=6)Fig. 7 Response of cardiomyocyte-based potential biosensor to drugs under 5 min treatment (Mean±SD, n=6)
3讨论
到目前为止,细胞和硅器件表面的耦合问题仍然是细胞传感器研究中的一个重大难点.细胞和硅表面的耦合情况直接影响了细胞传感器输出信号的大小.经验证明,细胞和硅表面耦合不紧密会直接导致检测到的信号幅度偏低,而难以进行有用信号的提取和分析,有时信号甚至会被淹没在噪声中.基于前人的研究,本文认为影响细胞和硅表面耦合的因素,从根本上讲分为2个方面:一方面为硅表面的亲水性、电荷密度和粗糙程度;另一方面为细胞的培养密度.
本文研究了心肌细胞和MEA芯片表面的耦合情况.经长期的实验摸索,发现MEA表面的亲水性和细胞培养密度是影响两者耦合的关键因素.一方面,研究结果表明:在强亲水性的MEA芯片表面,心肌细胞生长良好,细胞和芯片表面耦合紧密;而在亲水性差的MEA表面,就算以高密度接种的心肌细胞也难以在芯片上附着生长.这一现象和细胞膜的特殊结构有关.动物细胞表面有一层薄膜结构,称为细胞(质)膜,其疏水端朝向细胞质,亲水端朝向细胞外液,因此,原代贴壁细胞只有在强亲水性的基底上才能生长良好.基于细胞膜的这一特性,提高硅表面的亲水性是改善细胞和硅表面耦合的一种有效而简便的方法.另一方面,研究结果表明:在保证MEA表面强亲水性的情况下,合适的细胞密度可使心肌细胞在MEA上快速生长分化,形成一片均匀分布、高度融合、同步搏动的单细胞层.此时的细胞层与MEA形成高度紧密的耦合,在显微镜下观察可见每一个微电极表面均有数量相近的心肌细胞附着.在此情况下,MEA所检测到的EFP信号幅度高且一致性良好,几乎每一个通道都能记录到信号,而且各个通道记录到的信号之间的差异均小于40μV.由于细胞密度过低,心肌细胞在MEA上生长缓慢,细胞与细胞之间难以形成良好的细胞链接,使得相邻细胞之间的电兴奋传播受到抑制,只有少数的通道能记录到EFP信号,而且信号之间的差异较大.同样地,细胞密度过高,在细胞培养的成熟期,部分心肌细胞会因营养耗竭和细胞接触性抑制而提前死亡,细胞死亡过程中会分泌大量的有毒物质而影响其他细胞的放电活动,从而导致EFP信号幅度快速下降,而且部分电极会因死细胞的附着而无法记录到信号.因此,优化细胞密度是加强细胞和硅表面耦合的重要手段.
4结语
本文通过提高MEA表面亲水性和优化细胞密度,促使心肌细胞和MEA形成高度紧密的耦合,并成功构建了一种高度稳定性和重复性的心肌细胞电位传感器.该传感器可以长时程实时记录心肌细胞的放电活动,稳定输出一致性良好的高幅度EFP信号.性能测试结果表明:该心肌细胞电位传感器对测试药物做出了快速而灵敏的响应,有望成为药物检测和分析的有效平台.
参考文献(References):
[1]REDFERNW,CARLSSONL,DAVISA.etal.Relationshipsbetweenpreclinicalcardiacelectrophysiology,clinicalQTintervalprolongationandtorsadedepointesforabroadrangeofdrugs:evidenceforaprovisionalsafetymarginindrugdevelopment[J].CardiovascularResearch, 2003, 58(1): 32-45.
[2]LAVERTYH,BENSONC,CARTWRIGHTE,etal.Howcanweimproveourunderstandingofcardiovascularsafetyliabilitiestodevelopsafermedicines[J].BritishJournalofPharmacology, 2011, 163(4): 675-693.
[3]BOWESJ,BROWNAJ,HAMONJ,etal.Reducingsafety-relateddrugattrition:theuseofinvitropharmacologicalprofiling[J].NatureReviewsDrugDiscovery, 2012, 11(12): 909-922.
[4]LEXCHINJ.DrugwithdrawalsfromtheCanadianmarketforsafetyreasons, 1963-2004 [J].CanadianMedicalAssociationJournal, 2005, 172(6): 765-767.
[5]MOSSAJ,KASSRS.LongQTsyndrome:fromchannelstocardiacarrhythmias[J].JournalofClinicalInvestigation, 2005, 115(8): 2018-2024.
[6]BRAAMS.R,TERTOOLENL,VANDESTOLPEA,etal.Predictionofdrug-inducedcardiotoxicityusinghumanembryonicstemcell-derivedcardiomyocytes[J].StemCellResearch, 2010, 4(2): 107-116.
[7]GIORGIMA,BOLANOSR,GONZALEZCD,etal.QTintervalprolongation:preclinicalandclinicaltestingarrhythmogenesisindrugsandregulatoryimplications[J].CurrentDrugSafety, 2010, 5(1): 54-57.
[8]NATARAJANA,STANCESCUM,DHIRV,etal.Patternedcardiomyocytesonmicroelectrodearraysasafunctional,highinformationcontentdrugscreeningplatform[J].Biomaterials, 2011, 32(18): 4267-4274.
[9]HANCOXJC,MCPATEMJ,ELHARCHIA.ThehERGpotassiumchannelandhERGscreeningfordrug-inducedtorsadesdepointes[J].PharmacologyandTherapeutics, 2008, 119(2): 118-132.
[10]HANSENA,EDERA,BÖNSTRUPM,etal.Developmentofadrugscreeningplatformbasedonengineeredhearttissue[J].CirculationResearch, 2010, 107(1): 35-44.
[11]CHIKR.Revolutiondawningincardiotoxicitytesting[J].NatureReviewsDrugDiscovery, 2013, 12(8):565-567.
[12]ABASSIYA,XIB,LIN,etal.Dynamicmonitoringofbeatingperiodicityofstemcell‐derivedcardiomyocytesasapredictivetoolforpreclinicalsafetyassessment[J].BritishJournalofPharmacology, 2012,165(5): 1424-1441.
[13]MANDENIUSCF,STEELD,NOORF,etal.Cardiotoxicitytestingusingpluripotentstemcell-derivedhumancardiomyocytesandstate-of-the-artbioanalytics:areview[J].JournalofAppliedToxicology, 2011, 31(3): 191-205.
[14]FERMINIB,FOSSAAA.Theimpactofdrug-inducedQTintervalprolongationondrugdiscoveryanddevelopment[J].NatureReviewsDrugDiscovery, 2003, 2(6): 439-447.
[15]XIAOL,HUZ,ZHANGW,etal.Evaluationofdoxorubicintoxicityoncardiomyocytesusingadualfunctionalextracellularbiochip[J].BiosensorsandBioelectronics, 2010, 26(4): 1493-1499.
[16]MEYERT,KRAUSHAARU,GUENTHERE.MicroelectrodeArray(MEA)highresolutionelectrophysiologicalmappingofcardiaccell,tissueandorganpreparations[C] ∥ 2009WorldCongressonMedicalPhysicsandBiomedicalEngineering.Munich:IFMBE, 2009: 112-115.
[17]XUB,JACQUIRS,LAURENTG,etal.Phasespacereconstructionofanexperimentalmodelofcardiacfieldpotentialinnormalandarrhythmicconditions[C]∥2013AnnualInternationalConferenceoftheIEEE.Osaka:IEEE, 2013: 3274-3277.
[18]KORNBLUMA,PILLEKAMPF,MATZKIESM,etal.Anewmodeltoperformelectrophysiologicalstudiesintheearlyembryonicmouseheart[J].CellularPhysiologyandBiochemistry, 2013, 32(1): 1-10.
[19]JOHNSTONEAF,GROSSGW,WEISSDG,etal.Microelectrodearrays:aphysiologicallybasedneurotoxicitytestingplatformforthe21stcentury[J].Neurotoxicology, 2010, 31(4): 331-350.
[20]CASPIO,ITZHAKII,KEHATI,etal.Invitroelectrophysiologicaldrugtestingusinghumanembryonicstemcellderivedcardiomyocytes[J].StemCellsandDevelopment, 2009, 18(1): 161-172.
[21] 徐莹,余辉,张威,等.基于MEMS技术的微电极阵列细胞传感器 [J].自然科学进展, 2007, 17(9): 1265-1272.XUYin,YUHui,ZHANGWei,etal.MicroelectrodearraycellsensorbasedonMEMStechnology[J].ProcessinNaturalScience, 2007, 17(9): 1265-1272.
[22]KANEKOT,NOMURAF,HATTORIA,etal.Improvementofelectricalstimulationprotocolforsimultaneousmeasurementofextracellularpotentialwithon-chipmulti-electrodearraysystem[J].JapaneseJournalofAppliedPhysics, 2012, 51(6S): 06FK02.
[23]GUOL,ABRAMSRM,BABIARZJE,etal.Estimatingtheriskofdrug-inducedproarrhythmiausinghumaninducedpluripotentstemcell-derivedcardiomyocytes[J].ToxicologicalSciences, 2011, 123(1): 281-289.
[24]ZOUY,YAOA,ZHUW,etal.Isoproterenolactivatesextracellularsignal-regulatedproteinkinasesincardiomyocytesthroughcalcineurin[J].Circulation, 2001, 104(1): 102-108.
收稿日期:2014-11-20.
基金项目:国家海洋公益资助项目(201305010).
作者简介:王琴(1988—),女,博士生,从事细胞传感器研究. ORCID: 0000-0002-9944-5493. E-mail: cnqwang@zju.edu.cn 通信联系人:王平,男,教授.ORCID: 0000-0001-6474-2722.E-mail: cnpwang@zju.edu.cn
DOI:10.3785/j.issn.1008-973X.2016.06.028
中图分类号:R 318
文献标志码:A
文章编号:1008-973X(2016)06-1214-07
Optimizationdesignanddruganalysisofcardiomyocyte-basedbiosensor
WANGQin,FANGJia-ru,CAODuan-xi,ZHOUJie,SUKai-qi,LIHong-bo,WANGPing
(Biosensor National Special Laboratory, Key Laboratory of Biomedical Engineering of Ministry of Education,College of Biomedical Engineering and Instrument Science, Zhejiang University, Hangzhou 310027, China)
Abstract:The coupling property between cardiomyocytes and microelectrode array (MEA) was studied from two aspects, including MEA surface hydrophilicity and cell culture density, in order to build a cardiomyocyte-based potential biosensor of high stability and high consistency. MEA surface hydrophilicity was improved by high molecular protein (gelatin) modification, and the characteristics of extracellular field potential (EFP) signals of cardiomyocyte-based potential biosensor under different cell densities were emphatically analyzed. Results show that the high-closely coupling between cardiomyocytes and MEA is formed after cardiomyocytes seeded on the MEA with gelatin modification at the proper cell density of 1.2×105 cells/cm2. Under the optimal conditions, the cardiomyocyte-based potential biosensor presents high-stable and high-consistent EFP signals, the spike amplitude (SA) reaches about 1.2 mV, and the firing rate (FR) reaches about 180 beats/min, which continues for 3-4 days. Two typical tool drugs, isoprotenol (ISO) and lidocaine (LID) were applied to test the analytical performance of the optimized cardiomyocyte-based potential biosensor. Results show that SA and FR markedly increase after the treatment of 20 μM ISO for 5 min and significantly decrease after the treatment of 20 μM LID for 5 min. This biosensor performed rapid and sensitive response to these two drugs and will provide a promising platform for drug detection and analysis.
Key words:microelectrodes array; cardiomyocytes; cell-based biosensor; extracellular field potential (EFP) signal
