利用正交试验法优化团花不定芽分化培养基
2016-07-25黄浩蒙爱东
黄浩++蒙爱东


摘要:为了获得团花不定芽分化的最佳激素组合和外植体类型,以团花20~30 d无菌苗的子叶、下胚轴和真叶为外植体材料,采用L9(34)正交试验表,2,4-D、2-iP、6-BA为正交试验的3因素,进行直接诱导不定芽分化试验。结果表明,以真叶为外植体,不定芽分化率最高,为73.3%,激素组合为MS+0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA;下胚轴的不定芽分化率次之,最高为66.6%;子叶的不定芽分化率最低,最高值仅为40.0%。试验结果可为工厂化生产优良团花种苗,并可为团花遗传转化研究奠定基础。
关键词:团花;组织培养;正交试验;不定芽
中图分类号: Q813.1文献标志码: A文章编号:1002-1302(2016)06-0078-03
收稿日期:2015-05-18
基金项目:广西医疗卫生重点科研课题(编号:重200907)。
作者简介:黄浩(1972—),男,广西柳州人,助理研究员,主要从事药用植物育种和栽培研究。E-mail:hmouse@163.com。
通信作者:蒙爱东,教授,从事药用植物育种和组织培养。E-mail:mengaidong@126.com。团花[Neolamarckia cadamba(Roxb.)Bosser]为茜草科(Rubiaceae)团花属(Neolamarckia Bosser)植物,为亚洲热带十分罕见的阔叶速生树种。由于团花生长迅速,树干通直,因而被誉为“奇迹树”,早在20世纪70年代就受国内外普遍关注。其木材淡黄色,纹理通直,不易开裂和变形,是较好的家具、建筑装饰等用材。早在印度古医“阿优吠陀”经中,就有用树皮治疗疾病的记载;树皮含有丰富的生物碱类,其中 3α-二氢卡丹宾和3β-二氢卡丹宾为治疗高血压药物“钩藤总碱”的有效成分,具有强而持久的降压作用,其效价已经接近利血平[1]。树叶含较高蛋白质,可作动物饲料;花是良好的蜜源。因用途广泛而具有较高开发价值和较大应用前景[2-4]。
团花在中国仅有1种[5],主要分布于广东、广西、云南海拔50~1 100 m的山谷溪旁或杂木林下;在云南省海拔 1 080 m 以下的亚热带地区有集中分布[5-6],喜温不耐寒。国内外学者主要开展团花的树皮药用成分[1,7-11]、引种和栽培[12-18]生物技术[19-21]研究,并取得较好的进展。尽管利用大田苗顶芽或侧芽通过以芽繁芽的组织培养方式[22-23]进行团花植株再生研究已获得一定的成效,由于仅作为繁殖优良植株的目的,无法利用该不再生体系进行进一步的分子试验如遗传转化研究。本试验拟利用正交试验设计,通过器官直接分化方式对团花3种不同外植体进行不定芽诱导研究,以期优化出较好的外植体和激素组合。本试验不仅可快速获得大量健壮不定芽,也可为团花遗传转化特别是转抗寒或其他抗性基因的研究奠定基础。
1材料与方法
1.1材料和试剂
成熟、饱满的团花种子,采自广西药用植物园本草纲目园。经洗净晾干后于低温种子柜保存。
NaClO溶液500 mL塑料瓶包装,天津市津宇精细化工有限公司生产;灭菌工作溶液配制:将50 mL NaClO原液加入到950 mL无菌水中摇匀;2,4-D、2-iP、6-BA、琼脂、蔗糖购自北京鼎国昌盛生物技术有限责任公司。
1.2方法
1.2.1浸种和无菌幼苗的获得用小袋包好种子,放入装有约100 mL无菌水的250 mL玻璃组培瓶中,在37 ℃恒温振荡箱振荡浸泡24 h。在无菌超净台上,将包着种子的小袋浸于NaClO工作溶液中灭菌15 min,再用无菌水彻底冲洗5次,最后将种子播于不含任何激素的MS培养基中(培养室温度为(25±2)℃,诱导不定芽分化时前30 d采用暗培养,之后进行光培养(光周期为14 h),人工光照强度2 000 lx。)20~30 d后,即可得到含1对子叶和第1对真叶、高度为5~10 mm的无菌苗。
1.2.2外植体的获得外植体分别为无菌苗子叶、真叶、下胚轴。在无菌超净台中,子叶、真叶(均含叶柄)可用镊子从上述无菌幼苗小心剥下,不含子叶节的下胚轴直接用解剖刀切取。每种外植体均按L9(34)正交试验表进行单独的正交试验。
1.2.3试验设计正交试验设计采用L9(34)正交表,将培养基中的3个激素2,4-D、2-iP、6-BA设为正交试验的3因素,每因素设3水平,为避免在试验过程中人为因素导致的系统误差,因素水平数(激素浓度)在试验表中不完全按数值大小递增或递减顺序排列,而按随机化方法排列,空列作为方差分析的误差列[24]。试验因素和水平见表1,试验结果见表 2。
1.2.4培养基培养基均以MS作为基本培养基,添加琼脂6 g/L,蔗糖30 g/L,添加激素后调整pH值内5.8,然后在 0.1 MPa、121 ℃高温灭菌20 min,自然冷却凝固,放置1 d后使用。
1.3统计与数据处理
外植体接种后40 d,统计不定芽分化率,同时观察不定芽的生长情况。采用直观分析和方差分析法对数据进行分析。每种外植体重复3次,每次15个外植体,分化率为3次重复的平均值。
不定芽分化率=(长出不定芽的外植体个数/外植体总数)×100%。
数据处理和作图用Excel 2007完成。
2结果与分析
2.1不定芽分化率和直观分析
不同外植体的不定芽分化率结果见表 2。从极差项的结果可看出,在3个不同的外植体中,生长素2,4-D极差项均为最大值,表明2,4-D对3个外植体的不定芽分化影响最大。影响子叶直接分化不定芽的主次因素依次为2,4-D、2-iP(或6-BA)、6-BA(或2-iP),最优激素组合为0.5 mg/L 2,4-D+0.5 mg/L 2-iP+1.5 mg/L 6-BA,与试验号4吻合,子叶的不定芽分化率最高达40%。影响下胚轴直接分化不定芽的主次因素依次为2,4-D、2-iP、6-BA,最优激素组合为0 mg/L 2,4-D+0.5 mg/L 2-iP+2.0 mg/L 6-BA,与试验号1吻合,下胚轴的不定芽分化率最高达40%。影响真叶直接分化不定芽的主次因素依次为2,4-D、6-BA、2-iP,最优激素组合应为0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA,没有试验号与其吻合。
2.2不同激素诱导不定芽分化率比较
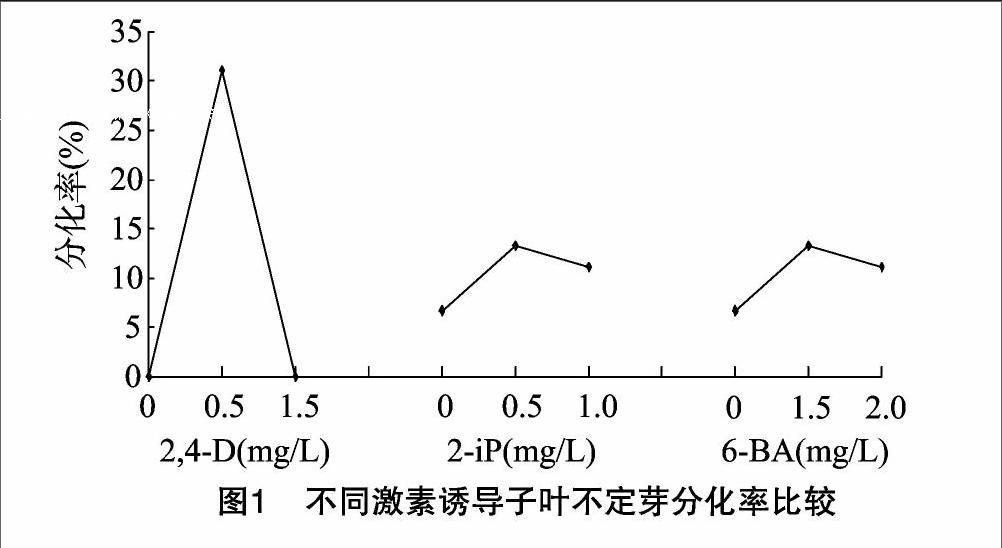
2.2.1不同激素诱导子叶不定芽分化率不同激素诱导子叶不定芽分化率见图1。随着2,4-D、2-iP、6-BA浓度升高,子叶诱导不定芽分化率均出现先增大后下降的趋势,当2,4-D浓度为0.5 mg/L,2-iP浓度为0.5 mg/L,6-BA浓度为1.5 mg/L时,不定芽分化的效果最佳。
2.2.2不同激素诱导下胚轴不定芽分化率不同激素诱导下胚轴不定芽分化率见图2,随着2,4-D、2-iP、6-BA浓度升高,下胚轴诱导不定芽分化率变化较大。当2,4-D浓度为0 mg/L,2-iP浓度为0.5 mg/L,6-BA浓度为2.0 mg/L时,不定芽分化效果最佳。此外,不定芽分化率有随6-BA浓度升高而提高的趋势,适当提高6-BA的浓度,有可能会得到更优的诱导不定芽分化组合。
2.2.3不同激素引导真叶不定芽分化率不同激素引导真叶不定芽分化率见图3,当2,4-D浓度为0.5 mg/L,2-iP浓度为1.0 mg/L,6-BA浓度为1.5 mg/L时,不定芽分化的效果最佳。不定芽分化率有随2-iP浓度升高而提高的趋势,
适当再提高2-iP的浓度,有可能会得到真叶诱导不定芽分化的更优方案。与下胚轴诱导不定芽分化率随6-BA浓度的升高而提高的趋势不同。
2.3方差分析
方差分析结果见表3。
从表3看出,除了2,4-D对子叶诱导不定芽分化具有显著影响外,2,4-D对其他2个外植体的不定芽诱导无显著影响;2-iP、6-BA对3种外植体不定芽诱导均无显著影响。
3讨论与结论
从试验的总体结果来看,子叶诱导不定芽分化率较低;从试验号1到试验号6,下胚轴诱导分化率最低为33%,最高为66.7%,诱导分化的总体状况较好;而真叶除了在试验号4和试验号6的诱导分化率较高外,其余试验均低于30%。另外,无论是从子叶、下胚轴还是真叶诱导分化出来的不定芽,生长均较健壮,生长状况无明显差异(图4)。
不同外植体的最佳不定芽分化率并不出现在同一个激素组合(即同一个试验号),可能是不同外植体组织(或细胞)在相同生长时期具不同生长特性,导致对相同激素组合的响应不同。
当2,4-D浓度为 0 mg/L 时,下胚轴的不定芽分化率较好;当2,4-D浓度为0.5 mg/L时,子叶和真叶的不定芽分化率较好;当2,4-D浓度为1.5 mg/L时,不论2-iP、6-BA浓度如何变化,3个不同外植体不定芽分化的诱导率均很低,可能是高浓度2,4-D对这些幼嫩的外植体产生一定的伤害,导致组织或细胞较难直接分化甚至死亡;而2-iP、6-BA对不定芽分化率影响不如2,4-D的变化显著。
在诱导真叶直接分化试验中,从直观分析和趋势中均可看出,最好的激素组合应为0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA,理论上应比试验号6的分化率(即最大值73.3%)高,但此激素组合并不在本试验的激素组合中。在下一步试验中可对主要因素(主要是2,4-D)的水平作适当调整,选取更优水平,以期获得更高的诱导分化率。
本试验研究结果表明,为获得质量较好的不定芽,可用MS+0 mg/L 2,4-D+0.5 mg/L 2-iP+2.0 mg/L 6-BA作为下胚轴的诱导培养基;或用MS+0.5 mg/L 2,4-D+1.0 mg/L 2-iP+1.5 mg/L 6-BA作为真叶的诱导培养基。这2种方法均可通过直接分化的方式获得健壮的不定芽,避免通过愈伤组组再分化的途径获取再生芽而产生的变异苗的可能;在获得不定芽后,按邓小梅等的方法[22-23]选取健壮的芽,进行扩繁、生根和移栽,即可获得再生小苗。移栽1年后,经与初生种子苗对比,在生长性状上无明显差异。通过直接分化获得不定芽,在很大程度上减少了培养周期、人力和物力,也为进一步进行团花遗传转化研究奠定基础。
参考文献:
[1]钟纪育,王文端. 卡丹宾——团花茎皮的主要生物碱[J]. 云南植物研究,1985,7(3):359-360.
[2]林协. 速生树木——团花[J]. 浙江林业科技,1974(2):9.
[3]祁承经,汤庚国. 树木学[M]. 北京:中国林业出版社,2005:521.
[4]钟纪育,王文端,张壮鑫,等. 团花树皮的化学成分[J]. 云南植物研究,1990,12(4):453-456.
[5]中国科学院中国植物志编辑委员会.中国植物志:第71卷第1分册被子植物门双子叶植物纲茜草科(一)[M]. 北京:科学出版社,1999.
[6]杨正杰. 浅谈团花育苗及造林技术[J]. 云南林业,1984(1):20.
[7]刘玲丽,朱锋,邸迎彤,等. 团花树中一个新的环烯醚萜苷[J]. 云南植物研究,2010,32(4):378-380.
[8]张雪. 锈毛千斤拔根及团花树皮化学成分研究[D]. 西双版纳:中国科学院研究生院,西双版纳热带植物园,2008.
[9]韦宏. 团花树皮的吲哚生物碱成分[J]. 广西科学院学报,1999,15(2):52-55.
[10]陈耀武,邓万华,沈镇德,等. 团花(Anthocephalus chinensis)种子和果实中抑制物质的研究[J]. 植物生理学报,1985,11(1):93-100.
[11]赵瑤金. 印度团花(Anthocephalus indicus Rioh.)树皮的化学研究 第2部分生物碱类成分[J]. 南药译丛,1962(1):19.
[12]耿云芬,邱琼,杨德军. 团花容器苗的育苗期施肥试验[J]. 西部林业科学,2010,39(1):73-76.
[13]苏光荣,易国南,杨清. 团花生长特性研究[J]. 西北林学院学报,2007,22(5):49-52.
[14]李秀全. 团花在平和县引种试验研究初报[J]. 安徽农学通报,2007,13(7):103-104.
[15]陶永强. 团花育苗及造林技术[J]. 云南林业,2005,26(4):25-26.
[16]杨德军,邱琼,王达明,等. 团花育苗技术研究[J]. 广西林业科学,2004,33(2):93-95,101.
[17]任盘宇,邹寿青. 热带速生树种团花的造林技术[J]. 林业实用技术,2004(6):6-8.
[18]邹寿青. 团花北移试种情况调查报告[J]. 热带植物研究,1977(11):26-35.
[19]欧阳昆唏. 黄梁木α扩展蛋白的基因克隆及功能研究[D]. 北京:北京林业大学,2013:133.
[20]马圣俊. 团花树形成层XET基因的克隆及功能初步分析[D]. 北京:北京林业大学,2010.
[21]李伟,李娜,陈晓阳. 团花树木葡聚糖转葡糖苷酶cDNA克隆及序列分析[J]. 北京林业大学学报,2010,32(5):45-49.
[22]邓小梅,詹艳玲,张倩,等. 黄梁木组培快繁技术研究[J]. 华南农业大学学报,2012,33(2):216-219,224.
[23]林碧珍,张树河,林加耕. 团花树组培快繁技术研究[J]. 中国热带农业,2009(3):46-47.
[24]李云雁,胡传荣. 试验设计与数据处理[M]. 北京:化学工业出版社,2005:257.
