猪细小病毒、猪伪狂犬病毒和猪圆环病毒2型多重PCR检测方法的建立及应用
2016-07-20山东绿都生物科技有限公司于新友李天芝沈志强山东省滨州畜牧兽医研究院王金良
文 / 山东绿都生物科技有限公司 于新友 李天芝 沈志强山东省滨州畜牧兽医研究院 王金良 莫 玲
猪细小病毒、猪伪狂犬病毒和猪圆环病毒2型多重PCR检测方法的建立及应用
文 / 山东绿都生物科技有限公司 于新友 李天芝 沈志强
山东省滨州畜牧兽医研究院 王金良 莫 玲
摘 要根椐GenBank中等录的猪细小病毒(PPV)、猪伪狂犬病毒(PRV)和猪圆环病毒2型(PCV2)病毒核苷酸序列,分别设计3对引物,在建立各病毒单项PCR技术的基础上,优化多重PCR反应条件,建立了3种病毒的多重PCR检测方法,用这3对引物对同一样品中的PPV、PRV、PCV2核酸模板进行多重PCR扩增,结果可同时扩增PPV的475bp,PRV的689bp,PCV2的245bp的特异性片段,而对其他4种病原的PCR扩增结果均为阴性。敏感性测定结果表明,该多重PCR技术能检出10pg的PPV、10pg的PRV和1pg的PCV2模板。用65份临床病料对本研究多重PCR技术和单项PCR技术进行对比验证,结果显示:两者的总符合率为100%。表明建立的多重PCR检测方法,具有特异、快速、准确的特点,可用于对这三种病毒的同时检测、鉴别和诊断。
关键词多重聚合酶链式反应;猪细小病毒;猪伪狂犬病毒;猪圆环病毒2型
猪细小病毒(Porcine parvovirus,PPV)会导致感染母猪产出死胎、畸形胎、木乃伊胎及产出的仔猪病弱[1]。猪伪狂犬病毒(Porcine Pseudorabies Virus,PRV)可导致妊娠母猪流产、死产、木乃伊胎,初生仔猪具有明显的神经症状,死亡率几乎100%[2]。猪圆环病毒2型(Porcine Circovirus 2,PCV2)与断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、仔猪先天性震颤等症状密切相关[3]。因此,这三种病毒均是猪繁殖障碍类疾病的病原体,单纯根据临床症状不能鉴别诊断,且三者在临床上常呈混合感染。当同时感染两种或三种病原时,临床症状加重,将给养猪业造成巨大的经济损失[4,5]。建立高效、快速、敏感的诊断方法对该3种猪病的防控非常关键。针对这3种病原传统检测方法耗时长、检测敏感性较低及准确性差等。PCR检测方法以检测快度、灵敏度高、特异性好等特点已经广泛应用于多种疾病的检测,多重PCR技术是在常规PCR基础上发展起来的一种检测技术,在一个PCR反应体系中加入多对特异性引物,针对多个DNA模板或同一模板的不同区域扩增多个目的片段的PCR诊断技术,具有简便、快速、敏感、特异、易于操作和鉴别多种病原的等优点,即可以节约时间,又可以节省人力和物力[6],适合大量临床样品(特别是混合感染样品)中病原体的快速诊断。本文选择PPV VP2、PRVgD和PCV2、ORF2保守基因序列设计引物,优化了反应条件,建立一种可用于上述3种病毒的多重PCR诊断方法,并对临床病料进行检测。
1 材料与方法
1.1 病毒
猪细小病毒(PPV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪瘟病毒(CSFV)、猪蓝耳病毒(PRRSV)、猪流行性腹泻病毒(PEDV)、流行性乙型脑炎病毒(JEV)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室提供。
1.2 工具酶及试剂盒
Taq DNA聚合酶、M-MLV反转录酶、RNasin、dNTPs、DL2000 Marker等试剂购自宝生物工程(大连)有限公司,多功能DNA纯化回收试剂盒、高纯质粒小量制备试剂盒购自北京百泰克生物科技有限公司产品,AxyPrep体液病毒DNA/RNA小量试剂盒购自爱思进生物技术(杭州)有限公司,其他化学试剂如氯仿、异丙醇、乙醇等,均为国产分析纯产品。
1.3 引物的设计与合成
参考GenBank中登录的PPV(JQ710901)、PRV(KF017337)和PCV2(DQ104423)基因序列,利用Primer Premier5.0软件设计3对特异性引物,由上海生工生物工程技术服务有限公司合成,用灭菌水溶解并配成15pmol/mL溶液备用。
1.4 病毒基因组的提取
取感染PPV、PRV、PCV2的细胞培养液,反复冻融3次,经12,000 rpm离心20 min,取上清作为待测样品。按AxyPrep体液病毒DNA/RNA小量试剂盒使用说明书分别提取提取PPV、PRV、PCV2的DNA,并提取其他几种病毒的核酸。
1.5 反应条件优化
最适退火温度的确定:分别以50℃、52℃、54℃、56℃、58℃、60℃、62℃的退火温度进行梯度PCR反应,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳退火温度。
最适引物浓度的确立:在25μL PCR反应体系中分别以0.2pmol/μL、0.3pmol/μL、0.4pmol/μL、0.6pmol/ μL、0.8pmol/μL和1.0pmol/μL的引物浓度进行PCR扩增,产物进行琼脂糖凝胶电泳观察,确定最佳引物浓度,筛选出多重PCR反应体系的最佳反应模式。
1.6 特异性试验
用已建立的多重PCR扩增,分别对PPV、PRV、PCV2、CSFV、PRRSV、PEDV和JEV 的模板进行扩增,扩增反应同时设双蒸水阴性对照,扩增反应结束后进行凝胶电泳检测,以检验多重PCR的特异性。
1.7 多重PCR的敏感性试验
分别提取PPV、PRV和PCV2的DNA,用仪器测定含量,并依次做10倍梯度稀释,每个稀释度取lμL为模板,采用已优化的多重PCR反应条件分别对上述不同稀释度的DNA 进行多重PCR扩增,反应结束后进行凝胶电泳检测,以检测建立的多重PCR的敏感性。
1.8 重复性试验
用建立的多重PCR检测方法分别对PPV感染的8份阳性样品,PRV感染6份阳性样品,PCV2感染的5份阳性样品及5份阴性样品重复检测3次,以验证本方法的重复性和稳定性。
1.9 临床样品的检测
对山东、河南、江西、福建、四川和吉林等省65份送检疑似病料进行多重PCR检测。

表1 PPV、PRV和PCV2 基因扩增引物
2 结果与分析
2.1 反应条件的优化
通过对PPV、PRV和PCV2 3种引物浓度及多重PCR扩增温度、时间和循环次数等的优化,最后确定多重PCR中最佳引物浓度分别为PPV 0.4pmol/μL、PRV 0.6pmol/μL、PCV2 0.6pmol/μL,多重PCR的最佳反应模式为:94℃ 5 min,94℃ 45s,56℃ 45s,72℃ 45 s,30个循环,最后 72℃ 延伸10 min。
2.2 扩增产物的检测
将PPV、PRV和PCV2的核酸分别进行多重PCR扩增,结果能扩增出与预期相符,PCV2的245bp,PPV的475bp,PRV的689bp的特异性片段,而对照组扩增不出任何条带,其扩增产物的电泳结果见图1。
2.3 特异性试验
采用建立的多重PCR方法对PPV、PRV、PCV2、CSFV、PRRSV、PEDV和JEV在相同的条件进行扩增。结果显示,PPV、PRV和PCV2的PCR产物的片段长度分别为475bp、 689bp和245bp,与预期大小一致,而CSFV、PRRSV、PEDV和JEV均未扩增出片段,琼脂糖凝胶电泳结果见图2,说明本研究建立的多重PCR方法特异性强。
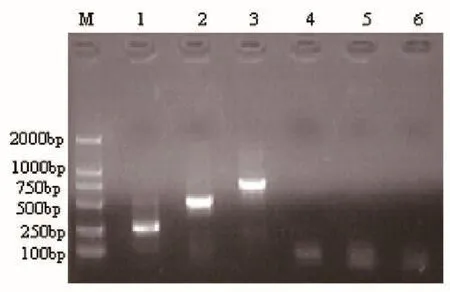
M:DL2000 MarKer,1:PPV PCR产物,2:PRV PCR产物,3:PCV PCR产物,4~5:3对引物的空白对照。图1 单项PCR扩增结果
2.4 敏感性试验
提取PPV、PRV、PCV2基因组DNA,用仪器测定含量,然后做10倍梯度稀释,每个稀释度取1μL,作为模板。结果显示用10pg的PPV、10pg的PRV、1pg的PCV2可以扩增出特异性条带(见图3)。表明该多重PCR敏感性强。
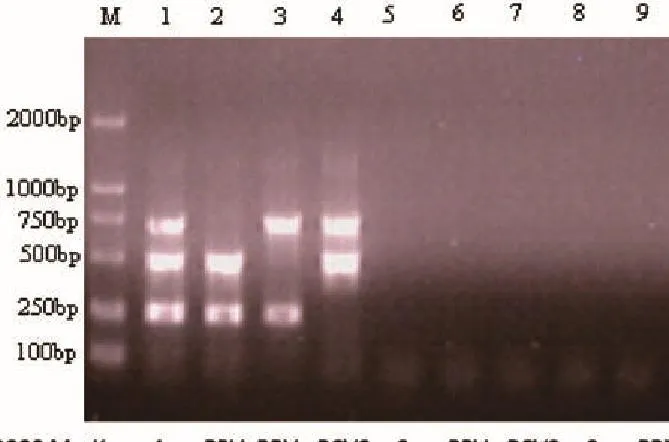
M:DL2000 MarKer,1:PPV+PRV+PCV2,2:PPV+ PCV2,3:PRV+ PCV2,4:PPV +PRV,5:CSFV,6:PRRSV,7:PEDV,8:JEV,9:空白对照。图2 三重PCR的特异性试验
2.5 重复性试验
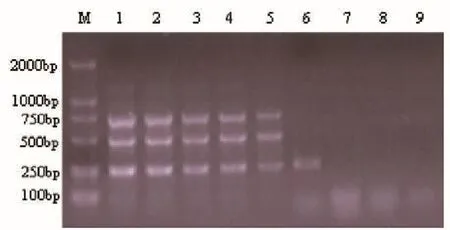
M:DL2000 MarKer,1:100ng PPV+100ng PRV+100ng PCV2,2:10ng PPV+10ng PRV+10ng PCV2,3:1ng PPV+1ng PRV+1ng PCV2,4:100pg PPV+100pg PRV+100pg PCV2,5:10pg PPV+10pg PRV+10pg PCV2,6:1pg PPV+1pg PRV+1pg PCV2,7:100fg PPV+100fg PRV+100fg PCV2,8:10fg PPV+10fg PRV+10fg PCV2,9:空白对照。图3 三重PCR的敏感性试验
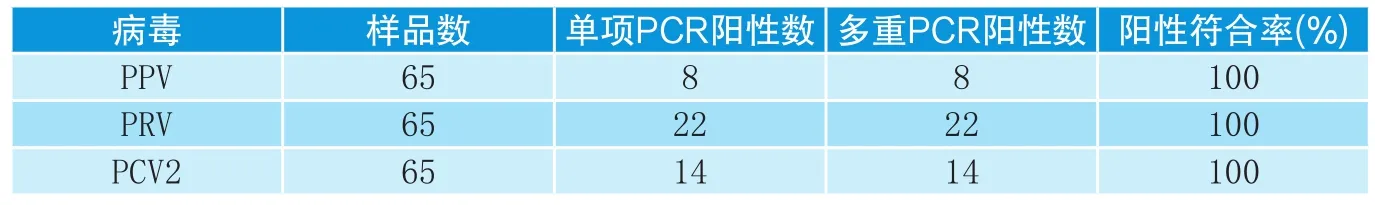
表2 被检病料单项PCR与多重PCR检测对比试验结果
经过3次重复操作,结果一致,表明本研究建立的多重PCR方法是稳定可靠的。
2.6 临床样品的检测
对65份在不同地区采集的疑似病料,用建立的多重PCR和单项PCR进行了检测,两者符合率达100%(见表2),结果表明建立的多重PCR检测体系的特异性和敏感性较好。
3 讨论
在多重PCR反应中,引物的设计很重要,对多重PCR反应是否成功起着决定性的作用。
本研究分别针对PPV VP2、PRV gB和PCV2 ORF2保守基因序列设计引物,在这3种病毒中,由于PPV基因组序列的G+C含量较低,而PRV属于疱疹病毒科,其G+C含量较高,达73%,因此,在设计引物时,将扩增PCV2、PPV、PRV这3对引物的G+C含量控制在45%~60%,这样能确保所有的引物在相近的退火温度进行多重PCR扩增,为成功进行多重PCR反应奠定了基础。最后确定多重PCR中最佳引物浓度分别为PPV、 PRV和PCV2最佳引物浓度分别为0.4pmol/μL、0.6pmol/μL和0.6pmol/ μL。多重PCR的最佳退火温度为56℃。该多重PCR方法具有良好的特异性,对PPV、PRV和PCV2的扩增片段大小分别为475bp、689bp和245bp,对CSFV、PRRSV、PEDV和JEV扩增结果均为阴性。该法敏感性高,对PPV、PRV和PCV2的最低检测量分别为10pg、10pg和1pg。
4 结论
本研究用建立的多重PCR方法对来自山东、河南、江西、福建、四川和吉林等省的65份病料进行检测,同时进行单项PCR检测,结果显示,多重PCR方法与单项PCR检测结果符合率为100%。共检出PPV阳性样品8份,PRV阳性样本22份,PCV2阳性样品14份,二重混合感染阳性样品8份,三重混合感染阳性样品3份。多重PCR方法比单项PCR检测方法可节省70%的时间和2/3的试剂用量,减少了污染环境的机会,对临床上猪细小病毒病、猪伪狂犬病毒病和猪圆环病毒病的检测具有较好的应用价值。
参考文献:
[1] Mengeling WL,Lager KM,Vorwald AC.The effect of por-cine parvovirus and porcine reproductive and respiratory syndrome virus on porcine reproductive performance[J]Anim Reprod Sci,2000,60~61:199~210.
[2] 韩秀珍.鉴别猪伪狂犬病毒强毒检测方法的研究进展[J].畜牧与兽医,2014,46(3):113~116.
[3] Allan GM,McNeilly F,Cassidy JP,et al.Pathogenesis of porcine circovirus;Experimental infections of colostrum deprived piglets and examination of pig foetal material[J].Veterinary Microbiol,1995,44 (1):49~64.
[4] 许立华,王玲,芦银华,等.三种猪繁殖障碍性病毒混合感染的分子生物学调查[J].中国兽医科技,2004,34(7):40~43.
[5] 贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学, 2004,19(5):467~470.
[6] Ogawa H,Taira O,Hirai T,et al. Multiplex PCR and multiplex RT-PCR for inclusive detection of major swine DNA and RNA viruses in pigs with multiple infections[J]. J Virol Methods,2009,160(1~2):210~214.
基金项目:山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-06-011-14)。
