人羊膜脱细胞基质填充材料的生物相容性及动物有效性研究
2016-07-18田智泉郜香黎李敏鸽冉永峰黄馨慧
何 越,田智泉,郜香黎,李敏鸽,冉永峰,黄馨慧
实验研究
人羊膜脱细胞基质填充材料的生物相容性及动物有效性研究
何 越,田智泉,郜香黎,李敏鸽,冉永峰,黄馨慧
目的 探讨人羊膜脱细胞基质填充材料的生物相容性及动物有效性。方法 通过生物学评价实验对羊膜脱细胞基质填充材料的刺激性、致敏性、细胞毒性等进行检测,并通过大鼠皮内植入实验检测材料的动物有效性(以上市产品双美胶原蛋白作为对照)。结果 羊膜脱细胞基质填充材料无致敏性、无刺激性,且细胞毒性不大于1级;大鼠皮内植入有效性实验显示,羊膜脱细胞基质填充材料于植入后20周依然有肉眼可观察到的材料保留。双美胶原植入剂降解完全,肉眼和HE染色均未见材料。且两种材料在体内降解期间的炎症反应和免疫排斥反应均为轻度反应。结论 人羊膜脱细胞基质填充材料具有良好的生物相容性,无明显炎症及免疫排斥反应。其在大鼠皮内耐降解性强,保留时间较长,可作为一种安全有效的填充注射产品应用于临床。
人羊膜脱细胞基质; 生物相容性; 动物有效性; 填充材料
目前,被美国FDA以医疗器械批准上市的用于修复皮肤组织缺损的可吸收材料包括:⑴透明质酸钠;⑵胶原蛋白;⑶羟基磷灰石;⑷聚乳酸[1-2]。羊膜脱细胞基质填充材料属于可吸收胶原类材料,已有大量研究证实,羊膜本身就是一种良好的生物材料[3],羊膜临床应用的研究很多,如眼科、口腔、外科、泌尿科等,且多数临床效果良好[4-5]。但关于羊膜脱细胞基质填充材料在整形美容、注射填充方面的相关研究少见。自 2012年3月至2015年10月,陕西瑞盛生物科技有限公司研发部对专利方法所制备的羊膜脱细胞基质填充材料的生物相容性及动物有效性进行了评价,以客观、准确的反应其安全性。
1 对象与方法
1.1 羊膜脱细胞基质填充材料的制备
1.1.1 对象与设备 新鲜羊膜(陕西省妇幼保健院获取,并与患者签订知情同意书);胰蛋白酶、碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS),均购买自美国GIBCO公司;控温摇床(上海君翼仪器设备有限公司);低温高速粉碎机(德国FRITSCH公司);高速微射流均质机(美国DEBEE公司)。
1.1.2 制备方法 取新鲜羊膜,使用75%乙醇进行病毒灭活,再使用0.25%胰蛋白酶进行脱细胞处理,配置EDC∶NHS(4∶1)体系进行交联改性,之后采用纯化水进行震荡清洗,充分洗去残留试剂,只保留羊膜细胞外基质成分。干燥后利用低温粉碎机将羊膜细胞外基质粉碎成粒径为60~120 μm的微粒,并与PBS溶液配置成混悬液,混悬液进行均质后灌装于预灌封注射器中,辐照灭菌,即获得凝胶状羊膜脱细胞基质填充材料。
1.2 生物相容性检测
1.2.1 致敏性 取白化豚鼠30只,体质量250~300 g,2~3个月龄,来源于第四军医大学动物中心。随机分成3组,阳性对照组(10只),试验组(10只)、阴性对照组(10只),开始适应环境,为时1周。试验前1 d,在胸廓的背前区备皮4 cm×6 cm。于豚鼠背部去毛,消毒后于肩胛骨内侧从头向尾成对注射6个点,每点注射 0.1 ml,见图1。A点注射完全弗氏佐剂与生理盐水(1∶1)混合液;B点试验组注射待检物与完全弗氏佐剂的等体积混合物,阴性对照组则注射生理盐水,阳性对照组注射巯基苯并噻唑;C点注射前2种注射液的等体积混合物。之后进行局部诱导和激发,并分别于激发后24 h和48 h观察各组动物激发部位皮肤情况,在自然光或全光谱光线下观察皮肤反应。根据Magnusson和Kligman分级标准对皮肤反应情况进行分级:0级,无明显改变;1级,散发性或斑点状红斑;2级,中度融合性红斑;3级,重度红斑和水肿[6]。
1.2.2 刺激性 取12只新西兰兔,体质量(2.0±0.2) kg,3~4个月龄,来源于第四军医大学动物中心。分笼饲养于空调室内,室温(21±2)℃,相对湿度40%~70%,光照12 h/d,自由饮用自来水。试验前适应性饲养3 d。并在试验前24 h将动物背部脊柱两侧背毛去除10 cm×15 cm,分为样品组和阳性对照组。通过单次接触、多次给药,在同一部位行皮肤刺激性试验,确保每次给药时间相同,贴敷时间一般不超过4周。在自然光线下观察皮肤反应(红斑和水肿),根据皮肤反应情况打分。红斑和焦痂形成:无红斑,0分;轻微红斑(勉强可见),1分;明显红斑,2分;中度~重度红斑,3分;严重红斑(紫红色)至轻微焦痂形成,4分。水肿形成:无水肿,0分;轻微水肿(勉强可见),1分;轻度水肿(皮肤隆起轮廓清楚),2分;中度水肿(皮肤隆起约1 mm),3分;重度水肿(皮肤隆起超过1 mm,范围扩大),4分。两项评分之和为其总分。根据GB16886[6]第十部分对刺激的评价标准评价产品有无刺激性。
1.2.3 细胞毒性 将传代48~72 h生长旺盛的L929细胞胰酶消化收集,用高糖DMEM培养基配置成1×104/ml的细胞悬液,接种至96孔板中,每孔200 μl。样品按照1∶9比例浸提,浸提介质为含10%新生牛血清的高糖DMEM培养液,浸提温度为37℃,浸提时间为24 h。将试验组、空白对照组及阳性对照组分别加入细胞悬液中,置于37℃、5%CO2、饱和湿度的细胞培养箱培养,每天显微镜下观察细胞形态。在培养第5天时,使用酶联免疫检测仪在490 nm波长下测各孔吸光度值(OD值),用空白调零孔OD值调零,取平均值并记录。根据各组的吸光度均值计算细胞的相对增殖率。根据细胞毒性反应分级标准对反应分级:细胞相对增殖率≥100%为0级,80%~99%为1级,50%~79%为2级,30%~49%为3级,1%~29%为4级,0为5级。
1.3 动物有效性实验检测
大鼠6只,220 g左右,3~4个月龄。分笼饲养于空调室内,室温(21±2)℃,相对湿度40%~70%,光照12 h/d,自由饮食饮水。每只大鼠背部皮下分别植入羊膜脱细胞基质填充材料和双美加强型胶原蛋白植入剂(台湾双美生物科技有限公司)各1个点,每点注射0.1 ml样品。分别于术后1、4、8、12、16和20周各处死1只大鼠并取材,拍照记录手术部位外观,观察有无红肿、溃烂等不良反应发生,对比观察不同植入材料的皮下降解情况,并对取材点进行常规HE组织学检测及免疫组化检测。
2 结果
2.1 生物相容性
2.1.1 致敏性 所有豚鼠皮内诱导体积均为0.1 ml,激发体积均为0.1 ml。根据Magnusson和Kligman分级标准,激发后24 h和48 h,试验组和阴性对照组的反应等级均为0级,阳性对照组为2、3级,有中、重度的致敏反应。
2.1.2 皮肤刺激性 样品组在24 h时,1例出现轻微红斑;48 h时,1例出现轻微红斑,1例出现轻微水肿。阳性对照组无一例出现红斑和水肿。根据GB16886标准,样品组与阳性对照组的评分差值小于1.0,且平均评分积分小于0.5,判断本产品无刺激性。
2.1.3 细胞毒性 羊膜脱细胞基质填充材料的细胞增殖率为(92.00±1.29)%,细胞毒性为1级。
2.2 动物有效性
2.2.1 大体观察与HE染色 大鼠背部注射羊膜脱细胞基质填充材料4周时,材料保留明显,材料周围有少量炎症细胞浸润;4周后炎症明显降低,材料缓慢降解;20周时依然可见部分材料残留,基本无炎症反应发生(图2)。双美胶原蛋白在20周时材料基本降解完全,仅见少许材料降解痕迹(图3)。
2.2.2 免疫组化 免疫组化检测结果显示,与阴性对照组相比,试验组在注射后4周和20周均无明显的免疫反应(图4)。
3 讨论
3.1 生物相容性 羊膜位于胎盘的最内层,其光滑,无血管、神经及淋巴,无免疫原性。华萍等[7]发现,冻干羊膜或新鲜羊膜均具有良好的组织相容性,不会引起明显的急性免疫排斥反应,作为异体移植材料免疫安全性较好。
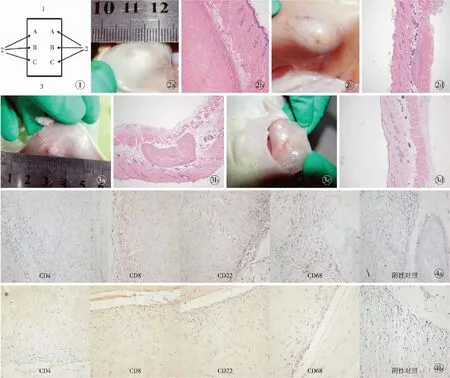
图1 豚鼠背部注射示意(1为大鼠头部,2为注射点,3为尾部) 图2 大鼠背部注入羊膜脱细胞基质填充材料 a.术后4周大体 b.术后4周HE染色(×40) c.术后20周大体 d.术后20周HE染色(×40) 图3 大鼠背部注入双美加强型胶原蛋白植入剂 a.术后4周大体 b.术后4周HE染色(×40) c.术后20周大体 d.术后20周HE染色(×40) 图4 材料植入部位不同时间点的免疫反应情况(×100) a.术后4周 b.术后20周
Fig 1 Schematic diagram of guinea pig back injection (1 is the head of rats,2 is injection site and 3 is rat tail). Fig 2 Gross observation and HE staining for amniotic membrane matrix implants at the rat back. a.postview at 4 weeks by gross observation. b.postview at 4 weeks by HE staining (×40). c.postview at 20 weeks by gross observation. d.postview at 20 weeks by HE staining (×40). Fig 3 Gross observation and HE staining for Sunmax plus at the rat back. a.postview at 4 weeks by gross observation. b.postview at 4 weeks by HE staining (×40). c.postview at 20 weeks by gross observation. d.postview at 20 weeks by HE staining (×40). Fig 4 Immune response of embedded parts at different time points(×100). a.postview at 4 weeks. b.postview at 20 weeks.
笔者报道的羊膜基质是以人体羊膜为原料,脱去细胞后保留以基底膜为主的细胞外基质,去除了其他抗原成分,主要成分为胶原蛋白及其他结构蛋白。羊膜脱细胞基质填充材料是将脱细胞处理的羊膜基质通过物理机械方法粉碎成粒径较为均一的微粒,之后均匀分散于低渗缓冲液中制成羊膜基质混悬液,填充于预灌封注射器中。本产品使用专利技术对羊膜基质进行脱细胞、去抗原、灭活病毒及灭菌处理等,保证了在去除细胞成分的同时,充分保留细胞外基质的空间结构以及主要成分,有效保证植入的安全性。研究结果也显示,所制备的产品具有良好的生物相容性,不引起明显的过敏反应和免疫排斥反应。这也与Spira等[8]的报道结果相一致,其经过动物实验证实,人羊膜胶原植入12个月,在纤维素增生、血管浸润和脂肪细胞与植入物的接合过程,其炎症反应均很低。
3.2 动物有效性
目前,国内外批准的注射填充类产品中,市场较为常见的是透明质酸和胶原类。双美胶原蛋白植入剂属于胶原类产品,其是由提取的猪皮胶原交联后与生理缓冲液混合形成,有报道称,双美胶原产品的体内有效性为9~12个月,且炎症反应小,无明显免疫反应[9]。
笔者报道的羊膜脱细胞基质填充材料,有效成分为脱细胞羊膜基质,为同种异体原料,主要成分为胶原蛋白。胶原是细胞外最重要的不溶性纤维蛋白,是构成细胞外基质的骨架成分,可以提高细胞的张力和弹性,并且具有低免疫原性的特点[10-11]。为进一步延迟体内降解时间,产品进行了EDC交联处理,并通过有效清洗进行清除,经检测合格,且对终产品进行了辐射照射灭菌。
通过动物有效性实验对比证实,羊膜脱细胞基质填充材料在观察期,除注射后1周炎症相对明显外,其他各观察点均具有较低的炎症反应,且于注射后4、12和20周时行免疫组化检测,均无明显反应。在20周时,双美胶原蛋白已经完全降解,而羊膜脱细胞基质填充材料降解缓慢,依然有较为明显的残留(22周时完全降解)。因此,羊膜脱细胞基质填充材料符合目前较为理想的保留时间较长的可降解吸收型填充产品的要求。本产品为可注射细胞外基质产品,相比于高纯度的胶原产品,所含的细胞外基质具有天然的生物支架结构,植入人体后能很好地引导周围组织纤维细胞长入,间接提高胶原分泌,而且其基质成分的微粒大小不同,使其能被更好的控制、延迟体内降解时间,提高有效性。故羊膜脱细胞基质填充材料具有更好的填充效果。Sclafani等[12]也证实,微粒化的细胞外基质产品与提取胶原类植入填充产品相比,其在鼻唇沟或唇部填充方面具有更好的填充效果和更长的持续时间,且植入皮内较植入皮下维持效果更为显著。
综上所述,人羊膜脱细胞基质填充材料具有良好的生物相容性,无明显炎症及免疫排斥反应;通过动物实验证实其皮内耐降解性强,保留时间长,可作为一种安全、有效的美容填充注射产品使用。
[1] Attenello NH,Maas CS.Injectable fillers:review of material and properties[J].Facial Plast Surg,2015,31(1):29-34.
[2] DeVore D,Zhu J,Brooks R,et al.Development and characterization of a rapid polymerizing collagen for soft tissue augmentation[J].J Biomed Mater Res A,2015 Oct 21.
[3] Okabe M,Kitagawa K,Yoshida T,et al.Hyperdry human amniotic membrane is useful material for tissue engineering:physical,morphological properties,and safety as the new biological material[J].J Biomed Mater Res A,2014,102(3):862-870.
[4] Sanluis-Verdes A,Yebra-Pimentel Vilar MT,García-Barreiro JJ,et al.Production of an acellular matrix from amniotic membrane for the synthesis of a human skin equivalent[J].Cell Tissue Bank,2015,16(3):411-423.
[5] Sujan S,Rathore K,Chakravarthy C,et al.The amniotic membrane in oral and maxillofacial surgery-an overview[J].Annals and Essences of Dentistry,2014,6(1):40-43.
[6] 国家食品药品监督管理局济南医疗器械质量监督检验中心.GB/T16886,医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验[S].北京:中国国家标准化管理委员会,2005.
[7] 华 萍,赵淑娥,赵集帅,等.体内植入羊膜的免疫安全性观察[J].南昌大学学报(医学版),2010,50(9):11-13.
[8] Spira M,Liu B,Xu Z,et al.Human amnion collagen for soft tissue augmentation-biochemical characterizations and animal observations[J].J Biomed Mater Res,1994,28(1):91-96.
[9] 金宝玉,钟李明,罗 曼,等.双美Ⅰ号胶原蛋白临床应用评价[C].第七届中国医师协会美容与整形医师大会论文集,2010.
[10] Chattopadhyay S,Raines RT.Review collagen-based biomaterials for wound healing[J].Biopolymers,2014,101(8):821-833.
[11] Reddy MRH,Sekhar Vmrmnvs,Sri RJK,et al.Dermal Fillers-Role in Post Orthognathic Surgery and Orthodontics-A Review[J].2014,4(1):1-6.
[12] Sclafani AP,Romo T 3rd,Jacono AA.Rejuvenation of the aging lip with an injectable acellular dermal graft (Cymetra)[J].Arch Facial Plast Surg,2002,4(4):252-257.
Research of biocompatibility and effectiveness in animals of human amniotic membrane acellular matrix filler material
HEYue,TIANZhi-quan,GAOXiang-li,LIMin-ge,RANYong-feng,HUANGXin-hui.
(DepartmentofResearchandDevelopment,ShanxiReshineBiotechnologyco.,LTD,Xi′an710077,China)
HUANGXin-hui,Email:huangxinhui@cbmrt.cn
Objective To investigate the biocompatibility and effectiveness in animals of human amniotic membrane acellular matrix filler material.Methods Irritation,sensitivity,and cell toxicity were detected by biological assessment experiments,and the efficacy of the material in animals was also inspected by a rat subcutaneous implantation experiment (Control group for Sunmax Ⅱ collagen implant agent).Results Amniotic membrane acellular matrix filler material was not sensitive or irritative,and the cytotoxicity of the cells was less than 1 degree.The results of the rat implant experiment showed the amniotic membrane matrix implants still retained visiblity at 20 weeks,while the Sunmax Ⅱ collagen implant agent degraded completely to detection by the naked eye and HE staining.The inflammatory reaction and immune rejection reaction of the two materials in vivo were both mild.Conclusion Human amniotic membrane acellular matrix material has excellent biocompatibility without obvious inflammation and immune rejection.The acellular amniotic matrix can be used as a safe and effective filling injection in clinical application because of its strong resistance to degradation and longer retention time.
Human amniotic acellular matrix; Biocompatibility; Animal efficacy; Filler material
710077 陕西 西安,陕西瑞盛生物科技有限公司 研发部
何 越(1987-),男,陕西西安人,硕士.
黄馨慧,710077,陕西瑞盛生物科技有限公司 研发部,电子信箱:huangxinhui@cbmrt.cn
10.3969/j.issn.1673-7040.2016.06.019
R318;R-332
A
1673-7040(2016)06-0381-04
2016-02-07)
