穗花杉双黄酮调控人瘢痕成纤维细胞活性及凋亡的研究
2016-07-18张金丽曹雯娟熊喜峰刘志河
张金丽, 曹雯娟, 熊喜峰, 刘志河
实验研究
穗花杉双黄酮调控人瘢痕成纤维细胞活性及凋亡的研究
张金丽, 曹雯娟, 熊喜峰, 刘志河
目的 探讨穗花杉双黄酮调控人增生性瘢痕成纤维细胞生长与凋亡的作用机制。方法 将细胞接种于24孔板,分别加入不同浓度的穗花杉双黄酮(0、25、50、100、150、200 μmol/L), 48 h后,酶标仪检测490波长的吸光度。选取浓度为50 μmol/L和100 μmol/L的穗花杉双黄酮作为后续实验的用药浓度,以0 μmol/L穗花杉双黄酮为对照,加入到人增生性瘢痕成纤维细胞中作用48 h,分别采用DAPI染色检测穗花杉双黄酮对人增生性瘢痕成纤维细胞凋亡的作用, Western blot检测穗花杉双黄酮对人增生性瘢痕成纤维细胞磷酸化AKT(p-AKT)及凋亡相关蛋白,如翻译控制肿瘤蛋白、BAX、caspase 3、caspase 8、caspase 9的影响。结果 穗花杉双黄酮对人增生性瘢痕成纤维细胞的活力具有剂量依赖性抑制作用,穗花杉双黄酮浓度为50 μmol/L以上与对照组相比,差异有统计学意义(P<0.05)。DAPI染色显示,穗花杉双黄酮具有诱导人增生性瘢痕成纤维细胞凋亡的趋势,与对照组相比,加药组细胞表现为细胞核深染、核膜皱缩、有凋亡小体形成。Westernblot显示,与对照组相比,AKT磷酸化水平降低;促凋亡蛋白BAX表达升高;抗凋亡蛋白TCTP表达降低;caspase3、caspase8、caspase9表达升高。结论 穗花杉双黄酮可诱导瘢痕成纤维细胞凋亡,抑制其活力,有望成为临床治疗增生性瘢痕的一种有效药物。
增生性瘢痕; 成纤维细胞; 凋亡; 穗花杉双黄酮; 实验研究
增生性瘢痕是烧伤患者受伤后伤口修复过程中常见的并发症。随着医疗技术的进步,伤后患者的生存率得到了很大的提高,但形成的增生性瘢痕却严重影响患者的生活质量和心理健康[1]。增生性瘢痕是因成纤维细胞增殖生长失控、胶原过度沉积导致受伤部位异常愈合而形成,其中成纤维细胞的异常增殖在瘢痕的形成中起主要的作用[2]。目前,增生性瘢痕的治疗仍以激素为主,同时还有5- 氟尿嘧啶、免疫调节剂等其他药物,但治疗效果各有利弊[3]。近年来,中草药治疗逐渐引起了人们的关注[4]。有研究证实,从卷柏中提取的穗花杉双黄酮(amentoflavone, AF)具有抗炎、抗肿瘤、抗病毒等多种功效,且AF对UVB照射引起的正常皮肤成纤维细胞DNA损伤有保护作用[5-8]。自2014年6月至2015年3月,暨南大学医学院附属广州红十字会医院创伤外科研究所将AF作用于增生性瘢痕成纤维细胞(hypertrophic scar fibroblasts, HSFBs),以观察其对HSFBs活力与凋亡的影响。
1 临床资料
1.1 主要试剂 高糖DMEM、胎牛血清、胰酶及青链霉素(美国GIBCO公司);XTT(美国SIGMA公司);兔多克隆抗体TCTP、小鼠单克隆抗体BAX(美国SANTA CRUZE公司);兔单克隆抗体caspase 3、兔多克隆抗体caspsae 8、小鼠单克隆抗体caspase 9、兔单克隆抗体p-AKT(美国CST公司);DAPI染色封片剂(美国SANTA CRUZE公司);AF(上海融禾医药科技发展有限公司)。
1.2 组织来源 增生性瘢痕组织来源于暨南大学医学院附属广州红十字会医院创伤外科研究所需做手术切除的3例男性患者,年龄分别为4、7、45岁。均为创面愈合后5~12个月的增生期瘢痕,瘢痕高出皮肤表面。颜色鲜红至暗红,患者自觉偶有瘙痒感,无瘢痕溃疡、破损、感染等情况,无合并肿瘤、糖尿病等基础疾病。均获患者的知情同意。
2 实验方法
2.1 HSFBs的分离培养 采用组织块培养法,将收集到的标本用灭菌PBS液反复冲洗3次,去除瘢痕组织的表皮层和脂肪组织,然后将组织剪碎成1 mm×1 mm×1 mm大小碎块,接种于培养瓶中,添加含10%胎牛血清的高糖DMEM培养基,待细胞从组织块中长出并接近融合成单层时用0.25%胰蛋白酶消化传代。
2.2 XTT检测AF对HSFBs活力的影响 取第3代生长旺盛的细胞接种于24孔板中,每孔接种3×104个细胞,次日,分别加入不同浓度的AF(0、25、50、100、150、200 μmol/L),每组3个复孔,48 h后加入XTT孵育4 h,放入酶标仪检测吸光度。
2.3 DAPI染色观察AF对HSFBs凋亡的影响 取第3代细胞接种于已铺有盖玻片的六孔板中,每孔接种10万个细胞,次日,分别加入不同浓度(0、50、100 μmol/L)AF,作用48 h后,PBS洗3次,加入4%多聚甲醛固定30 min,加入DAPI对细胞核进行染色并至荧光显微镜下观察细胞核的形态。
2.4 Western blot检测AF对HSFBs蛋白表达的影响 细胞接种于培养皿中,加入不同浓度AF(0、50、100 μmol/L)作用48 h后,弃上清,PBS洗3次,加入RIPA细胞蛋白裂解液,离心后收集上清测定蛋白浓度,SDS-PAGE电泳分离蛋白,半干转膜仪转膜,3%BSA封闭2 h,分别加入一抗(TCTP、BAX、caspase 3、caspase 8、caspase 9、p-AKT),4℃冰箱摇床孵育过夜,次日TBST洗3次,分别加入相应二抗,室温孵育1 h,TBST洗3次后加入ECL发光液,放入化学发光凝胶成像仪显影拍照。
3 结果
3.1 XTT检测显示AF抑制HSFBs的活力 当AF浓度为50 μmol/L时,与对照组(0 μmol/L)相比,差异具有统计学意义(P<0.05),表明AF对HSFBs的生长有抑制作用;随着药物浓度的增加,抑制作用越强(图1)。
3.2AF对HSFBs凋亡的影响DAPI染色显示,与对照组相比,50μmol/L与100μmol/LAF组细胞核变小、染色质浓缩、核膜皱缩呈不规则样、凋亡小体形成(图2)。
3.3Westernblot检测AF对HSFBs蛋白表达的影响Westernblot显示,以对照组蛋白表达为100%,p-AKT和翻译控制肿瘤蛋白的表达降低,在50、100μmol/LAF的作用下,p-AKT相对蛋白表达分别是(49.30±10.44)%和(54.00±10.69)%,抗凋亡蛋白翻译控制肿瘤蛋白(translationallycontrolledtumorprotein,TCTP)相对蛋白表达为(70.00±17.00)%和(57.00±13.00)%(图3,4);与对照组相比,差异具有统计学意义(P<0.05)。促凋亡蛋白BAX、caspase3、caspase8、caspase9表达升高,在50、100μmol/lAF作用下,蛋白表达分别为BAX:(120.00±36.00)%、(180.00±43.00)%;caspase3:(277.00±38.00)%、(387.00±55.00)%;caspase8:(213.00±20.00)%、(367.00±21.00)%;caspase9:(166.00±56.00)%、(266.00±71.00)%(图5,6),与对照组相比,差异具有统计学意义(P<0.05)。
4 讨论
正常情况下,人体组织受伤后,伤口部位成纤维细胞的生长与凋亡、细胞外基质的沉积与消退始终维持着一个动态平衡,此动态平衡是保证伤口正常愈合的关键。然而,在有些烧伤患者中,由于炎症或其他因素的影响,导致伤口处成纤维细胞的异常增生、细胞外基质过度沉积,从而形成了增生性瘢痕。因此,抑制HSFBs的增生、诱导HSFBs的凋亡,从而减少细胞外基质的分泌是治疗增生性瘢痕的一个重要途径。
本研究结果显示,AF能够剂量依赖性的抑制HSFBs的生长。AF具有抗炎的作用,能够抑制多种炎症因子如一氧化氮、前列腺素E2等的表达和释放。黄振青等[9]研究发现,AF能够降低急性肝损伤大鼠血清中TNF-α、TGF-β1、IL-1β 和IL-6的含量,而且肝组织TNF-α和iNOS基因的表达也显著下调。李巍等[10]研究表明,黄芩甙能够通过抑制TGF-β1和Ⅲ型胶原蛋白的表达水平减少细胞外基质的异常沉积来影响皮肤瘢痕的形成。因此,AF很可能通过减少这些炎症因子的生成而降低炎症因子对HSFBs的生长刺激作用,从而抑制HSFBs的生长。此外,我们还通过DAPI染色观察AF处理过的HSFBs细胞核形态,发现这些细胞核具有细胞凋亡的特征;Western blot检测结果也证实,AF能够激活caspase 3、caspase 8、caspase 9蛋白酶从而诱导HSFBs凋亡。caspase 8可通过两条平行通路促进凋亡:一方面它可以直接剪切并激活caspase 3;另一方面它还可以切割Bid,截短的Bid进入线粒体,促进细胞色素C的释放,从而激活caspase 9和caspase 3,而caspase 3是所有凋亡途径的必经之路。曾有文献报道,AF可以增强细胞周期素依赖性蛋白激酶抑制剂和抑癌基因p53的活性,通过下调细胞周期素等途径,激活细胞凋亡蛋白酶caspase 3 和caspase 9,通过线粒体固有途径诱导细胞凋亡[11]。杨雨等[12]研究也发现,AF可以通过影响caspase 3和β-catenin表达诱导结肠癌细胞SW480凋亡。
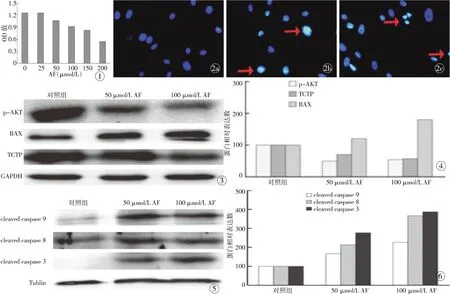
图1 不同浓度AF对HSFBs活力的影响 图2 荧光显微镜下观察HSFBs凋亡细胞核的形态学特征(×400) a.对照组 b.50 μmol/L AF组 c.100 μmol/L AF组 图3 Western blot检测AF对HSFBs中p-AKT、BAX、TCTP蛋白表达的影响 图4 p-AKT、BAX、TCTP蛋白表达半定量分析 图5 Western blot检测AF对HSFBs中caspase 8、caspase 9、caspsae 3蛋白表达的影响 图6 caspase 8、caspase 9、caspsae 3蛋白表达半定量分析
Fig 1 Effect of different concentration AF on HSFBs vitality. Fig 2 Apoptotic features of HSFBs nuclear under fluorescence microscopy (×400). a. control group. b. 50 μmol/L AF group. c. 100 μmol/L AF group. Fig 3 Influence of AF on the expression of apoptosis-related protein in HSFBs examined by Western blot. Fig 4 Expression of p-AKT, BAX, TCTP proteins examined by semiquantitative analysis. Fig 5 Influence of AF on the expression of apoptosis protein in HSFBs examined by Western blot. Fig 6 Expression of caspase 8, caspase 9, caspsae 3 proteins examined by semiquantitative analysis.
细胞凋亡是一种受调节的细胞自杀机制,细胞凋亡的发生,一方面需要促凋亡因子的表达,另一方面则需要抑制抗凋亡蛋白的表达。那么,在本研究中AF如何调控HSFBs凋亡的呢?我们分别检测了BAX、TCTP及p-AKT的表达,AKT是生存信号传导中一个重要因子,能够被许多促生长因子活化,在维持细胞的存活与增殖方面起重要作用,当AKT的活化被抑制以后,能够阻断许多促细胞生长、抗凋亡信号的转导,从而抑制细胞的增殖,诱导细胞的凋亡。其结果显示,当AF作用于HSFBs时,HSFBs的AKT磷酸化被抑制,而BAX表达升高,TCTP表达降低。BAX属于一种促凋亡蛋白,当BAX的表达升高时,可以募集并激活caspase 9,从而诱导细胞凋亡的发生。唐悦玲等[13]研究表明,肿瘤坏死因子α可通过调节瘢痕成纤维细胞内BAX的表达而诱导其凋亡。而TCTP具有抗凋亡作用。Rho 等[14]在肺癌细胞系人肺腺癌细胞(A549)中过表达,TCTP能降低由p53 介导的细胞凋亡,而利用siRNA 干扰TCTP的表达则增加了细胞的凋亡。张飞等[15]发现,在胰腺癌细胞中异常高表达TCTP,可通过上调Bcl-xL抑制细胞凋亡,从而促进胰腺癌的发生和发展。因此,AF很可能是通过抑制AKT磷酸化、降低TCTP蛋白表达、促进BAX升高,进而激活caspase 8、caspase 9及caspase 3,从而抑制HSFBs生长并促进其凋亡。
[1] 王大方, 殷竹鸣, 范金财. 烧伤整形患儿父母心理分析及心理干预的研究进展[J]. 中国美容整形外科杂志, 2014,25(3):144-146.
[2] Sarrazy V, Billet F, Micallef L, et al. Mechanisms of pathological scaring: role of myofibroblasts and current developments[J]. Wound Repair Regen, 2011,19(Suppl 1):s10-s15.
[3] 江 华, 张盈帆. 瘢痕研究的现状和展望[J]. 中国美容整形外科杂志, 2015,26(3):129-131.
[4] 李力群, 郑君达, 倪彬婷, 等. 复合中草药成分的硅酮喷雾剂对增生性瘢痕疗效的研究[J]. 中国美容整形外科杂志, 2013,24(11):648-651.
[5] Hwang IS, Lee J, Jin HG, et al. Amentoflavone stimulates mitochondrial dysfunction and induces apoptotic cell death in candida albicans[J]. Mycopathologia, 2012,173(4):207-218.
[6] Ishola IO, Chatterjee M, Tota S, et al. Antidepressant and anxiolytic effects of amentoflavone isolated from Cnestis ferruginea in mice[J]. Pharmacol Biochem Behav, 2012,103(2):322-331.
[7] Prasad J, Shrivastava A, Khanna AK, et al. Antidyslipidemic and antioxidant activity of the constituents isolated from the leaves of Calophyllum inophyllum[J]. Phytomedicine, 2012,19(14):1245-1249.
[8] Park NH, Lee CW, Bae JH, et al. Protective effects of amentoflavone on Lamin A-dependent UVB-induced nuclear aberration in normal human fibroblasts[J]. Bioorg Med Chem Lett, 2011,21(21):6482-6484.
[9] 黄振青, 韦燕飞, 刘雪梅, 等. 穗花杉双黄酮对急性肝损伤大鼠炎症相关因子的影响[J]. 中国实验方剂学杂志, 2014,20(11):147-150.
[10] 李 巍, 李 峥, 陈 锋. 黄芩对皮肤瘢痕形成过程中TGF-β1、Ⅲ型胶原蛋白表达水平影响[J]. 西部医学, 2012,24(3):462-464.
[11] Lee S, Kim H, Kang JW, et al. The biflavonoid amentoflavone induces apoptosis via suppressing E7 expression,cell cycle arrest at sub-G(1) phase,and mitochondria-emanated intrinsic pathways in human cervical cancer cells[J]. J Med Food, 2011,14(7-8):808-816.
[12] 杨 雨, 徐文娟, 彭 康, 等. 穗花杉双黄酮通过影响caspase-3和β-catenin表达诱导结肠癌细胞SW480凋亡[J]. 南方医科大学学报, 2014,34(7):1035-1038.
[13] 唐悦玲, 李小静, 陈 钊, 等. TSG-6对病理性瘢痕成纤维细胞凋亡的影响[J]. 中国美容整形外科杂志, 2014,25(3):157-160.
[14] Rho SB, Lee JH, Park MS, et al. Anti-apoptotic protein TCTP controls the stability of the tumor suppressor p53[J]. FEBS Lett, 2011,585(1):29-35.
[15] 张 飞, 王 瑧, 张 萍, 等. 异常高表达TCTP通过上调Bcl-xL抑制胰腺癌细胞的细胞凋亡[J]. 中国癌症杂志, 2013,23(5):321-327.
Influence of Amentoflavone on the viability and apoptosis of hypertrophic scar fibroblasts
ZHANGJin-li,CAOWen-juan,XIONGXi-feng,LIUZhi-he.
(InstituteofTraumaticSuigery,GuangzhouRedCrossHospital,MedicalCollageofJinanUniversity,Guangzhou510220,China)
LIUZhi-he,Email:zliu0731@163.com
Objective To investigate the effect of Amentoflavone (AF) on the viability and apoptosis of hypertrophic scar fibroblasts (HSFBs) and its underlying mechanism. Methods XTT assay was performed to assess cell viability. HSFBs were seeded at 3.0×104cells/well in a 24-well plate overnight, and then treated with different concentrations of AF(0 μmol/L, 25 μmol/L, 50 μmol/L, 100 μmol/L, 150 μmol/L, 200 μmol/L. After incubation for 48 h, cell absorbance was detected at 490 nm wavelength. In following experiments, 50 μmol/l AF and 100 μmol/l AF concentration was used. HSFBs were incubated with 50 μmol/L AF or 100 μmol/L AF or 0 μmol/L AF for 48 h. Cell apoptosis were examined by DAPI staining. Western blotting was used to analyze the expression of cell apoptosis-related proteins such as translationally controlled tumor protein (TCTP), BAX, caspsae 3, caspase 8, caspase 9, and p-AKT in HSFB treated with AF. Results AF can inhibit the viability of HSFB dose dependently. Comparing control group (AF: 0 μmol/L) with 50 μmol/L AF or higher AF groups, the difference in cell viability was significant (P<0.05).DAPIstainingshowedAF-inducedapoptosisinHSFBs.AFinducestypicalapoptoticfeaturessuchasmembraneblebbing,cellshrinkageanddetachment,nuclearcondensationandfragmentation.WesternblotshowedthattheexpressionofAKTphosphorylationandanti-apoptoticproteinTCTPwerelower,whiletheexpressionofpro-apoptoticproteinBAXandcaspase3,caspase8,caspase9werehighercomparedwiththecontrolgroup. Conclusion Amentoflavone could induce aptosis of scar fibroblasts so as to inhibit its activity which is expected to become effective medicine for hyperplastic scar treatment.
Hypertrophic scar; Fibroblast; Apoptosis; Amentoflavone; Experimental study
国家自然科学基金(81272222);广州市医药卫生科技项目(20131A011038) 作者单位:510220 广东 广州,暨南大学医学院附属广州红十字会医院 创伤外科研究所 第一作者:张金丽(1979-),女,河南人,主管技师,硕士研究生. 通信作者:刘志河,510220,暨南大学医学院附属广州红十字会医院 创伤外科研究所,电子信箱:zliu0731@163.com
10.3969/j.issn.1673-7040.2016.03.018
R
A
1673-7040(2016)03-0173-04
2015-12-19)
