抗氧化剂N-乙酰半胱氨酸对糖尿病大鼠早期视网膜神经组织的保护作用
2016-07-14张小玲张富军王宝英
陈 玲,张小玲,郝 扬,史 强,王 静,张富军,王宝英
(1. 西安交通大学第一附属医院眼科,陕西西安 710061;2. 西安市儿童医院眼科,陕西西安 710004;3. 西安交通大学医学部,陕西西安 710061)
◇基础研究◇
抗氧化剂N-乙酰半胱氨酸对糖尿病大鼠早期视网膜神经组织的保护作用
陈玲1,2,张小玲1,郝扬1,史强1,王静1,张富军3,王宝英3
(1. 西安交通大学第一附属医院眼科,陕西西安710061;2. 西安市儿童医院眼科,陕西西安710004;3. 西安交通大学医学部,陕西西安710061)
摘要:目的探讨抗氧化剂N-乙酰半胱氨酸(N- acetylcysteine, NAC)对糖尿病大鼠早期视网膜神经组织的保护作用。方法选用健康成年Sprague-Dawley(SD)雄性大鼠(2月龄)60只,体质量180~220 g。随机分组为正常对照组(CON组,20只)和糖尿病组(DM组,40只)。采用腹腔注射10 g/L的链脲佐菌素(streptozotocin, STZ)溶液(60 mg/kg)建立糖尿病大鼠模型,血糖≥16.7 mmol/L者视为糖尿病大鼠动物模型成功(32只),CON组注射等量的柠檬酸-柠檬酸钠缓冲溶液。将糖尿病大鼠模型随机分为糖尿病1月组和糖尿病2月组,每组16只。每只糖尿病模型大鼠左眼设定为糖尿病对照组(D组),右眼设定为NAC治疗组(NAC组)。糖尿病大鼠病程2周时,NAC组玻璃体腔注射4 μL(1.6 μg/μL)NAC,其余糖尿病大鼠玻璃体腔注射4 μL 0.01 mmol/L的PBS。HE染色观察视网膜外核层厚度变化;透射电镜观察视网膜神经节细胞的超微结构变化;免疫荧光法检测视网膜神经节细胞的数量。结果在不同的时间点上NAC组较D组视网膜外核层厚度增加(P<0.01);而NAC组与CON组视网膜外核层厚度没有明显差异(P>0.05)。透射电镜下NAC组较D组视网膜神经节细胞中细胞器多,细胞质电子密度高,线粒体肿胀较轻;而NAC组与CON组相比视网膜神经节细胞超微结构无明显差异。在不同的时间点上NAC组较D组视网膜神经节细胞数量增加(P<0.01);而NAC组与CON组视网膜神经节细胞数量没有明显差异(P>0.05)。结论抗氧化剂NAC对糖尿病大鼠早期视网膜神经组织有保护作用。
关键词:抗氧化剂;N-乙酰半胱氨酸;糖尿病;视网膜神经组织;大鼠
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病最为常见和严重的并发症之一,已经成为全球性四大主要致盲原因之一,预计到2030年全球约有3亿DR患者[1]。长期以来,人们认为DR的主要病理改变为微血管损害,并把糖尿病血管损害作为其特征性表现[2-3]。近年来,随着研究的进一步深入和技术水平的不断提高,发现除了微血管损害外,DR还是一种神经组织的慢性退行性病变,并且在糖尿病初期即可发生,早于视网膜微血管病变。糖尿病早期,视网膜神经组织的损害主要表现在视网膜神经元和神经胶质细胞的功能损害。当出现上述改变时,视网膜微血管超微结构无变化,提示视网膜神经损害发生在微血管损害之前[4-5]。KERN[6]等认为糖尿病大鼠在发病8周时可以加速视网膜神经节细胞的减少。抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine, NAC)具有抑制糖尿病视网膜新生血管生成的作用[7]。然而,NAC对糖尿病大鼠视网膜神经节组织的作用则鲜有报道。本实验通过建立糖尿病大鼠早期视网膜神经组织损伤的模型,探讨NAC对糖尿病大鼠早期视神经组织的保护作用。
1材料与方法
1.1实验动物及分组选用健康成年Sprague-Dawley(SD)雄性大鼠(2月龄)60只,体质量180~220 g,购自西安交通大学医学部实验动物中心。根据随机分组的原则,分为正常对照组(CON组,20只)和糖尿病组(DM组,40只)。DM组大鼠禁食12 h后,一次性左下腹腔注射10 g/L的链脲佐菌素(streptozotocin, STZ)溶液(60 mg/kg)建立糖尿病大鼠模型,72 h后,断尾取血,检测血糖,血糖≥16.7 mmol/L者视为糖尿病大鼠动物模型成功,成模率为80%(32只)。CON组腹腔注射等量的柠檬酸-柠檬酸钠缓冲溶液。将糖尿病模型大鼠随机分为糖尿病1月组(DM1)和糖尿病2月组(DM2),每组16只,将每一只糖尿病模型大鼠左眼设定为糖尿病对照组(D组),右眼设定为NAC治疗组(NAC组)。糖尿病大鼠病程2周时,对NAC组大鼠玻璃体腔注射NAC 4 μL(1.6 μg/μL),D组大鼠则给予玻璃体腔注射等量0.01 mmol/L的PBS,每周1次,连续注射2次。不限饮食、饮水,分组喂养。糖尿病病程1月及2月时,每组各取8只大鼠(8只眼),以100 g/L水合氯醛腹腔注射麻醉处死大鼠,摘除眼球,制备标本。
1.2样本处理和HE染色将眼球角膜距角巩缘0.5 mm针刺定位,固定脱水后常规包埋,根据针刺定位点过视神经垂直于子午线平面切成5 μm厚的切片。每只眼选择5张切片,进行形态学观察;同时每张切片分别于视盘上缘2.5个视盘直径处选取2个视野,随后每隔270 μm选取一个视野,每张切片共选取5个视野,测量视网膜外核层厚度,取平均值。
1.3透射电镜标本的制备将摘取的标本置于预冷的25 g/L戊二醛固定液中,于4 ℃固定2 h后,沿角膜缘剪开眼球,去除眼前节及玻璃体,仅剩眼杯后复置于固定液中固定过夜。次日取出复置于25 g/L戊二醛固定液中2 h,0.1 mol/L磷酸缓冲液浸洗30 min,10 g/L四氧化锇固定液4 ℃后固定2 h。0.1 mol/L磷酸缓冲液浸洗10 min,乙醇梯度脱水,环氧丙烷置换10 min。环氧树脂EPON812浸透、包埋,聚合后作半超薄切片1~2 μm。日本日立H-600透射式电子显微镜下观察、拍照。
1.4视网膜组织Thy-1.1表达的测定采用免疫荧光法检测,按照说明书操作。兔抗大鼠Thy-1.1(CD90)多克隆抗体购于北京博奥森,工作浓度1∶50;FITC标记山羊抗兔IgG购于北京博奥森,工作浓度1∶200。

2结果
2.1大鼠体质量及血糖的变化糖尿病病程1、2月时,分别测量大鼠体质量及血糖。与对照组相比,糖尿病病程1、2月时,糖尿病组体质量明显减轻、血糖明显升高,差异均有统计学意义(P<0.01,表1)。
表1各组大鼠体质量及血糖比较
Tab.1Comparison of the weight and blood glucose among the groups

组别n体质量(g)血糖(mmol/L)CON18347.63±4.756.04±0.29DM18268.63±26.73*24.42±2.86*CON28403.38±10.786.04±0.29DM28335.63±29.17*26.94±2.15*
与同时间点对照组比较,*P<0.01。CON:对照组;DM:糖尿病组;1、2分别为1月、2月。
2.2视网膜外核层的厚度正常对照1月、2月组大鼠视网膜视杆细胞内外节排列规则,视网膜外核层(the outer nuclear layer of retina, ONL)厚度分别为(50.28±1.20)μm、(49.41±1.24)μm,细胞排列紧密,数目较多,内外核层界限清楚。NAC 1月、2月组大鼠视网膜视杆细胞内外节排列也较规则,ONL厚度分别为(51.52±2.99)μm、(48.83±3.54)μm。D 1月、2月组大鼠视网膜视杆细胞内外节较同一时间点正常组、NAC组排列稍紊乱,ONL排列稍紊乱且厚度变薄,分别为(39.05±2.85)μm、(34.18±3.33)μm,差异具有统计学意义(P<0.01,图1、图2)。

图1各组不同时间点视网膜ONL平均厚度的比较
Fig.1 Comparison of mean ONL thickness among the groups
与同一时间点正常对照组比较,*P<0.01;与同一时间点D组比较,#P<0.01。

图2各组不同时间点视网膜组织的形态学改变
Fig.2 Morphological changes of retina tissues at different time points in each group (×40)
A:正常对照1月组;B:NAC 1月组;C:糖尿病对照1月组;D:正常对照2月组;E:NAC 2月组;F:糖尿病对照2月 组。GCL:神经节细胞层;IPL:内网层;INL:内核层;OPL:外网层;ONL:外核层。
2.3视网膜神经节细胞超微结构的变化正常对照1月组及2月组视网膜神经节细胞的超微结构类似,电镜下可见神经节细胞中正常的细胞质、线粒体、内质网、高尔基体,细胞器数量较多,胞质的电子密度高,线粒体结构正常、无肿胀,可见线粒体嵴(图3、图4A、B、C)。而糖尿病1月组电镜下可见神经节细胞中细胞质小片溶解区,胞质电子密度低,线粒体肿胀,线粒体嵴模糊不清、变短、(图3 D、E、F)。糖尿病2月组电镜下可见神经节细胞胞质大片溶解区,空泡变性,胞质纤维化,电子密度更低,细胞器减少明显,线粒体更加肿胀且肿胀的线粒体数目增多,线粒体嵴更加模糊不清、甚至消失(图4D、E、F)。NAC1、2月组电镜下结构与正常对照组相似,可看到正常的细胞器结构及大量的线粒体、内质网、高尔基体,线粒体无肿胀,线粒体嵴清晰可见(图3、图4G、H、I)。

图3各组病程1月时视网膜神经节细胞的超微结构的变化
Fig.3 Changes of retinal ganglion cell ultrastructure in rats at one month of diabetes (A, D, G: ×5 000; B, E, H: ×20 000; C, F, I: ×30 000)
A、B、C:正常对照1月组;D、E、F:糖尿病1月组;G、H、I:NAC 1月组。
2.4视网膜神经节细胞数量的变化正常对照组1月、2月大鼠视网膜神经节细胞排列规则、紧密,数量较多,分别为(25.50±4.18)个、(24.00±1.60)个。NAC组1月、2月大鼠视网膜视杆细胞内外节排列也较规则、紧密,视网膜神经节细胞数量分别为(22.88±3.56)个、(23.25±3.84)个。D组1月、2月大鼠视网膜神经节细胞数量较同一时间点正常对照组、NAC组排列稍紊乱,数量减少,分别为(8.00±2.00)个、(4.50±1.60)个,差异均有统计学意义(P<0.01,图5、图6)。
3讨论
长期以来,人们认为糖尿病的主要病理改变为微血管损害,对糖尿病的病理损害的研究主要集中在视网膜血管内皮细胞和周细胞组成的微血管损害上。近年来研究发现,DR发生在糖尿病初期,主要表现为视网膜神经元和神经胶质细胞的功能损害。大量研究显示,NAC抗氧化应激对糖尿病大鼠视网膜血管具有保护作用[7]。然而NAC对糖尿病大鼠视网膜神经组织的作用尚不清楚。
本实验采用STZ诱导建立糖尿病大鼠模型,应用HE染色、透射电镜、免疫荧光的方法从形态学观察糖尿病大鼠早期视网膜神经组织的变化。HE染色发现,糖尿病1月时,视网膜神经组织已经发生病理变化,主要表现为视网膜外核层变薄、排列疏松;而正常对照组与NAC组视网膜外核层厚度无明显变化。提示NAC对早期糖尿病大鼠视网膜神经组织有保护作用。透射电镜下观察到糖尿病病程1个月时,与正常对照组及NAC组相比,视网膜神经节细胞超微结构发生了比较明显的变化,主要表现为视网膜神经节细胞胞质减少,胞质电子密度减低,细胞器减少,尤以线粒体减少明显,线粒体肿胀,线粒体嵴开始变短、模糊不清。糖尿病病程2个月时与正常对照组及NAC组相比,视网膜神经节细胞超微结构的改变更加明显,在病程1个月的基础上又出现了视网膜神经节细胞胞质大片溶解区,胞质纤维化,细胞器大量减少,线粒体肿胀,线粒体嵴消失。上述变化与文献报道一致[8]。MOORE等[9]在研究糖尿病大鼠视网膜神经节细胞时,也发现在糖尿病1月时大鼠视网膜神经节细胞已发生损伤,与本实验研究结果一致。NAC 1、2月组与正常对照1、2月组相比视网膜神经节细胞的超微结构无明显变化,提示NAC对糖尿病大鼠早期视网膜神经节细胞具有保护作用。Thy-1.1是存在于视网膜神经节细胞胞膜或胞体上的一种特异性的糖蛋白。BARNSTABLE等[10]研究发现Thy-1.1(CD90)是啮齿动物视网膜神经节细胞的特异性标记物。本研究结果显示,糖尿病大鼠1、2月时,视网膜神经节细胞较正常对照组分别减少约60%、80%,而NAC 1、2月组与正常对照组相比均没有差异。同样LIU等[11]在研究糖尿病大鼠视网膜神经节细胞中也得出相似的结果。提示NAC的抗氧化应激对糖尿病大鼠早期视网膜神经组织具有保护作用。
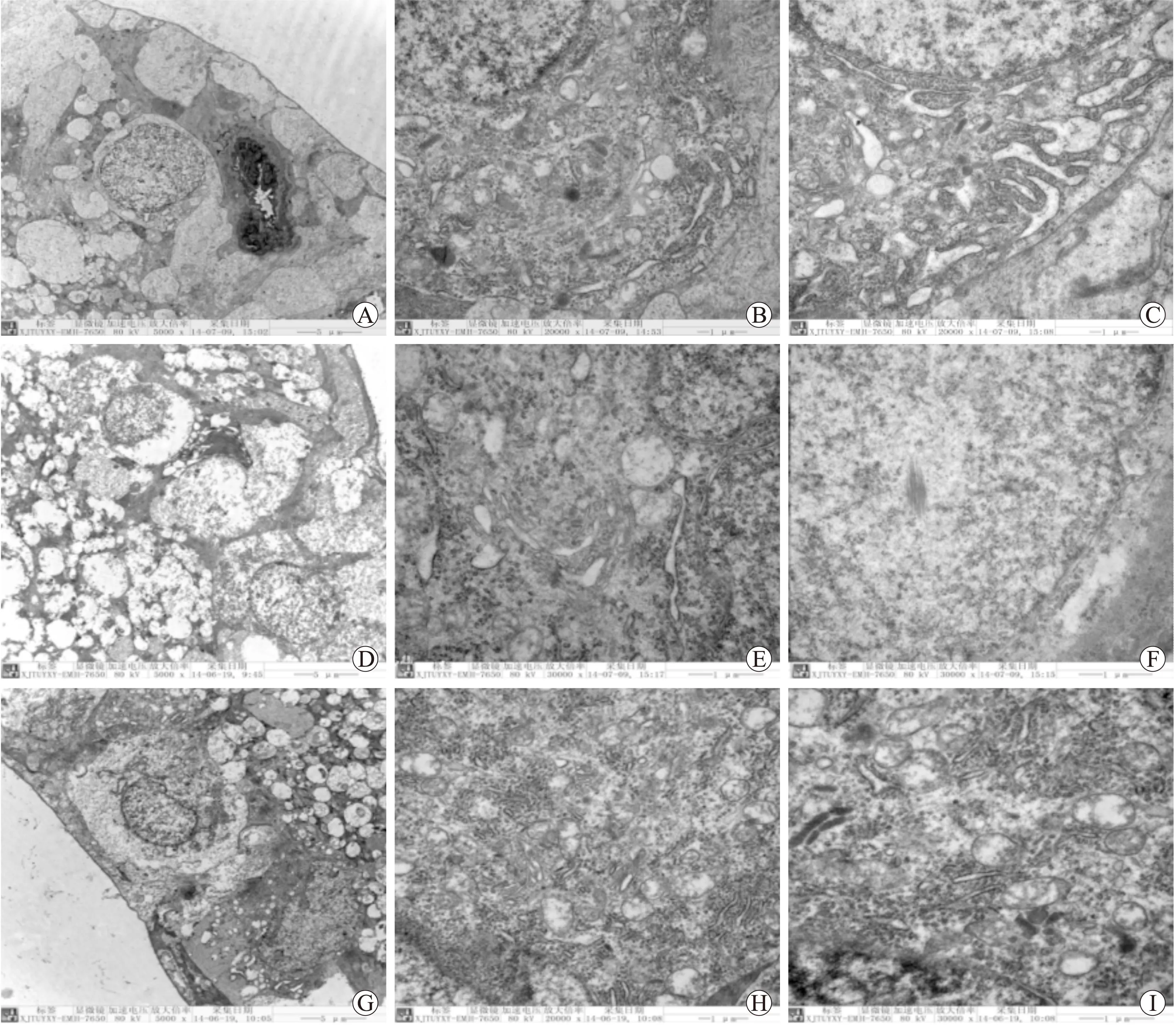
图4各组病程2月时视网膜神经节细胞的超微结构改变
Fig.4 Changes of retinal ganglion cell ultrastructure in rats at two months of diabetes (A, D, G: ×5 000; B, E, H: ×20 000; C, F, I: ×30 000)
A、B、C:正常对照2月组;D、E、F:糖尿病2月组;G、H、I:NAC 2月组。
糖尿病引起的视网膜神经组织的病变,除了高血糖的影响外,视神经周围血管的低灌注以及缺血缺氧引起的神经营养因子供给减少等原因可能是其发生发展的主要原因之一。在用高糖培养的视网膜细胞中及糖尿病动物模型、糖尿病患者的血液中均可检测到活性氧量的增多,而在正常情况下,体内的活性氧可以被一些抗氧化的防御系统所清除[12-13]。糖尿病时,由于体内血糖的增高,这些抗氧化酶类活性减低、抗氧化防御系统崩溃,加剧了氧化应激对机体组织的损伤。NAC是一种含巯基的抗氧化剂,具有干扰自由基生成,清除自由基,调节细胞代谢活性和细胞凋亡程序等作用。体内实验发现NAC能提高红细胞、肝脏组织和肺组织中细胞内的谷胱甘肽水平[14]。体外实验亦发现细胞在含有NAC的生长介质中具有很强的摄取NAC的能力,并可利用它进行谷胱甘肽合成[15]。
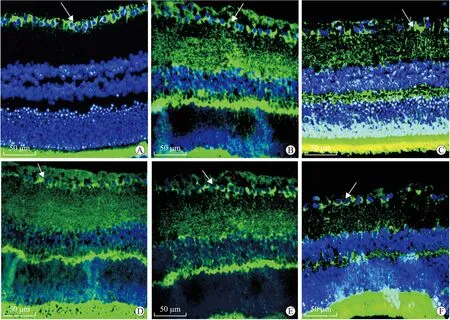
图5免疫荧光法检测各组大鼠视网膜神经节细胞
Fig.5 The retinal ganglion cells measured by immunofluorescence (×40)
图中箭头所指为显色的视网膜神经节细胞的胞膜及树突。A、D:正常对照1、2月组大鼠视网膜神经节细胞荧光强,且排列规则、紧密、整齐,数量多;B、E:NAC 1月组大鼠视网膜神经节细胞荧光强度及细胞数量、排列规则及紧密程度与正常对照组相似;C、F:糖尿病1、2月组视网膜神经节细胞荧光强度较同时间点正常对照组及NAC组弱,且细胞排列疏松、不规则、不紧密。

图6各组大鼠视网膜神经节细胞(GCL)数量的比较
Fig.6 Comparison of the counts of retinal ganglion cells among the groups
与同时间点正常对照组比较,*P<0.01;与同时间点D组比较,#P<0.01。
本研究结果显示糖尿病大鼠早期,视网膜神经节细胞数量减少,视网膜外核层厚度变薄,外核层细胞排列疏松且不规则,并随病程的延长呈现加剧的变化趋势。给予NAC,外源性补充抗氧化物质对内源性的视网膜抗氧化系统也有加强保护作用,使糖尿病引起的视网膜神经组织氧化损伤减轻,视网膜神经节细胞及视网膜外核层细胞丢失减少,从而对视网膜神经组织起到保护的作用。其作用机制可能是:①具有清除视网膜组织中活性氧并且抵御氧化应激的作用;②降低血管内皮生长因子等在视网膜组织中过量的表达;③提高机体内谷胱甘肽的含量,有效地清除体内多余的活性氧,对视网膜神经节细胞起保护作用;④NAC通过调节凋亡相关基因的变化达到抑制细胞凋亡的目的,从而对视网膜神经组织起到保护作用[16]。当然,NAC除了具有清除活性氧自由基、抵抗氧化应激外,还有广泛的生物学作用。因此NAC发挥视网膜神经组织的保护作用可能还涉及其他相关机制,有待进一步深入研究。
参考文献:
[1] NAKAJIMA M, COONEY MJ, TU AH, et al. Normalization of retinal vascular permeability in experimental diabetes with genistein[J]. Invest Ophthalmol Vis Sci, 2001, 42(9):2110-2114.
[2] CAI J, BOULTON M. The pathogenesis of diabetic retinopathy: old concepts and new questions[J]. Eye (Lond), 2002, 16(3):242-260.
[3] ANTONETTI DA, BARBER AJ, BRONSON SK, et al. Diabetic retinopathy: seeing beyond glucose-induced microvascular disease[J]. Diabetes, 2006, 55(9):2401-2411.
[4] GARDNER TW, ANTONETTI DA, BARBER AJ, et al. New insights into the pathophysiology of diabetic retinopathy: potential cell-specific therapeutic targets[J]. Diabetes Technol Ther, 2000, 2(4):601-608.
[5] KERN TS, BARBER AJ. Retinal ganglion cells in diabetes[J]. J Physiol, 2008, 586(Pt 18):4401-4408.
[6] KERN TS, TANG J, BERKOWITZ BA. Validation of structural and functional lesions of diabetic retinopathy in mice[J]. Mol Vis, 2010, 16:2121-2131.
[7] ZHU Y, ZHANG XL, ZHU BF, et al. Effect of antioxidant N-acetylcysteine on diabetic retinopathy and expression of VEGF and ICAM-1 from retinal blood vessels of diabetic rats[J]. Mol Biol Rep, 2012, 39(4):3727-3735.
[8] BARBER AJ, LIETH E, KHIN SA, et al. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin[J]. J Clin Invest,1998, 102(4):783-791.
[9] MOORE P, EL-SHERBENY A, ROON P, et al. Apoptotic cell death in the mouse retinal ganglion cell layer is induced in vivo by the excitatory amino acid homocysteine[J]. Exp Eye Res, 2001, 73(1):45-57.
[11] LIU X, ZUO Z, LIU W, et al. Upregulation of Nogo receptor expression induces apoptosis of retinal ganglion cells in diabetic rats[J]. Neural Regen Res, 2014, 9(8):815-820.
[12] HAIDARA MA, YASSIN HZ, RATEB M, et al. Role of oxidative stress in development of cardiovascular complications in diabetes mellitus[J]. Curr Vasc Pharmacol, 2006, 4(3):215-227.
[13] BAYNES JW. Role of oxidative stress in development of complications in diabetes[J]. Diabetes, 1991, 40(4):405-412.
[14] GREGORY S, KELLY KD. Clinical applications of N-acetylcysteine[J]. Altern Med Rev, 1998, 3(2):114-127.
[15] WU GY, ZHAO YR. The study advancement of N-acetylcysteineon the pharmacologic action mechanism [J]. Mod Med Health, 2004, 20(19):2001-2002.
[16] 刘晶晶,刘丹. N-乙酰半胱氨酸对大鼠挫伤性视网膜病变的保护作用[J]. 国际眼科杂志, 2013, 13(3):438-440.
(编辑邱芬)
收稿日期:2015-08-31修回日期:2016-03-29
基金项目:陕西省科技计划项目资助(No.S2012SF2511)
通讯作者:张小玲. E-mail:zhangxle@mail.xjtu.edu.cn
中图分类号:R774.1
文献标志码:A
DOI:10.7652/jdyxb201604010
Protective effect of antioxidant N-acetylcysteine on the retinal nerve tissue of early diabetic rats
CHEN Ling1,2, ZHANG Xiao-ling1, HAO Yang1, SHI Qiang1,WANG Jing1, ZHANG Fu-jun3, WANG Bao-ying3
(1. Department of Ophthalmology, the First Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710061; 2. Department of Ophthalmology, Xi’an Children’s Hospital, Xi’an 710004;3. Xi’an Jiaotong University Health Science Center, Xi’an 710061, China)
ABSTRACT:ObjectiveTo explore the protective effect of the antioxidant N-acetylcysteine (NAC) on the retinal nerve tissue of early diabetic rats. MethodsWe randomly divided 60 healthy adult Sprague-Dawley (SD) rats weighing between 180 g and 220 g into 2 groups: normal control (CON, n=20) and diabetic (DM, n=40). By intraperitoneal injection of streptozotocin (60 mg/kg), the model of diabetic rats was established. The rats were considered diabetic only when they had hyperglycemia (set at ≥16.7 mmol/L) (32). The CON group was injected with the same amount of citric acid and sodium citrate buffer solution. After successful model establishment, the diabetic rats were randomly divided into 1-month diabetes group and 2-month diabetes group, with 16 rats in each group. The left eye of each experimental diabetic rat was set for diabetes control group (D) while the right eye was set as NAC treatment group (NAC). At 2 weeks of diabetes, 4 μL (1.6 μg/μL) of NAC was injected into the vitreous chamber of NAC group and 4 μL (0.01 mmol/L) of PBS was injected into the vitreous chamber of the other diabetic rats. The thickness changes of outer nuclear layer retina was observed by HE, ultrastructural changes of retinal ganglion cells were observed under the transmission electron microscope, and the number of retinal ganglion cells was detected by immunofluorescence method. ResultsAt different time points, retina outer nuclear layer in NAC group was thicker than in D group (P<0.01). However, the NAC group and the CON group did not differ (P>0.05). Under the transmission electron microscope, NAC group had more retinal ganglion cell organelles, higher electron density of the cytoplasm, and milder mitochondria swelling than D group. The NAC group did not differ from CON group in the ultrastructure of retinal ganglion cells. NAC group had an increased number of retinal ganglion cells at different time points compared with the D group (P<0.01), but the NAC and CON groups did not differ in the number of retinal ganglion cells (P>0.05). ConclusionThe antioxidant N-acetylcysteine has a protective effect on the retinal nerve tissue of early diabetic rats.
KEY WORDS:antioxidant; N-acetylcysteine; diabetes; retinal nerve tissue; rat
Supported by the Science and Technology Plan Project of Shaanxi Province (No.S2012SF2511)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.0910.012.html(2016-06-15)
