ZnO—Sm纳米复合物制备及可见光催化降解RhB
2016-07-14李小明张志贝杨伟强李志军徐
李小明 张志贝++杨伟强++李志军++徐秋翔++周理++谢伟强++陈寻峰��

摘要:采用简单的水热反应后于400 ℃煅烧3 h,制备出正六边形柱状ZnOSm纳米颗粒.合成的ZnO材料用紫外可见光谱仪(UVvis)、扫描电子显微镜(SEM)、能谱分析仪(EDX)和傅氏转换红外线光谱分析仪(FTIR)表征.SEM扫描图片显示合成的ZnO材料为柱状正六边形纳米颗粒,且随着Sm的掺杂ZnO纳米颗粒的晶体体积变小,但并未改变ZnO晶体形态.EDX图谱证明Sm成功掺杂进入ZnO晶体.光催化实验显示在可见光照射下原子分数2.0 %ZnOSm纳米材料比纯ZnO纳米材料对玫瑰红B(RhB)的降解效果提高了近30%,并探索了最佳实验条件以获得更好的光催化效果.结果表明ZnOSm纳米材料在废水处理中具有潜在的应用价值.
关键词:水热法;掺杂钐氧化锌;纳米结构物;光催化
中图分类号:X703 文献标识码:A
近年来染料废水已成为主要的工业有害废水之一,其主要来源于染料及其相关生产行业.由于染料工业的蓬勃发展,产生的染料废水已经成为主要的水体污染源之一.然而,由于染料废水的成分复杂,很难降解,且具有生物积累性,所以目前传统的水处理工艺对染料废水的处理效果并不好[1].
目前利用n型半导体纳米材料作为催化剂光催化氧化降解染料废水成为一种有效的污水处理技术.ZnO是重要的ⅡⅥ族半导体氧化物,是一种多功能的半导体材料,具有光催化性、压电性、发光性、导电性、气敏性等诸多优越的性能,主要应用在光催化、传感器、激光器、太阳能电磁等方面.ZnO材料因具有很高的化学和光化学稳定性,来源广泛,价格低廉,反应活性高且制备简单等优点而得到广泛的研究和应用.纳米氧化锌是一种优良的直接带隙宽禁带半导体材料,禁带宽度为3.37 eV,可有效地被紫外光激发而表现出良好的光催化活性.诸多报道表明,ZnO纳米材料在一定的条件下,在处理一些难降解的有机物时,比已经广泛研究的TiO2,表现出更高的光催化活性和量子产率,被认为是极其具有应用前景的高活性光催化剂.然而ZnO的带隙较宽(3.37 eV),只能对波长较短的紫外光(λ<368 nm)有响应,能强烈地吸收紫外光,所以不能充分利用太阳光能.而且由紫外光激发的光生电子和空穴复合时间短,复合率高,量子效率偏低.这些都制约了ZnO材料的实际应用和发展[2-7].
针对上述问题,当前的诸多研究表明,通过对ZnO进行特殊元素离子掺杂的方式可以改善ZnO固有的缺陷,降低ZnO光生电子和空穴的复合率,扩展氧化锌的光响应范围,提高其光催化效率.如Yayapao等[8]的研究指出与纯ZnO相比,NdZnO对MB的光催化效率更高.Karunakaran等[9]的研究表明掺杂Ce后,CeZnO带隙变窄,产生红移,提高了其对可见光的吸收能力.然而目前鲜有关于掺杂钐元素离子改性氧化锌的可行性和掺杂后的效果方面的研究报告.本文采用掺杂钐元素离子的方法,改变ZnO半导体的光电性质,增强ZnO半导体在可见光范围内的光吸收强度,降低光生电子和空穴的复合率,从而提高其对可见光的利用率,增强ZnO纳米材料的光催化效率 [10-13].最后利用改性后的ZnO纳米材料在可见光下进行光催化降解玫瑰红B染料试验.
1实验
1.1实验试剂和实验仪器
整个实验过程用水均为去离子水,药品均为分析纯试剂,无其他任何处理.
醋酸锌(Zn(CH3COO)22H2O); 硝酸钐(H12N3O15Sm); 氢氧化钠(NaOH); 玫瑰红B(C28H31CIN2O3); 无水乙醇(CH3CH2OH); 分析天平; 紫外可见分光光度计(UV2800); 聚四氟乙烯内衬反应釜(100 mL);恒温磁力搅拌器; 离心机; 真空干燥箱; 马弗炉; 实验室超纯水机;氙灯(紫外滤光片,300 W);场发射扫描电子显微镜(JSM6700F);紫外可见光谱仪(PE lambda 35);红外光谱仪(WQF410).
1.2样品制备
1.2.1掺杂钐的纳米氧化锌制备
称取1.98 g醋酸锌(Zn(CH3COO)2·2H2O),然依次搭配80.0 mg,160.0 mg,240.0 mg的硝酸钐(H12N3O15Sm)(原子分数依次为2.0%,4.0%,6.0%)溶于50 mL的去离子水中,然后置于150 mL三口烧瓶中,在60 ℃下剧烈搅拌30 min后,保持剧烈搅拌,逐滴缓慢加入适量的事先配制好的氢氧化钠(0.3 mol/L)溶液,继续搅拌60 min后移入100 mL的聚四氟乙烯内衬的反应釜中,然后置于马弗炉中,在160 ℃下反应12 h.自然冷却后取出,离心分离,所得沉淀物用无水乙醇和超纯水清洗数次,于真空干燥箱中60 ℃干燥一夜.最后将干燥后的样品置于马弗炉中在400 ℃下煅烧3 h,冷却后取出备用,并依次记为样品A1,A2,A3.
1.2.2纳米氧化锌的制备
纯纳米氧化锌的制备过程和掺杂钐的纳米氧化锌制备过程保持相同,仅仅是不加入硝酸钐,并记为A0样品.
1.3样品表征
1.3.1扫描电子显微镜(SEM)表征
图1 为纯ZnO和2.0%ZnOSm的SEM扫描图片.从图中可以看出纯ZnO和2.0%ZnOSm晶体在形貌上区别不大,都是呈正六边形柱状体结构.且掺杂Sm后晶体的体积有所减小,说明Sm掺杂起到抑制晶体生长的作用.
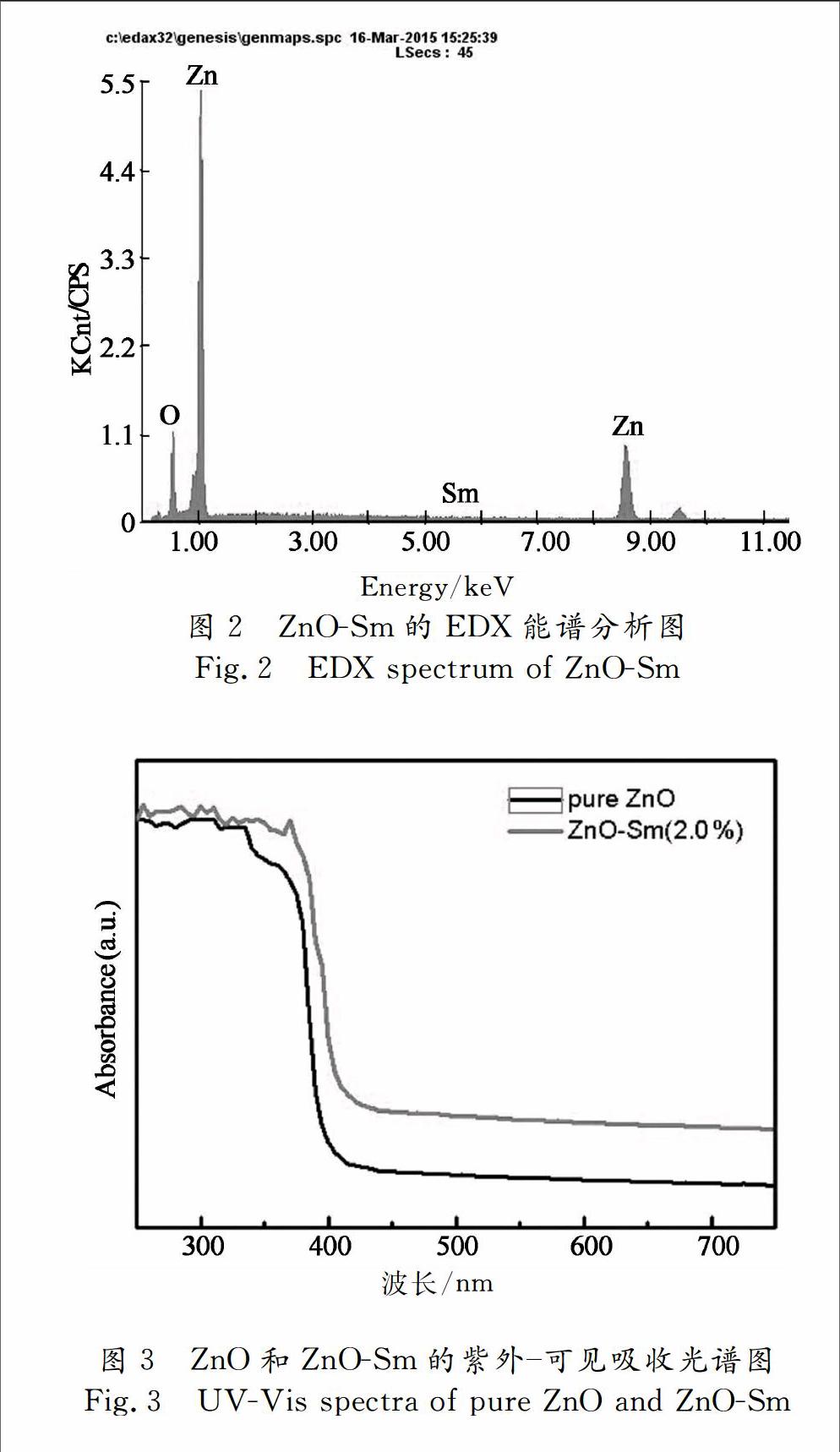
图2为2.0%ZnOSm的EDX图谱.表明该晶体由Zn,O,Sm组成.证明了样品为高纯度的氧化锌晶体,且说明了Sm元素成功的掺杂进ZnO晶体结构中.Zn∶O的平均原子百分比大约为49∶50,证明所制备的氧化锌晶体材料化学计量比Zn∶O为1∶1.
1.3.2紫外可见漫反射表征
图3为纯ZnO和ZnOSm(2.0%)的紫外可见吸收光谱图.从图3中可以看出掺杂Sm元素离子后,ZnO的光吸收性能显著改善.在可见光波段范围,ZnOSm(2.0%)的光吸收能力明显高于纯ZnO.且ZnOSm(2.0%)样品的吸收边发生红移,该红移可能是因为Sm掺杂进入ZnO后产生缺陷引起能带间电子转移造成的[14].
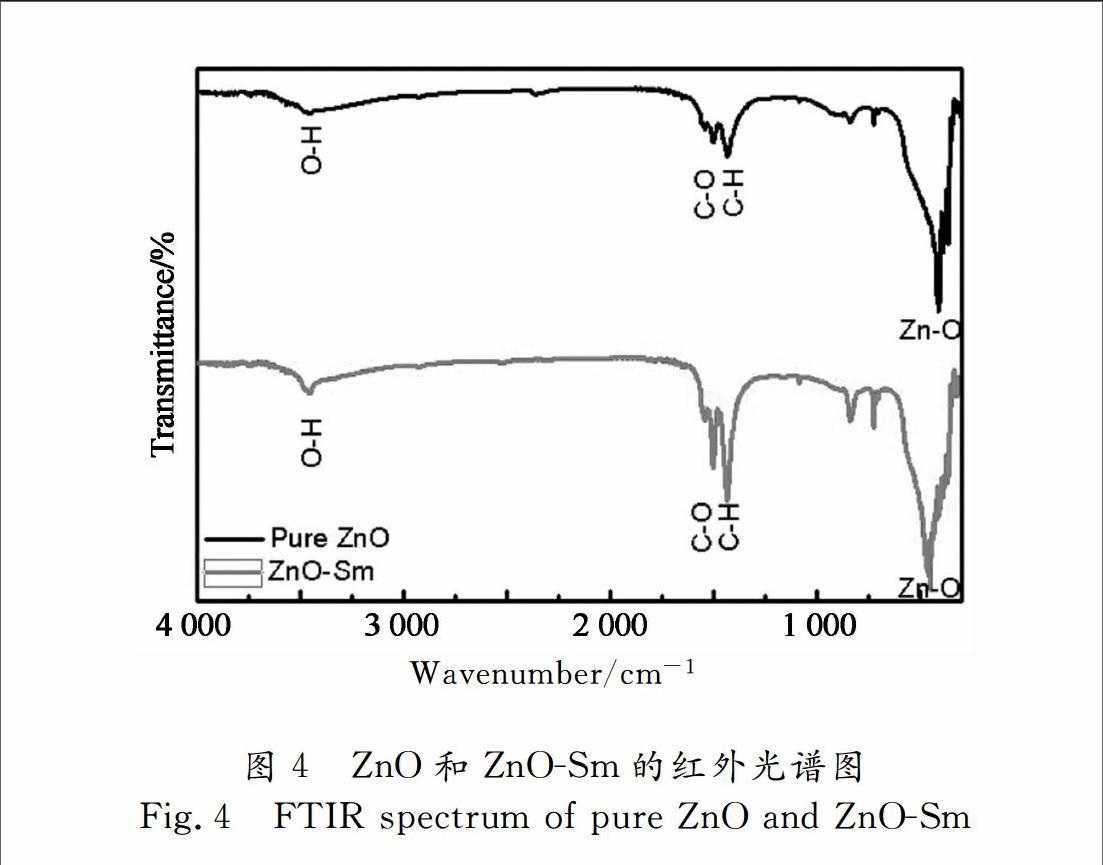
1.3.3红外光谱表征
图4为纯ZnO和ZnOSm(2.0%)的红外光谱图.图中在460 cm-1处有强烈的Zn-O键伸缩振动吸收峰,证明生成了氧化锌晶体.在1 600 cm-1处有微弱的C=O键的伸缩振动.在3 500 cm-1处有微弱的宽带吸收峰,其对应H-O键的伸缩振动[15] .
1.4光催化降解RhB
配置10 mg/L的RhB溶液,取100 mL置于烧杯中,向其中加入0.1 g的上述A1样品(ZnOSm),再置于遮光处暗反应1 h,使其达到吸附反应平衡.然后置于自制的光催化反应装置内,在以氙灯(配置滤光片)为光源的可见光之下搅拌反应,光源灯和反应液面的距离为9 cm.每隔20 min取样一次,并离心后取上清液.采用紫外可见分光光度计在RhB的最大吸收波长554 nm处测定上清液的吸光度值,并记录.
采用改变单一变量原则,并保持其他实验条件相同,依次进行样品A2,A3和样品A0(ZnO)的光催化实验.
2结果和讨论
2.1材料形貌和生长机制分析
从图1中的高倍图谱中可以清晰地看到氧化锌晶体为上表面是正六边形的柱状颗粒,且大多是两两结合在一起,具有统一的规则形状.这种柱状六方体氧化锌颗粒的比表面积比棒状的氧化锌高很多,能够更好地促进氧化锌的光催化作用.通过对比Sm掺杂前后的样品形态,发现掺杂Sm后样品的粒径尺寸有所减小,说明掺杂Sm起到抑制晶体生长的作用 [16-17] .而且通过对比纯ZnO样品和2.0%ZnOSm 样品的SEM扫描图谱发现后者的晶体颗粒外形呈现出较多的不规则形状,这可能是由于Sm掺杂后对ZnO的晶体生长产生了某种破坏作用,这可能和Sm能抑制ZnO的晶体生长有关 [18] .
根据上述分析和实验数据,ZnO纳米结构的生长过程可以用如下的化学反应方程式表示[19]:
ZnCH3COO2→Zn2++2CH3COO-2
Zn2++2OH-→ZnOH2↓
ZnOH2+2OH-→ZnOH2-4
ZnOH2-4→ZnO+H2O+2OH-
2.2降解效果分析
图5(a)为不同掺杂比例的ZnOSm样品对RhB的降解效果图(仅Sm的掺杂比例不同,其它实验条件保持相同).从图中可知ZnOSm(2.0%)对RhB的降解效率最高达到了71.1%,相比于纯氧化锌样品降解效率提高了近30%,其它掺杂比例的ZnOSm样品的降解效率也都有提高,说明氧化锌适量的掺杂Sm元素能够有效地增强对可见光的吸收强度,降低光生电子和空穴的复合率,从而提高ZnO的光催化效率.然而当掺杂率过高时,Sm元素掺杂所形成的缺陷又会重新形成光生电子空穴对的复合中心,导致了电子空穴复合率增加,降低了光催化效率 [20-21] .本实验的最佳掺杂比例为2.0at.%(Sm/ ZnO).由图5(a)看出氧化锌适量掺杂钐元素离子后提高了其在可见光下的催化效果,使其对RhB的降解率有明显的提高.表明适当的钐离子掺杂获得了明显的提升效果,增强了氧化锌的光催化活性.
图5(b)为ZnOSm(2.0%)样品在不同pH下对RhB的降解效果图.(仅pH不同,其他实验条件保持相同)从图5(b)中可以看出ZnOSm(2.0%)样品在溶液pH为中性范围时降解效果最好.在强碱性或强酸性条件下降解效果明显变差 [22] .
图5(c)为不同物质量的ZnOSm(2.0%)对RhB的降解效果图(仅催化剂的物质量不同,其他实验条件保持相同)从图中可得当催化剂的量由0.05 g增加到0.10 g时,样品的降解效果随催化剂的量增加而增加,之后继续增加催化剂的量,降解效果的增加幅度显著减小.说明在一定范围内增加催化剂的量可以提高光吸收能力,增强光利用率.而当催化剂的量过多时,减弱了光的透过率和催化剂对光的吸收效率,这时催化剂的降解效率受到抑制 [23].
准一级动力学方程式模拟光催化反应速率[24]如下:
-lnCtC0=κt (1)
式中:Ct为t时刻的RhB溶液浓度;C0为暗反应后的RhB溶液的初始浓度;κ为反应速率动力学常数[25].
图6(a)~(c)是根据上述公式计算得到的线性拟合结果绘制而成.直线斜率即为反应速率常数κ.图6(a)中ZnOSm(2.0%)样品的反应速率常数κ最大,是纯ZnO样品反应速率常数κ的2倍,表明将Sm元素以合适的比例掺杂进入ZnO晶体能够显著提高ZnO的光催化效果.这一结论与图5(a)一致.根据准一级动力学模拟结果得到在降解100 mL的10 mg/L RhB溶液时,Sm最佳掺杂比例为Sm/ZnO为2.0%,最佳反应溶液pH为中性范围,最佳催化剂的量为0.10 g.该结果与降解效果图一致.
2.3光催化机理分析
ZnO是宽禁带半导体,禁带宽度为3.37 eV,吸收波长的阈值在紫外光区.当ZnO被紫外光照射时,光激发电子从低能价带跃迁到高能导带,同时产生导带电子(e-)和价带空穴(h-).在光催化的过程中,光生电子和空穴分离且迁移到催化剂表面,被催化剂表面的有机物捕获并发生氧化还原反应,或者光生电子被晶格表面的缺陷捕获[26].而空穴具有极强的得电子能力,能将催化剂表面吸附的OH-和H2O分子氧化成羟基自由基(·OH).而羟基自由基(·OH)的氧化电位高达2.7 eV,具有极强的氧化性,可以将催化剂表面的有机物氧化降解为CO2和H2O等简单物质[27].然而,由于纯ZnO只具有紫外光区的光催化活性,太阳光能利用率低.ZnO掺杂Sm离子后,Sm进入到ZnO晶格中,以Sm—O—Zn化学键的形式存在,引入了杂质能级并减小了禁带宽度,使ZnO的能带变窄,扩宽了掺杂后的ZnO吸收波带,将ZnO的吸收波带从紫外光带扩展到了可见光带,提高了ZnO的光能利用率[28].而且由于Sm3+离子的半径(96 pm)比Zn2+的半径(74 pm)要大,其进入ZnO晶格后取代了Zn2+离子,使ZnO晶格膨胀变大,导致ZnO的晶格发生畸变,产生缺陷,而正是Sm掺杂形成的缺陷成为了在光催化中捕获光生电子和空穴的陷阱,降低了ZnO的导带电子和价带空穴的复合率,延长了光生电子的寿命,从而提高了光生电子的利用率.因为还原态的Sm2+离子非常不稳定,能够很容易的捕获到光生电子并传送到O2,形成羟基自由基(·OH).此时Sm掺杂形成的缺陷可以作为光生电子载体,促进在可见光激发下的导带电子传递,从而提高ZnOSm纳米半导体在可见光下的光催化效率[29].因此,适当的掺杂钐离子能增强ZnO对可见光的吸收强度,提高其在可见光下的催化活性.根据上述分析,ZnOSm的降解机理可以用如下方程式表示[30]:
ZnO+hν→ZnO(ech+h+vb)
h+vb+H2O→H++·OH
h+vb+OH·→ · OH
e-cb+O2→O-2·
O-2· +H+→ ·OOH
·OOH+H++e-cb→H2O2
H2O2+e-cb→ ·OH+OH-
3结论
1) 以醋酸锌、氢氧化钠和硝酸钐为主要原料,采用简单水热法反应后在400 ℃高温煅烧,制备出了不同比例的Sm掺杂的ZnO纳米材料,为正六边形柱状结构的颗粒.
2) Sm的掺杂起到了扩展ZnO光吸收的范围,增强了ZnO对可见光的响应能力,提高了光催化效果.
3) 以100 mL的10 mg/L RhB溶液为目标检验了ZnOSm材料的可见光催化活性.实验结果表明,Sm在ZnO中的掺杂比为2.0%,溶液pH为中性范围,催化剂的质量0.10 g时为最佳实验条件,可以得到较好的降解效果(70%以上).
4) 采用Sm修饰后的ZnO纳米材料处理染料废水具有一定的可行性,值得进一步的研究和探索.
参考文献
[1]任南琪, 周显娇, 郭婉茜, 等. 染料废水处理技术研究进展[J]. 化工学报, 2013, 64(1):84-94.
REN Nanqi, ZHOU Xianjiao, GUO Wanqian. A review on treatment methods of dye wastewater[J]. Journal of Chemical Industry and Engineering, 2013, 64(1):84-94.(In Chinese)
[2]YANG Q, LI M, LIU J, et al. Hierarchical TiO2 photonic crystal spheres prepared by spray drying for highly efficient photocatalysis[J]. Journal of Materials Chemistry A, 2013, 1(3): 541-547.
[3]MENG Q, ZHOU N, RONG Y, et al. Size effect on the fe nanocrystalline phase transformation[J]. Acta Materialia, 2002, 50(18): 4563-4570.
[4]LI K, WANG Y, WANG S, et al. A comparative study of CuO/TiO2SnO2, CuO/TiO2 and CuO/SnO2 catalysts for lowtemperature CO oxidation[J]. Journal of Natural Gas Chemistry, 2009, 18(4): 449-452.
[5]LEI Y, ZHAO G, LIU M, et al. Fabrication, characterization, and photoelectrocatalytic application of ZnO nanorods grafted on vertically aligned TiO2 nanotubes[J]. The Journal of Physical Chemistry C, 2009, 113(44): 19067-19076.
[6]陈金华, 樊桢, 周海晖, 等. 表面活性剂对纳米氧化锌合成及分散性的影响 [J]. 湖南大学学报: 自然科学版, 2004, 31(6):1-5.
CHEN Jinhua, FAN Zhen, ZHOU Haihui,et al. Impact of surfactant on the synthesis and dispersion of zinc oxide nanoparticles[J]. Journal of Hunan University:Natural Sciences, 2004, 31(6):1-5.(In Chinese)
[7]李玉平, 贺卫卫, 王亚强, 等. 用氧化锌精矿制备 ZnO 纳米晶须[J]. 湖南大学学报: 自然科学版, 2006, 32(6): 82-86.
LI Yuping, HE Weiwei, WANG Yaqiang,et al. Preparation of zno nanowhiskers from refined zinc oxide ore[J]. Journal of Hunan University:Natural Sciences, 2006, 32(6): 82-86. (In Chinese)
[8]YAYAPAO O, THONGTEM T, PHURUANGRAT A, et al. Ultrasonicassisted synthesis of Nddoped ZnO for photocatalysis[J]. Materials Letters, 2013, 90: 83-86.
[9]KARUNAKARAN C, GOMATHISANKAR P, MANIKANDAN G. Preparation and characterization of antimicrobial Cedoped ZnO nanoparticles for photocatalytic detoxification of cyanide[J]. Materials Chemistry and Physics, 2010, 123(2): 585-594.
[10]CHEN J, DENG H, WEI M. Hydrothermal synthesis and optical properties of ZnO singlecrystal hexagonal microtubes[J]. Materials Science and Engineering: B, 2009, 163(3): 157-160.
[11]MOON J, YUN C Y, CHUNG K W, et al. Photocatalytic activation of TiO2 under visible light using Acid Red 44[J]. Catalysis Today, 2003, 87(1): 77-86.
[12]KANG M, CHOUNG S J, PARK J Y. Photocatalytic performance of nanometersized FexOy/TiO2 particle synthesized by hydrothermal method[J]. Catalysis Today, 2003, 87(1): 87-97.
[13]JOSE L A, LINET J M, SIVASUBRAMANIAN V, et al. Optical studies of nanostructured Ladoped ZnO prepared by combustion method[J]. Materials Science in Semiconductor Processing, 2012, 15(3): 308-313.
[14]DENG Q R, XIA X H, GUO M L, et al. Mndoped TiO2 nanopowders with remarkable visible light photocatalytic activity[J]. Materials Letters, 2011, 65(13): 2051-2054.
[15]RAJBONGSHI B M, SAMDARSHI S K. ZnO and CoZnO nanorodscomplementary role of oxygen vacancy in photocatalytic activity of under UV and visible radiation flux[J]. Materials Science and Engineering: B, 2014, 182: 21-28.
[16]PEIRO A M, AYLLON J A, PERAL J, et al. Microwave activated chemical bath deposition (MWCBD) of zinc oxide: influence of bath composition and substrate characteristics[J]. Journal of Crystal Growth, 2005, 285(1): 6-16.
[17]ANANDAN S, VINU A, LOVELY K L P S, et al. Photocatalytic activity of Ladoped ZnO for the degradation of monocrotophos in aqueous suspension[J]. Journal of Molecular Catalysis A: Chemical, 2007, 266(1): 149-157.
[18]CHONG X, LI L, YAN X, et al. Synthesis, characterization and room temperature photoluminescence properties of Al doped ZnO nanorods[J]. Physica E: Lowdimensional Systems and Nanostructures, 2012, 44(7): 1399-1405.
[19]UMAR A, CHAUHAN M S, CHAUHAN S, et al. Largescale synthesis of ZnO balls made of fluffy thin nanosheets by simple solution process: structural, optical and photocatalytic properties[J]. Journal of Colloid and Interface Science, 2011, 363(2): 521-528.
[20]XIAO Q, ZHANG J, XIAO C, et al. Photocatalytic decolorization of methylene blue over Zn1xCoxO under visible light irradiation[J]. Materials Science and Engineering: B, 2007, 142(2): 121-125.
[21]BO ZHONG J, ZHANG L J, LU Y, et al. Fabrication of Bi 3+doped ZnO with enhanced photocatalytic performance[J]. Applied Surface Science, 2012, 258(11): 4929-4933.
[22]SOBANA N, SWAMINATHAN M. The effect of operational parameters on the photocatalytic degradation of acid red 18 by ZnO[J]. Separation and Purification Technology, 2007, 56(1): 101-107.
[23]LAM S M, SIN J C, ABDULLAH A Z, et al. Degradation of wastewaters containing organic dyes photocatalysed by zinc oxide: a review[J]. Desalination and Water Treatment, 2012, 41(1/3): 131-169.
[24]FU M, LI Y, LU P, et al. Solgel preparation and enhanced photocatalytic performance of Cudoped ZnO nanoparticles[J]. Applied Surface Science, 2011, 258(4): 1587-1591.
[25]ZHANG Z, SHAO C, LI X, et al. Hierarchical assembly of ultrathin hexagonal SnS2 nanosheets onto electrospun TiO2 nanofibers: enhanced photocatalytic activity based on photoinduced interfacial charge transfer[J]. Nanoscale, 2013, 5(2): 606-618.
[26]HOFFMANN M R, MARTIN S T, CHOI W, et al. Environmental applications of semiconductor photocatalysis[J]. Chemical Reviews, 1995, 95(1): 69-96.
[27]WANG L, CHANG L, ZHAO B, et al. Systematic investigation on morphologies, forming mechanism, photocatalytic and photoluminescent properties of ZnO nanostructures constructed in ionic liquids[J]. Inorganic Chemistry, 2008, 47(5): 1443-1452.
[28]LI P, DENG S, LI Y, et al. Firstprinciples study on neutral nitrogen impurities in zinc oxide[J]. Chinese Journal of Chemical Physics, 2012, 25(1): 48-52.
[29]SIN J C, LAM S M, LEE K T, et al. Photocatalytic performance of novel samariumdoped sphericallike ZnO hierarchical nanostructures under visible light irradiation for 2, 4dichlorophenol degradation[J]. Journal of Colloid and Interface Science, 2013, 401: 40-49.
[30]PEREZLARIOS A, LOPEZ R, HERNANDEZGORDILLO A,et al. Improved hydrogen production from water splitting using TiO2ZnO mixed oxides photocatalysts[J]. Fuel, 2012, 100: 139-143.
