氯化钠对葡萄糖水溶液近红外光谱的影响
2016-07-12于旭耀白志亮王海均徐可欣
于旭耀,白志亮,刘 蓉*,袁 晶,余 辉,王海均,徐可欣
1. 天津大学精密测试技术及仪器国家重点实验室,天津 300072 2. 天津大学生物医学检测技术与仪器天津市重点实验室,天津 300072
氯化钠对葡萄糖水溶液近红外光谱的影响
于旭耀1,白志亮1,刘 蓉1*,袁 晶2,余 辉2,王海均2,徐可欣1
1. 天津大学精密测试技术及仪器国家重点实验室,天津 300072 2. 天津大学生物医学检测技术与仪器天津市重点实验室,天津 300072
人体内钠盐的含量影响血糖代谢且与糖尿病具有较高的相关性。因此,在进行血糖的近红外光谱无创检测时,不仅要考虑血液中大颗粒及大分子物质对光谱的吸收和散射影响,也应从分子结构层面上分析小分子物质对葡萄糖分子结构及其特征吸收的影响。基于声光可调谐滤波器(AOTF)的高精度近红外光谱采集系统,测量并研究了在水溶液环境下氯化钠(NaCl)对葡萄糖分子结构及其近红外特征吸收的影响。首先,测量含有不同NaCl含量的葡萄糖水溶液透射光谱,分别采用纯水和同浓度 NaCl 样本进行背景修正,实验表明,在水溶液环境中 NaCl会改变水分子和葡萄糖分子特征吸收峰的位置和强度; 对不含NaCl和含有NaCl的糖水样本分别扣除纯水和同浓度NaCl样本后进行二维相关光谱分析,同步谱的切线谱显示NaCl减弱了葡萄糖分子在1 400和1 520~1 700 nm处的特征吸收。最后,通过偏最小二乘回归模型定量分析NaCl对葡萄糖预测精度的影响,发现模型的预测均方根误差随NaCl含量的增加而增大,并且含NaCl的样本与不含NaCl的样本对葡萄糖浓度预测值之差的平均值与加入的NaCl含量近似为线性关系。结果表明,在水溶液环境下NaCl分子会改变葡萄糖分子键状态并影响其特征吸收,从而降低模型的预测精度。若将NaCl含量作为变量因子,有助于提升血糖的近红外光谱无创检测精度。
近红外光谱; 葡萄糖; 氯化钠; 偏最小二乘; 二维相关光谱
引 言
糖尿病是一种由多重因素造成的高血糖代谢紊乱疾病,至今没有彻底根治的医学手段。世界卫生组织推荐患者进行血糖浓度的自我监测,及时调整药物或胰岛素剂量,将血糖浓度控制在合理范围内,进而减少各种并发症的发生和发展[1]。目前,患者一般通过针刺取血,再采用便携式血糖仪进行血糖监测,属于有创方式且存在感染的风险,给患者带来痛苦和诸多不便,也限制了血糖监测频率[2]。由于近红外光对生物组织有较强的穿透性,且具有快速、无损、无污染等特点,已成为血糖浓度无创伤检测的主要研究方向之一[3]。但葡萄糖在近红外区域吸收微弱,容易被水的强吸收覆盖,且人体内干扰信息复杂多变,导致其有用信息很难被精确提取。在以往的研究中,大多主要关注人体组织内包括水、脂肪、皮肤、肌肉及骨骼等大颗粒及大分子物质对血糖无创检测的影响[4-5],对血液成分中的无机盐的影响研究较少。
钠和氯是人体的宏量元素,均占体重0.15%,在循环和消化系统中起主导作用。钠离子(Na+)能保持人体血压和血容量,氯离子(Cl-)可维持体内酸碱平衡。已有研究表明,在不考虑胰岛素影响情况下,组织对葡萄糖的吸收受到钠盐饮食情况的影响[6]。吴枢武和晏渠如[7]通过临床试验证明,血钠可作为糖尿病足病早期的风险预测指标。Sakabe等[8]以Ⅱ型糖尿病患者为对象进行研究,表明每日盐摄取与作为糖尿病肾病标志的尿蛋白具有相关性。姜虹和施康平[9]的研究表明,Ⅱ型糖尿病合并低钠血症者可能存在因肾上腺皮质功能相对不足而引起低钠血症的风险。由此可见,在人体特别是糖尿病患者体内,钠盐含量与血糖浓度具有较高的相关性。而作为体内主要金属阳离子,血钠正常值(135~145 mmol·L-1)是血钾正常值(3.5~5.5 mmol·L-1)的30倍。所以,在人体检测时,应考虑NaCl对血糖吸收光谱的影响。
近红外光谱主要为一些含氢基团如C—H,N—H,O—H与S—H等,化合物基频振动的倍频和合频吸收,因此NaCl分子并不存在红外活性。但在水溶液环境下,NaCl主要以离子形式存在,可能致使溶液中原有基团发生形变甚至断裂,进而改变其他基团特征吸收峰的位置和形状。陈剑虹等分析了近红外光谱检测溶液中的钠离子机理,并选定8 333~6 898和6 898~5 586 cm-1波段,建立了NaCl浓度在同一温度和不同温度下的偏最小二乘(partial least square,PLS) 模型,结果均能满足日常检测精度要求; Huang等[10]利用短波近红外反射光谱检测熏鱼肉的水分和盐浓度,分别建立PLS和人工神经网络模型,结果表明,PLS模型具有更好的预测效果。
由于近红外区域的吸收谱带表征低能级间电子跃迁,谱峰弱而宽,且高度重叠,图谱解析和定量分析存在一定的困难。Noda在1986年提出了二维相关光谱分析技术,将光谱信号从一维扩展到二维,大大提高了光谱分辨率及重叠峰的分离度,能更直观地反映光谱强度和扰动变量的相关性。该技术目前已在药物、聚合物、蛋白质、生物学等领域取得了成功,如生物蛋白质的次级结构研究、中草药成分鉴定、聚合物材料的结构性能研究以及化学反应的机理和动力学研究等[11]。
测量了含有不同NaCl含量的葡萄糖溶液的近红外透射光谱,分析了NaCl的存在对葡萄糖水溶液吸光度的影响,并通过二维相关分析技术,考察了NaCl分子对葡萄糖分子特征吸收信息的扰动情况,最后,建立了不同NaCl含量下的葡萄糖PLS回归模型,分析了NaCl含量对溶液中葡萄糖浓度预测精度的影响。
1 实验部分
1.1 仪器与试剂
采用课题组自行研制的基于声光可调谐滤波器(acousto-optic tunable filter, AOTF, Brimrose Company, USA)的高精度双光路近红外光谱采集系统,参考路主要用于监测系统的光源漂移并对样品路进行修正[12]。样品路和参考路的样品池均为固定光程1 mm的石英玻璃,并利用蠕动泵自动进样。
配置样本所使用葡萄糖(Tianjin GuangFu Fine Chemical Research Institute)、NaCl(Tianjin JiangTian Chemical Technology Co., Ltd)均为分析纯级试剂,预先在105 ℃干燥至恒重后,利用电子分析天平(BS224S,Sartorius,Germany)称量,称重精度为±0.1 mg,最后使用去离子水进行定容配置。
1.2 数据处理
实验样品温度控制在(20±0.1)℃内,光谱范围为1 100~1 700 nm,光谱扫描10次取平均以消除随机误差的影响。为减小系统误差影响,对待测样本随机进样,采用“Sandwich”方式的测量方法进行光谱采集,即交替测量待测样本和纯水背景。
应用CAMO公司的Unscrambler 9.7近红外光谱处理软件进行光谱S-Golay平滑处理、基线校正及PLS模型建立。二维相关光谱分析采用美国MathWorks公司的Matlab 2012b进行计算及图像生成。
2 结果与讨论
2.1 NaCl对葡萄糖水溶液近红外吸收的影响
样本: (1)NaCl水溶液样本10个(浓度范围: 100~1 000 mg·dL-1,间隔: 100 mg·dL-1); (2)葡萄糖水溶液样本10个(浓度范围: 400~4 000 mg·dL-1,间隔: 400 mg·dL-1); (3)含有固定NaCl(1 000 mg·dL-1)的葡萄糖水溶液样本10个,葡萄糖浓度设置同(2)。
以空样品池为背景,计算纯水和NaCl水溶液样本的吸收光谱,结果如图1所示。从图中可以看出,两种样本的强吸收峰均出现在1 400~1 600 nm波段范围内,二者吸光度的差异主要出现在1 450~1 700 nm波段范围内。

图1 纯水和NaCl溶液的吸收光谱
以纯水为背景,计算NaCl水溶液与纯水之间的吸光度差,结果如图2(a)所示。由于NaCl在水溶液环境中以离子形式存在,Cl-半径较大,阻碍水分子形成网状结构,而Na+半径小且具有较强的正电效应,又会促进水分子形成网状结构。因此,这两种离子的相互作用使得水环境下分子状态变化较为复杂,引起光谱的差异变化较大。从图中可以看出,NaCl溶液在1 400和1 500~1 700 nm处具有明显的负吸收峰,且吸收强度随NaCl浓度的增加而增强。原因主要来自两方面: 一方面,与纯水相比,NaCl溶液中由于NaCl的溶解置换了部分水分子,降低了水分子浓度,从而导致水的O—H键吸收强度减小; 另一方面,在水溶液环境下,离子进行水合作用产生水-离子键,该键能远大于水分子之间的氢键键能,从而影响了水分子间氢键的对称伸缩振动(ν1)和弯曲振动(ν2),致使其吸收峰位置和强度发生了改变。
图2(b)和2(c)分别为不含NaCl和固定含量NaCl的葡萄糖水溶液与纯水之间的吸光度差。从图中可以看出,二者均在1 400 nm附近出现了较强的负吸收峰,而在1 600 nm附近出现正吸收峰。前者主要是由于部分水分子被溶质置换导致水的吸收强度降低,后者则是葡萄糖的一级倍频吸收。从强度上来看,在1 400 nm处,含有NaCl的葡萄糖水溶液与纯水之间的吸收差异更大,由于二者糖浓度一致,因此,主要原因在于NaCl的加入置换了更多的水分子; 而在1 600 nm附近葡萄糖的吸收区域,含有NaCl的样本强度则要低于不含NaCl的样本,可能的原因是,NaCl对水分子影响所形成的负吸收峰(1 500~1 700 nm附近,如图2(a)所示)抵消了部分葡萄糖的特征吸收,从而使得该区域的吸收下降。
在葡萄糖的水溶液中,由于葡萄糖分子与水分子之间的置换效应,吸光度与葡萄糖浓度无关的基准波长出现在波长1 525 nm处[如图2(b)所示]。而在图2(c)中,由于NaCl的影响,与葡萄糖浓度无关的基准波长向短波长方向偏移至1 510 nm。所以,在葡萄糖水溶液中加入NaCl能够影响糖分子与水分子的结合。

图2 不同水溶液的吸收光谱
(a): 扣除纯水背景的NaCl水溶液; (b): 扣除纯水背景的葡萄糖水溶液; (c): 扣除纯水背景的葡萄糖和NaCl混合水溶液; (d): 扣除NaCl含量相同水溶液背景的葡萄糖和NaCl混合水溶液
Fig. 2 Absorbance difference between different aqueous solutions
(a): NaCl aqueous solutions based on pure water; (b): Glucose aqueous solutions based on pure water; (c): Glucose aqueous solutions with NaCl based on pure water; (d): Glucose aqueous solutions with NaCl based on NaCl sample with same concentration
2.2 NaCl对葡萄糖水溶液影响的二维相关分析
以葡萄糖浓度为外扰,在1 100~1 700 nm波段,计算图2(b)和(d)光谱数据的二维相关光谱。图3(a)和(b)分别为不含NaCl的葡萄糖水溶液扣除纯水和含NaCl的葡萄糖水溶液样本扣除NaCl后的二维相关同步谱(32层等高线),对应的对角线切线谱如图3(c)所示。
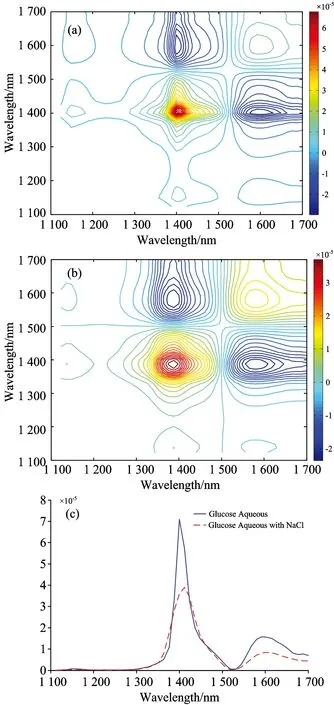
图3 不同溶液的二维相关同步谱
(a): 葡萄糖水溶液; (b): 葡萄糖和NaCl混合水溶液; (c): 两个同步谱的对角线切线谱
Fig.3 2D correlation synchronous spectra
(a): Glucose aqueous solutions; (b): Glucose aqueous solutions with fixed content NaCl; (c): Slice spectrum based on diagonal line of the synchronous spectrum
以相同浓度的NaCl溶液为背景,计算含有NaCl 的葡萄糖水溶液与NaCl水溶液之间的吸光度差,结果如图2(d)所示。从图中可以看出,通过扣除同浓度的NaCl水溶液后,NaCl对吸收峰的影响基本消除,吸收谱图的外形、强度以及基准波长的位置基本与以葡萄糖水溶液吸收谱接近[图2(b)]。但通过这种简单对比,很难判断NaCl对葡萄糖的干扰情况是否已完全去除,需要进行进一步的分析。
从图3中不难看出,两组溶液的同步谱3(a)和3(b)中,在1 400和1 600 nm附近区域均形成了自相关峰,且水分子吸收强度远大于葡萄糖的吸收强度[图3(c)中也可以观察到]; 在(1 400,1 600 nm)和(1 150,1 400 nm)处分别出现了负交叉峰和正交叉峰,表明在葡萄糖扰动下,水的吸收峰与葡萄糖的吸收峰强度变化方向相反,而1 150和1 400 nm变化方向相同(均属于水的吸收峰,1 150 nm吸收太微弱,并未出现其自相关峰)。
从图3(c)中的对比还可以发现,含有NaCl的葡萄糖溶液扣除同含量的NaCl背景后,其自相关峰强度均低于不含NaCl的样本,尤其是在水的吸收峰附近,这表明NaCl的加入,可能不仅减小了水分子和葡萄糖分子在溶液内占比,而且压缩了溶液中O—H和C—H含氢键的键长,改变了其振动频率,使得吸收峰也随之减弱。
2.3 NaCl对溶液内葡萄糖含量浓度预测的影响
样本: (1)葡萄糖水溶液样本20个(浓度范围: 50~1 000 mg·dL-1,间隔: 50 mg·dL-1),以纯水为背景,交替测量糖浓度样本与纯水样本的透射光谱; (2) 含有固定NaCl(500~1 000 mg·dL-1,间隔100 mg·dL-1)的葡萄糖水溶液样本6组,每组22个,葡萄糖浓度设置同(1),分别以纯水和含有同浓度NaCl水溶液为背景,交替测量糖浓度样本、水以及NaCl样本的透射光谱。
以纯水为参考,计算样本4和样本5的吸收光谱。首先,进行S-Golay平滑处理,去除高频噪声,提高信噪比; 然后,利用基线校正有效消除光源光谱轮廓、检测器光谱响应、干涉等的影响; 最后,采用Leave-one-out内部交互验证建立葡萄糖浓度的PLS预测模型,以校正误差均方根(root mean square error of calibration,RMSEC)、相关系数(R)和交互验证均方根误差 (root-mean-square error of cross validation,RMSECV)等参数对模型效果进行评价,结果见表1。
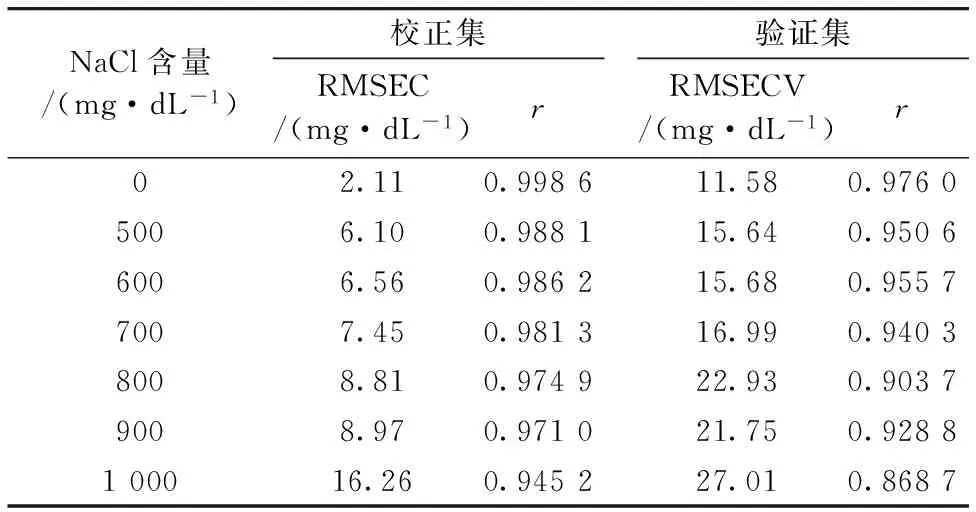
表1 扣除纯水背景后吸收光谱PLS模型预测结果
从表1的建模结果可以看出,校正集和验证集模型的相关系数r>0.9,且预测误差均低于30 mg·dL-1,表明建立的模型具有较高的预测能力。随着葡萄糖水溶液中NaCl含量增大,模型的预测误差有所增加,特别是最后一组溶液的预测均方根误差明显增大。可能是由于NaCl含量较高时,由其引起的水分子吸收变化为吸收光谱的主要因素,掩盖了葡萄糖的特征信息。
对含有固定NaCl含量的葡萄糖水溶液样本5,扣除相应含量NaCl的水溶液光谱后,对数据采取同上的预处理后建立葡萄糖的PLS模型,结果见表2。与表1结果对比可以看出,即使扣除NaCl干扰后,建模效果有所提升,但仍低于不含NaCl的葡萄糖水溶液的预测结果。
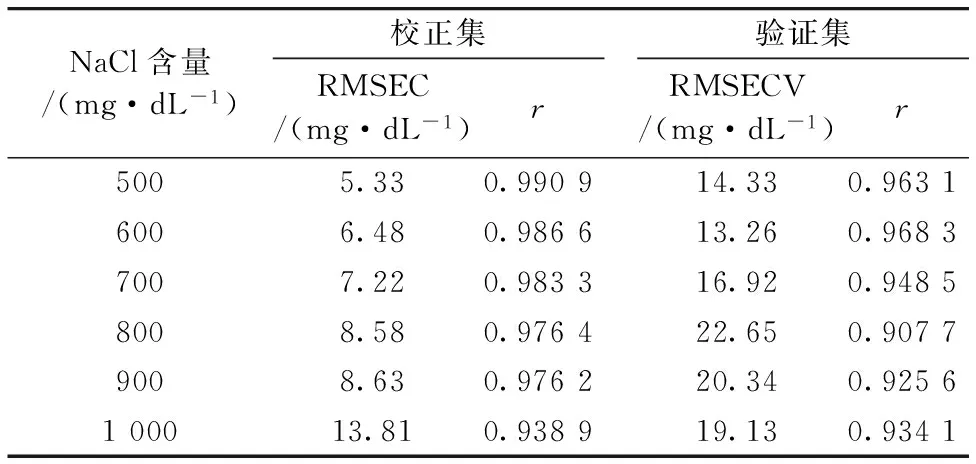
表2 扣除相同NaCl含量的水溶液背景后吸收光谱的PLS模型预测结果
为了进一步确定NaCl含量对葡萄糖浓度检测结果的影响程度,提取多组样本扣除相应含量NaCl的水溶液光谱处理后的建模结果,按照式(1)计算含NaCl的葡萄糖水溶液与不含NaCl的葡萄糖水溶液模型预测浓度差的平均值,结果如图4所示。
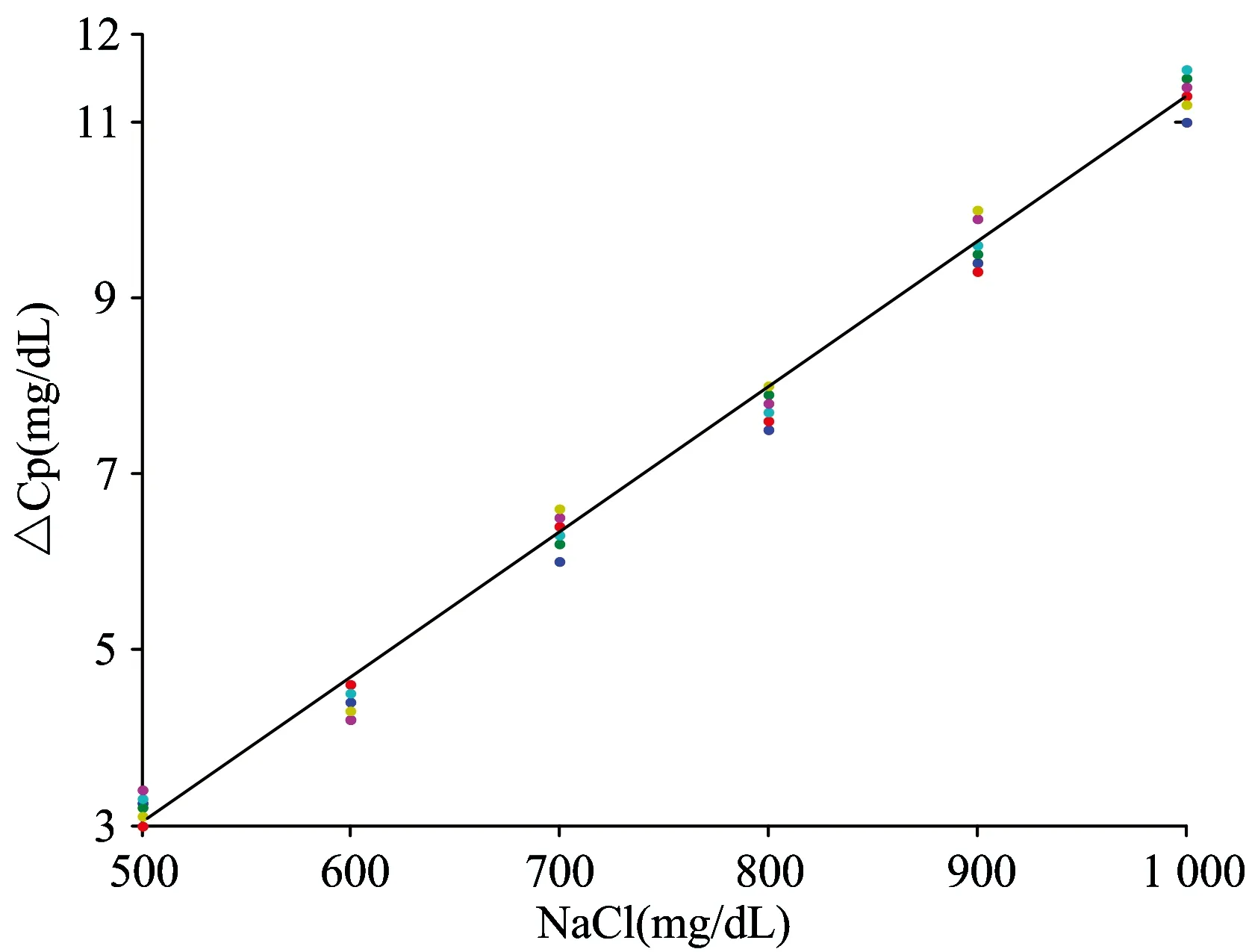
图4 NaCl含量不同的葡萄糖水溶液的Δcp
从图4中可以看出,葡萄糖浓度预测差的平均值Δcp与NaCl的含量近似为线性关系,该结果进一步证明NaCl的加入会降低葡萄糖浓度预测的精度,即使扣除了同浓度的NaCl水溶液,其影响也无法消除,因此可以认为在水溶液环境下NaCl 改变了葡萄糖分子键振动模式,从而使得其在近红外光谱范围内的特征吸收发生了变化。
3 结 论
通过以不同溶液为背景,对混合溶液的近红外吸收光谱进行校正,结果表明虽然NaCl在近红外波段没有吸收,但在溶液环境下,钠离子的水合作用影响分子内及分子间共价键的形成和状态,从而间接影响溶液中葡萄糖和水分子的特征吸收。利用二维相关谱分析可以明显看出NaCl减弱了水分子(1 400 nm)和葡萄糖一级倍频(1 500~1 600 nm)处的特征吸收。
分别以纯水和相应含量NaCl水溶液为背景,对含NaCl葡萄糖水溶液吸收光谱数据进行处理,并建立葡萄糖浓度PLS预测模型。结果表明,经过NaCl溶液背景修正后,模型效果有所改善,但仍小于不含NaCl的葡萄糖溶液,且二者对葡萄糖浓度的预测差值与溶液中加入的NaCl的含量近似为线性关系。
综上所述,可以认为在水环境中,NaCl 改变了葡萄糖分子的分子键振动模式,从而影响其对近红外光谱的特征吸收。因此在血糖的近红外光谱无创检测研究时,也应充分考虑人体血液中如钠盐等小分子物质对光谱的影响,将其作为修正因子引入血糖浓度预测模型,有助于改进和提升血糖无创检测精度。
[1] The Diabetes Control and Complications Trial Research Group. New England J. Med.,1993,329(14): 977.
[2] Sindhu Sivanandan,Aditi Sinha,Vandana Jain,et al. Indian J Pediatr,2011,78(2): 576.
[3] LIU Yi-fei,ZHAO Wen-li,MAO Xiao-bo,et al(刘一飞,赵文丽,毛晓波,等). Electronic Design Engineering(电子设计工程),2013,21(14): 35.
[4] John V Frangioni. Curr. Opin. Chem. Biol.,2003,7(5): 626.
[5] Jiang Jingying,Lu Junsheng,Zhang Hao,et al. Proc. of SPIE,Dynamics and Fluctuations in Biomedical Photonics Ⅺ, 2014,8942: 89420Y.
[6] Gomes M A,de Oliveira D R,de Freitas S E,et al. Exp. Parasitol,2012,131(4): 448.
[7] WU Shu-wu,YAN Qu-ru(吴枢武,晏渠如). Med. Information(医学信息),2010,5(4): 834.
[8] Sakabe Kazumi Fukui,Michiaki Ushigome,Emi Hamaguchi,et al. Hypertens Res,2012,35(12): 1176.
[9] JIANG Hong,SHI Kang-ping(姜 虹,施康平). Mordern J Inter Traditional Chinese and Western Med.(现代中西医结合杂志),2013,22(29): 3253.
[10] CHEN Jian-hong,ZHU Ling-jian,HUA Deng-xin(陈剑虹,朱凌建,华灯鑫). Spectroscopy and Spectral Analysis(光谱学与光谱分析),2012,32(4): 949.
[11] Huang Yiqun,Rogers Todd M,Wenz Melissa A,et al. J. Agric. Food Chem.,2001,49: 4161.
[12] SUN Yan-hui,CAI Hua-zhen,JIA Xiao-li,et al(孙艳辉,蔡华珍,贾小丽,等). Chinese J. Anal. Chem.(分析化学),2013,41(9): 1373.
[13] Min X,Liu R,Hu Y,et al. Anal Methods-UK,2014,6(24): 9831.
*Corresponding author
(Received Feb. 14, 2015; accepted Jun. 11, 2015)
Study on the Effect of Sodium Chloride Salt on Near-Infrared Spectroscopy of Glucose Aqueous Solution
YU Xu-yao1, BAI Zhi-liang1, LIU Rong1*, YUAN Jing2, YU Hui2, WANG Hai-jun2, XU Ke-xin1
1. State Key Laboratory of Precision Measuring Technology and Instruments, Tianjin University, Tianjin 300072, China 2. Key Laboratory of Biomedical Testing Technology and Instruments in Tianjin, Tianjin University, Tianjin 300072, China
The sodium chloride (NaCl) salt has been reported to be associated with glucose metabolism. However, the effect of it on non-invasive detection of blood glucose using near-infrared spectroscopy is still an open question. The aim of this study was to investigate this affection through transform background correction analysis two-dimensional (2D) correlation synchronous spectrum and the partial least-squares (PLS) regression. First, the transmittances of glucose aqueous solutions with different NaCl content are collected and the pure water and NaCl aqueous solution are measured as the background. Results show that, the dissolving of NaCl in water changes the amplitude and position of the absorption peak of water. There are two negative peaks in 1 400 and 1 500~1 700 nm corrected spectra of NaCl aqueous obviously and the amplitude of peaks associated with NaCl concentration. That’s because NaCl affect the molecular binding and vibration of water. Then the glucose aqueous solutions without NaCl and with NaCl are corrected by the spectra of pure water and NaCl aqueous solution, respectively. So we get the conclusion that NaCl also affect the combination of glucose and water molecules. And the two-dimensional correlation spectroscopy analysis is performed under the perturbation of glucose concentration. The slice spectra of synchronous correlation spectra show that, the adding of NaCl weakens the spectral variation due to glucose concentration change in the wavelength of 1 400 and 1 520~1 700 nm. Finally, the partial least square (PLS) regression models were built to quantitatively conduct the influence of NaCl on glucose prediction accuracy. Comparison results showed that, NaCl molecule in aqueous solution will deteriorate the model accuracy, where root mean square error of prediction increases with the NaCl content; the mean difference of predicted glucose concentration between models based on glucose aqueous solutions with NaCl and without NaCl, is linear with NaCl concentration in samples.
Near infrared spectroscopy; Glucose aqueous; Sodium chloride; Partial least square method; Two-dimensional correlation spectroscopy
2015-02-14,
2015-06-11
国家自然科学基金项目(81471698, 81401454, 60938002)和国家(863)计划项目(2012AA022602)资助
于旭耀,1988年生,天津大学精密测试技术及仪器国家重点实验室博士研究生 e-mail: yuxuyao@tju.edu.cn *通讯联系人 e-mail: rongliu@tju.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)06-1706-06
猜你喜欢
杂志排行
光谱学与光谱分析的其它文章
- 基于光声光谱联合主成分回归法的血糖浓度无损检测研究
- Structural, Morphological and Optical Properties of Well-Ordered CdO Nanostructures Synthesized by Easy-Economical Chemical Bath Deposition Technique
- Sensitivity Enhancement in Uranium Determination by UV-Visible Spectroscopy Using Ion Imprinted Polymer
- 采用小波分析方法降低可调谐半导体激光吸收光谱技术测量下限的实验研究
- 钠钾替代条件下不同基因型棉花叶片的FTIR光谱研究
- 近红外高光谱成像技术用于转基因大豆快速无损鉴别研究
