胃蛋白酶的分离现状及其活性研究进展
2016-06-29梁兴国
刘 宇, 董 平, 梁兴国
(中国海洋大学 食品科学与工程学院, 青岛 266003)
胃蛋白酶的分离现状及其活性研究进展
刘 宇, 董 平, 梁兴国
(中国海洋大学 食品科学与工程学院, 青岛 266003)
摘 要阐述了胃蛋白酶的结构及性质,总结了哺乳动物和鱼类胃蛋白酶的分离进展,并比较分析了不同物种间胃蛋白酶的性质和特点;同时对胃蛋白酶新发现的降解糖类和核酸类物质的新活性进行了总结分析。胃蛋白酶作为生物体内重要的消化酶,其具有蛋白酶、糖酶和核酸酶活性,是一种“多功能酶”,将为胃蛋白酶进一步研究以及应用提供一定参考。
关键词胃蛋白酶;酶系组成;新活性;多功能酶
胃蛋白酶是一种典型的天冬氨酸肽链内切酶,活性位点由2个天冬氨酸组成,在体内以酶原形式分泌,在pH值小于5.0时酶原自动激活形成有活性的酶,在酸性条件下可降解多种蛋白质。胃蛋白酶的专一性较强,能水解位于多肽链中由芳香族氨基酸(如苯丙氨酸、酪氨酸)的氨基(-NH2)与酸性氨基酸(如谷氨酸、天冬氨酸)的羧基(-COOH)形成的酰胺键(-CO-NH-)[1],如酪蛋白、球蛋白、组蛋白及角蛋白质等。
由于胃蛋白酶是哺乳动物胃肠道中重要的多肽水解酶,因此无论是在动物饲料营养方面,还是在医药方面皆有重要应用,而胃蛋白酶众多特性及丰富的酶系为其充分利用提供了重要的理论依据。胃蛋白酶的研究相对较为成熟,关于其研究的热点多放在不同物种中胃蛋白酶的分离纯化,以及作为工具酶来利用。本文总结了近年来胃蛋白酶的分离纯化情况,并对其出现的新活性进行了分析,以期为胃蛋白酶的研究注入新的活力,重新引起科研工作者的注意,为胃蛋白酶进一步研究以及应用提供参考。
1胃蛋白酶的结构与性质
胃蛋白酶的一级结构中酸性氨基酸含量高于碱性氨基酸。胃蛋白酶的二级结构由β折叠组成,含有2个构象相似的结构域,其氨基酸组成和高级结构与其他天冬氨酸蛋白酶家族成员具有很高的同源性,不同物种胃蛋白酶氨基酸序列和结构之间同样高度保守[2]。胃蛋白酶在酸性环境下(pH 1.0~5.0)具有较高的活性,一般随着pH值的升高而活性降低。不同来源的胃蛋白酶最适pH值及pH值稳定性略有差异。胃蛋白酶一般在50℃以下较为稳定,但随着酶的来源不同而略有差异。
蛋白酶一般具有较广泛的作用位点,然而胃蛋白酶是专一性较强的蛋白酶,具有一定的氨基酸序列选择特异性,优先断裂由芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)或亮氨酸形成的肽键。当pH值降至1.3时,这种序列选择特异性表现得更明显,胃蛋白酶仅倾向于剪切N端为亮氨酸或苯丙氨酸的肽键[3]。在体外胃蛋白酶持续作用可降解约30%蛋白分子的成肽键,形成脙、胨和一些氨基酸,但是角蛋白、黏蛋白和低相对分子量的蛋白衍生物不能被胃蛋白酶所分解[4]。胃蛋白酶作为一种关键的酸性蛋白酶,已经被广泛应用于食品、医药等领域之中。在食品工业中,胃蛋白酶被广泛应用于啤酒、果汁的澄清、酸奶发酵[5]等,此外,胃蛋白酶还可以用于饲料添加剂[6]等方面;在医药领域,从动物身上提取的胃蛋白酶可以与其他酶类配合或单独使用制成片剂,应用在胃病病人的治疗当中,已经是治疗胃病较为成熟的药品。
2胃蛋白酶的分离纯化研究进展
2.1胃蛋白酶的提取方法
目前,胃蛋白酶的提取方法主要有2种:酸法提取和碱法提取。其中酸法提取较为简便,可以直接得到成熟的胃蛋白酶,一般使用的是盐酸、柠檬酸等酸性缓冲液[7]。通过pH 2.5的盐酸,直接从组织中提取被激活了的胃蛋白酶。有研究提出利用超声辅助酸法提取猪胃蛋白酶,收到了良好的效果,较传统的碱法浸提时间缩短了15倍,比活力提高36.4%;较传统酸法浸提时间缩短1.5 h,比活力提高70%[8]。但是由于酸法提取的为已激活后的胃蛋白酶,其稳定性较低,提取纯化的过程中的一些因素(如温度、pH值、粗酶液中的其他物质、微生物)都可能会导致酶活的降低,因此对纯化过程的条件控制要求较高,如文献报道的金线鱼胃蛋白酶[7]和猪胃蛋白酶[9]皆采用酸法提取。
相对于酸法提取得到的是成熟的胃蛋白酶,碱法提取得到的是尚未被激活的胃蛋白酶原,提取过程中一般使用的是碱性磷酸盐缓冲液,该法提取得到的胃蛋白酶原较为稳定,对后续纯化过程中的环境控制要求较低,但提取的时间长,杂蛋白多,得到的酶量低。根据文献报道,大部分已知的胃蛋白酶采用的是碱法提取,如黄鳍鲷和鳜鱼[10]等。采用碱法提取虽然时间长,但提取得到的为胃蛋白酶原,有利于分析研究酶原的激活性质,并且有利于长期保存。
2.2胃蛋白酶的分离方法
胃蛋白酶的分离方法主要有3种:有机溶剂沉淀法、盐析法和底物亲和法。有机溶剂沉淀法分辨力比盐析法好,溶剂易除去;缺点是易使酶变性,故操作时要求条件比盐析严格。盐析法根据不同蛋白质在一定浓度的盐溶液中溶解度降低程度的不同而达到彼此分离的目的,其相对于有机溶剂法得到的胃酶活力得率高(70%)。胃蛋白酶在不同饱和度的硫酸铵条件下溶解度差异较大,由于胃蛋白酶一般在20%饱和硫酸铵时溶解度较高,60%饱和硫酸铵时溶解度较低,因此采用20%饱和硫酸铵去除杂质,60%饱和硫酸铵沉淀浓缩胃蛋白酶,可以达到良好的分离纯化目的[11]。盐析法用盐量较大,采用有机溶剂(如甲醇、乙醇等)结合盐析法可减少盐的用量[12],但后续需要增加去除有机溶剂的程序,未除净的有机溶剂会严重影响胃蛋白酶的活力,并且对后续的柱层析纯化极为不利。底物亲和法是利用胃蛋白酶与酪蛋白的亲和特性和不同物质之间的等电点差异,通过改变溶液的pH值促使底物和酶的复合物沉淀及底物和酶的分离,与有机溶剂法、盐析法比较,底物亲和分离法具有简单高效的优点,同时具有较高的特异性[13]。
此外,近年来一些新型分离纯化方法逐渐被应用于胃蛋白酶的分离纯化。如双水相萃取结合聚电解质沉淀法[14],利用该方法从牛胃组织匀浆中提取纯化得到胃蛋白酶,纯化倍数可达到9倍;聚乙二醇/硫酸铵萃取[15]以及膜分离技术[16]等。膜分离技术是典型的物理分离过程,不用化学试剂和添加剂,胃蛋白酶不会受到二次污染,且处理量可大可小,较为灵活,是近年来应用较为广泛的分离技术。胃蛋白酶在物种间高度保守,分子质量一般在30~40 ku之间,因此可应用膜分离技术对其进行选择性分离,可达到初步纯化的目的。
2.3胃蛋白酶的纯化方法
上述分离方法仅是对胃蛋白酶的一个粗分离的过程,得到的胃蛋白酶仍含有其它杂蛋白和盐离子,为了满足实验需要,通常采用离子交换和凝胶过滤层析方法进行进一步纯化。在实际应用中,为得到纯度较高的胃蛋白酶,通常采用离子交换层析和凝胶过滤层析相结合的方法进行纯化。Sitthipong Nalinanon等在鲣鱼胃蛋白酶的纯化时先后采用DEAE-纤维素、Sephadex G-50和Sephadex G-75柱层析法,得到了2种鲣鱼胃蛋白酶[17]。
目前蛋白质的分离纯化方法在胃蛋白酶的分离纯化研究方法应用较为成熟,其流程为:浸提-盐析沉淀(可辅以膜分离方法)-离子交换层析与凝胶过滤层析配合使用纯化胃蛋白酶或酶原。其中粗酶液一般采用盐析沉淀法进行粗分离,并辅以超滤膜分离去除大部分杂质以及除盐,且可达到浓缩的目的。此外,透析法也可有效除盐,且使样品均一的分散到其它缓冲液中,但该方法耗时长、样品处理量小且样品易损失;超滤法可借助加压的方式有效缩短处理时间,达到除盐和浓缩的目的,但使样品更换缓冲液较为困难,除盐和换液效率略低于透析法,因此在实际应用中一般采用透析法除盐、超滤法浓缩两者有效结合的方法[8]。对胃蛋白酶浓缩除盐后,一般采用DEAE阴离子交换柱与凝胶柱相结合的方法进行进一步的纯化,可使胃蛋白酶的纯度在95%以上。
目前一般的蛋白纯化策略已很好地应用到胃蛋白酶的分离纯化中,方法也较为成熟。胃蛋白酶具有在强酸性环境下活性高的特点,同时胃蛋白酶是一种广泛的蛋白酶,利用胃蛋白酶的这2种性质,可有效去除杂蛋白,简化其纯化过程,然而胃蛋白酶在酸性条件下稳定性较差,酶得率较低[17],因此胃蛋白酶在酸性条件下的稳定性还有待提高。
2.4哺乳动物及鱼类胃蛋白酶酶系的组成及性质
哺乳动物常见的胃蛋白酶主要有3种,分别为胃蛋白酶A、B和C(表1)。其中胃蛋白酶A由胃底腺体的主细胞分泌,猪胃蛋白酶D是未磷酸化的胃蛋白酶A[18];胃蛋白酶B主要存在于猪和狗[19]胃肠道内,又称副胃蛋白酶或明胶酶,对明胶的水解活性较高;胃蛋白酶C又称胃亚蛋白酶,是胃粘膜细胞分化成熟的终末产物[20, 21],大鼠的胃蛋白酶主要为胃蛋白酶C,在人和猪胃中也存在胃蛋白酶C。3种胃蛋白酶中,胃蛋白酶A和C的基因调控机制不同,但蛋白编码区所在基因结构非常相似;胃蛋白酶B和C除了底物特异性比A较强外,其他性质非常相似[22]。此外在胎儿和幼龄动物中还发现胃蛋白酶原F和凝乳蛋白酶原,在成熟以后逐渐被胃蛋白酶A代替[23]。

表1 哺乳动物主要的胃蛋白酶

表2 鱼类胃蛋白酶的性质
注:以七星鲈鱼为例,七星鲈鱼(3)代表七星鲈鱼中分离得到3种胃蛋白酶;最适pH值、最适温度、Km和kcat从左到右分别对应七星鲈鱼胃蛋白酶I、II和III
近年来,随着海洋资源的开发利用,从鱼类中提取胃蛋白酶的研究也在逐渐展开,国内外科学家已经从多种鱼类中得到胃蛋白酶(表2),并对其性质和功能进行分析研究。鱼类胃蛋白酶的分子质量在30~39 ku之间不等,大部分集中在30~32 ku;最适pH值略高于哺乳动物,在3.0左右。海洋资源丰富多样,对海洋鱼类胃蛋白酶的开发利用将是胃蛋白酶功能开发利用的良好方向。
3胃蛋白酶新活性的发现与发展
科研工作者对胃蛋白酶的研究关注已有80年之久,关于其作用机理、理化性质等研究也较为透彻,因此科学家们对胃蛋白酶的关注多在于对不同物种胃蛋白酶的提取纯化以及其在临床诊断方面的应用[36]。然而最近有研究指出猪胃蛋白酶具有降解糖类物质[37, 38]和核酸[39]的新活性,这在一定程度上来说是对胃蛋白酶颠覆性的认识,这些发现说明在进化过程中,胃蛋白酶可能不仅仅是作为“蛋白酶”发挥功能,而是作为“多功能酶”对生物体的生长发育发挥着重要作用。
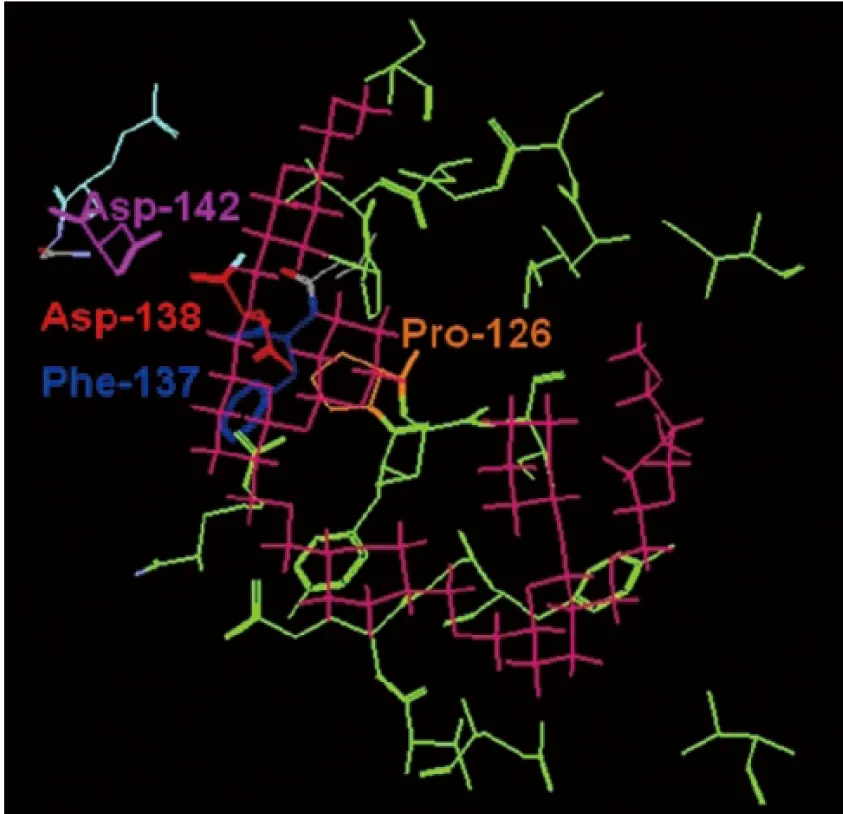
图2 胃蛋白酶降解糖类活性中心预测[37]
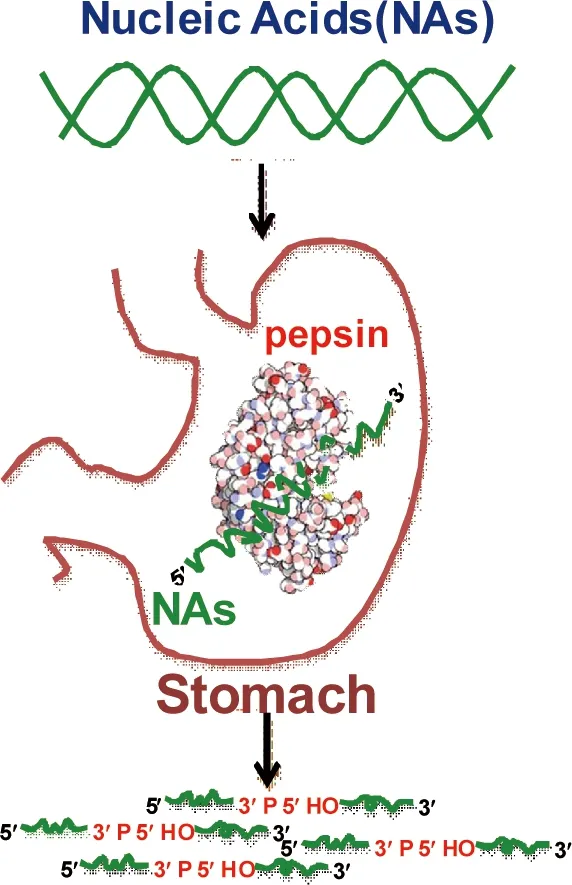
图3 胃蛋白酶对核酸的降解[36]
Shobha等[37]研究发现猪胃蛋白酶具有降解脱支瓜尔豆半乳甘露聚糖的功能,表明胃蛋白酶具有对糖苷类底物的非特异性催化功能。该研究表明,胃蛋白酶降解脱支瓜尔豆半乳甘露聚糖的最适pH 5.5,最适温度45℃,反应动力学产生Km为5.0 mg/mL,猪胃蛋白酶作用于脱支瓜尔豆半乳甘露聚糖的活性中心与其降解蛋白的活性中心有所不同,其中Asp138可能对其催化水解糖类有重要作用。该研究展示了一种由猪胃蛋白酶用不同的活性位点残基进行催化的一种新型的模式。
Liang等[39]所在研究团队近期发现猪胃蛋白酶具有降解核酸的活性。胃蛋白酶即可催化单链DNA的降解,也可催化双链DNA的降解,同时也具有RNA降解活性;对单链底物具有一定的序列选择性;降解产物为5′羟基,3′磷酸;其最适pH值为3.8,最适温度为60℃,反应动力学常数Km为55.6 μM,专一性常数kcat/Km为1.05×10-2s-1。该研究结果为胃蛋白酶在生物进化中的作用提供了新的思路,为完善核酸的体内消化代谢途径提供理论支持,同时也为丰富完善胃蛋白酶的功能提供帮助。
4展望
综上所述,胃蛋白酶作为一种蛋白消化酶,科学家长期关注其组成结构、降解蛋白的理化性质以及提取纯化方法,不断有新的胃蛋白酶从新的物种中分离纯化得到,丰富了胃蛋白酶家族酶系,为胃蛋白酶新活性的发现和胃蛋白酶的系统性研究提供帮助。然而随着猪胃蛋白酶具有降解糖类和核酸类物质的新功能的发现,胃蛋白酶作为一种“多功能酶”,关于其具有“多功能”的作用机理还有待深入研究,其活性和功能、在生物体内的作用以及在进化中的位置必将引起科学界的重新审视。
参考文献:
[1]KAGEYAMA H, UEDA H, TEZUKA T, et al. Differences in the P1′ substrate specificities of pepsin A and chymosin [J]. J Biochem, 2010, 147(2): 167-174.
[2]谢 光. 茶叶生物碱对胃蛋白酶部分理化性质的影响 [D]. 成都: 四川大学, 2006.
[3]KAGEYAMA T. Pepsinogens, progastricsins, and prochymosins: structure, function, evolution, and development [J]. Cell Mol Life Sci, 2002, 59(2): 288-306.
[4]RAWLINGS N D, BATEMAN A. Pepsin homologues in bacteria [J]. BMC Genomics, 2009, 10: 437.
[5]严 颖, 夏 明, 朱 娜, 等. 胃蛋白酶预处理对大豆酸奶发酵过程的影响 [J]. 现代食品科技, 2011, 27(12): 1440-1442.
[6]王潍波, 赵国琦, 韩庆广, 等. 胃蛋白酶-胰蛋白酶体外消化豆粕适宜条件的研究 [J]. 中国饲料, 2009(2): 41-43.
[7]陶 红. 金线鱼胃蛋白酶纯化鉴定及结构研究[D]. 广州: 华南理工大学, 2007.
[8]王 莹. 猪胃蛋白酶分离纯化新工艺建立及技术参数研究 [D]. 大庆: 黑龙江八一农垦大学, 2009.
[9]张丽萍, 王 莹, 崔素萍. 酸法提取猪胃蛋白酶的工艺研究 [J]. 食品科学, 2009, 30(10):46-48.
[10]周 琼. 黄鳍鲷和鳜鱼胃蛋白酶原的分离纯化与酶的性质研究 [D]. 厦门: 集美大学, 2007.
[11]CHEN W Q, CAO M J, YOSHIDA A, et al. Study on pepsinogens and pepsins from snakehead (Channaargus) [J]. J Agric Food Chem, 2009, 57(22): 10972-10978.
[12]张继平, 郭照良, 唐冬生, 等. 暗纹东方鲀胃蛋白酶的分离纯化及部分性质研究 [J]. 湖南农业大学学报(自然科学版), 2005, 30(6): 526-529.
[14]BOERIS V, SPELZINI D, FARRUGGIA B, et al. Aqueous two-phase extraction and polyelectrolyte precipitation combination: A simple and economically technologies for pepsin isolation from bovine abomasum homogenate [J]. Process Biochemistry, 2009, 44(11): 1260-1264.
[15]张 儒, 张变玲, 谢 涛, 等. 聚乙二醇/硫酸铵双水相萃取猪胃蛋白酶工艺研究 [J]. 食品工业科技, 2012, 33(15): 245-247.
[16]SVIRIDENKO U Y, ABRAMOV D V, MURUNOVA G V, et al. Application of membrane technology to liquid pepsin extract processing [J]. Petroleum Chemistry, 2014, 54(8): 710-713.
[17]NALINANON S, BENJAKUL S, KISHIMURA H. Purification and biochemical properties of pepsins from the stomach of skipjack tuna (Katsuwonuspelamis) [J]. European Food Research and Technology, 2010, 231(2): 259-269.
[18]CIOLKOWSKI M, ROZANEK M, BRYSZEWSKA M, et al. The influence of PAMAM dendrimers surface groups on their interaction with porcine pepsin [J]. Biochimica Et Biophysica Acta, 2013, 1834(10):1982-1987.
[19]NARITA Y, ODA S, MORIYAMA A, et al. Primary structure, unique enzymatic properties, and molecular evolution of pepsinogen B and pepsin B [J]. Arch Biochem Biophys, 2002, 404(2): 177-185.
[20]HALLAL C, CHAVES V S, BORGES G C, et al. Acid and weakly acidic gastroesophageal reflux and pepsin isoforms (A and C) in tracheal secretion of critically ill children [J]. Chest, 2015, 148(2):333-339.
[21]SCHUBERT M L. Gastric exocrine and endocrine secretion [J]. Curr Opin Gastroenterol, 2009, 25(6): 529-536.
[22]陈 荣, 汲广东. 天冬氨酸蛋白酶家族的分类, 功能和演化 [J]. 鲁东大学学报(自然科学版), 2011, 27(4): 328-334.
[23]KAGEYAMA T. New world monkey pepsinogens A and C, and prochymosins. Purification, characterization of enzymatic properties, cDNA cloning, and molecular evolution[J]. J Biochem, 2000, 127(5): 761-770.
[24]TANJI M, YAKABE E, KAGEYAMA T, et al. Purification and characterization of pepsinogens from the gastric mucosa of African coelacanth,Latimeriachalumnae, and properties of the major pepsins [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 146(3): 412-420.
[25]CAO M J, CHEN W Q, DU C H, et al. Pepsinogens and pepsins from Japanese seabass (Lateolabraxjaponicus) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2011, 158(4): 259-265.
[26]吴 涛. 黄鳝和欧洲鳗鲡胃蛋白酶原的分离纯化与酶的性质研究 [D]. 厦门: 集美大学, 2009.
[27]WU T, SUN L C, DU C H, et al. Identification of pepsinogens and pepsins from the stomach of European eel (Anguillaanguilla) [J]. Food chemistry, 2009, 115(1): 137-142.
[28]刘西之, 邱晓燕, 蔡秋凤, 等. 青石斑鱼胃蛋白酶原的分离纯化及酶学性质 [J]. 水产学报, 2011, 35(11): 1736-1744.
[29]BOUGATEF A, BALTI R, ZAIED S B, et al. Pepsinogen and pepsin from the stomach of smooth hound (Mustelusmustelus): Purification, characterization and amino acid terminal sequences [J]. Food Chemistry, 2008, 107(2): 777-784.
[30]NALINANON S, BENJAKUL S, KISHIMURA H. Biochemical properties of pepsinogen and pepsin from the stomach of albacore tuna (Thunnusalalunga) [J]. Food chemistry, 2010, 121(1): 49-55.
[31]ZHOU Q, FU X P, ZHANG L J, et al. Purification and characterization of sea bream (SparuslatusHouttuyn) pepsinogens and pepsins [J]. Food Chemistry, 2007, 103(3): 795-801.
[32]ZHOU Q, LIU G M, HUANG Y Y, et al. Pepsinogens and pepsins from mandarin fish (Sinipercachuatsi) [J]. J Agric Food Chem, 2008, 56(13): 5401-5406.
[33]成 芳, 闫 欣, 李 伟, 等. 大鲵胃蛋白酶分离纯化及其性质的研究 [J]. 食品工业科技, 2013, 34(1): 125-128.
[34]KLOMKLAO S, KISHIMURA H, YABE M, et al. Purification and characterization of two pepsins from the stomach of pectoral rattail (Coryphaenoidespectoralis) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147(4): 682-689.
[35]MIURA Y, KAGEYAMA T, MORIYAMA A. Pepsinogens and pepsins from largemouth bass,Micropterussalmoides: Purification and characterization with special reference to high proteolytic activities of bass enzymes [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 183: 42-48.
[36]史玲玲, 张英波, 董 林. 胃癌早期诊断中血清胃蛋白酶原检测的应用价值 [J]. 中国实用医药, 2014, 9(26):22-23.
[37]SHOBHA M S, GOWDA L R, THARANATHAN R N. A novel catalysis by porcine pepsin in debranching guar galactomannan [J]. Carbohydr Polym, 2014, 102: 615-621.
[38]MYSORE S S, RUDRAPATNAM T N. Modulation in the rheological behaviour of porcine pepsin treated guar galactomannan on admixture with κ-carrageenan [J]. Carbohydrate Polymers, 2015, 115: 253-259.
[39]LIU Y, ZHANG Y F, DONG P, et al. Digestion of nucleic acids starts in the stomach[J]. Scientific Reports, 2015,5:11936. doi: 10.1038/srep11936.
The research progress in pepsin purification and enzymatic activity
LIU Yu, DONG Ping, LIANG Xing-guo
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
AbstractThe structure and properties of pepsin were summarized in this study. The enzyme system compositions of mammal and fish were concluded and the differences in these pepsins were presented. In addition, the newly founded activities of pepsin including digestion of guar galactomannan and nucleic acids were illustrated in details. As pepsin is the main digestive enzyme, the founding that pepsin is a "multifunctional enzyme". Based on the above, some suggestions were proposed for the future study and application of pepsins.
Key wordspepsin; enzyme system composition; new activities; multifunctional enzyme
收稿日期:2015-05-11;修回日期:2015-05-26
基金项目:国家自然科学基金(31201327);国家教育部留学回国人员科研启动基金资助项目;国家青年千人计划(National Youth Qianren Plan);山东省自然科学基金杰出青年基金(JQ201204)
作者简介:刘 宇,博士研究生,研究方向为食品化学与营养支持,E-mail: shishui87@163.com; 通信作者:梁兴国,教授,研究方向为核酸化学与生物技术,E-mail: liangxg@ouc.edu.cn。
中图分类号Q556
文献标识码A
文章编号2095-1736(2016)03-0075-05
doi∶10.3969/j.issn.2095-1736.2016.03.075
