雅培ARCHITECT c16000全自动生化分析仪血清指数在生化检测中的应用
2016-06-23四川省医学科学院四川省人民医院检验科四川成都6007四川大学华西医院呼吸内科四川成都6004
黄 燚,刘 丹(.四川省医学科学院·四川省人民医院检验科,四川 成都 6007;.四川大学华西医院呼吸内科,四川 成都 6004)
雅培ARCHITECT c16000全自动生化分析仪血清指数在生化检测中的应用
黄 燚1,刘 丹2
(1.四川省医学科学院·四川省人民医院检验科,四川 成都 610072;2.四川大学华西医院呼吸内科,四川 成都 610041)
目的 探讨血清指数在辨别血清样本溶血、黄疸和脂血等常见干扰中的作用。方法 收集临床常规检测的血清样本1733例,经肉眼辨别无溶血、黄疸和脂血,通过雅培ARCHITECT c16000全自动生化分析,采用生理盐水法检测1733例样本的溶血、黄疸和脂血的干扰指数。结果 在1733例经肉眼未发现溶血、黄疸和脂血的血清样本中,126例血清指数偏高。其中溶血50例,黄疸76例,未检测出样本脂血指数偏高。126例干扰样本中,50例样本的丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、总胆红素(TBIL)、直接胆红素(DBIL)、镁(Mg2+)、二氧化碳(CO2)检测受溶血影响,黄疸和脂血均未对肉眼辨别无干扰的样本检测产生影响。结论 通过全自动生化仪检测血清指数判定溶血、黄疸和脂血经济、高效,是生化检测中有效的判定常见干扰的方法。
雅培;全自动生化分析仪;血清指数;干扰
实验室检测指标受多种因素影响,其中,溶血、黄疸和脂血样本是检测中常见的干扰因素,对检测产生严重影响,干扰结果判读。Romero等报道由溶血导致的样本拒收占分析前不合格样本的36.2%[1],Jane等报道门诊不合格样本中,18.1%是由于溶血导致[2]。尽管近年来自动化分析和临床检验技术不断提高,检测错误仍在不断发生。Plebani等研究表明68.2%的检测错误是由于分析前因素导致。影响检验分析前因素众多,不同患者的生理或病理状态对检验结果都会造成影响。另外,检验样本的采集和运输等也会对检测指标产生不同的影响[3]。现有国内临床实验室对于样本质量的判断主要还是依靠肉眼,其中最常见的即对于溶血、黄疸和脂血样本的判断。溶血、黄疸和脂血样本对检测结果会产生严重干扰[4],肉眼判断样本质量可以在很大程度上过滤有效信息并反馈给临床,给临床医生对于检验结果判读提供帮助。然而,Glick等报道肉眼判断血清溶血、黄疸和脂血结果是不可靠的[5]。在国内大型医院检验样本量逐年增加的背景下,肉眼判断样本质量也会大大增加检验工作者的工作量。因此,自动化的、快速的对于血清干扰的判断是临床自动化工作的趋势。本研究利用全自动生化分析仪自带的血清指数,对1733例血清样本进行评估,并将血清指数的自动检测和实验室信息系统(LIS)进行关联,通过双向通讯自动检测样本血清指数。
1 材料与方法
1.1 材料 选取2016年5月在四川省医学科学院·四川省人民医院申请的门诊、住院和体检常规生化样本1733例,均为早晨空腹静脉血。按照标准操作规程采集于4.0 ml BD血清真空采血管(BD,Franklin Lakes,NJ,USA)中,待样本凝集后,3000 rpm离心5分钟,离心后血清样本经生化检验组工作人员经过肉眼判定排除溶血、黄疸和脂血干扰。
1.2 方法 将肉眼判断无干扰的血清样本在雅培ARCHITECT c16000全自动生化分析仪上利用生理盐水法检测血清指数。通过LIS自动将待测血清样本的检测指令发送到生化分析仪,分别将5.3 μl血清与200 μl生理盐水混合检测,仪器通过检测7个波长的吸光度,利用自带的计算公式求出血清指数。其中溶血指数的界值为0.3 Index,黄疸指数的界值为34.2 Index,脂血指数的界值为0.57 Index,血清指数的结果也可以用1+、2+、3+和4+表示,对应关系如表1所示。
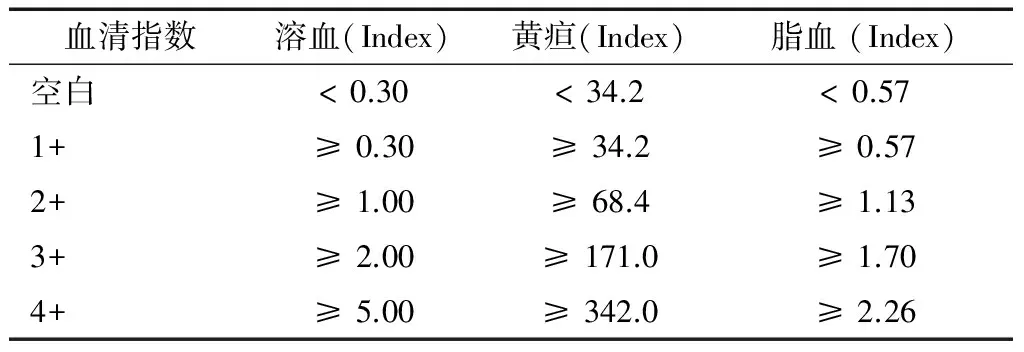
表1 血清溶血、黄疸和脂血指数检测值的换算
血清指数与干扰样本浓度的相关性:将洗涤红细胞加生理盐水稀释,反复冻融离心取上清,制作血红蛋白溶液,利用XN1000血常规流水线(Sysmex,Kobe,Japan)检测血红蛋白浓度,收集混合严重黄疸和严重脂血样本,利用ABBOTT c16000生化仪检测血清总胆红素(TBIL)水平。收集正常对照混合血清,按不同比例混合血红蛋白溶血和黄疸样本。计算血清指数和血红蛋白和TBIL浓度的相关性,脂血指数即通过生化仪直接检测样本浊度。
2 结果
2.1 血清样本的一般情况 在1733例肉眼判断无干扰的血清样本中,通过血清指数检测发现,127例样本的血清指数增高,其中溶血50例,黄疸76例,未检测出样本脂血指数偏高。溶血和黄疸样本分别占总样本量的2.89%和4.39%;在所有存在干扰的样本中,溶血样本占39.68%,黄疸占60.32%。
2.2 血清指数的相关性验证 将血红蛋白溶血检测后稀释到7.2 g/L作为原液,严重黄疸血清TBIL浓度为251.7 μmol/L,严重脂血血清甘油三酯浓度为10.29 mmol/L,将三种干扰样本按不同比例稀释,分别检测不同浓度干扰样本的溶血指数、黄疸指数和脂血指数,见表2。利用回归方程分别计算样本浓度和血清指数的相关性后显示,溶血指数和血红蛋白浓度的相关系数r=0.9991,黄疸指数和TBIL浓度的相关系数r=1.0000,脂血指数和甘油三酯浓度的相关系数r=0.9997,见图1。分析黄疸指数和黄疸样本的血清TBIL和直接胆红素(DBIL)水平可见,103例肉眼可见和肉眼未见的黄疸样本血清TBIL、DBIL和黄疸指数的相关系数r=0.9892;r=0.9827,见图2。

表2 不同浓度干扰样本中各项指标检测结果
2.3 干扰与生化检测结果的关系 本实验室采用中生雅培试剂,在常用生化检测项目中,不对检测产生明显影响的干扰物浓度,见表2。溶血样本对血清丙氨酸氨基转移酶(ALT)、天门氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、TBIL、DBIL、Mg、CO2检测产生影响,也会导致K+浓度增高;脂血样本对TBIL和DBIL检测产生影响。利用回归方程,参照表3将干扰物浓度换算为血清指数后发现:在1733例肉眼判断无干扰的样本中,利用溶血指数判定,50例样本的ALT、AST、LDH、TBIL、DBIL、Mg2+、CO2检测受血红蛋白影响;利用黄疸指数判定,23例样本的高密度脂蛋白胆固醇(HDL-C)检测受胆红素(BIL)影响;利用脂血指数计算,未发现检测受脂血浊度的影响。

图1 血红蛋白溶液及混合血清与溶血指数、黄疸指数和脂血指数的相关性验证 a:溶血指数;b:黄疸指数;c:脂血指数

图2 103例黄疸样本血清总胆红素、直接胆红素和黄疸指数的相关关系散点图 a:总胆红素;b:直接胆红素
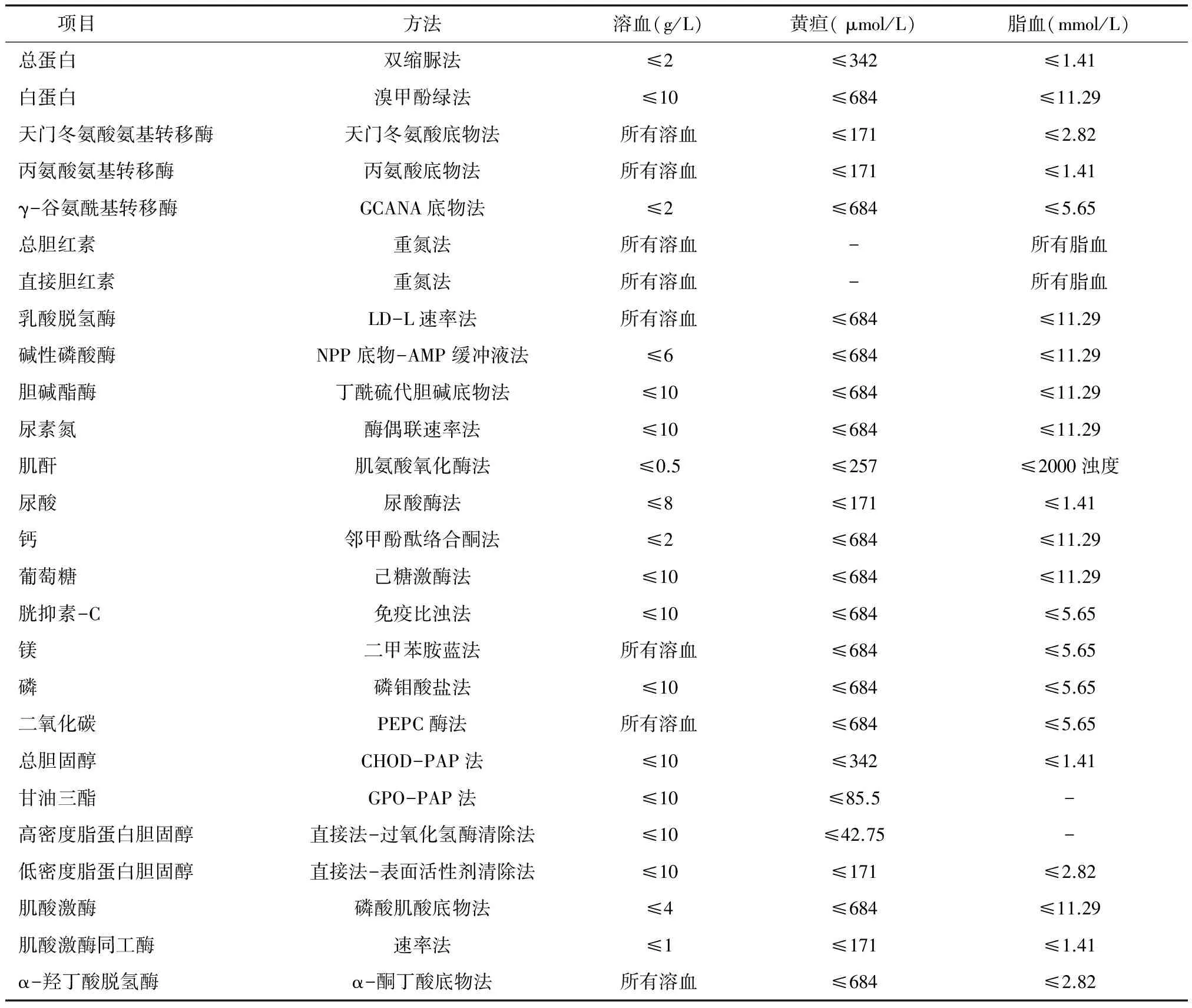
表3 常用生化检测试剂的方法学和抗干扰能力
3 讨论
溶血、黄疸和脂血是临床检验最常见的干扰。在临床检验分析前环节,样本溶血在不合格和拒收样本比例中占36.2%~70%[1,2,6]。本研究中,溶血样本占所有受干扰样本的39.68%,黄疸样本占60.32%。
溶血是红细胞膜破坏后血红蛋白由细胞内释放到细胞外造成的,通常要通过分离血清或血浆才能通过肉眼识别。当血红蛋白浓度超过0.3 g/L时,通过肉眼可以根据血清或血浆的颜色变化判断是否溶血。然而,肉眼判断带有一定的主观性和个体差异,容易将轻度溶血样本漏检。溶血对多种检测项目的准确度造成影响,如血清K+、Na+、Ca2+、Mg2+、BIL、LDH、TP、AST、ALT、γ-谷氨酰基转移酶(GGT)等[7,8]。在本实验中,按检测试剂的干扰实验数据,在1733例样本中,50例样本ALT、AST、LDH、TBIL、DBIL、Mg2+、CO2的检测受溶血影响。由于红细胞内K+含量远高于血清,50例样本的血清K+检测也受溶血影响。
血清TBIL在17.1~34.2 μmol/L,而肉眼看不出黄疸时,称隐性黄疸;当血清TBIL浓度超过34.2 μmol/L时,称为显性黄疸。通过检测103例黄疸样本的血清TBIL、DBIL和黄疸指数,进一步验证了血清BIL和黄疸指数具有良好的相关性。在本研究使用的各种常规生化试剂中,干扰实验抗黄疸的cut-off值均高于隐性黄疸水平,故在肉眼辨别无干扰的样本中,未发现其受黄疸影响。
在脂血样本中,常规检测项目只有BIL检测直接受脂血影响,本研究的纳入样本中同样未发现样本检测受脂血影响。临床上,最常见的导致脂血的原因主要是饮食、酒精摄入、糖尿病、高甘油三酯血症、慢性肾衰竭、胰腺炎等。本研究发现混合的严重脂血血清与脂血指数具有良好的相关性。脂血指数即检测血清样本的浊度而非血清甘油三酯的浓度,脂血的干扰机制有光散射、不可溶的物质增多导致浊度增加和样本内物质的极性与非极性增加三种,主要由乳糜微粒(CM)和极低密度脂蛋白(VLDL)导致。因此,在在临床检测中,通过浊度推算甘油三酯浓度是不可信的[9,10]。本研究在评估脂血指数的相关性时旨在利用样本浊度评价其与仪器脂血指数(浊度)检测的相关性。
通过全自动生化仪检测血清指数判定溶血、黄疸和脂血经济、高效,是生化检测中有效的判定常见干扰的方法。
[1] Romero A,Cobos A,López-León A,et al.Preanalytical mistakes in samples from primary care patients [J].Clin Chem Lab Med,2009,47(12):1549-1552.
[2] Dale JC,Novis DA.Outpatient phlebotomy success and reasons for specimen rejection [J].Archives of Pathology & laboratory Medicine,2002,126(4):416-419.
[3] Plebani M,Carraro P.Mistakes in a stat laboratory: types and frequency [J].Clinical Chemistry,1997,43(8 Pt 1):1348-1351.
[4] Kroll MH,Elin RJ.Interference with clinical laboratory analyses [J].Clinical chemistry,1994,40(11):1996-2005.
[5] Glick MR,Ryder KW,Glick SJ,et al.Unreliable visual estimation of the incidence and amount of turbidity,hemolysis,and icterus in serum from hospitalized patients [J].Clinical chemistry,1989,35(5):837-839.
[6] Jones BA,Calam RR,Howanitz PJ.Chemistry specimen acceptability: a College of American Pathologists Q-Probes study of 453 laboratories [J].Archives of pathology & laboratory Medicine,1997,121(1):19-26.
[7] Guder WG.Haemolysis as an influence and interference factor in clinical chemistry[J].Journal of Clinical Chemistry and Clinical Biochemistry,1986,24(2):125-126.
[8] Ji JZ,Meng QH.Evaluation of the interference of hemoglobin,bilirubin,and lipids on Roche Cobas 6000 assays [J].Clinica Chimica Acta; International Journal of Clinical chemistry,2011,412(17-18):1550-1553.
[9] Lim KH,Lian WB,Yeo CL.Does visual turbidity correlate with serum triglyceride levels in babies on total parenteral nutrition [J].Annals of the Academy of Medicine,2006,35(11):790-793.
[10]Twomey PJ,Don-Wauchope AC,McCullough D.Unreliability of triglyceride measurement to predict turbidity induced interference [J].Journal of clinical pathology,2003,56(11):861-862.
Application of serum indices of ABBOTT c16000 automated analyzer in biochemistry detection
HUANGYi1,LIUDan2
(1.ClinicalLaboratory,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China;2.DepartmentofRespiratoryandCriticalCareMedicine,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Objective To evaluate the role of serum indices in distinguishing the disturbance by hemolysis, lipemia and icterus of serum samples. Methods We collected 1,733 serum samples without hemolysis, lipemia and icterus identified by naked eye, and then analyzed serum indices of hemolysis, lipemia and icterus on ABBOTT ARCHITECT c16000 autoanalyzer using the Saline protocol. Results One hundred and twenty seven samples with interferences that could not be detected previously by naked eye were detected. These samples included 50 samples with hemolysis and 76 with icterus. Among the 126 samples interfered, 50 samples were influenced by hemolysis when determined serum ALT, AST, LDH, TBIL, DBIL, Mg2+, CO2, while none of the samples was influenced by icterus or lipemia when determined routine chemistry parameters. Conclusion Automated analyzers should be used for exclusion of pre-analytical errors induced by hemolysis, lipemia and icterus instead of visual detection.
ABBOTT; Automated analyzer; Serum index; Interference
四川省医学科院·四川省人民医院博士基金资助项目(编号:30305030563)
R446.11
A
1672-6170(2016)05-0077-04
2016-05-09;
2016-06-24)
