大黄传统饮片与煮散颗粒在不同时间点蒽醌类成分和干膏收率的比较
2016-06-23任虹傅超美何瑶罗妮妮季宁平杨欢
任虹,傅超美,何瑶,罗妮妮,季宁平,杨欢
·炮制制剂·
大黄传统饮片与煮散颗粒在不同时间点蒽醌类成分和干膏收率的比较
任虹,傅超美*,何瑶,罗妮妮,季宁平,杨欢
目的:比较大黄传统饮片与煮散颗粒在不同煎煮时间点总蒽醌含量、干膏收率的变化。方法:采用HPLC法测定并比较大黄传统饮片和煮散颗粒在不同煎煮时间点煎出液中总蒽醌含量以及干膏收率。结果:煎煮5~60 min时,不同时间点大黄煮散颗粒煎出液中的总蒽醌含量及干膏收率均高于大黄传统饮片煎出液。结论:本试验验证了中药煮散省材省时之优点,以期为中药传统饮片应用形式提供适应现代社会需求的新型饮片。
大黄传统饮片;大黄煮散颗粒;总蒽醌;游离型蒽醌;结合型蒽醌
大黄性寒、味苦,归大肠、脾、胃、肝、心经,具有泻下攻积、泻火解毒、凉血止血、活血祛瘀和清泄湿热的功效[1],临床常用于治疗实热便秘,热结胸痞,湿热泻痢,黄疸,淋病,水肿腹满,小便不利等症[2]。其中有效成分[3]主要为蒽醌类化合物,其中游离型蒽醌有大黄素、大黄素甲醚、芦荟大黄素、大黄酸、大黄酚。结合型蒽醌有大黄素甲醚-8-O-β-D-葡萄糖苷,大黄酚-1-O-β-D-葡萄糖苷,大黄素甲醚-6-O-β-D-葡萄糖苷,芦荟大黄素-8-O-β-D-葡萄糖苷,大黄酸-8-O-β-D-葡萄糖苷,大黄素甲醚-8-O-β-D-葡萄糖苷等,经过水解后,结合型蒽醌会转化成游离型蒽醌。中药煮散是指以水为溶媒,将药材颗粒或药材细末煎煮后,取汁服用的用药形式[4-6],本试验在传统中药煮散理论指导下,通过比较不同时间点大黄传统饮片与煮散颗粒[7]煎煮过程中总蒽醌含量、干膏收率的变化,为临床安全使用煮散颗粒以及开发节药、环保的新型中药现代饮片提供思路。
1 材料与方法
1.1 试验药物
大黄传统饮片(四川新荷花中药饮片股份有限公司,产地四川,批号1204127,经鉴定为蓼科植物药用大黄,且符合2015年版《中国药典》大黄项下规定),大黄煮散颗粒为提前制备的实验室自制颗粒(取大黄细粉,按1 mL/g均匀加水,过1号网筛,挤出制粒,于60 ℃干燥3 h取出,整粒即得大黄煮散颗粒)。
1.2 试剂
大黄素甲醚对照品(四川省维克奇生物技术有限公司,批号120902,纯度≥98%)大黄素对照品(四川省维克奇生物技术有限公司,批号120210,纯度≥98%),芦荟大黄素(四川省维克奇生物技术有限公司,批号120723,纯度≥98%),大黄酸(四川省维克奇生物技术有限公司,批号120115,纯度≥98%),大黄酚(四川省维克奇生物技术有限公司,批号120621,纯度≥98%),甲醇(色谱纯),水为蒸馏水,其他试剂均为分析纯。
1.3 仪器
LC-20A型高效液相色谱仪(日本岛津公司),DJ灵巧型粉碎机(上海淀久中药机械制造有限公司),Sartorius-BS110S 型分析天平(德国赛多利斯公司),R501B旋转蒸发仪(上海申顺生物科技有限公司),HH-4数显恒温水浴锅(国华电器有限公司)。
1.4 方法
试验依据 2015 年版《中国药典》中大黄项下的定量测定的方法和文献中用的各种方法,选择测定大黄中的芦荟大黄素、大黄酸、大黄酚、大黄素和大黄素甲醚以及干膏收率的含量进行测定。
1.4.1 色谱条件与系统适用性试验 色谱柱DiamonsilTMC18(5μm,250 mmx4.6 mm);流动相:甲醇-0.1%磷酸溶液(85:15);检测波长:254 nm;流速:1 ml/ min;柱温:30 ℃;理论板数按大黄素峰计算应不低于3000。
1.4.2 对照品溶液的制备 取各对照品适量,精密称定,加甲醇制成每1 ml对照品含芦荟大黄素、大黄酸、大黄酚、大黄素和大黄素甲醚分别为24 μg、279 μg、126 μg、13 μg、19.5 μg的标准溶液,备用。
1.4.3 供试品溶液的制备 根据前期预试验结果,探讨出了具体的供试品溶液制备方法,为分别精密称取大黄传统饮片5 g,共10份,分别加入16倍量水,浸泡15 min,取5份样品分别煎煮5、10、15、20、30 min,滤过,滤液定容至100 ml,备用。另5份样品煎煮30 min,滤过,收集滤液备用,滤渣中加入16倍量水分别煎煮5、10、15、20、30 min,滤过,合并2 次滤液,定容至100 ml,备用。水煎液冷却后,经0.45μm 微孔滤膜过滤,取续滤液,即得。分别精密称取大黄煮散颗粒5 g,共10份,同法制备大黄煮散颗粒的供试品溶液。
用移液管取10 ml大黄传统饮片提取液续滤液于分液漏斗中,分别加入三次氯仿溶液,每次分别为20 ml、20 ml、10 ml氯仿,待分层后,收集氯仿层溶液,保留水层待用,挥干氯仿液后,用甲醇溶解并定容放置于10 ml容量瓶中,即得大黄传统饮片游离型蒽醌供试品溶液。
将上述水层溶液置于圆底烧瓶中,加入8%盐酸5 mL和20 ml氯仿后,置75 ℃水浴锅中水浴1 h,收集氯仿层;同法提取两次,每次氯仿液量分别为20 ml、10 ml。收集三次氯仿液,挥干氯仿液后,用甲醇溶解并定容放置于10 ml容量瓶中,即得大黄传统饮片结合型蒽醌供试品溶液。
同法制得大黄煮散颗粒游离型蒽醌供试品溶液和大黄煮散颗粒结合型蒽醌供试品溶液。
总蒽醌含量=游离型蒽醌含量+结合型蒽醌含量。
1.4.4 标准曲线的绘制 取“1.4.2”项下对照品溶液2,6,10,14,18 μl注入液相色谱仪,测定峰面积。以进样量为横坐标(X)、峰面积值为纵坐标(Y)绘制芦荟大黄素、大黄酸、大黄酚、大黄素和大黄素甲醚的标准曲线。计算得到回归方程分别为Y1= 7E+06 X1 + 28396 R=0.9994, Y2= 3E+06 X2 - 39854 R=0.9996, Y3= 1E+06 X3 - 8088 R=0.9991, Y4=8E+06 X4 + 22980 R=0.9991, Y5=2E+06 X5 + 8786 R=0.9992.五种对照品分别在48~432 ng,558~5022 ng,252~2268 ng,26~234 ng,39~351 ng范围内线性关系良好。
1.4.5 样品测定 分别精密吸取大黄对照品10μL,大黄饮片及煮散颗粒不同时间点的供试品溶液10μL,按“1.4.1”项下色谱条件测定。色谱图见图1、2、3。

图1 大黄对照品色谱图

图2 大黄煮散颗粒30min色谱图

图3 大黄传统饮片30min色谱图
1.4.6 干膏收率的测定 分别精密称取大黄传统饮片5 g,共10份,分别加入16倍量水,浸泡30 min,取5份样品分别煎煮5、10、15、20、30 min,滤过,滤液定容至100 ml,备用。另5份样品煎煮30 min,滤过,收集滤液备用,滤渣中加入16倍量水分别煎煮5、10、15、20、30 min,滤过,合并2 次滤液,定容至100 ml,得大黄传统饮片不同时间点的干膏收率供试品溶液。分别精密称取大黄煮散颗粒5 g,共10份,同法制备大黄煮散颗粒不同时间点的干膏收率供试品溶液。分别精密吸取上述供试液50 ml,置已恒重的蒸发皿中,水浴蒸干,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定质量。
干膏收率%=[(干膏重量×煎出液总量)/(药材量×所取药液量)]×100%
2 结果与结论
将大黄传统饮片与煮散颗粒不同煎煮时间点总蒽醌含量和干膏收率的测定结果见表1、2,由表2结果更为直观的转化成折线图后,见图4、5。在每个测定含量的时间点,煮散颗粒的游离型蒽醌含量、结合型蒽醌含量、总蒽醌含量总是高于传统饮片,且含量相差的倍数分别为1.36~2.68倍、1.39~1.97倍、1.37~2.19倍。并且大黄煮散颗粒的干膏收率是大黄传统饮片干膏收率量的1.39~1.90倍。

表1 大黄传统饮片与大黄煮散颗粒总蒽醌含量(n=3)
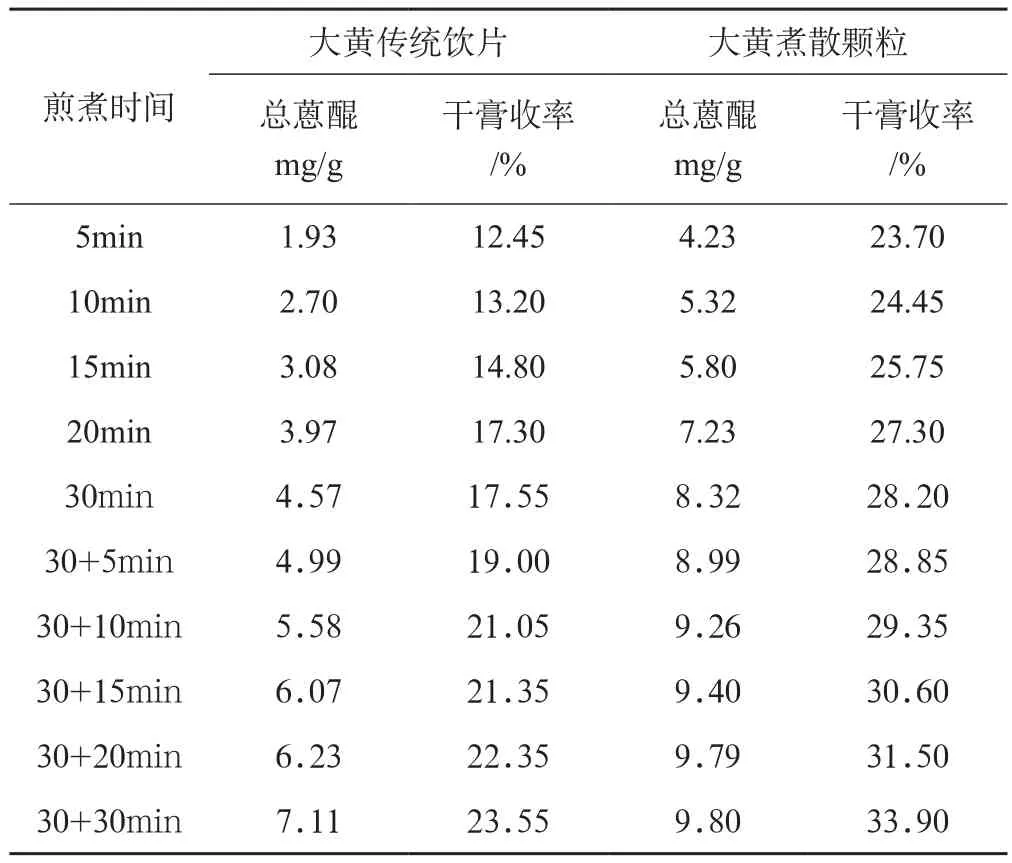
表2 大黄传统饮片、煮散颗粒不同煎煮时间总蒽醌含量及干膏收率的对比(n=3)
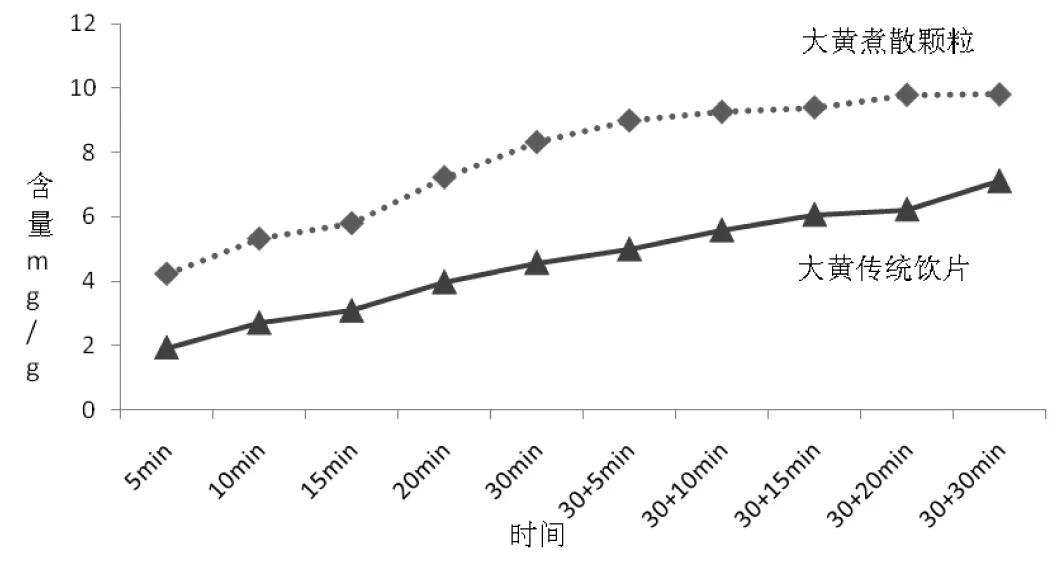
图4 大黄传统饮片、煮散颗粒不同煎煮时间总蒽醌的对比

图5 大黄传统饮片、煮散颗粒不同煎煮时间干膏收率的对比
3 讨论
在前期试验中,课题组对不同粒度的大黄煮散颗粒进行了考察,结果得出大黄粉末粒度越细,其有效成分煎出率较高,成型性较好,但其滤过性较差,故通过对以后实际生产的考虑,确定大黄细粉为最佳粒度。故本试验以大黄细粉为研究对象。
通过大黄传统饮片与煮散颗粒煎煮过程中总蒽醌含量和干膏收率变化的考察,大黄传统饮片粉碎成细粉后进行煎煮,总蒽醌含量和干膏收率大大增加。目前,中药材的使用需求量日益增大,中药材的资源保护迫在眉睫,而纵观现行的中药传统饮片、中药配方颗粒等均不能很好的解决这些问题。本试验结果不仅验证了中药煮散省材省时之优点,同时为中药传统饮片应用形式的创新提供新思路。
本试验从大黄的主要有效成分含量方面对大黄传统饮片和大黄煮散颗粒进行了对比研究,结果发现无论在哪一方面,大黄煮散颗粒都是优于大黄传统饮片的,这为促进煮散颗粒在中医药事业方面的应用提供了一定的依据。但在以后的研究中应同时对大黄煮散颗粒的毒理作用和体内药物代谢动力学方面进行深入的研究,从而准确确定大黄煮散颗粒的使用剂量,以便更加安全的使用于临床治疗中。
[1] 张廷模.临床中药学.上海科学技术出版社.第一版,2006:136.
[2] 国家药典委员会.中国药典(一部).中国医药科技出版社.2015: 22.
[3] 南京中医药大学.中药大辞典.上海科学技术出版社. 第二版.2006,138.
[4] 穆兰澄,曹京梅,李冀湘,等.中药煮散的历史沿革与现代研究概述.中国实验方剂学杂志,2008;14(7):74.
[5] 江泳,冯欣,杨殿新,等.对中药煮散剂现状的认识与思考.四川中医,2010;28(5):69.
[6] 林俊芝,傅超美,毛茜,等. 黄柏饮片与煮散颗粒在不同煎煮时间点盐酸小檗碱含量和干膏收率的比较.中国实验方剂学杂志,2012;12(18):41~43.
[7] 孙冬梅,饶梅冰,熊红,等.大黄不同煎煮时间对小承气汤中结合型蒽醌含量的影响.江西中医学院学报,2011;5(23):53~55.
(责任编辑:傅舒)
Comparison of total anthraquinone content and yield of dry extract from decoction pieces and powder of Rhubarb at different boiling time
/REN Hong, FU Chao-mei, HE Yao, LUO Ni-ni, JI Ning-ping, YANG Huan//(School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective:The thesis is to explore the variation of total anthraquinone content and yield of dry extract between traditional decoction pieces and powder of Rhubarb at different boiling time.Method:HPLC was used to detect the content of total anthraquinone and yield of dry extract from decoction of traditional decoction pieces and powder of Rhubarb at different time.Result:The content of total anthraquinone and yield of dry extract in powder were increased compared with those in traditional decoction pieces of Rhubarb during 5~60 min.Conclusion:This study has testified the advantage of timesaving and energy-saving of Chinese medicine decoction made from powder so as to provide new decoction pieces for modern society.
Rhubarb traditional decoction pieces;the powder of Rhubarb;total anthraquinone;free anthraquinone;combined anthraquinone
R285.5
A
1674-926X(2016)05-007-03
成都中医药大学 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室—省部共建国家重点实验室培育基地,四川 成都 611137
任虹,女,助教,从事中药制剂新技术新方法研究 Tel:15882232829 Email:363568917@qq.com
傅超美,男,教授,从事中药制剂新技术新方法研究 Email:chaomeifu@126.com
2016-04-12
