甘蓝型油菜核质不育与双隐性核不育花药发育的细胞学研究
2016-06-16张咏梅王开芳张金文
张咏梅,王开芳,张金文
(甘肃农业大学甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070)
甘蓝型油菜核质不育与双隐性核不育花药发育的细胞学研究
张咏梅,王开芳,张金文
(甘肃农业大学甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070)
摘要:【目的】 了解甘蓝型油菜(Brassica napus L.)不同类型雄性不育系的败育时期与细胞学特征.【方法】 采用石蜡制片方法,对核质不育系‘105A’和双隐性核不育系‘11AB-1’花药从孢原细胞至成熟花粉形成各阶段的发育进行研究.【结果】 ‘105A’的雄蕊大多数败育时期较早,花药发育受阻于孢原细胞分化期,无花粉囊形成;只有极少数雄蕊可正常发育至单核小孢子,此后至单核小孢子晚期开始发生异常,且花粉囊壁的绒毡层延迟退化.‘11AB-1’所有雄蕊均可正常发育形成大而圆的花粉囊,花粉囊内花药发育可能受阻于造孢细胞和花粉母细胞增殖期,花粉母细胞形成数量少,且这少量的花粉母细胞不能进行正常的减数分裂.【结论】 大多数‘105A’花药败育发生在孢原细胞阶段,极少数花药败育发生在单核小孢子晚期,属无花粉囊败育型为主,单核败育型为辅;‘11AB-1’花药发育属于花粉母细胞败育型之花粉母细胞死亡型.
关键词:甘蓝型油菜;雄性不育;减数分裂;花粉母细胞;花药
杂种优势利用是提高作物产量、缓解产量与品质之间矛盾、增强品种抗(耐)逆性的一条有效途径.油菜作为我国乃至全世界最主要的油料作物之一,由于为常异花授粉作物,存在显著的杂种优势,油菜杂交种一般可增产20%~30%,好的组合增产幅度可达50%[1].利用细胞质雄性不育(cytoplasmic male sterility,CMS)是目前甘蓝型油菜杂种优势育种最重要的途径[3-4].
雄性不育材料花药败育的细胞学研究是重要的基础工作.正常雄蕊花药发育过程主要包括孢原细胞时期、造孢细胞时期、花粉母细胞期、减数分裂期、单核花粉期、二核花粉期和三核花粉期.高等植物花药败育可以发生在小孢子发育的每一个时期[5],通过对被子植物13个科26个属的38种植物的小孢子败育的研究,发现单子叶植物花药败育多发生在单核期至双核期,双子叶植物多数在造孢细胞至四分体期败育较多[5-6].一般说来,不育系花粉的败育或退化,大都经过3个时期:即造孢细胞和花粉母细胞增殖期;减数分裂期;单胞花粉期(或单核晚期)或称雄配子体产生时期,大多数花粉是在这个时期败育的[5].而且,不同类型的雄性不育系花药败育的特点也各不相同[7].余凤群和傅廷栋根据油菜雄性不育发生的时期及特点,将不育系分成:无花粉囊败育型、花粉母细胞败育型和单核败育型3类,其中花粉母细胞败育又分为花粉母细胞死亡型、拟小孢子型和减数分裂异常型[8].Golver认为任何干扰雄蕊发育、胞原细胞分化或开花的基因突变,均有可能导致植物的雄性不育[9].
控制油菜雄性不育的遗传基础比较复杂,研究和比较同一物种在不同遗传背景下的不育系花药发育过程中表现的败育时期和细胞学特点,是进一步深入研究雄性不育基因时空表达的基础,也有助于揭示植物雄性不育机制[10].本研究以甘蓝型油菜‘青杂5号’不育系‘Polima CMS 105A’和双隐性核不育材料‘GMS 11AB-1’为试材,将两者的不育花药与‘青杂五号’恢复系‘1831R’可育花药相比较,对小孢子发生和花粉发育过程进行研究,以确定花药的败育时期和败育方式,为油菜雄性不育分子机制的研究和杂种优势的利用提供理论依据.
1材料与方法
1.1试验时间及地点
本研究试验材料于2013年4月至7月在甘肃农业大学试验基地种植.3种材料的种子于2013年初春经低温春化20 d后播种于陶制花盆中.出苗后进行正常的田间管理.石蜡制片和观测试验在甘肃农业大学研究测试中心和甘肃省作物遗传改良与种质创新重点实验室进行.
1.2供试材料
‘青杂5号’不育系‘Polima CMS 105A’、双隐性核不育材料‘GMS 11AB-1’和‘青杂五号’恢复系‘1831R’.
1.3方法步骤
待油菜生长至现蕾期、初花期、盛花期时,根据花药发育的不同时期选择生长势良好无病虫害的植株,用镊子摘取整束未开放的花序置于卡诺液(无水乙醇∶冰醋酸∶=3∶1)中固定.24 h后转入70%酒精中保存.在70%乙醇下将花序中的花蕾分离,按不同大小将<0.5 mm、0.5~1 mm、1~3 mm、3~5 mm、5~7 mm、>7 mm的花蕾分别聚类.按常规石蜡切片程序制片:95%乙醇(含1%伊红)洗涤2~3次(方便包埋时辨认材料)至材料不含冰乙酸气味;无水乙醇脱水2次,每次2 h;通风橱中二甲苯透明,逐步从无水乙醇过渡至二甲苯中,纯二甲苯更换2次,每次1 h;浸蜡,切取少许碎蜡加入二甲苯中,待完全溶解后再不断加入碎蜡,待至50%石蜡时需40~42 ℃浸蜡0.5~3 h,75%石蜡时需48~50 ℃浸蜡0.5~3 h, 56~58 ℃纯蜡需更换3次,每次0.5~1 h;包埋;Leica切片机切片,切片厚度6 μm或8 μm;37 ℃充分烤片72 h;埃利希氏(Ehrlich’s)苏木精-伊红(HE)双染法染色,染色时用4%铁矾媒染20 min;流水冲洗10 min,0.5%苏木精染色20 min;流水冲洗10 min,1%铁矾分色8 s;水洗返蓝10 min,此后逐级脱水,在含1%伊红的95%酒精中复染;二甲苯透明;中性树胶封片.Leica DM6000 B生物显微镜下对切片观察并拍照.
2结果与分析
2.1‘青杂五号(305)’恢复系‘1831R’小孢子发育的细胞形态学观察
2.1.1造孢细胞期对1831R的可育花蕾横切面进行观察发现,6个雄蕊发育正常(图1-A),花药4个角隅已发育出孢原细胞,孢原细胞经平周分裂形成内、外2层(图1-B),外层的周缘细胞经过平周分裂和垂周分裂,由外向内逐渐形成药室内壁、中层和绒毡层,与花药表皮共同构成了花粉囊壁;内层的造孢细胞形成初生造孢细胞.
花药中部的药隔由薄壁细胞和维管束组成,药隔连接着花粉囊,可提供花药发育所需要的水分和养分(图1-B).
2.1.2花粉母细胞和减数分裂初生造孢细胞经过分裂形成花粉母细胞.油菜花药具有4个花粉囊,花粉囊饱满呈圆形,其内充盈着大量正在发育的花粉母细胞(图1-A).此时,花粉母细胞排列紧密均匀地分布在整个花粉囊中,为多边形,细胞核大且染色较深,细胞质浓,没有明显的液泡,花粉母细胞之间,以及与绒毡层细胞之间有丰富的胞间连丝相连,将同一个花粉囊内的花粉母细胞连接成合胞体(图1-C).绒毡层具有高度的代谢活性,这时的绒毡层细胞大,细胞核较大,细胞质浓,细胞器丰富(图1-C~D).当进入减数分裂中期Ⅰ时,花粉母细胞变为椭圆形(图1-D).第1次减数分裂后,花粉母细胞形成二分体(图1-E).之后再次分裂为四分体,形成的四分体呈正四面体形排列(图1-F).此时绒毡层细胞发育达到顶峰.
在同一可育花药的花粉囊中,花粉发育进程不同步,分裂相从未分裂的花粉母细胞、二分体、四分体都可同时观察到(图1-F).花粉母细胞减数分裂有连续型胞质分裂和同时型胞质分裂2种.
2.1.3小孢子释放期四分体小孢子外周包被的胼胝质为绒毡层分泌的胼胝质酶水解,小孢子被释放出来(图1-G).此时小孢子为圆形,细胞质浓,无液泡,细胞核较大位于细胞中央(图1-H).随着单核小孢子逐渐发育,小孢子出现液泡,将细胞核挤向一边,花粉粒呈三角花形(图1-I).绒毡层细胞开始退化(图1-H-I).
2.1.4雄配子体发育期 单核花粉经过1次不均等的有丝分裂形成二核花粉,形成一个大的营养核和一个小的生殖核.之后,生殖核再次有丝分裂形成2个精细胞.这时油菜花粉才发育为成熟的三核花粉(图1-J).绒毡层细胞已完全解体(图1-J-K).
花药成熟,药室细胞壁除外切向壁外,其他各面的壁多产生不均匀的条纹状加厚,有利于药室壁的纵向开裂,散出花粉(图1-L).
2.2‘青杂五号(305)’不育系‘105A’小孢子发育的细胞形态学观察
‘105A’的花蕾横切面进行观察发现,6个雄蕊发育不良,花药发育不整齐,在花药角隅处应形成花粉囊的位置,始终保持薄壁细胞状态,不分化形成花粉囊;只有个别花药的部分角隅发育出孢原细胞.花药中部的药隔发育完整(图2-A).组成药隔的薄壁细胞和维管束清晰明显(图2-B),可为这少数正常发育的孢原细胞的生长提供养分.‘105A’由孢原细胞发育至四分体之前与恢复系可育花的花药发育基本一致.具体表现为:孢原细胞向内发育由次生造孢细胞生长为花粉母细胞,向外发育由周缘细胞分裂形成花粉囊壁,绒毡层已经形成;花粉母细胞由多边形的合胞体(图2-C)生长变化为椭圆形(图2-D),进而经减数分裂形成二分体(图2-E),再次减数分裂形成四分体(图2-F),绒毡层细胞发育达到高峰.包裹四分体的胼胝质解体后,小孢子被释放出来形成单核小孢子,绒毡层细胞开始退化.早期单核小孢子呈圆形,细胞质浓,细胞核位于细胞中央(图2-G),这与恢复系可育花同期小孢子形态结构相似.此后,花粉粒单核小孢子停止发育,此时细胞质染色较淡,核仁较小,出现液泡(图2-G).单核晚期的小孢子败育趋势更加明显,细胞核染色变淡,核仁开始消失.细胞质继续液泡,内含物质明显减少,细胞核消失,只有大的液泡和内空的花粉壁.切片结果表明花粉囊的绒毡层消失比较缓慢(图2-G对图1-H),以至于花粉成熟时也没有完全消失殆尽,中层消失.不育的花粉药室皱缩变形,只剩下外壳(图2-H-I).
2.3双隐性核不育系‘11AB-1’小孢子发育的细胞形态学观察
‘11AB-1’的花蕾横切面进行观察发现,6个雄蕊均可正常发育形成饱满、大而圆的花粉囊(图3-A).说明雄蕊原基四角隅的表皮细胞均能正常分化形成孢原细胞,孢原细胞经平周分裂进一步形成内、外2层,经分裂向外发育逐渐形成药室内壁、中层和绒毡层,与花药表皮共同构成了花粉囊壁;向内发育可形成初生造孢细胞、次生造孢细胞;中部的药隔发育完整.组成药隔的薄壁细胞和维管束清晰明显(图3-B).花粉囊内花药发育可能受阻于造孢细胞和花粉母细胞增殖期,造孢细胞经多次分裂只能形成少量的花粉母细胞(图3-C),甚至有的花粉囊内无花粉母细胞形成,出现空囊(图3-A-B).这少量的花粉母细胞质浓,核大,核仁清晰,胞间连丝丰富.此后花粉母细胞的继续发育受阻,花粉母细胞停止生长,质浓但核仁消失,不能进行正常的减数分裂,绒毡层开始退化,至逐淅消失(图3-D).花粉母细胞逐渐分解殆尽,花粉囊变成空腔(图3-E).花药全部瘪缩变形,只剩下外壳(图3-F).
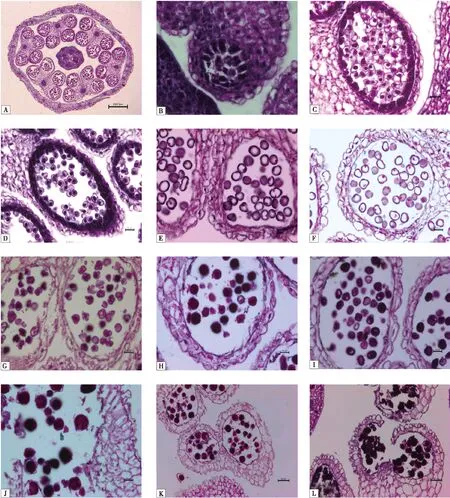
A:6雄蕊(×50);B:孢原细胞(×400);C:多边形花粉母细胞(×400);D:椭圆形花粉母细胞(×400);E:第1次减数分裂形成二分体(×400);F:第2次减数分裂形成四分体(×400);G:小孢子释放期(×400);H:单核小孢子(×400);I:三角花形花粉粒(×400);G:三核花粉粒(×400);K:成熟花粉囊(×200);L:花粉囊开裂(×200).图1 ‘1831R’可育花蕾小孢子发育的细胞学观察Fig.1 Cytological observation of microspore genesis of ‘1831R’ in Brassica napus

A:示6个发育不全的雄蕊(×50);B:发育不全的花药(×200);C:多边形花粉母细胞(×400);D:椭圆形花粉母细胞(×400);E:第1次减数分裂形成二分体(×400);F:第2次减数分裂形成四分体(×400);G:单核小孢子(×400);H:花药败育(×200);I:个雄蕊败育(×50).图2 ‘105A’小孢子发育的细胞学观察Fig.2 Cytological observation of microspore genesis of ‘105A’ in Brassica napus
3讨论
3.1不育系花药败育时期与特点
雄性不育材料花药败育的细胞学研究是重要的基础工作.不同类型雄性不育系花药败育的时期和细胞的败育特点各不相同.研究发现‘波里马’不育系(还有‘nap’和‘陕2A’不育系)花药发育受阻于孢原细胞阶段,不形成花粉囊,属无花粉囊型[1,10];萝卜质不育系(‘Ogu’)花药室内细胞败育在四分体至单核花粉期之间,以单核期败育为主,属单核期败育型[1];显性细胞核雄性不育系‘宜3A’药室内细胞出现败育或异常是在花粉母细胞期,属花粉母细胞败育型[1];生态不育系‘533S’的花药发育受阻于孢原细胞时期,其主要特点是不能形成正常的孢原细胞进而分化出花粉囊,属无花粉囊型败育型[11];而‘373S’小孢子在花粉母细胞时期出现异常,花药败育分别发生于单核小孢子早期[12],‘H50S’花药败育分别发生于单核小孢子晚期[13],两者均属单核败育型;‘大白菜Ogura’不育系(‘OBY’‘OBK’‘OD5’)小孢子败育均发生在单核早期,在开花前完全败育,属单核败育型[14];重叠隐性上位基因和一对上位抑制性基因控制的核不育系‘C022A’花药在小孢子发生的不同阶段均出现败育现象,最早的败育表现为花粉母细胞的退化解体,有些因花粉母细胞减数分裂异常不能形成小孢子四分体,还有的因小孢子在四分体中不能正常释放而败育,并伴随着绒毡层细胞的畸形化、异常生长等现象[10];受3对隐性基因互作控制的核不育材料‘1665’花药在花粉母细胞减数分裂时期出现异常,部分花粉母细胞细胞分裂相不均等分裂或分裂异常,导致部分四分体形状异常[15].诸多对不育系细胞学研究反映出花药败育是非常复杂和多途径的.再次说明:对于不同种的植物,甚至同一种植物,不育系花粉的败育形式和时期也各不尽同[5].本研究‘Polima CMS 105A’的花药大多数败育时期较早,花药发育受阻于孢原细胞分化期,与前人发现pol胞质不育系的花药发育受阻于孢原细胞分化期,无花粉囊形成的研究结论基本一致[1,10].但是,‘105A’个别花药的1-2个角隅可正常发育,仍有极少量花粉囊内有花粉母细胞形成,经减数分裂至四分体形成过程与可育花一致,待小孢子被释放出来形成了单核小孢子之后,单核小孢子的发育出现异常.花粉粒单核小孢子停止发育,细胞质变淡,核仁较小至逐渐消失,细胞核消失,出现液泡,且液泡化程度逐步加强,内含物质明显减少,单核小孢子晚期只剩下大的液泡和内空的花粉壁,这部分败育的花药属于典型的单核败育型.这一结论与甘蓝型油菜细胞质雄性不育系‘NCa’雄性败育发生于单核花粉晚期的结果类似[4].由青海省农林科学院培育的‘青杂5号’是2006年通过国家审定的高产双低高含油量甘蓝型春油菜品种[16],2008年-2012年连续5年被农业部确定为全国的主导油菜品种,曾在2010年、2011年先后创造了全国油菜单产6 072.0 kg/hm2和6 756.8 kg/hm2的历史最高纪录,已成为青海、甘肃、新疆、内蒙等春油菜省区的主栽品种和国家春油菜区域试验的对照品种,并已走出国门在蒙古国大面积推广种植.据报道,其亲本不育系‘105A’属于低温不敏感性,具有不育性稳定且彻底,花瓣张开角度大,结实指数和制种产量高的优点[17].对其不育系花药败育的细胞学观察发现:‘105A’表现出花药败育主要发生在孢原细胞阶段,极少数可继续发育的花药也在单核小孢子晚期发生败育,属无花粉囊败育型为主,单核败育型为辅,这可能是‘105A’虽可产生微量花粉,但不育性稳定且彻底的主要原因.

A:6个雄蕊(×50);B:完整的雄蕊(×200);C:花粉母细胞(×200);D:花粉母细胞不能进行减数分裂(×400);E:3-5 药室空腔(×200); F:6个雄蕊败育(×50).图3 ‘11AB-1’小孢子发育的细胞学观察Fig.3 Cytological observation of microspore genesis of 11AB-1 in Brassica napus L.
本研究材料双隐性核不育‘11AB-1’花药败育方式和时期完全有别于‘Polima CMS 105A’.花药发育受阻于花粉母细胞期,花粉母细胞形成数量少,不能进行正常的减数分裂,难以形成正常的花粉,属于花粉母细胞败育型,之花粉母细胞死亡型.与聂明建[18]对隐性核不育‘86A’花药细胞学观察结果较为一致.‘86A’花药壁发育正常,前期亦能发育形成造孢细胞,分化出花粉母细胞,花药室也明显可见,但在此时,有的花药室开始解体,有的发育却正常,花粉母细胞败育存在不同步现象,但完全不产生花粉.花粉母细胞进入减数第一分裂后,细胞的原生质开始浓缩、收缩,随后解体,最后完全消失,形成空的花粉囊,不能通过减数分裂,和‘11AB-1’一样,同属花粉母细胞败育型.
3.2不育系花药败育可能原因的探讨
油菜细胞核雄性不育是由隐性基因控制的.在被子植物的小孢子发生、发育及花粉成熟过程中,一系列的细胞和生化变化是由许多核基因控制的.只要这些基因中的某个基因的结构或表达发生变异,就会引起小孢子发生、发育或花粉成熟的异常,从而导致植株表现出雄性不育[19]观察发现,‘11AB-1’所有雄蕊均可正常发育形成饱满、大而圆的花粉囊,形成花粉囊壁的重要组成部分—绒毡层发育正常;所有花粉囊内,花粉母细胞形成数量少,且这些少量的花粉母细胞不能完成减数分裂,说明由孢原细胞分化为周缘细胞和造孢细胞后,与周缘细胞继续生长有关的基因表达正常,而与造孢细胞继续分化有关的基因可能发生了突变,影响了造孢细胞向花粉母细胞的分化;也可能是与调控花粉母细胞进行减数分裂的相关基因发生了变异.
绒毡层细胞含有较多的RNA、蛋白质和酶,并含有丰富的油脂、类胡萝卜素和孢粉素等物质,它对花粉的发育形成起着重要的营养和调节作用.绒毡层细胞能合成和分泌胼胝质酶,使单核花粉粒互相分离而保证正常发育.大量研究表明,多数植物不育系花药败育与花粉的哺育组织绒毡层的异常有关,因为绒毡层能提供小孢子发育过程中所需要的营养成分和信号,尤其是花粉壁发育所需要的脂类物质和蛋白质[20-22].Scoles等将绒毡层的异常现象分为2类:一类是绒毡层细胞维持分生细胞性质,过度生长膨大并侵占药室而挤压小孢子;另一类是绒毡层细胞提早解体,不能及时分泌胼胝质酶,使小孢子无法从四分体中释放出来,同时解体的细胞内含物常融合形成周原质团,侵入药室引起小孢子败育[23].本研究材料‘105A’切片结果表明花粉囊的绒毡层消失比较缓慢,以至于在等同于可育花花粉成熟期也没有完全消失殆尽,且中层消失.很显然这一结论并不符合Scoles所描述的2种现象.那么,‘105A’单核小孢子败育是否也与绒毡层延迟退化有关呢?如果有相关性,或许可以解释为,绒毡层细胞延迟退化,占用了部分营养物质,造成单核小孢子营养供给缺乏,从而影响了小孢子的发育.因为绒毡层细胞提前退化或延缓退化以及过度生长等异常现象,影响了不育系花粉的营养供应,而导致花粉败育,这也可能是造成花粉不育原因之一[5].此外,大量研究表明,线粒体基因及其表达产物与细胞质雄性不育直接相关[24].‘105A’少量能发育至花粉母细胞的花药最终败育可能与线粒体基因或片段有关.具体造成花药败育的影响因素还有待于进一步探索、研究.
参考文献
[1]傅廷栋,杨光圣,杨小牛,等.甘蓝型油菜波里马细胞质雄性不育的发现、研究与利用[J].自然科学进展:国家重点实验室通讯,1995,5(2):287-293
[2]李慧,胡胜武,李玮,等.甘蓝型油菜隐性上位互作核不育系的选育及其细胞学研究[J].西北农林科技大学学报:自然科学版,2010,38(1):111-118,124
[3]杨光圣,傅廷栋,Gregory G Brown.甘蓝型油菜细胞质雄性不育的遗传分类研究[J].中国农业科学,1998,31(1):27-31
[4]危文亮,王汉中,刘贵华.甘蓝型油菜细胞质雄性不育系 NCa花药发育的细胞学观察[J].中国农业科学,2005,38(6):1232-1237
[5]利容千.几种农作物雄性不育的细胞学研究[J].武汉大学学报:自然科学版,1978(1):83-96
[6]Laser K D,Lersten N R.Anatomy and cytology of microsporogenesis in cytoplasmic male sterile angiosperms[J].The Botanical Review,1972,38(3):425-450
[7]杨光圣,瞿波,傅廷栋.甘蓝型油菜显性细胞核雄性不育系宜3A花药发育的解剖学研究[J].华中农业大学学报,1999,18(5):405-408
[8]余凤群,傅廷栋.甘蓝型油菜几个雄性不育系花药发育的细胞形态学研究[J].武汉植物学研究,1990,8(3):209-218
[9]Golver J,Grelon M,Craig S,et al.Cloning and characterization of MS5 fromArabidopsis:a gene critical in male meiosis[J].The Plant Journal,1998,15(3):345-356
[10]龙欢,姚家玲,涂金星.3种甘蓝型油菜雄性不育系花药发育的细胞学研究[J].华中农业大学学报,2005,24(6):570-575
[11]董军刚,董振生,刘绚霞,等.甘蓝型油菜生态雄性不育系 533S花药发育的细胞学研究[J].西北农林科技大学学报:自然科学版,2004,32(7):61-66
[12]孙晓敏,李玮,李英,等.油菜生态型不育系373S小孢子败育的电镜观察[J].中国农学通报,2011,27(7):123-132
[13]孙晓敏,胡胜武,于澄宇.油菜生态不育系H50S花药败育的细胞学观察[J].西北农业学报,2009,18(5):153-158
[14]王书强,刘俊英,崔辉梅.大白菜Ogura雄性不育系及保持系花药发育的细胞学观察[J].新疆农业科学,2011,48(6):996-1000
[15]张雪梅,董振生.甘蓝型油菜隐性上位互作核不育材料1665花药败育的细胞学研究[J].西北植物学报,2009,29(1):43-48
[16]傅廷栋,杨小牛,杨光圣.甘蓝型油菜波里马细胞质雄性不育系的选育与研究[J].华中农业大学学报,1989,8(3):201-207
[17]王瑞生,杜德志,唐国永,等.杂交油菜新品种青杂5 号高产栽培模式研究[J].甘肃农业科技,2009(7):28-30
[18]聂明建,王国槐,朱卫平.甘蓝型油菜 3种类型雄性不育系花药败育的细胞学研究[J].中国农业科学,2007,40(7):1543-1549
[19]林良斌,官春云.油菜雄性不育分子机理的研究进展[J].湖南农业大学学报,1996,22(4):406-414
[20]Mascarenhas J P.The biochemistry of angiosperm pollen development[J].The Botanical Review,1975,41(3):259-314
[21]Chapman G P.The Tapetum[J].International Review of Cytology,1987,107:111-125
[22]邓云娟,胡胜武,田保明,等.甘蓝型油菜双显性细胞核雄性不育系Shaan-GMS雄配子发育观察[J].中国油料作物学报,2010,32(1):1-5
[23]Scoles G J,Evans L E.Pollen development in male fertile and cytoplasmic male sterile rye[J].Canadian Journal of Botany,1979,57:2782-2790
[24]袁美,杨光圣,傅廷栋.油菜细胞质雄性不育的分子生物学研究进展[J].中国油料作物学报,2002,24(2):87-90
(责任编辑李辛)
Cytology of anther development of genic-cytoplasmic and double recessive genetic sterile inBrassicanapus
ZHANG Yong-mei,WANG Kai-fang,ZHANG Jin-wen
(Gansu Agricultural University,Gansu Key Lab of Crop Improvement & Germplasm Enhancement,Lanzhou 730070,China)
Abstract:【Objective】 Understanding male sterility periods and cytological characteristics of male sterile line in Brassica napus.【Method】 Paraffin section method was used to compare stamens ontogeny of genic-cytoplasmic male sterile (GCMS) line ‘105A’ with that of genic male sterility (GMS) line ‘11AB-1’ at various stages from sporogonium to pollen formation.【Result】 Most stamens of ‘105A’ aborted at the earlier stage.The development of anther was blocked in sporogonium differentiation without pollen sac formation.Only a very few stamens could develop to mono-nucleus microspore (MNM) stage,then became abnormal at the later MNM stage,and tapetum cells of anther wall lingeringly degenerated.All stamens of ‘11AB-1’ normally developed into big and circular pollen sac.The development of anther maybe was blocked at sporogenous cell and pollen mother cell (PMC) proliferating phase.A small number of PMC were formed and could not proceed normal meiosis.【Conclusion】 Most anther of ‘105A’ aborted at sporogonium stage and a very few anther abortion occurred at the later MNM stage,therefore ‘105A’ is mainly of no-pollen abortion,MNM abortion as supplementary factor.‘11AB-1’ is of pollen mother cell death.
Key words:Brassica napus;male sterile;meiosis;pollen mother cell;anther
通信作者:张金文, 教授,博士生导师,研究方向为作物遗传育种.E-mail:jwzhang305@163.com
基金项目:甘肃省高等学校基本科研业务费(035-041018);甘肃省干旱生境作物学重点实验室-省部共建国家重点实验室培育基地开放基金(GSCS-2012-07).
收稿日期:2015-03-17;修回日期:2015-06-01
中图分类号:S 634.3
文献标志码:A
文章编号:1003-4315(2016)02-0061-08
第一作者:张咏梅(1974-),女,博士,副研究员,研究方向为牧草种质资源与育种.E-mail:zym824@sina.com
