Thermusaquaticus DNA连接酶的连接特性研究❋
2016-06-16梁兴国
于 欣, 王 静, 安 然, 梁兴国
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
ThermusaquaticusDNA连接酶的连接特性研究❋
于欣, 王静, 安然, 梁兴国❋❋
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘要:为进一步研究Thermus aquaticus (Taq) DNA连接酶的作用机理、开发以DNA连接作为关键步骤的新生物技术,本文以含有超稳定发卡结构的DNA(带有11nt长的单链部分)和另一条单链DNA为连接底物,研究了片段长度、反应温度、连接位点的结构特性、聚乙二醇(Polyethylene glycol, PEG)的添加等对连接的影响,探讨了Taq DNA连接酶的连接特性。连接结果显示:单链DNA的3’端同发卡结构I底物相连的连接率,比单链DNA的5’端同发卡结构II底物相连的连接率更高;可以连接的最短单链DNA片段的长度为6nt;在20~65℃范围内,一般连接率随温度升高而升高。在连接时,由2条底物通过互补配对形成的复合体的热稳定性对连接率影响不大,一般在连接温度远远高于该复合体的熔点(Melting Temperature, Tm)时仍有很高的连接率。在70或75℃时,虽然连接率有所降低,但仍然可以连接9nt的单链DNA片段。研究还发现,在片段连接上,PEG 6000对较难连接的片段(6~7nt)有促进作用,对容易连接的片段(8~10nt)促进作用不显著,甚至有一定抑制作用。
关键词:Taq DNA连接酶;发卡结构;短片段
引用格式:于欣,王静,安然,等. Thermus aquaticus DNA连接酶的连接特性研究[J].中国海洋大学学报(自然科学版), 2016, 46(5): 50-55.
YU Xin, WANG Jing, AN Ran, et al. Investigation of the ligation characteristics of thermus aquaticus DNA ligase[J]. Periodical of Ocean University of China, 2016, 46(5): 50-55.
DNA连接酶在DNA的复制、重组和修复过程中扮演重要角色[1]。它以ATP或NAD+作为辅酶来催化2个DNA链之间的3’-羟基(3’-OH)和5’-磷酸(5’-P)形成磷酸二酯键。这2类连接酶的反应机理相近:(1)NAD+或ATP将其腺苷酰基转移到DNA连接酶赖氨酸残基的ε-氨基上,形成酶-腺苷酸共价复合物中间体,同时释放出烟酰胺单核苷酸(NMN)或焦磷酸;(2)然后,酶-腺苷酸共价复合物上的腺苷酰基转移到DNA链的5’-P,形成被激活的焦磷酸键;(3)最后,相邻链的3’-OH与被激活的5’-P结合在2条链之间形成磷酸二酯键,同时释放出一磷酸腺苷(AMP)[2-7]。常用的DNA连接酶有E.coliDNA连接酶、T4 DNA连接酶和Thermusaquaticus(Taq) DNA连接酶等。T4 DNA连接酶来源于T4噬菌体,是ATP依赖的DNA连接酶,可连接双链DNA的黏性末端和平末端。但它只能在低于37℃的温度下使用,且对于碱基错配(Mismatch)不敏感[8]。TaqDNA连接酶热稳定性高,来源于ThermusaquaticusHB8,是NAD+依赖的连接酶,在45~65℃均有很强的活性[9-10]。
随着生物技术的深入发展,连接酶的应用越来越广泛。例如,T4 DNA连接酶在基因工程中常被用于将目的片段与载体连接,构建新的表达载体;它也可用于连接酶介导的PCR等基因检测技术[11]。但是由于T4 DNA连接酶错配区分能力较差,连接特异性低,容易出现假阳性。而热稳定的TaqDNA连接酶,区别错配的能力明显高于T4 DNA连接酶,因此TaqDNA连接酶可更好地应用于检测技术。T4 DNA连接酶发现较早,其连接特性已得到了较深入研究[7,12-13],但一般认为TaqDNA连接酶只能连接较长的黏性末端或切口部位,对其连接特性,尤其是短链的连接还很少有报道,因此本研究对其连接特性进行了系统研究,可为开发与DNA连接酶相关的生物技术提供依据。
由于TaqDNA连接酶的连接温度较高(65℃),一般需要足够长的DNA双链(>22nt)来确保该双链在连接温度下不发生解链[9-10],很难研究更高温度(如70℃)的连接特性。另外,使用双链底物时很难保证连接的寡核苷酸片段以1∶1的比例加入。我们注意到有些短的发卡结构在高温下很稳定,如环区序列为GNA或GNNA的发卡结构都非常稳定。而且发卡结构在分子内形成,一条链即可形成连接所需的黏性末端结构,而且茎部只有5~6个碱基(GC含量较高)时,其Tm值就可达到80℃[14-15]。因此,为简化设计和降低实验成本,本研究选用环区序列为GAA的稳定发卡结构作为连接底物来探究TaqDNA连接酶的连接特性。
1材料和方法
1.1 实验材料和仪器
T4多聚磷酸激酶和0’RangeRulerTM5 bp DNA ladder购自Thermo Scientific公司;TaqDNA连接酶购自New England Biolabs公司;Eva Green购自Biotium公司;短链DNA(见表1)由英潍捷基(上海)贸易有限公司合成;其他试剂均为国产分析纯试剂;PCR仪购自杭州博日科技有限公司;电泳设备购自北京六一仪器厂;凝胶成像仪购自美国BIO-RAD公司。

表1 连接所用稳定发卡结构和短片段
注:所标注的发卡结构I(Hp-I)分别与I-5~I-10片段进行连接反应,所标注的发卡结构II(Hp-II)分别与II-5~II-10片段进行连接反应。Hp-I ligated to oligonucleotides from I-5 to I-10 and Hp-II ligated to oligonucleotides from II-5 to II-10.
1.2 寡核苷酸片段5’-羟基的磷酸化
在100μL的反应体系中含有:1.5mmol/L ATP,1×T4 DNA多聚磷酸激酶缓冲液(50mmol/L Tris-HCl(pH=7.6,25℃),10mmol/L MgCl2,5mmol/L DTT,0.1mmol/L亚精胺),20U的T4多聚磷酸激酶,10μmol/L寡核苷酸片段;将含有以上反应体系的EP管置于PCR仪上,37℃反应4h,75℃ 10min(灭活多聚磷酸激酶)[16];反应后不经处理直接用于后续连接反应。
1.3 连接反应
在10μL的反应体系中含有:1μmol/L发卡底物,1μmol/L短片段,1×TaqDNA连接酶缓冲液(20mmol/L Tris-HCl(pH=7.6),25mmol/L KAc,10mmol/L Mg(Ac)2,10mmol/L DTT,1mmol/L NAD和0.1% Triton X-100),12UTaqDNA连接酶;将含有以上反应体系的EP管置于PCR仪上,20~65℃反应一定时间,进行电泳分析。
1.4 电泳分析
取1.5μL连接反应溶液,用15%聚丙烯酰胺凝胶电泳分析。电泳后用溴化乙锭染色15min后置于凝胶成像仪(Gel Doc XR+)上成像。
1.5 Image Lab软件分析电泳连接率
用Image Lab软件定量分析条带的亮度,具体的连接率由以下公式计算。
Y=aε/(aε+b)。
式中:Y为连接率;a为连接产物的条带的亮度;b为未连接发卡结构I或II条带的亮度;ε为修正系数。
片段连接后因碱基数的增多亮度会增加,计算连接反应率时应予以修正,因此引入修正系数ε。假定碱基对的数目同DNA染色后的荧光强度成线性关系,经计算6~10nt片段的修正系数分别是:0.71、0.69、0.67、0.65和0.63。
2结果
2.1 底物设计
本研究的连接温度主要采用20~65℃,需要发卡底物的熔点至少65℃,因此拟采用环区序列为GAA的稳定性强的发卡结构作为连接底物(序列见表1)。发卡结构I(见图1-I中发卡)和发卡结构II(图1-II中发卡)的茎干区碱基数分别是7和8bp,单链部分都是11nt,用于同连接的单链DNA结合(见图1)。测得其Tm值(Melting temperature)在65℃左右,满足研究对于连接底物稳定性的要求。发卡结构I和II分别有3’突出的黏性末端和5’突出的黏性末端,可以研究连接反应的方向性对连接率的影响,连接原理见图1。
2.2 不同长度片段连接情况
本研究采用15%聚丙烯酰胺凝胶电泳来分析连接产物,图2A和2B分别是结构I序列组和结构II序列组分别在20、37、45和65℃下连接12h的电泳结果。
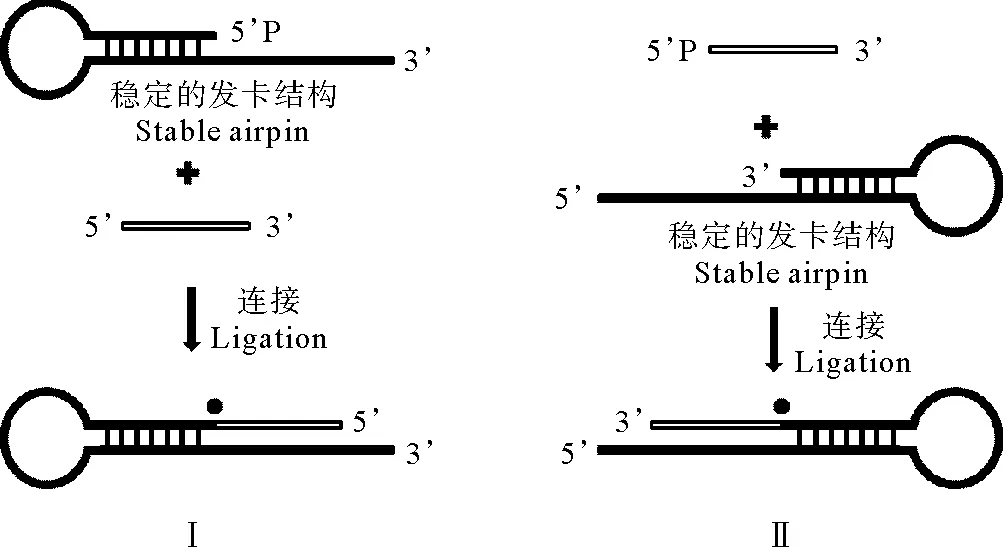
(I:3’突出黏性末端的发卡结构与5~10nt短片段的3’连接;II:5’突出黏性末端的发卡结构与5~10nt短片段的磷酸化的5’连接.●:TaqDNA连接酶。I: Hairpin with 3’-sticky end ligated to the 3’-end of 5~10 nt fragments; II: Hairpin with 5’-sticky end ligated to the phosphorylated 5’-end of 5~10 nt fragments. ●:TaqDNA ligase.)
图1TaqDNA连接酶对不同长度单链DNA片段连接原理图
Fig.1Scheme ofTaqDNA ligase ligating
single-stranded DNA of various lengths
由于连接产物比未连接产物长5~10个碱基,因此连接后迁移率显著降低,足以同原料完全分开,便于进行定量分析。未连接的短片段由于过短而未能染色,电泳图上未显示(见图2)。从图2A可以看出结构I序列组,5nt片段在不同温度下没有连接产物,即使延长连接反应时间到96h也未发现发生连接(数据未显示);6~10nt片段的连接率随片段长度增长而增加;6~10nt在45℃时连接率最高,在20~45℃的范围内连接率随温度升高而升高。图2B显示,对于结构II,5nt片段也不连接,能连接的6~10nt片段的连接率也随片段长度增长而升高;6~10nt片段在20~65℃范围内的连接率随温度升高而升高。
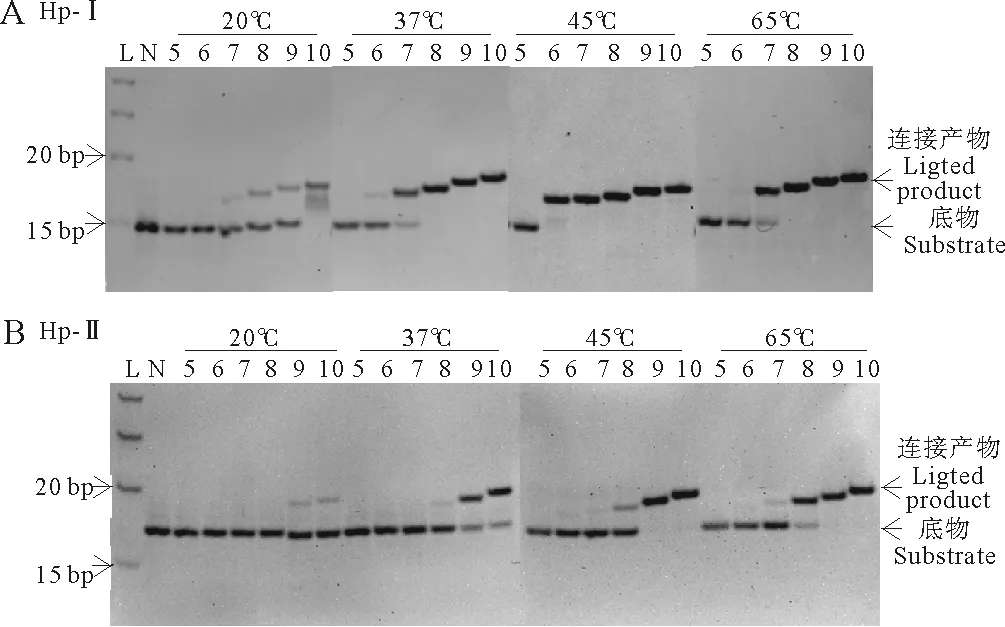
(L: Ladder;N:负对照。A:5~10nt片段(见图1,Hp-I)与发卡底物Hp-I在20、37、45和65℃温度下连接12h产物电泳图。B:5~10nt片段(见图1,Hp-II)与发卡底物Hp-II在20、37、45和65℃温度下连接12h产物电泳图。L:Ladder; N: Negative control. A: Hp-I ligated to fragments from I-5 to I-10 for 12 h. B: Hp-II ligated to fragments from II-5 to II-10 for 12 h.)
图2不同温度下各片段连接产物电泳图
Fig.2Effects of reaction temperature on the
ligation efficiency of various fragments
综上所述:(1)图2A和2B比较分析,结构I相同长度片段同一温度下连接率明显高于结构II连接率;(2)结构I和结构II序列组中,只有5nt片段无法连接;(3)TaqDNA连接酶所能连接的最短片段是6nt长的片段,但是除45℃外,其他温度连接率都很低;(4)不同片段长度连接率不同,大致连接率顺序是10nt>9nt>8nt>7nt>6nt;(5)温度越高连接率越高,但是6nt片段在65℃时连接率远低于45℃。
2.3 不同长度片段的连接速率比较和反应温度对反应速率的影响
要详细研究反应温度和反应时间对连接效率的影响,需要对连接情况进行定量分析。本文采用Image Lab软件对电泳得到的各个条带进行定量分析,计算出产物的连接率,分析结果如图3所示。图3A和3C分别是结构I和结构II在45℃下同6~10nt片段产物的连接率随时间变化的折线图。明显看出,片段越长连接速度越快。如结构I,10nt片段在3h就已完全连接,而6nt片段在48h时连接率只有91.8%(见图3A)。对于结构II,不同长度的片段之间的连接速度差别更大(见图3C)。为了进一步比较温度对各长度片段连接效率的影响,考察了在各温度下反应6h的定量分析结果(见图3B(结构I)和图3D(结构II))。总体看来,连接率随温度升高而增加。例如,对于7nt连接片段和Hp-I(结构I)的连接,以及8~10nt片段和Hp-II(结构II)的连接,都是温度越高连接率越高。而8~10nt片段和Hp-I(结构I)的连接,45和65℃在现有条件下看不出差别。在55℃下连接时,连接率介于45和65℃之间(数据未显示),对以上结论影响不大。我们还试验了70和75℃下9nt片段同Hp-I(结构I)的连接,发现连接率明显下降,但有意思的是即使在75℃高温时仍有较多产物产生,说明TaqDNA连接酶在75℃仍有活性(见图4)。意外的是,采用另外设计的连接体系发现,15nt长的片段在75℃下的连接率甚至高于65℃的连接率(数据未显示)。
2.4 PEG 6000对连接率的影响
据报道PEG 6000对有些连接反应有促进作用,本研究在连接体系中加入PEG,探索PEG对短片段连接的影响。实验结果显示,结构I和结构II在不同温度,不同连接时间,与短片段(6和7nt)连接,加入PEG后连接率有一定升高,而较长片段(8~10nt)加入PEG后促进作用下降甚至发生抑制作用(数据未显示)。现以差异较明显的结构I在45℃、反应3h条件下的连接产物为例,介绍PEG对连接反应的影响。根据图5可以发现,结构I在PEG加入后,6nt片段的连接率从10.6%增加到20.6%,7nt片段从33.1%增加到61.6%,8~10nt片段连接率在加入PEG后反而有所下降。

(A:45℃条件下6~10nt片段与发卡底物Hp-I(见图1,结构I)在不同时间的连接率。B:6~10nt片段与发卡底物Hp-I(见图1,结构I)在不同温度下连接6h连接率。C:45℃条件下6~10nt片段与发卡底物Hp-II(见图1,结构II)片段在不同时间的连接率。D:6~10nt片段与发卡底物Hp-II(见图1,结构II)在不同温度下连接6h连接率。A: Ligation ratio of hairpin-I ligating to the fragments from I-6 nt to I-10 nt at 45℃. B: Ligation ratio of hairpin-I ligating to I-6 nt~I-10 nt at various temperatures for 6 h. C: Ligation ratio of hairpin-II ligating to the fragments from II-6 nt to II-10 nt at 45℃. D: Ligation ratio of hairpin-I ligating to I-6 nt~I-10 nt at various temperatures for 6 h.)
图3反应时间以及温度对不同长度片段连接率的影响
Fig.3Effects of reaction time and temperature on ligation ratio of various length fragments
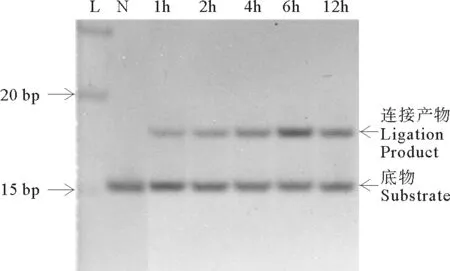
(L:Ladder;N:不加连接酶空白对照Negative control.)
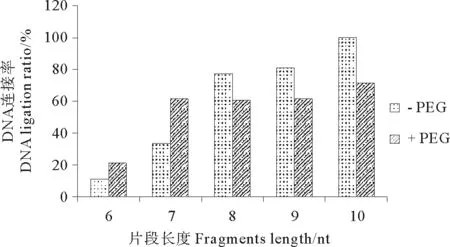
图5 PEG对6-10nt片段(I)的连接率的影响(45℃连接3h)
3讨论
本文利用稳定的发卡结构探索了TaqDNA连接酶在不同条件下的连接情况。通过比较2种结构在不同温度下与不同长度片段的连接率,发现3’突出黏性末端的发卡结构(Hp-I)更易与短片段连接。研究结果显示,对于足够长的黏性末端TaqDNA连接酶所能连接的最短DNA片段是6nt。另外,总结不同温度下各片段的连接情况得出,片段与底物结合稳定性对连接率的影响远低于TaqDNA连接酶的活性对它的影响。在20~65℃内连接率会随着温度升高而升高。
3.1 2种结构对连接率的影响
同一长度的片段在相同温度下,结构Ⅰ的连接率明显高于结构II的连接率。说明3’端突出的发卡结构的连接率明显高于5’端突出的发卡结构的连接率。有研究指出5’-P端长度对连接率有较大影响,在一定范围内5’-P端双链越长连接率越高[17]。本研究结果显示,结构I中作为连接底物的发卡结构5’-P端有8bp的双链DNA结构,提供了足够的与TaqDNA连接酶结合的空间,但是在结构II中,只有当5’-P化片段由6nt增长到8nt时连接率才会明显提高。Doherty和Dafforn的研究指出T7 DNA连接酶可以连接5’-P端长7~9nt和3’-OH端长3~5nt的片段[18]。Chorella virus DNA连接酶可以结合5’-P端长11~12nt和3’-OH端长8~9nt的片段[19]。T4 DNA连接酶以非对称的方式结合在存在缺口的封端双链DNA上,最短可以结合5’-P端长6nt和3’-OH端长5nt的DNA[17]。由此得出以ATP为辅酶的连接酶与底物结合,需要在5’-P端长度长于3’-OH端时才能进行。同时本研究结果显示以NAD+为辅酶的TaqDNA连接酶,在一定范围内5’-P端双链越长连接率越高。其次,由于TaqDNA连接酶更容易使结构I的DNA腺苷酰化,而结构II的单链DNA很难同TaqDNA连接酶和NAD+作用生成中间体,从而结构I连接效率明显高于结构II连接效率。
3.2 片段长度、温度和PEG 6000对连接率的影响
酶的活性、片段与底物的结合稳定性是影响连接率的主要因素。5nt片段无法连接,可能是片段太短,缺乏连接酶与连接片段紧密结合的位点,导致无法连接;6nt长的片段连接率很低,可能是片段太短酶很难识别,也有可能是片段与底物结合太不稳定从而导致连接率很低;随着片段增长,片段与底物结合稳定性增强,从而连接率升高;酶的活性随温度升高(20~65℃)而升高,温度升高连接率也不断升高。
5~10nt片段与发卡结合用引物设计软件Primer Premier 6.0估算其Tm值大约是19.2~35.2℃,即在20~35℃时片段与发卡底物才能结合的较稳定。但研究结果显示20℃时6~10nt片段与发卡底物结合较稳定,但其连接率远低于65℃时底物与发卡底物结合不稳定时的连接率。结果显示,温度越高反而连接率越高,而且在20℃时TaqDNA连接酶的活性明显低于65℃,由此说明酶活性对连接率的影响要明显高于片段与底物结合稳定性的影响。
6~7nt片段中加入PEG后连接率升高,原因可能是:(1)PEG的存在会使连接酶或酶与底物复合物稳定性增强:(2)由于大分子的簇拥作用,促进短片段和发卡底物与酶的相互作用。本研究发现底物结合稳定性对连接率的影响并不是很大,所以对于较易连接的8~10nt片段,加入PEG后促进作用显著下降,甚至有一定的抑制作用。Pheiffer和Zimmerma曾指出在大分子的作用下如PEG 6000可以促进黏性末端和平末端DNA的连接[20]。Hayashi等人也发现PEG 6000既能促进分子间连接又能促进分子内连接[21]。而本研究的结果显示PEG可能还有一定的抑制作用,这与已有的研究不同,可能原因是之前研究都是在底物复合物较稳定的情况下进行的,而本研究是在底物复合物不稳定的条件下进行的。
综上所述,在高温下与发卡底物结合不稳定的短片段也能连接,且在一定范围内(20~65℃)连接率随温度升高而升高。片段长度,PEG和连接位点的结构特性对连接率也有很大影响。更高温度(75℃甚至80℃)下TaqDNA连接酶的活性更高,温度升高后错配结合的可能性降低,从而使TaqDNA连接酶在检测遗传疾病、病原体和病毒等方面有更加广阔的应用前景。
参考文献:
[1]Timson D J, Singleton M R, Wigley D B. DNA ligases in the r-epair and replication of DNA[J]. Mutation Research/DNA Repair, 2000, 460(3): 301-318.
[2]Gumport R I, Lehman I. Structure of the DNA ligase-adenylate i-ntermediate: Lysine-(ε-amino)-linked adenosine monophosphoramid-ate[J]. Proceedings of the National Academy of Sciences of the United States of America, 1971, 68(10): 2559-2563.
[3]Weiss B, Richardson C C. Enzymatic breakage and joining of de-oxyribonucleic acid III. An enzyme-adenylate intermediate in the polynucleotide ligase reaction[J]. Journal of Biological Chemistry, 1967, 242(18): 4270-4272.
[4]Becker A, Lyn G, Gefter M, et al. The enzymatic repair of DNAII. Characterization of phage-induced sealase[J]. Proceedings of th-e National Academy of Sciences of the United States of America, 1967, 58(5): 1996-2003.
[5]Modrich P, Anraku Y, Lehman I. Deoxyribonucleic acid ligase is-olation and physical characterization of the homogeneous enzyme fromEscherichiacoli[J]. Journal of Biological Chemistry, 1973, 248(21): 7495-7501.
[6]Yudelevich A, Ginsberg B, Hurwitz J. Discontinuous synthesis of DNA during replication[J]. Proceedings of the National Academy of Sciences of the United States of America, 1968, 61(3): 1129-1136.
[7]易萍, 李力, 陈竹钦. DNA连接酶及相关检测技术研究进展[J]. 中国优生与遗传杂志, 2007, 15(8): 5-9.
Yi P, Li L, Chen Z Q. Research progress for DNA ligase and related detection technology[J]. Chinese Journal of Birth Health and Heredity, 2007, 15(8): 5-9.
[8]Kuhn H, Frank-Kamenetskii M D. Template-independent ligation of single-stranded DNA by T4 DNA ligase[J]. FEBS Journal, 2005, 272(23): 5991-6000.
[9]Barany F. Genetic disease detection and DNA amplification using cloned thermostable ligase[J]. Proceedings of the National Acade-my of Sciences of the United States of America, 1991, 88(1): 189-193.
[10]Takahashi M, Yamaguchi E, Uchida T. Thermophilic DNA ligase. Purification and properties of the enzyme fromThermusthermop-hilusHB8[J]. Journal of Biological Chemistry, 1984, 259(16): 10041-10047.
[11]Nilsson M, Antson D O, Barbany G, et al. RNA-templated DNA ligation for transcript analysis[J]. Nucleic Acids Research, 2001, 29(2): 578-581.
[12]Rossi R, Montecucco A, Ciarrocchi G, et al. Functional character-ization of the T4 DNA ligase: A new insight into the mechanism of action[J]. Nucleic Acids Research, 1997, 25(11): 2106-2113.
[13]Cherepanov A V, de Vries S. Binding of nucleotides by T4 DNA Ligase and T4 RNA Ligase: Optical absorbance and fluorescence studies[J]. Biophysical Journal, 2001, 81(6): 3545-3559.
[14]Hirao I, Nishimura Y, Tagawa Y, et al. Extraordinarily stable mini-hairpins: electrophoretical and thermal properties of the various sequence variants of d (GCGAAAGC) and their effect on DNA s-equencing[J]. Nucleic Acids Research, 1992, 20(15): 3891-3896.
[15]Antao V P, Lai S Y, Tinoco I. A thermodynamic study of unusu-ally stable RNA and DNA hairpins[J]. Nucleic Acids Research, 1991, 19(21): 5901-5905.
[16]Berkner K, Folk W R. Polynucleotide kinase exchange reaction: quantitave assay for restriction endonuclease-generated 5'-phosphor-oyl termini in DNA[J]. Journal of Biological Chemistry, 1977, 252(10): 3176-3184.
[17]Ng P S, Bergstrom D E. Protein-DNA footprinting by endcapped duplex oligodeoxyribonucleotides[J]. Nucleic Acids Research, 2004, 32(13): 107-113.
[18]Doherty A J, Dafforn T R. Nick recognition by DNA ligases[J]. Journal of Molecular Biology, 2000, 296(1): 43-56.
[19]Odell M, Shuman S. Footprinting of Chlorella Virus DNA ligase bound at a nick in duplex DNA[J]. Journal of Biological Chemis-try, 1999, 274(20): 14032-14039.
[20]Zimmerman S B, Pheiffer B H. Macromolecular crowding allows blunt-end ligation by DNA ligases from rat liver orEscherichiacoli[J]. Proceedings of the National Academy of Sciences of the United States of America, 1983, 80(19): 5852-5856.
[21]Hayashi K, Nakazawa M, Ishizaki Y, et al. Regulation of interand intramolecular ligation with T4 DNA ligase in the presence of polyethylene glycol[J]. Nucleic Acids Research, 1986, 14(19): 7617-7631.
责任编辑朱宝象
Investigation of the Ligation Characteristics ofThermusaquaticusDNA Ligase
YU Xin, WANG Jing, AN Ran, LIANG Xing-Guo
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:Background: DNA ligation is significant for both molecular biology and biotechnology. The ligation detail of T4 DNA ligase has been well studied and found that ligation can occur even when mismatched base pairs are present. Such scenario should be avoided when T4 DNA ligase is used for sequence specific DNA detection in which only positive result is expected for full matched case. On the other hand, the ligation characteristics of Thermus aquaticus (Taq) DNA ligase have not been studied in detail, especially for the temperature dependence. To further investigate the mechanism of Taq DNA ligase for the development of new biotechnologies using DNA ligation, here we used thermal stable DNA hairpin containing a 11 nt overhang and another single-stranded DNA as substrates to evaluate the effect of fragment length, temperature, structure of ligation sites, polyethylene glycol (PEG) concentration on DNA ligation by Taq DNA ligase . Results and Discussion: The results showed that structure of ligation substrates affected DNA ligation greatly. The yield of ligation between short DNA and hairpin I with 3' overhang was much higher than that between hairpin II with 5' overhang and short DNA with 5'-phosphate. Interestingly, 6 nt short DNA could be ligated to both hairpin structures although the efficiency was not high. The difference in ligation efficiency may be caused by the differences of forming ligation intermediate attaching AMP. Usually, 12 nt sticky ends are suggested to be used as ligation substrate, but we found 7 or 8 nt DNA could be ligated efficiently. This finding facilitated the molecular design of DNA detection technology. The ligation yield increased gradually with the increase of temperature from 20 to 65℃. Even for 8 or 9 nt short DNA which forms duplex (with its complementary sequence) with a Tm as low as 30℃, unexpectedly, the ligation efficiency was higher at 65℃than that at 45 or 55℃. This demonstrated that the complex of DNA ligase and 5’-phosphate substrate could help the hybridization. Even at 70 or 75℃, the 9 nt single stranded DNA could still ligate to the substrate, although the efficiency became lower. It is obvious that the mismatched substrate should be difficult to be ligated. The results also revealed that PEG 6000 improved the ligation of short fragments (6~7 nt) but not long ones (8~10 nt). Conclusions: Surprisingly, Taq DNA ligase could ligate a single-stranded DNA as short as 6 nt. Even for DNA as short as 8~9 nt, higher temperature (>65℃) gave higher yield of ligation. Structure Hp-I was found to be a better substrate because it has 5'phosphate, and could form the intermediate with Taq DNA ligase. These results are significant for developing DNA detection technology based on DNA ligation.
Key words:Taq DNA ligase; hairpin; short fragment
基金项目:❋ 山东省自然科学杰出青年基金项目(JQ201204);国家自然科学基金项目(31201327)资助
收稿日期:2015-02-17;
修订日期:2015-05-09
作者简介:于欣(1990-),女,硕士生,研究方向:生物工程。E-mail:yuxinhello2008@163.com ❋❋通讯作者: E-mail:liangxg@ouc.edu.cn
中图法分类号:Q783.2
文献标志码:A
文章编号:1672-5174(2016)05-050-06
DOI:10.16441/j.cnki.hdxb.20150057
Supported by Fund for Distinguished Young Scholars of Shandong Province (JQ201204); The National Natural Science Fund (31201327)
