谷胱甘肽对微囊藻毒素-LR所致小鼠肾脏氧化损伤的保护作用研究*
2016-06-15韩知峡何梅燕张青碧
韩知峡,何梅燕,崔 琰,熊 伟,张青碧△
谷胱甘肽对微囊藻毒素-LR所致小鼠肾脏氧化损伤的保护作用研究*
韩知峡1,何梅燕2,崔琰1,熊伟1,张青碧1△
[摘要]目的研究谷胱甘肽(GSH)对微囊藻毒素-LR(MC-LR)致小鼠肾脏氧化损伤的保护作用。方法用随机数字表法将40只健康清洁级昆明小鼠分为5组,分别为生理盐水组、GSH对照组 、MC-LR染毒组、GSH低剂量+MC-LR染毒组、GSH高剂量+MC-LR 染毒组,每组8只(雌雄各半),经腹腔注射染毒,每日1次,持续15 d,取出肾脏用于病理观察及检测过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力和谷胱甘肽(GSH)、丙二醛(MDA)含量。结果与生理盐水组比较,MC-LR染毒能引起MDA含量[(2.31±0.22)nmol/mg prot]明显升高(P=0.000),以及GSH含量[(0.68±0.02)mg/g prot]、CAT活力[(320.54±38.99)nmol/mg prot]、SOD活力[(180.93±15.30)U/mg prot]、GSH-Px活力[(295.11±42.40)U/mg prot]下降(P<0.05);而外源性加入GSH干预后,与MC-LR染毒组比较,GSH高剂量+MC-LR染毒组MDA含量[(1.94±0.12)nmol/mg prot]明显下降(P<0.05),GSH低、高剂量+MC-LR染毒组GSH含量[(1.01±0.08)mg/g prot、(1.08±0.16)mg/g prot]、CAT活力[(383.46±21.98)nmol/mg prot、(428.50±28.61)nmol/mg prot]均明显升高(P<0.05),GSH高剂量+MC-LR染毒组SOD活力[(222.01±11.51)U/mg prot]、GSH-Px活力[(358.37±20.29)U/mg prot]活力均明显升高(P<0.05)。结论MC-LR可能通过促进肾脏细胞发生脂质过氧化反应而引起导致肾脏氧化损伤,而加入GSH则可能通过减少脂质过氧化物质,提高抗氧化物活力,清除氧自由基而达到一定的肾脏保护作用。
[关键词]肾;谷胱甘肽;微囊藻毒素-LR;氧化损伤;保护作用
随着水体富营养化日益严重,江、河、湖泊中由藻类引起的水华现象频发,其产生的藻毒素引起的水污染与人群健康问题已引起广泛关注[1]。其中微囊藻毒素(microcystins,MCs) 在自然水体中存在最普遍,对人体健康危害最大[2]。MCs是一种含有7个氨基酸的多肽化合物[3],主要由蓝藻产生。MCs家族包含多个结构相似的亚型,其中MC-LR最常见、毒性最强且被广泛研究[4]。有研究表明MC-LR具有肾毒性[5],并有研究报道,肾脏是MCs除肝之外的另一个重要的靶器官[6],由于MCs会在肾中产生蓄积,所以可能产生的肾毒性更大[7]。而关于其损伤机制,早期就有研究指出氧化损伤可能在MCs对哺乳动物的致毒机制中起了关键作用[8]。故本研究着眼于MC-LR致肾脏的氧化损伤,并探索应用抗氧化剂能否减轻MC-LR的肾毒性。
1材料与方法
1.1材料
1.1.1实验动物健康清洁级5周龄昆明小鼠40只(雌雄各20只),体质量18~22 g,购自四川医科大学实验动物中心,许可证号:SYXK(川)2013-065。适应性喂养1周后分组,在屏障环境下分笼饲养,室温(22±2) ℃,湿度50%~70%,光照12 h/d。
1.1.2主要试剂MC-LR标准品(瑞士Alexis公司),注射用还原型谷胱甘肽(山东绿叶制药有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、MDA试剂盒均购于南京建成生物工程研究所。
1.2方法
1.2.1实验方法40只健康清洁级昆明小鼠按随机数字表法分为5组,每组8只,雌雄各半,具体如下:生理盐水组(生理盐水腹腔注射)、GSH对照组 (100 mg/kg腹腔注射)、MC-LR染毒组(5 g/kg MC-LR腹腔注射)、GSH低剂量 (100 mg/kg腹腔注射)+MC-LR染毒(5 g/kg MC-LR腹腔注射)组、GSH高剂量(200 mg/kg腹腔注射)+MC-LR染毒(5 g/kg MC-LR腹腔注射)组,每只小鼠按0.01 mL/g注射。每天观察小鼠,称质量,染毒,连续15 d。染毒结束后将所有小鼠颈椎脱臼处死。迅速解剖分离出小鼠两侧肾脏,剔除包膜,用生理盐水清洗,用滤纸吸干水份,称质量,记录数据,用锡箔纸包裹好后置于-80 ℃冰箱。
1.2.2指标测定方法(1)脏器系数(肾体比):肾体比=肾脏质量(g)/体质量(g)×100%。(2)病理改变:迅速取部分肾脏组织置于10%中性甲醛固定液中,72 h后常规石蜡包埋切片,苏木素-伊红(HE)染色光镜下观察肾组织病理变化。(3)GSH、MDA含量及GSH-Px、SOD、CAT活力的测定:将肾脏制备成10%的匀浆,备用。分光光度法测定MDA、GSH含量及SOD、GSH-Px、CAT活力(均按试剂盒说明书进行)。

2结果
2.1体质量和脏器系数实验期间无动物死亡。各组小鼠平均体质量均有所上升,组间差异无统计学意义(P>0.05)。与生理盐水组对比,MC-LR组肾脏系数明显升高,差异具有统计学意义(F=7.088,P=0.005);与MC-LR染毒组相比,GSH低剂量+MC-LR染毒组肾脏系数明显降低,差异具有统计学意义(F=3.010,P=0.075),见表1。
2.2病理结果各实验组小鼠的肾脏大体观未见明显异常。镜下结果显示:生理盐水组和GSH对照组肾小球、肾小管无异常;MC-LR染毒组肾小球间质纤维化明显,有少量炎细胞,上皮细胞轻微变性;GSH低剂量+MC-LR染毒组可见肾小球组间质和血管周围有少量炎细胞;GSH高剂量+MC-LR染毒组间质可见散在炎细胞,其余未见异常。
2.3各组小鼠肾脏细胞MDA含量的检测结果与生理盐水组对比,MC-LR染毒组MDA含量明显升高,差异具有统计学意义(F=21.779,P=0.000);与MC-LR染毒组对比,GSH高剂量+MC-LR染毒组明显降低,差异具有统计学意义(F=4.791,P=0.038),见表2。
2.4各组小鼠肾脏细胞GSH含量和CAT、SOD、GSH-Px活力的检测结果与生理盐水组对比,MC-LR染毒组抗氧物质GSH含量明显降低,差异有统计学意义(F=9.686,P=0.006),SOD活力(F=12.539,P=0.003)、CAT活力(F=21.596,P=0.000)和GSH-Px活力(F=6.099,P=0.021)均明显降低。与MC-LR染毒组对比,GSH低、高剂量+MC-LR染毒组的抗氧化物质GSH含量增加(P<0.05),CAT活力明显升高(P<0.05);GSH高剂量+MC-LR染毒组可见SOD活力明显升高(F=7.459,P=0.012)和GSH-Px活力明显提高(F=5.042,P=0.034),见表3。

表1 各组小鼠体质量及脏器系数的变化±s,n=8)
a:P<0.05 ,与生理盐水组比较;b:P<0.05,与MC-LR染毒组比较。
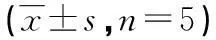
表2 各组小鼠肾脏细胞MDA含量
a:P<0.05 ,与生理盐水组比较;b:P<0.05,与MC-LR染毒组比较。
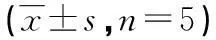
表3 各组小鼠肾脏细胞GSH含量和SOD、GSH-Px、CAT活力
a:P<0.05 ,与生理盐水组比较;b:P<0.05,与MC-LR染毒组比较。
3讨论
众多研究表明,肝脏是MCs主要的靶器官,但随着研究的进展,不少研究发现肾脏也是其重要的靶器官[6]。机体若长期暴露于MC-LR,将会引起严重的肝肾损伤[9]。早期Falconer等[10]的研究表明,MCs会导致肾脏的肾小管和肾小球的管腔增大、管腔内红细胞增多及肾小管的上皮细胞脱落或消失、胞间淋巴细胞浸润。而近期杨黎江等[11]的研究也表明MC可致肾小体毛细血管球体积增大,肾小球内细胞数目尤其是红细胞明显增多,肾小管管腔壁上皮细胞脱落导致肾小管管腔堵塞及细胞间隙炎症细胞浸润。作者通过本次研究发现,MC-LR染毒能使小鼠肾脏系数明显升高,通过光学显微镜进一步观察发现,MC-LR染毒组肾小球间质纤维化明显,有少量炎细胞,上皮细胞轻微变性,这也证实了MC-LR对肾脏产生了损伤,而在加入了谷胱甘肽干预后,小鼠肾脏的病理损伤程度较单纯染毒组小鼠有所减轻,提示谷胱甘肽可能有一定的保护肾脏的作用。
目前,关于MCs的损伤机制尚未阐明,但MCs促进脂质过氧化反应产生氧化损伤的观点得到广泛认可。谢蕾等[12]报道MCs可引诱细胞活性氧的产生从而诱发脂质过氧化。GSH是由L-谷氨酸、L-半胱氨酸和甘氨酸经肽键缩合而成的生物活性三肽化合物。GSH具有抗氧化的作用,通过巯基和机体的自由基结合使其失去活性,从而转化成代谢物质排出体外,从而达到治疗疾病的目的[13]。GSH也可直接使自由基还原或促进超氧化物歧化酶合成[14],当发生肾脏损伤或肾中毒时肾组织中的GSH明显减少,机体细胞抗氧化和过氧化的能力也随之减弱,降低了细胞膜的稳定性,使细胞容易发生损伤[15]。故本次研究通过外源性加入GSH,检测小鼠肾脏脂质过氧化产物MDA的含量和抗氧化物质SOD、CAT、GSH-Px的活力及GSH的含量,观察GSH在对抗MC-LR肾脏氧化损伤中所起的作用。
本次研究结果发现MC-LR染毒的确升高了MDA含量,这提示MC-LR可能促进了肾脏的氧化损伤。而加入了高剂量GSH实验组的小鼠肾脏MDA含量较MC-LR染毒组明显降低,这提示了外源性GSH的注入有助于减轻脂质过氧化反应而起到对抗MC-LR肾脏氧化损伤的作用。同时,本次研究还发现,MC-LR染毒组的抗氧化物质SOD、CAT、GSH-Px的活力及GSH的含量均明显下降,而加入不同剂量的GSH后均能逆转这些抗氧化物质活力和含量的降低。这进一步说明了给予一定剂量的外源性GSH能够对抗MC-LR引起肾脏细胞氧化应激损伤,提高肾脏细胞的抗氧化能力。
综上所述,MC-LR可能促进肾脏细胞发生脂质过氧化反应从而引起导致肾脏氧化损伤,而外源性加入GSH则可能通过减少脂质过氧化物质,提高抗氧化物活力,清除氧自由基而达到对抗MC-LR所致的肾氧化损伤作用,起到了对肾脏的保护效应。而关于GSH用于治疗MC-LR肾损伤的疗效及疗效与剂量的相关性还有待进一步的研究。
参考文献
[1]Michalak AM,Anderson EJ,Beletsky D,et al.Record-setting algal bloom in lake erie caused by agricultural and meteorological trends consistent with expected future conditions[J].Proc Nati Acad Sci,2013,110(16):6448-6452.
[2]黄艺,张郅灏.微囊藻毒素的致毒机理和人体健康风险评价研究进展[J].生态环境学报,2013,22(2):357-364.
[3]Boume DG,Jones GJ,Blakeley RL,et al.Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR[J].Appl Environ Microbiol,1996,62(11):4086-4094.
[4]王昊,徐立红.微囊藻毒素研究的当前进展和未来方向[J].水生生物学报,2011,35(3):504-515.
[5]Milutinovic A,Zivin M,Zorc-Pleskovic R,et al.Nephrotoxic effects of chronic administration of microcystins-LR and-YR[J].Toxicon,2003,42(3):281-288.
[6]张占英,俞顺章,卫国荣,等.微囊藻毒素-LR在动物体内整体水平及细胞水平的分布[J].卫生毒理学杂志,2002,16(1):5-8.
[7]Ito E,Takai A,Kondo F,et al.Comparison of protein phosphatase inhibitory activity and apparent toxicity of microcystins and related compounds[J].Toxicon,2002,40(7):1017-1025.
[8]Guzman RE,Solter PF.Hepatic oxidative stress following prolonged sublethal microcystin LR exposure[J].Toxicol Patho1,1999,27(5):582-588.
[9]李秀娣,毛光明.微囊藻毒素-LR对SD大鼠的短期毒效应研究[J].食品研究与开发,2013,34(1):14-17.
[10]Falconer IR,Stephen JH,Andrw RH,et al.Hepatic and renal toxicity of the blue-green alga(cyanobacterium)elylindrospermopsis raeibomlii in male Swiss Albino mice[J].Environ Toxicol,1999,14:143-150.
[11]杨黎江,沈放,路斌,等.滇池微囊藻毒素对小鼠肾脏的毒性研究[J].昆明学院学报,2012,34(6):52-54.
[12]谢蕾.微囊藻毒素诱导氧化损伤机制的研究进展[J].毒理学杂志,2007,22(5):403-405.
[13]李国华.注射用丹参多酚酸盐联合还原型谷胱甘肽治疗急性肾损伤疗效观察[J].实用中西医结合临床,2012,12 (1):40-41.
[14]刘嵋,张金辉,邵安华.糖尿性病神经病变的药物治疗现状[J].中华内分泌代谢杂志,1996,12(1):38-39.
[15]李继芳.还原型谷胱甘肽液对急性肾功能损害的应用观察[J].中国现代药物应用,2013,7(8):105-106.
(四川医科大学:1.环境卫生与劳动卫生学教研室;2.公共卫生学院预防医学系,四川泸州 646000)
The protective effects of glutathione on renal oxidative damage induced by microcystin-LR on mice*
HanZhixia1,HeMeiyan2,CuiYan1,XiongWei1,ZhangQingbi1△
(1.DepartmentofEnvironmentalandOccupationalHygiene;2.MajorofPreventiveMedicine,SchoolofPublicHealth,SichuanMedicalUniversity,Luzhou,Sichuan646000,China)
[Abstract]ObjectiveTo study the protection of glutathione (GSH) on renal oxidative damage to mice which caused by microcystin-LR(MC-LR).MethodsForty healthy KM mice were divided into five groups by randomly sampling,which were saline control group,GSH control group,MC-LR group,low dose GSH +MC-LR group and high dose GSH +MC-LR group,and the experiment was lasting 15 days by intraperitoneal injection.Then we took out the kidney for pathological observation and detected the activity of CAT,SOD,GSH-Px and the content of GSH,MDA.ResultsCompared with control group,the MC-LR increased the content of MDA[(2.31±0.22)nmol/mg prot,P=0.000] and decreased the content of GSH[(0.68±0.02)mg/g prot].The activity of CAT[(320.54±38.99)nmol/mg prot],SOD[(180.93±15.30)U/mg prot],GSH-Px[(295.11±42.40)U/mg prot](P<0.05).However,after GSH was given,compared with MC-LR group,MDA content[(1.94±0.12)nmol/mg prot]of high dose GSH+MC-LR group significantly decreased (P<0.05),GSH content[(1.01±0.08)mg/g prot,(1.08±0.16)mg/g prot]and CAT activity[(383.46±21.98)nmol/mg prot,(428.50±28.61)nmol/mg prot] of both GSH groups significantly increased (P<0.05),the activity of SOD[(222.01±11.51)U/mg prot] and GSH-Px[(358.37±20.29)U/mg prot] of high dose GSH +MC-LR group significantly increased (P<0.05).ConclusionMC-LR may cause renal oxidative damage through promoting the lipid peroxidation on renal cells.The GSH may reach a certain protective effect on kidney by reducing the lipid peroxidation,improving the antioxidant activity,and removing oxygen free radicals.
[Key words]kidney;glutathione;microcystin-LR;oxidative damage;protective effect
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.010
*基金项目:四川省卫生厅自然科学基金项目(120384);泸州医学院大学生科研项目(2012075)。
作者简介:韩知峡(1981-),讲师,硕士,主要从事环境毒理学研究。△通讯作者,E-mail:qingbizhang@126.com。
[中图分类号]R285
[文献标识码]A
[文章编号]1671-8348(2016)03-0320-03
(收稿日期:2015-08-02修回日期:2015-10-28)
