海岸盐沼湿地可培养硫酸盐还原菌多样性及其时空变化规律
2016-06-14公丕贤幸颖薛雅蓉刘常宏
公丕贤+幸颖+薛雅蓉+刘常宏

摘要:为了揭示盐沼湿地生态系统中可培养硫酸盐还原菌(sulfate-reducing bacteria,SRB)的多样性及其时空变化规律,探讨大米草与互花米草定植对SRB多样性及种群数量的影响,采用选择性培养基培养方法及16S rRNA基因序列分析技术,定性、定量分析江苏射阳海岸盐沼湿地可培养SRB的多样性及种群数量。结果共获得210株硫酸盐还原菌,归属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)的17个属,其中假单胞菌属(Pseudomonas)为优势类群;发现了一些未见报道的新SRB种属,如Agromyces、Brachybacterium、Oceanimonas、Microbulbifer、Photobacterium、Sporosarcina和Tetrathiobacter等;盐沼湿地可培养SRB多样性及种群数量受季节变化而改变;定植米草直接或通过改变土壤性质而间接影响盐沼湿地可培养SRB多样性及种群数量。SRB是盐沼生态系统的重要组成部分,其种群多样性、数量及分布受生物、非生物因素的影响。
关键词:盐沼湿地;硫酸盐还原菌;种群;米草;互花米草
中图分类号:Q938.1;S182
文献标志码: A
文章编号:1002-1302(2016)04-0457-06
硫酸盐还原菌(sulphate-reducing bacteria,SRB)是一类厌氧原核微生物,具有利用惰性硫酸盐作为呼吸代谢的最终电子受体、氧化有机物或无机物而获得能量、异化产生具有化学性质活泼的H2S的能力。SRB是生物圈中起源较早的生物类群,在硫元素的生物地球化学循环、有机物质降解、温室气体释放(与甲烷产生菌共同作用)、金属离子还原、含氯化合物生物处理等方面发挥作用[1-7]。
盐沼湿地(salt marsh)是世界上生产力最高的生态系统,其初级生产力为460~3 700 g/(cm2·年)。米草,特别是互花米草(Spartina alterniflora)是盐沼湿地生态系统中的先锋植物,除少量的米草及其代谢产物进入海水外,绝大部分则留在了湿地的沉积物中,并通过发酵、厌氧呼吸而分解。与有氧呼吸、反硝化作用和金属还原途径相比,目前认为由SRB介导的硫酸盐还原是盐沼湿地土壤的主要呼吸途径,占盐沼湿地土壤总呼吸的67%~80%[8]。
SRB是盐沼湿地生态系统中的优势功能类群,它在盐沼湿地物质循环过程中扮演重要角色[9]。目前有关盐沼湿地SRB多样性的研究多基于对16S rRNA基因序列或异化的亚硫酸盐还原酶(dissimilatory sulfite reductase,Dsr)基因序列分析结果,对于可培养的SRB多样性研究报道较少,而可培养SRB的获得是认知生态系统中SRB多样性及功能的关键。为此,本研究以江苏射阳海岸盐沼湿地为对象,采用选择性培养基培养的方法研究不同季节、不同米草定植以及不同土壤深度SRB的多样性及种群数量分布规律,为深入了解盐沼湿地生态系统中硫循环生物驱动机理提供新的参考依据。
1 材料与方法
1.1 选择培养基组成
选择性培养基[10-13]组成:0.33 g乙酸钠,230 μL无水乙醇,0.12 g苯甲酸钠,0.45 g乳酸钠,0.19 g丙酸钠,15 g NaCl,6.8 g MgSO4·7H2O,5.7 g MgCl2·6H2O,0.09 g KBr,0.7 g KCl,0.25 g NH4Cl,0.2 g KH2PO4,1.5 g CaCl2·2H2O,2.52 g NaHCO3,0.1 g酵母膏,1.66 g Fe(NH4)2(SO4)2·6H2O,20 g琼脂,定容至1 L,调节pH值为7.0,1×105 Pa灭菌30 min。
1.2 样品采集
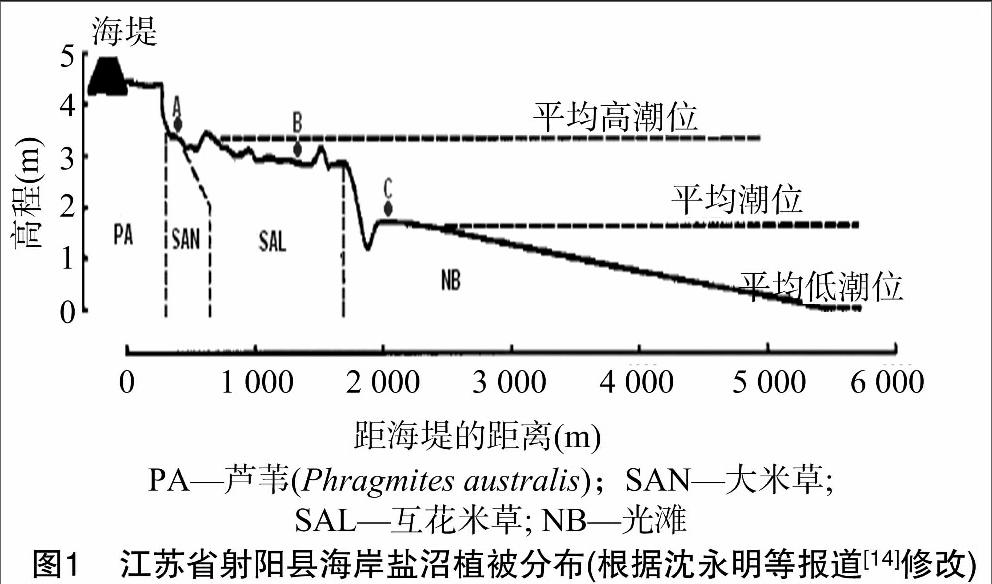
如图1,样点A为大米草(Spartina anglica)地,B为互花米草地,C为无植被光滩(naked beach)。A、B、C样地沿着潮汐沟,垂直于海岸线呈地带性分布。取样时间分别为米草生长初期(5月)、扬花期(9月)、成熟期(11月)。每个样点随机选取3个1 m ×1 m的样方,样方间距10 m以上。样方内分别取0~5 cm、5~10 cm 2个深度的土壤样品各100 g左右,置于聚丙烯塑料样品袋中,立即带回实验室,在超净工作台中将每个样地的3个样方土壤样品充分混匀,即每个样地最终得到2个深度共2份土样,于4 ℃保存。
1.3 土壤理化性质的测定
按照GB 7833-1987《森林土壤含水量的测定》,分别测定土壤含水量、pH值[15]。采用铬酸钡光度法测定土壤SO42-浓度[16-17]。土壤样品中碳、氮元素含量用德国Heraeus公司的CHN-O-Rapid型元素分析仪测定;硫元素含量用ZCL自动定硫仪测定。
1.4 可培养SRB种群数量的测定
土壤样品经系列稀释后,涂布于选择培养基上,然后置于密闭的干燥器中,采用燃烧蜡烛耗氧法去除干燥器中的氧气,于30 ℃培养箱中培养24 h,菌落及其周围变黑的即为硫酸盐还原菌。统计各平板SRB菌落数,换算为单位质量土壤中的菌落数,单位CFU/g,。同时,根据菌落形态及生长差异纯化SRB菌株。
1.5 16S rRNA基因序列分析
根据徐晓宇等方法[18],提取各SRB菌株的基因组DNA,并进行16S rRNA基因的PCR扩增。PCR扩增引物为8f[19]、907r[8]。反应条件为:95 ℃ 5 min;94 ℃ 30 s,57 ℃ 1 min,72 ℃ 1 min,25个循环;72 ℃ 10 min;4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测和胶回收后测序。采用序列图谱软件Chromas对所得序列进行核对,将序列相同的菌株合并为1个种,并选择1个菌株的序列作为代表序列,使用BLASTN在GenBank+EMBL+DDBJ+PDB基因库中对每株菌的16S rDNA序列进行同源性分析,同时选择相似性较高的序列作为参比,用MEGA 5.0进行系统进化树构建。
2 结果与分析
2.1 土壤理化性质
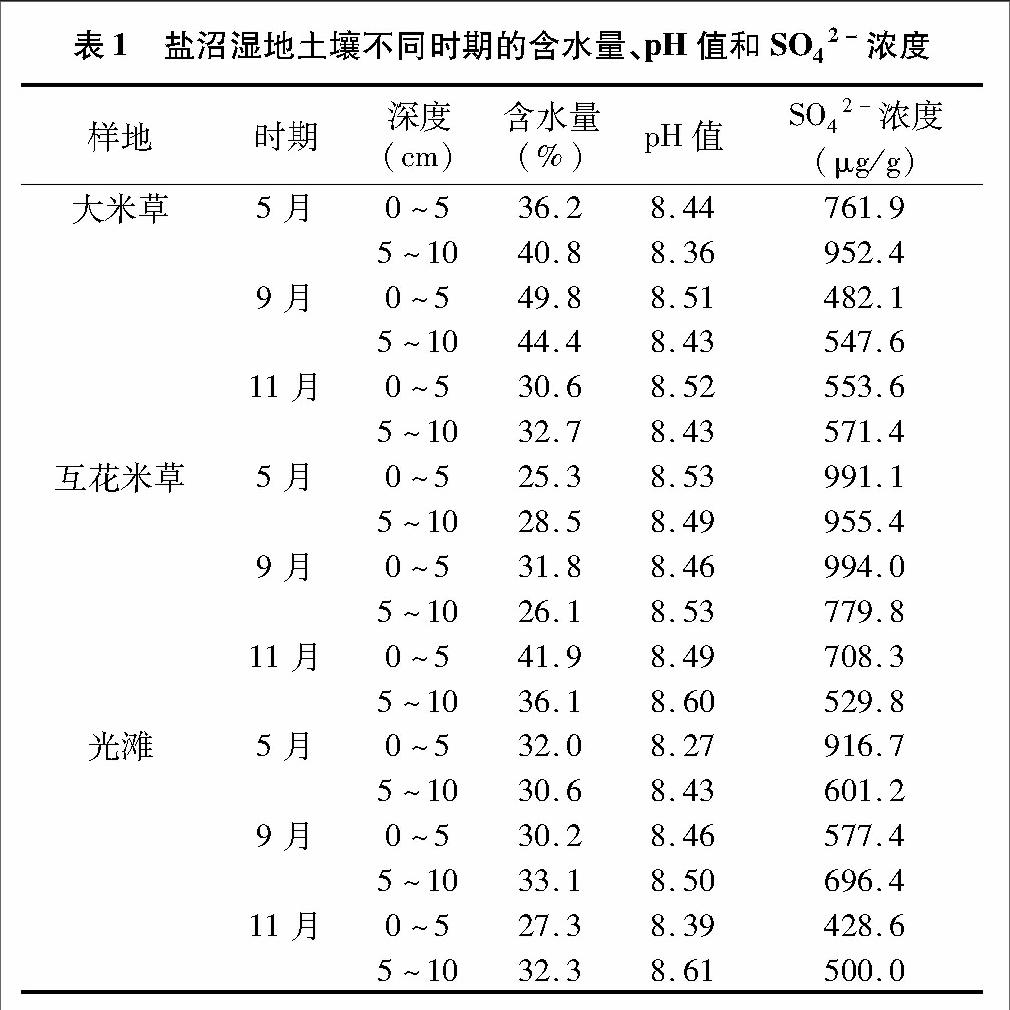
盐沼湿地土壤含水量因季节、是否种植植物以及植物品种而异(表1)。大米草、互花米草种植土壤最大含水量分别发生在9月(44.4%~49.8%)、11月(36.1%~41.9%);而光滩土壤含水量随季节变化不大(27.3%~33.1%)。相同季节不同土壤含水量有较大差异。5月、9月大米草土壤含水量(36.2%~49.8%)明显高于互花米草土壤(25.3%~31.8%)、光滩土壤(30.2%~33.1%),而互花米草土壤在此期间含水量与光滩土壤相比偏低。11月,互花米草土壤含水量(36.1%~41.9%)明显高于大米草土壤(30.6%~32.7%)、光滩土壤(27.3%~32.3%)。
虽然种植米草及季节变化对盐沼湿地土壤pH值影响不大(表1),但是与光滩相比(5~10 cm>0~5 cm),互花米草定植土壤pH值的变化具有类似趋势(5~10 cm>0~5 cm),而大米草定植土壤的pH值则随深度加深而略有降低(5~10 cm<0~5 cm)。
盐沼湿地土壤SO42-浓度随季节变化而逐渐降低,而种植米草则能够明显提高盐沼湿地土壤中的SO42-浓度(表1)。在相同月份,种植互花米草土壤SO42-浓度基本明显高于种植大米草、光滩土壤。不同深度土壤中的SO42-浓度因定植植物品种而异:定植大米草土壤中的SO42-浓度随深度加深而增加,而互花米草土壤则正好相反。
对9月份各土壤样品的碳、氮、硫元素含量检测结果显示,与光滩土壤相比,定植米草可明显提高表层土壤(0~5 cm)中这些营养元素的含量,而对深层土壤(5~10 cm)中的含量无明显影响(表2)。
2.2 SRB种群结构
由于硫酸盐还原菌还原SO42-的产物H2S可与培养基中Fe2+形成黑色沉淀FeS,因此平板上出现黑色菌落或菌落周围变黑的即为SRB菌株。从大米草、互花米草和光滩土壤样品中共分离获得210株SRB。经基因序列同源性(>98%)比对和系统发育分析可知,这些菌株分布于17个属,其中20株(R14、R15、R24、R27、R29)属于厚壁菌门的2个属Bacillus、Sporosarcina(相似性均达100%),27株(R6、R16、R18、R19、R21、R25、R30)属于放线菌门的5个属Agromyces、Brachybacterium、Dietzia、Micrococcus和Rhodococcus(相似性均达100%)。其他163株属于变形菌门细菌,其中39株(R11、R13、R23、R28、R31)属于α-变形菌纲的3个属Paracoccus、Rhizobium、Rhodobacter(相似性均达100%),5株(R20)为β-变形菌纲的Tetrathiobacter属(相似性达100%),119株属于γ-变形菌纲6个属Aeromonas(相似性100%)、Halomonas(相似性达100%)、Microbulbifer(相似性达99%)、Oceanimonas(相似性99%)、Photobacterium(相似性100%)和Pseudomonas(相似性达99%~100%)(图2)。Pseudomonas属细菌在3种土壤及不同季节中所占比例(28.90%~ 43.40%)明显高于其他属,为优势种群(表3)。从大米草与互花米草定植土壤以及光滩土壤中分别分离到属于11、16、12属SRB,其中Agromyces、Bacillus、Halomonas、Oceanimonas、Microbulbifer、Pseudomonas、Photobacterium、Rhizobium和Rhodobacter为3种土壤共有。从各土壤样品SRB的香农-威纳指数分析结果(表3)来看,SRB多样性大小为:大米草土壤>互花米草土壤>光滩,但是各取样点土壤中香农-威纳指数在不同季节变化不大。
2.3 SRB种群数量及结构的时空分布规律
盐沼湿地土壤SRB种群数量因定植植物品种、季节变化以及深度而改变,定植米草土壤的SRB种群数量明显高于光滩土壤(图3)。在大米草、互花米草定植的浅层土壤(0~5 cm)中,SRB种群数量分别在9、11月到达最高值,而在深层土壤(5~10 cm)中均于11月到达最高值,其中5—9月,大米草定植土壤中SRB种群数量明显高于互花米草定植土壤。
虽然Pseudomonas为3个样地的优势SRB类群,但不同采样地点土壤样品的亚优势SRB仍有一定差异,如大米草定植土壤、互花米草定植土壤、光滩土壤的亚优势种所属属别分别为Bacillus、Agromyces,Halomonas、Rhizobium,Rhizobium、Paracoccus(图4)。
同一季节、同一SRB类群在不同土壤样品中的分布比例也存在差异(图4)。例如在5月,优势类群Pseudomonas占互花米草定植土壤中总SRB的32.30%,较在大米草定植土壤、光滩土壤(约42%)约低10%;而Halomonas在互花米草定植土壤中的比例(26.70%)远高于大米草定值土壤(5.30%)、光滩土壤(5.30%)。9月的结果与5月类似,Pseudomonas在大米草定植土壤中的比例(43.40%)高于互花米草定植土壤(28.90%)、光滩土壤(34.00%);Halomonas在互花米草定植土壤中的比例(22.60%)远高于大米草定植土壤(5.90%)、光滩土壤(1.90%)。而到了11月,优势种群Pseudomonas在光滩土壤中的比例明显提高(38.60%),高于互花米草(31.70%)、大米草(31.8%)定植土壤中的比例。
SRB类群在不同土壤样品中的分布也存在一定的专化性,只存在于某一种或某几种土壤中(图4)。例如,Tetrathiobacter只分布于大米草定植土壤,而Aeromonas、Dietzia、Sporosarcina则只分布于互花米草定植土壤中。此外,Rhodococcus只分布于米草定植土壤中,Brachybacterium、Micrococcus、Paracoccus分布于互花米草定植土壤、光滩土壤中,但在大米草定植土壤中没有发现。
相同类型的SRB种群在同一土壤样地中分布比例随季节变化而改变(图4)。例如Pseudomonas属在5—9月是大米草定植土壤中的绝对优势种群,但其种群数量到11月明显降低,而Agromyces、Microbulbifer属则不断提高;在互花米草定植土壤中,Agromyces属细菌数量随季节变化而增加,而Rhodobacter则不断下降,作为优势种群的Pseudomonas在5、11月所占比例很高,在9月略有下降;在光滩土壤中,Agromyces、Pseudomonas在9月的比例低于5、11月,而Paracoccus、Rhizobium在9月的比例高于5、11月。上述结果显示,盐沼湿地SRB种群结构与数量随季节而呈动态变化,米草的定植显著改变了盐沼湿地生态系统中SRB的种群结构及数量。
3 讨论与结论
本研究利用选择性培养基以及16S rRNA基因序列分析,从米草定植以及光滩土壤中共分离获得210株可培养SRB,主要分属于变形菌门、厚壁菌门、放线菌门的17个属,其中Aeromonas、Bacillus、Dietzia、Halomonas、Micrococcus、Paracoccus、Pseudomonas、Rhizobium、Rhodobacter、Rhodococcus等属已有报道[20-27],且都在兼性厌氧条件下有硫酸盐还原活性,但Agromyces、Brachybacterium、Oceanimonas、Microbulbifer、Photobacterium、Sporosarcina、Tetrathiobacter等属未见报道,但经本试验研究表明,其可在培养基平板上产生H2S,具有硫酸盐还原活性,可能为新的SRB类群。
Pseudomonas为优势种群,这与房琳在十红滩铀矿床中分离的SRB优势种群[28]一致,该研究采用燃烧蜡烛法,不能完全去除容器中的氧,分离到一些兼性厌氧和微好氧SRB菌株,没有分离到如脱硫弧菌科(Desulfovibrionaceae)[4]、降硫细菌科(Desulfobacteriaceae)[29]等严格厌氧SRB。由美国材料实验协会(ATSM)标准D2863-2000(石蜡)可知,蜡烛燃烧的临界氧浓度为1.42~8.52 mg/L;张小里等研究表明,降硫弧菌属SRB能够耐受 4.5 mg/L的环境溶解氧浓度,而氧浓度到9.0 mg/L时不能存活[30],因此蜡烛燃烧法可以满足SRB生长的氧化还原电位要求。Desulfovibrio的比较基因组结果显示,该菌含有编码还原酶Cyd的基因,因此可以产生抗分子氧的保护酶,可以在微好氧条件下生长[31]。本研究分离到的Bacillus、Pseudomonas、Rhizobium、Paracoccus、Rhodobacter等属SRB中也检测到了相应分子氧的还原酶[32-36]。房琳在有大量含氧水的氧化带铀矿中也分离到厌氧SRB菌株[28]。这些结果表明,耐氧或微好氧SRB可能是盐沼湿地生态系统的重要成员,在驱动硫的化学循环中扮演着重要角色。
影响盐沼湿地土壤中SRB种群数量及分布的因素很多,如温度、土壤基质、植被等。Edgcomb等发现,SRB的种群数量、硫酸盐还原速率在8月以后达到峰值[37];Nie等发现,扬子江河口三角洲盐沼湿地硫酸盐还原菌种群多样性及数量在互花米草的生长后期(秋冬季)达到最高[38]。本研究进一步证明了盐沼湿地可培养SRB种群数量随季节变化较大,但季节对各个取样点中SRB的种群多样性影响不大。
通过比较不同深度土壤SRB数量,发现浅层土壤(0~5 cm)的SRB种群数量高于深层土壤(5~10 cm)。此外,土壤基质的性质也会对土壤中SRB种群产生一定的影响,例如土壤含水量、pH值、离子浓度、有机质含量等。大米草、互花米草定植土壤中的碳、氮、硫含量及SO42-浓度均明显高于光滩,这些营养元素及底物浓度的增加可能是导致米草定植土壤SRB种群结构和数量显著高于光滩土壤的主要原因。Wang等也报道了类似的现象,认为互花米草通过提高土壤中有机碳含量而促进SRB种群数量的增加[39]。土壤性质对硫酸盐还原菌的种群构成也有一定影响,大米草土壤含水量高于互花米草、光滩土壤,对应的Pseudomonas、Agromyces、Bacillus属的比例也较高;互花米草土壤中SO42-浓度明显高于大米草、光滩土壤,对应的Halomonas、Oceanimonas、Rhizobium属的比例也较高,这与不同种类微生物生长所需理化条件不同有关。据报道,海水及海岸盐沼湿地中典型SRB的最适pH值为7.0~7.8[40],而取样点土壤pH值为8.4左右,这就可能造成当地土壤酸碱度不适宜典型厌氧SRB生长,因此在本研究中未分离到。总之,射阳盐沼湿地土壤理化性质的特殊可能造成了该地SRB种群结构的特异性。
土壤微生物种群结构及数量还受到定植植物品种影响[41]。米草的定植一方面提高了SRB的种群数量,另一方面又使土壤SRB的种群多样性提高。不同种类米草定植对土壤中SRB种群结构影响不同,如互花米草定植后Aeromonas、Dietzia、Sporosarcina属才在土壤中出现,而Tetrathiobacter只存在于大米草土壤。又如,大米草定植使Bacillus属比例明显升高,而使Rhizobium属比例明显降低,互花米草定植使Halomonas属比例明显升高而使Micrococcus属比例明显降低。可见不同植物定植对不同的SRB种群有影响。不同植物的定植会影响土壤理化性质,从而形成特定的生境系统,进而影响微生物种群结构[42],因此不同类型米草的定植就形成了当地植物-土壤系统的特异性,从而综合影响SRB种群。
总之,盐沼湿地土壤中SRB种群数量及分布受多种因素的影响,植物种类、季节变化以及深度等都会影响其动态变化规律。今后有必要针对优势SRB类群,通过定量PCR技术和酶活检测技术,进一步评估盐沼湿地SRB在元素硫循环中的作用,探讨SRB的生态学效应。
参考文献:
[1]Castro H F,Williams N H,Ogram A. Phylogeny of sulfate-reducing bacteria1[J]. FEMS Microbiology Ecology,2000,31(1):1-9.
[2]Holmer M,Storkholm P.Sulphate reduction and sulphur cycling in lake sediments :a review[J].Freshwater Biology,2001,46(4):431-451.
[3]陈 效,孙立苹,徐 盈,等. 硫酸盐还原菌的分离和生理特性研究[J]. 环境科学与技术,2006,29(9):38-40.
[4]陈 涛,曹 毅,伊芬芬,等. 一株耐酸硫酸盐还原菌的分离筛选及生理特性研究[J]. 四川大学学报:自然科学版,2006,43(2):451-457.
[5]李新荣,沈德中. 硫酸盐还原菌的生态特性及其应用[J]. 应用与环境生物学报,1999(增刊1):10-13.
[6]吕 琴,陈中云,闵 航. 重金属污染对水稻田土壤硫酸盐还原菌种群数量及其活性的影响[J]. 植物营养与肥料学报,2005,11(3):399-405.
[7]孙翠霞,弓爱君,邱丽娜,等. 硫酸盐还原菌对环境的影响及其应用[J]. 腐蚀科学与防护技术,2006,18(3):196-198.
[8]Klepac-Ceraj V,Bahr M,Crump B C,et al. High overall diversity and dominance of microdiverse relationships in salt marsh sulphate-reducing bacteria[J]. Environmental Microbiology,2004,6(7):686-698.
[9]Teske A,Dhillon A,Sogin M L. Genomic markers of ancient anaerobic microbial pathways:sulfate reduction,methanogenesis,and methane oxidation[J]. The Biological Bulletin,2003,204(2):186-191.
[10]Widdel F,Bak F. Gram-negative mesophilic sulfate-reducing bacteria[M]//Balows A,Truper H G,Dworkin M,et al. The Prokaryotes. New York:Springer,1992:3352-3378.
[11]So C M,Young L Y. Isolation and characterization of a sulfate-reducing bacterium that anaerobically degrades alkanes[J]. Applied and Environmental Microbiology,1999,65(7):2969-2976.
[12]Hines M E,Evans R S,Genthner B R,et al. Molecular phylogenetic and biogeochemical studies of sulfate-reducing bacteria in the rhizosphere of Spartina alterniflora[J]. Applied and Environmental Microbiology,1999,65(5):2209-2216.
[13]Sigalevich P,Meshorer E,Helman Y,et al. Transition from anaerobic to aerobic growth conditions for the sulfate-reducing bacterium Desulfovibrio oxyclinae results in flocculation[J]. Applied and Environmental Microbiology,2000,66(11):5005-5012.
[14]沈永明,刘咏梅,陈全站. 江苏沿海互花米草(Spartina alterniflora Loisel)盐沼扩展过程的遥感分析[J]. 植物资源与环境学报,2002,11(2):33-38.
[15]刘光崧. 中国生态系统研究网络观测与分析标准方法[M]. 北京:中国标准出版社,1996.
[16]邱勋鹏,黄承玲,鄢建平. 间接光度法测定水和废水中硫酸盐[J]. 理化检验:化学分册,2003,39(12):711-712.
[17]孙智敏,张德强,孙汉文. 火焰原子吸收光谱法间接测定水中硫酸盐[J]. 理化检验:化学分册,2005,41(8):573-574.
[18]徐晓宇,闵 航,刘 和,等. 土壤微生物总DNA提取方法的比较[J]. 农业生物技术学报,2005,13(3):36.
[19]Blazejak A,Erséus C,Amann R,et al. Coexistence of bacterial sulfide oxidizers,sulfate reducers,and spirochetes in a gutless worm (Oligochaeta) from the Peru margin[J]. Applied and Environmental Microbiology,2005,71(3):1553-1561.
[20]Asaulenko L H,Abdulina D R,Purish L M. Taxonomic position of certain representatives of sulphate-reducing corrosive microbial community[J]. Mikrobiolohichnyǐ Zhurnal,2010,72(4):3-10.
[21]Nazina T N,Grigorian A A,Sue K F,et al. Phylogenetic diversity of aerobic saprotrophic bacteria isolated from the Daqing oil field[J]. Microbiology,2002,71(1):103-110.
[22]Zhou J M,Song Z Y,Yan D J,et al. Performance of a haloalkaliphilic bioreactor under different NO-3/SO2-4 ratios[J]. Bioresource Technology,2014,153(2):216-222.
[23]Vogel H,Bruschi M,Le Gall J. Phylogenetic studies of two rubredoxins from sulfate reducing bacteria[J]. Journal of Molecular Evolution,1977,9(2):111-119.
[24]Chen C,Ren N,Wang A,et al. Microbial community of granules in expanded granular sludge bed reactor for simultaneous biological removal of sulfate,nitrate and lactate[J]. Applied Microbiology and Biotechnology,2008,79(6):1071-1077.
[25]Kopriva S,Büchert T,Fritz G,et al. The presence of an iron-sulfur cluster in adenosine 5′-phosphosulfate reductase separates organisms utilizing adenosine 5′-phosphosulfate and phosphoadenosine 5′-phosphosulfate for sulfate assimilation[J]. The Journal of Biological Chemistry,2002,277(24):21786-21791.
[26]Medihala P G,Lawrence J R,Swerhone G D,et al. Effect of pumping on the spatio-temporal distribution of microbial communities in a water well field[J]. Water Research,2012,46(4):1286-1300.
[27]Koronelli T V,Komarova T I,Porshneva O V,et al. Extracellular metabolites of hydrocarbon-oxidizing bacteria as a substrate for sulfate reduction[J]. Prikladnaia Biokhimiia i Mikrobiologiia,2001,37(5):549-553.
[28]房 琳. 砂岩型铀矿不同矿带中可培养硫酸盐还原菌类群及其分布[D]. 西安:西北大学,2009.
[29]Jackson K L,Whitcraft C R,Dillon J G. Diversity of desulfobacteriaceae and overall activity of sulfate-reducing microorganisms in and around a salt pan in a southern California coastal wetland[J]. Wetlands,2014,34(5):969-977.
[30]张小里,刘海洪,陈开勋,等. 硫酸盐还原菌生长规律的研究[J]. 西北大学学报:自然科学版,1999,29(5):397-402.
[31]Ravcheev D A,Thiele I. Systematic genomic analysis reveals the complementary aerobic and anaerobic respiration capacities of the human gut microbiota[J]. Frontiers in Microbiology,2014,5:674.
[32]Larsson J T,Rogstam A,Von Wachenfeldt C. Coordinated patterns of cytochrome bd and lactate dehydrogenase expression in Bacillus subtilis[J]. Microbiology,2005,151(10):3323-3335.
[33]Cooper M,Tavankar G R,Williams H D. Regulation of expression of the cyanide-insensitive terminal oxidase in Pseudomonas aeruginosa[J]. Microbiology,2003,149(5):1275-1284.
[34]Lopez O,Morera C,Miranda-Rios J,et al. Regulation of gene expression in response to oxygen in Rhizobium etli:role of FnrN in fixNOQP expression and in symbiotic nitrogen fixation[J]. Journal of Bacteriology,2001,183(24):6999-7006.
[35]Otten M F,Stork D M,Reijnders W N,et al. Regulation of expression of terminal oxidases in Paracoccus denitrificans[J]. European Journal of Biochemistry/FEBS,2001,268(8):2486-2497.
[36]Roh J H,Kaplan S. Interdependent expression of the ccoNOQP-rdxBHIS loci in Rhodobacter sphaeroides 2.4.1[J]. Journal of Bacteriology,2002,184(19):5330-5338.
[37]Edgcomb V P,Mcdonald J H,Devereux R,et al. Estimation of bacterial cell numbers in humic acid-rich salt marsh sediments with probes directed to 16S ribosomal DNA[J]. Applied and Environmental Microbiology,1999,65(4):1516-1523.
[38]Nie M,Wang M,Li B. Effects of salt marsh invasion by Spartina alterniflora on sulfate-reducing bacteria in the Yangtze River estuary,China[J]. Ecological Engineering,2009,35(12):1804-1808.
[39]Wang M,Chen J K,Li B. Characterization of bacterial community structure and diversity in rhizosphere soils of three plants in rapidly changing salt marshes using 16S rDNA[J]. Pedosphere,2007,17(5):545-556.
[40]Vallero M V G,Lettinga G,Lens P N L. High rate sulfate reduction in a submerged anaerobic membrane bioreactor (SAMBaR) at high salinity[J]. Journal of Membrane Science,2005,253(1):217-232.
[41]Wardle D A,Bardgett R D,Klironomos J N,et al. Ecological linkages between aboveground and belowground biota[J]. Science,2004,304(5677):1629-1633.
[42]Kourtev P S,Ehrenfeld J G,Hggblom M. Exotic plant species alter themicrobial community structure and function in the soil[J]. Ecology,2002,83(11):3152-3166.张庆辉,刘兴旺,贺晓慧,等. 包头市南郊污灌区农田表层土壤镨的平面空间分布特征[J]. 江苏农业科学,2016,44(4):463-466.
