LSD1与冬凌草提取物相互作用的电化学研究
2016-06-03葛蓓蕾陈艳左菲菲姚珂徐少博徐霞
葛蓓蕾 陈艳 左菲菲 姚珂 徐少博 徐霞
(1.郑州大学 实验动物中心 河南 郑州 450052; 2.郑州大学 药学院 河南 郑州 450001)
LSD1与冬凌草提取物相互作用的电化学研究
葛蓓蕾1陈艳2左菲菲2姚珂2徐少博2徐霞2
(1.郑州大学 实验动物中心河南 郑州450052; 2.郑州大学 药学院河南 郑州450001)
【摘要】目的研究LSD1与冬凌草提取物的相互作用。方法在PH 7.40的缓冲液中,采用循环伏安法研究LSD1与冬凌草提取物(JD160和JD284)在不同条件下的相互作用。结果 在分别改变提取物浓度和扫描速率的条件下,提取物峰电流与提取物浓度和扫描速率均呈现良好的线性关系。在pH 7.40的缓冲液中,LSD1无峰电流出现,提取物有峰电流出现,且其电化学行为具有典型的不可逆特征。当LSD1逐渐加入到提取物中,二者发生作用,峰电流减小,峰电位负移。结论JD160和JD284均可与LSD1结合生成非电活性化合物,使电解液中游离化合物浓度降低。LSD1的加入使冬凌草提取物的氧化峰峰值电流减小。LSD1与JD160的相互作用可逆,与JD284不可逆。
【关键词】LSD1;冬凌草提取物;循环伏安法;峰值电流
组蛋白的表观遗传共价修饰主要包括甲基化、乙酰化、磷酸化等。其中,组蛋白的甲基化是研究较多的修饰方式。赖氨酸特异性组蛋白去甲基化酶(lysine specific demethylase 1,LSD1) 是2004年被发现的第1个可以催化组蛋白h1K4和h1K9去甲基化的特异性去甲基化酶[1]。近几年的研究发现,LSD1的活化过程与肿瘤细胞发生和发展相关,在前列腺癌、结肠癌、肺癌等肿瘤细胞中均发现了LSD1的高表达[2-4]。因此,LSD1一直被视为一个重要的和有前途的抗癌目标,新型LSD1抑制剂的研发也成了科研的热点。
冬凌草是一种多年生草本植物,主产地在河南省济源王屋山和太行山一带。当地人用于治疗食道癌已有30多年的历史[5]。冬凌草提取物已经广泛应用于治疗肠炎、关节炎、黄疸、蛔虫病、肝炎等病,先前的研究发现冬凌草中的二萜类化合物(如冬凌草甲素,冬凌草乙素)对人癌细胞有明显的抑制作用[6]。本研究选择新的冬凌草提取物JD160(图1A)和JD284(图1B),通过循环伏安法研究冬凌草提取物JD160和JD284与LSD1的相互作用。LSD1可以影响基因转录的激活和抑制,JD160和JD284与LSD1之间的相互作用可能会为LSD1抑制剂的研发提供一些重要的信息。
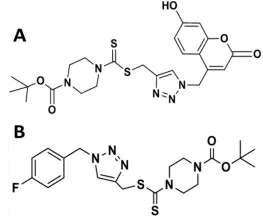
图1 JD160(A)和JD284(B)的分子结构
1实验部分
1.1试剂与仪器CHI-650A型电化学工作站(上海辰华仪器公司),电化学实验用三电极系统:碳电极为工作电极,饱和甘汞电极和铂电极分别作为参比电极和辅助电极。PHS-3C型酸度计(上海精密科学仪器有限公司),KQ-100型超声波清洗器(昆山市超声波仪器厂),LSD1(美国Sigma公司)用二次重蒸水配制成0.125×10-6mol/L储备液,-20 ℃冰箱保存。冬凌草提取物JD160和JD284(均为郑州大学药学院自制)溶于二甲基亚砜(DMSO,天津恒兴化学试剂有限公司)配成浓度为0.5×10-3mol/L的储备液,4 ℃冰箱保存。磷酸盐缓冲溶液(PBS,pH 4.0~6.86)备用,根据实际需要再稀释到所需的pH值,在pH计上校准。其它试剂均为分析纯或优级纯。实验用水为二次石英重蒸水。
1.2试验方法将碳电极在湿润的金相砂纸上磨光,然后用0.05 μm的Al2O3悬浮液抛光成镜面,并依次用无水乙醇、二次重蒸水超声波清洗,之后浸入到pH 7.4磷酸盐电解液中备用。实验在室温(25℃)下进行。
在2个10 ml容量瓶中以pH 7.40的PBS缓冲液为底液,分别加入一定量的JD160和JD284溶液,在改变提取物浓度和扫描速率的条件下分别测定相应的循环伏安曲线。在3个10 ml容量瓶中以pH 7.40的PBS缓冲液为底液,分别加入一定量的JD160和JD284溶液及LSD1溶液,然后在前两者中加入一定量的LSD1溶液,测定相应的循环伏安曲线。扫描速率100 mV/s,扫描范围1.0~2.0 V。
2结果
2.1提取物浓度对峰值电流的影响用循环伏安法测定提取物浓度与峰值电流的关系如图2所示。JD160和JD284浓度在1~8 μmol/L范围逐渐增加时,与峰电流之间呈现线性关系。JD160浓度与峰电流的关系式为y=0.077x+0.085,相关系数R2=0.998;JD284浓度与峰电流的关系式为y=0.025x+0.136,R2=0.999。根据测定结果,选取4 μmol/L的提取物用于下一步分析。


图2 JD160(左)和JD284(右)浓度与峰值电流的关系
2.2扫描速率对峰值电流的影响在pH 7.4的PBS电解液中,JD160和JD284在玻璃碳电极的CV图显示,峰值电流在第二周期减小,说明峰电流有吸附行为[7]。当扫描速率分别为20、50、100、150、200和250 mV/s,扫描范围为1~2 V时,得到的速率与电流的关系如图3所示。随着扫描速率增加,JD160和JD284的氧化电流增大,并呈现良好的线性关系。JD160的峰电流与扫速的关系式为y=31.06x+2.368,R2=0.999;JD284的峰电流与扫速的关系式为y=32.00x+0.789,R2=0.998。二者关系说明在一定的扫描速率区间内,提取物JD160和JD284在电极表面上的反应受吸附控制[8]。


图3 不同扫描速率对6.0 μmol/l的JD160(左)和JD284(右)峰值电流的影响
2.3提取物与LSD1的相互作用循环伏安法测定结果如图4所示。0.125×10-6mol/L的LSD1溶液在pH 7.4的PBS缓冲液中1.0~2.0 V的扫描范围内无峰电流出现。JD160和JD1284在pH 7.4的PBS缓冲液中有峰电流出现,且其电化学行为具有典型的不可逆特征[9]。当LSD1逐渐加入到JD160和JD1284中,二者相互作用,峰电流减小,峰电位负移,说明JD160和JD1284与LSD1发生了较强的作用。


a:0.125×10-6mol/L LSD1;b:4 μmol/L JD160 (JD284);c:4 μmol/L JD160 (JD284) +0.125×10-6mol/L LSD1;d:4 μmol/L JD160 (JD284) +0.25×10-6mol/L LSD1。
图4提取物JD160(左)和JD284(右)与LSD1的相互作用
2.4相互作用时间对峰值电流的影响反应时间与峰值电流变化的关系见图5。由左图可见,随着JD160与LSD1相互作用时间的增加,氧化电流开始下降,但二者作用到一定时间后,氧化电流逐渐增大。从电流减少转向增大发生在相互作用30 min到40 min之间。由此初步推断,LSD1与JD160可以结合生成非电活性化合物,且LSD1对JD160的抑制作用是可逆的。由右图可见,随着JD284与LSD1相互作用时间的增加,氧化电流开始下降,但二者作用15 min后,氧化电流基本保持稳定。由此推断LSD1对JD284的抑制作用可能是不可逆的。


图5 相互作用时间对JD160(左)和JD284(右)峰值电流的影响
2.5电化学参数的计算JD160和JD1284与LSD1相互作用前后的电子转移系数可以按照下列公式计算:
|Ep-Ep/2|= 0.056 5/n
Ep/2是半峰电位,n是电子转移常数。JD160和JD284的n值计算结果均为1。电子转移系数α是用来描述电极电势对阴阳极反应影响的程度,也是最动力学参数之一。根据Laviron理论[10]来估算α。
Ep=Eo-(RT/αnF)ln(αnF/RTK)-(RT/αnF)lnυ.
其中R是通用气体常数[8.314 J/(K·mol)],T是298K,F是法拉第常数(96487 C/mol),υ是扫描速率。JD160的Epa和lnυ的线性关系为Epa= 0.073 6lnυ +1.27,R2= 0. 990,结合以上公式计算出α值为0.348。JD284的Epa和lnυ的线性关系为Epa= 0.064lnυ +1.23,R2= 0.990, 得出α值为0.40。
3讨论
本文利用循环伏安法研究LSD1和冬凌草提取物之间的相互作用。结果表明,当LSD1逐渐加入到JD160和JD1284中时,二者相互作用,峰电流减小,峰电位负移,但随着作用时间的增加,氧化电流开始下降,继续作用到一定时间后,JD160氧化电流逐渐增大,JD1284氧化电流基本不变。这表明JD160和JD284可以与LSD1结合,生成非电化合物。LSD1对JD160的抑制是可逆的,对JD284的抑制不可逆。据此推测,LSD1与两种提取物作用的结果不同可能与提取物的结构和相互作用的机制有关。化学参数计算结果示,JD160和JD284的电子转移常数n为1,JD160和JD284电子转移系数α分别为0.348和0.40。
综上所述,我们成功地采用循环伏安法对LSD1与提取物的作用进行了测定,实验结果证实该方法具有良好的灵敏度及选择性,有良好的应用前景。本实验也为新型LSD1抑制剂的研发提供了思路。
参考文献
[1]Shi Y,Lan F,Matson C,et al.Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J].Cell,2004,119(7):941-953.
[2]Cai C,He H H,Chen S,et al.Androgen receptor gene expression in prostate cancer is directly suppressed by the androgen receptor through recruitment of lysine-specific demethylase 1[J].Cancer Cell,2011,20(4):457-471.
[3]Pollock J A,Larrea M D,Jasper J S,et al.Lysine-specific histone demethylase 1 inhibitors control breast cancer proliferation in ERα-dependent and -independent manners[J].ACS Chem Biol,2012,7(7):1221-1231.
[4]Lim S,Janzer A,Becker A,et al.Lysine-specific demethylase 1 (LSD1) is highly expressed in ER-negative breast cancers and a biomarker predicting aggressive biology[J].Carcinogenesis,2010,31(3):512-520.
[5]Tang J,Zhao M,Wang Y,et al.One single HPLC-PDA/(-)ESI-MS/MS analysis to simultaneously determine 30 components of the aqueous extract of Rabdosia rubescens[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(26):2783-2793.
[6]刘静,梁敬钰,谢韬.冬凌草研究进展[J].海峡药学,2004,16(2):1-7.
[7]王辰,付艳丽,王振.环境激素双酚A与蛋白质相互作用的电化学研究[J].云南民族大学学报(自然科学版),2011,20(2):92-95.
[8]廖天录,赵强.红霉素与DNA相互作用的电化学研究[J].大庆师范学院学报,2011,31(6):45-47.
[9]刘德龙,吴彦环,郭慧芳.钙调素与重金属Pb2+结合反应的方波极谱与循环伏安法研究[J].高等学校化学学报,2009,30(11):2154-2158.
[10]Dai H,Yang C,Tong Y,et al.Label-free electrochemiluminescent immunosensor for α-fetoprotein: performance of Nafion-carbon nanodots nanocomposite films as antibody carriers[J].Chem Commun(Camb),2012,48(25):3055-3057.
Electrochemical detection of lysine specific demethylase 1(LSD1) and Rabdosia extracts
Ge Beilei1, Chen Yan2, Zuo Feifei2, Yao Ke2, Xu Shaobo2, Xu Xia2
(1.TheLaboratoryAnimalCenter,ZhengzhouUniversity,Zhengzhou450052,China;2.SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001,China)
【Abstract】ObjectiveTo screen the interaction of lysine specific demethylase 1(LSD1) and Rabdosia extracts. MethodsIn pH 7.4 buffer, the interaction of LSD1 and Rabdosia extracts (JD160 and JD284) was detected by cyclic voltammetry under different conditions. ResultsWhen changing extract concentration and scan rate respectively, the peak current of extract showed good linear relationship with the extract concentration and scan rate. In pH 7.40 buffer, no peak current of LSD1 appeared, while the peak current of extract appeared, and the electrochemical behavior was typically irreversible. When adding LSD1 into the extract gradually, the peak current obviously decreased, and there was a negative shift in the oxidation peak of extracts. ConclusionBoth JD160 and JD284 can be combined with LSD1 to generate non-electric complexes, which led to a decrease in the free drug concentration in the solutions. From changes to the reduction and oxidation currents, it can be concluded that the inhibition of JD160 against LSD1 is reversible, whereas JD284 is irreversible.
【Key words】lysine specific demethylase 1; Rabdosia extracts; cyclic voltammetry; peak current
(收稿日期:2015-10-27)
【中图分类号】R 915
doi:10.3969/j.issn.1004-437X.2016.04.004
基金项目:河南省教育厅科学技术研究重点项目(13A350598)。
