清肝解毒胶囊的质量标准研究
2016-05-28林兰兰黄木土谢新民韩丽萍
林兰兰,黄木土,谢新民,陈 强,韩丽萍
(广州军区广州总医院药剂科,广州 510010)
清肝解毒胶囊的质量标准研究
林兰兰,黄木土*,谢新民,陈强,韩丽萍
(广州军区广州总医院药剂科,广州510010)
摘要:目的建立清肝解毒胶囊的质量标准。方法对清肝解毒胶囊中的黄芪、大黄、赤芍和柴胡采用薄层色谱法定性鉴别;对清肝解毒胶囊中蒽醌类成分的含量采用高效液相色谱法测定,以大黄素、大黄酸和大黄酚进行总量计算。结果薄层鉴别项斑点清晰,分离度较好,阴性无干扰。大黄素峰面积在2.864~143.2 μg·mL-1范围内呈良好的线性关系(r=0.999 9,n=7);大黄酸峰面积在3.544~177.2 μg·mL-1范围内呈良好的线性关系(r=0.999 8,n=7);大黄酚峰面积在3.984~199.2 μg·mL-1范围内呈良好的线性关系(r=0.999 9,n=7)。大黄酸的平均加样回收率达99.0%,RSD为1.42%;大黄素的平均加样回收率达99.5%,RSD为0.88%;大黄酚的平均加样回收率达101.9%,RSD为1.99%。结论该方法专属性强、稳定性好、重复性好、加样回收符合含量测定要求。
关键词:大黄;清肝解毒胶囊;薄层色谱法,HPLC
清肝解毒胶囊是由柴胡、制大黄、赤芍、黄芪等11种中药制备而成,其功效为健脾补肾、清肝解毒、活血化瘀[1],主要对乙型肝炎病毒携带者、病毒性肝炎等病症有疗效。为了更加全面地鉴别大黄,为制剂生产提供稳定的工艺,在原有大黄酸鉴别的基础上增加了对大黄素和大黄酚的鉴别,增强了大黄鉴别的专属性。研究结果表明,大黄中的游离蒽醌类化合物在人体代谢中有重要的作用,尤其是在清除毒素方面的效果显著,在肾脏病和肝功能方面的治疗有着独特的药效[2],本质量标准增加了对产品中蒽醌类成分的含量测定。
1仪器与试药
1.1仪器BP211D型电子天平(德国赛多利斯股份公司);HWS28型电热恒温水浴箱(上海恒科仪器有限公司);Agilent 1100 Series高效液相色谱仪(安捷伦科技有限公司);KPQ-1200型超声波清洗器(广州科普有限公司,超声功率为1 200 W);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司)。
1.2试药大黄酚(批号110796-201118)、大黄酸(批号110757-200206)、大黄素(批号110756-200110)、黄芪甲苷(批号110781-200613)、柴胡对照药材(批号120992-201108),以上对照品均由中国药品生物制品检定所提供;清肝解毒胶囊(医院自制,批号分别为13J07001,150226,150302);甲醇,色谱纯;水,双重蒸馏水;其他试剂均为分析纯。
2方法与结果
2.1薄层鉴别2.1.1大黄取清肝解毒内容物2 g,加入30 mL甲醇,置于水浴锅上加热回流30 min,过滤,滤液在水浴锅上蒸干;加水20 mL溶解残渣,过滤,滤液加3 mL盐酸,在水浴锅上加热回流30 min,冷却;转移到分液漏斗中,用乙醚振摇提取3次,每次20 mL,合并乙醚溶液,置于水浴锅上蒸干,加入1 mL二氯甲烷溶解残渣[3],为供试品溶液。取对照品大黄酚、大黄素和大黄酸适量,加适量二氯甲烷试剂制得1 mL含大黄酸、大黄素、大黄酚各0.5 mg的混合对照品溶液。另制大黄阴性样品并取其2 g,按照上述方法制备大黄阴性样品液。按照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)实验,取上述样品液10 μL、阴性液10 μL、混合对照品液5 μL,分别点在同一硅胶G薄层板上,展开剂为石油醚(60~90 ℃)甲酸乙酯-甲酸(15∶5∶1)的上层溶液,展开,展距约为8 cm,取出,晾干,用浓氨试液熏蒸至斑点清晰,在肉眼可见光下检视[4]。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,并且阴性样品无相应斑点。薄层色谱结果表明,其他药材对大黄中大黄酸(Rf=0.23)、大黄素(Rf=0.35)和大黄酚(Rf=0.77)的鉴别无影响。见图1。
2.1.2黄芪取清肝解毒内容物约10 g,加30 mL甲醇,在水浴锅上加热回流30 min,过滤,滤液蒸干,加20 mL水溶解残渣,过滤。滤液分别用30,20和10 mL水饱和的正丁醇提取 3次。合并水饱和正丁醇液,再用20,20和10 mL氨试液洗涤 3次。将正丁醇液蒸干,加1 mL甲醇溶解残渣,作为供试品溶液。取黄芪甲苷对照品适量制成质量浓度为1 mg·mL-1的对照品溶液。另制黄芪阴性样品并取其10 g,按照上述方法制备黄芪阴性样品溶液。按照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)实验,取上述供试品溶液10 μL、阴性溶液10 μL、对照品溶液5 μL,分别点在同一硅胶G薄层板上,展开剂为醋酸乙酯-丁酮-甲醇-水 (5∶3∶1∶1)上层溶液,展开,展距约为8 cm时取出,晾干,喷100 mL·L-1的硫酸乙醇溶液,在烘箱加热到斑点清晰,检视。供试品色谱中,在与对照品色谱相应的位置(Rf=0.29)上,显相同颜色的斑点,并且阴性样品无相应斑点。薄层色谱结果表明,其他药材对黄芪甲苷鉴别无干扰。见图2。

图1大黄薄层色谱鉴别
1.阴性;2.混合对照(自下到上)大黄酸、大黄素、大黄酚;3~5.样品(13J07001,150226和150302)
Fig.1 TLC identification of rhubard
1.negative;2.mixed reference substance (from bottom to top)rhubarb;emodin;chrysophanol;3-5.samples(13J07001,150226 and 150302)
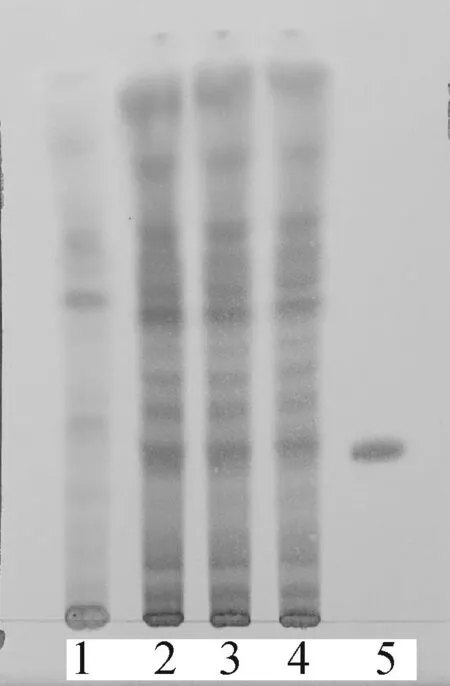
图2黄芪甲苷薄层色谱鉴别 1.阴性;2~4.样品(13J07001,150226和150302);5.黄芪甲苷
Fig.2 TLC identification ofRadixastragali1.negative; 2-4.samples(13J07001,150226 and 150302);5.astragalus saponins
2.1.3赤芍取清肝解毒内容物约10 g,加体积分数为70%的乙醇20 mL,置于超声仪中超声30 min,过滤,滤液置于水浴锅上蒸干,加20 mL水溶解残渣,过滤。滤液分别用30,20和10 mL水饱和的正丁醇提取 3次,合并提取液,用20,20和10 mL氨试液洗涤 3次。正丁醇提取液置于水浴上蒸干,加1 mL甲醇溶解残渣,为供试品溶液。取芍药苷对照品适量制成质量浓度为1 mg ·mL-1的对照品溶液。另制赤芍阴性样品并取其10 g,按照上述方法制成赤芍阴性样品溶液。按照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)实验,取上述供试品溶液10 μL、阴性样品液10 μL、对照品溶液5 μL,分别点在同一硅胶G薄层板上,展开剂为醋酸乙酯-丁酮-甲醇-水(5∶3∶1∶1)上层溶液,展开,展距约8 cm,取出并晾干,喷100 mL·L-1硫酸乙醇液,置于烘箱加热至斑点清晰,检视。供试品色谱中,在与对照品色谱相应的位置(Rf=0.66)上,显相同颜色的斑点,并且阴性样品无相应斑点。薄层色谱结果表明,其他药材对赤芍鉴别无影响。见图3。

图3赤芍薄层色谱鉴别
1.阴性;2~4.样品(13J07001,150226和150302);5.芍药苷
Fig.3 TLC identification ofRadixpaeoniaerubra1.negative; 2~4.samples(13J07001,150226 and 150302);5.herbaceous peony
2.1.4柴胡取清肝解毒内容物约10 g,加30 mL水,置于水浴锅上加热回流1 h,过滤,过滤液用30,20和10 mL水饱和的正丁醇提取 3次,合并提取液,用20和10 mL氨试液洗涤 2次,将正丁醇提取液置于水浴上蒸干,加1 mL甲醇溶解残渣,为供试品溶液。取0.5 g柴胡对照药材,按照上述方法制备对照药材溶液。另制柴胡阴性样品并取其10 g,按照上法制备柴胡阴性样品溶液。按照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)实验,取供试品液10 μL、柴胡阴性样品液10 μL、对照药材液10 μL,分别点在同一硅胶G薄层板上展开剂为醋酸乙酯-乙醇-水 (8∶2∶1),展开,展距约8 cm,取出并晾干,喷10 g·L-1对二甲氨基苯甲醛硫酸-乙醇(1→10)液,在70 ℃烘箱中加热至斑点清晰,置于日光和紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置(Rf=0.44)上,显相同颜色的斑点,并且阴性样品无相应斑点。薄层色谱结果表明,其他药材对柴胡鉴别无影响。见图4~5。

图4柴胡薄层色谱鉴别(日光)
1.阴性;2~4.样品(13J07001,150226和150302);5.柴胡对照药材
Fig.4 TLC identification ofRadixbupleuri(sunlight) 1.negative;2-4.samples(13J07001,150226 and 150302);5.Radixbupleurireference medicinal meterials

图5柴胡薄层色谱鉴别(365 nm)
1.阴性;2~4.样品(13J07001,150226和150302);5.柴胡对照药材
Fig.5 TLC identification ofRadixbupleuri(365 nm)
1.negative;2-4.samples(13J07001,150226 and 150302);
5.Radixbupleurireference medicinal meterials
2.2含量测定
2.2.1色谱条件填充剂:十八烷基硅烷键合硅胶;流动相:甲醇-2 mL·L-1磷酸液(85∶15);检测波长:430 nm;流速:1.0 mL·min-1;柱温:30 ℃[5]。理论塔板数按照大黄素峰计算应不低于3 000。
2.2.2对照品储备液制备分别精密称取大黄素(110756-200110)、大黄酸(110757-200206)和大黄酚(110796-201118)对照品7.16,8.86和9.96 mg,置于50 mL量瓶中,加甲醇稀释至刻度,摇匀,制得含大黄素、大黄酸和大黄酚分别为143.2,177.2和199.2 μg·mL-1的储备液。2.2.3供试品溶液制备取清肝解毒内容物3.0 g,精密称定, 置于具塞三角瓶中,精密加入甲醇50 mL,称定质量,置于水浴锅上加热回流1 h,取出,放至室温,再称定质量,用甲醇补足减失的质量,摇匀,立即过滤,精密移取10 mL续滤液至烧瓶中,挥干溶剂,加入稀盐酸20 mL,超声2 min,加入氯仿20 mL,加热回流1 h,放冷,置于分液漏斗中,分取氯仿层,再加氯仿萃取3次,每次20 mL,合并氯仿层,挥干溶剂,用甲醇溶解残渣[6]并定容至25 mL,即得供试品溶液。
2.2.4阴性对照溶液取不含大黄的阴性样品3.0 g,按照供试品溶液制备方法制成阴性对照溶液。
2.2.5线性关系考察精密吸取对照品储备液适量,制成含有大黄素质量浓度分别为2.864,5.728,14.320,22.912,28.640,34.368和143.2 μg·mL-1;大黄酸质量浓度为3.544,7.088,17.720,28.352,35.44,42.528和177.2 μg·mL-1;大黄酚质量浓度为3.984,7.968,19.920,31.872,39.840,47.808和199.2 μg·mL-1的对照品溶液[7]。依次加入高效液相色谱仪中,测定各峰面积。以纵坐标为峰面积(Y)、横坐标为质量浓度(X),进行线性回归,结果:大黄素回归方程为Y=24.409X-25.313,r=0.999 9(n=7);大黄酸回归方程为Y=20.963X-34.499,r=0.999 8(n=7);大黄酚回归方程为Y=21.779X-11.327,r=0.999 9(n=7)。结果表明,大黄素在质量浓度2.864~143.2 μg·mL-1、大黄酸在质量浓度3.544~177.2 μg·mL-1、大黄酚在质量浓度3.984~199.2 μg·mL-1范围内,与峰面积呈良好线性关系。
2.2.6专属性实验精密量取供试品溶液、对照品溶液和阴性对照溶液各10 μL,分别加入高效液相色谱仪中,记录色谱图,见图6。从色谱图中可见,在供试品液色谱中与对照品溶液色谱相应位置上具有相同保留时间的色谱峰,并且阴性对照溶液在此保留时间上没有相应的色谱峰出现,实验结果表明,该制剂中的其他药材对大黄酸、大黄素和大黄酚的含量测定无干扰,阴性对照溶液对大黄酸、大黄素和大黄酚的含量测定无干扰,该方法专属性强。

图6HPLC图
A.混合对照品;B.清肝解毒胶囊样品;C.阴性对照;
1.大黄酸;2.大黄素;3.大黄酚
Fig.6 HPLC chromatograms
A.mixed reference substances;B.the sample of Qingganjiedu Capsules;C.negative;. 1.rhubarb; 2.emodin; 3. chrysophanol
2.2.7精密度实验精密量取10 μL混合对照品溶液,加入高效液相色谱仪中,重复进样5次并测定其峰面积。结果显示,大黄素RSD为0.06 %(n=5),大黄酸RSD为0.19 %(n=5),大黄酚RSD为0.08%(n=5),表明高效液相仪器有良好的精密度。
2.2.8稳定性实验取供试品溶液适量,分别在第0,2,4,8,12和24 h时进样,测定峰面积。结果显示,大黄素RSD为1.04 %(n=6),大黄酸RSD为1.20%(n=6),大黄酚RSD为1.66 %(n=6),表明供试品溶液在24 h内比较稳定。
2.2.9重复性实验取3.0 g同一批号的样品6份(批号13J07001),制备供试品溶液并测定其峰面积。结果显示,样品中大黄酸、大黄素和大黄酚的平均含量分别为0.048%,0.455%和0.112%,大黄酸RSD为1.57 %(n=6),大黄素RSD为0.60 %(n=6),大黄酚RSD为1.20 %(n=6),表明本方法重复性好。
2.2.10加样回收率实验分别精密称取1 g已知含量样品6份(批号140328),取其中5份分别精密加入对照品大黄酸430.00 μg、大黄素2 979.20 μg和大黄酚1 000.94 μg,按照供试品溶液的制备方法制备溶液,并测定其含量,计算回收率。计算出大黄酸的平均加样回收率达99.0%,RSD为1.42%;大黄素的平均加样回收率达99.5%,RSD为0.88%;大黄酚的平均加样回收率达101.9%,RSD为1.99%,表明此方法加样回收率达到含量测定的要求。结果见表1。2.2.11样品含量测定取3批样品各3.0 g,精密称定,按照供试品的制备方法制备样品液,测其峰面积并计算本品蒽醌类的含量。3批样品含大黄酸、大黄素和大黄酚的总量分别为0.615%,0.584%和0.610%。
表1加样回收率实验结果
Tab.1 Results of recovery experiment

(n=5)
3讨论
清肝解毒胶囊为我院自制药品,本实验采用薄层色谱法对清肝解毒胶囊中的黄芪、大黄、赤芍和柴胡进行定性鉴别,在原有只对大黄中大黄酸鉴别的基础上,增加了大黄素和大黄酚的鉴别,薄层色谱结果表明,其他药材对大黄中大黄酸(Rf=0.23)、大黄素(Rf=0.35)和大黄酚(Rf=0.77)的鉴别无影响。大黄素和大黄酚在薄层展开中斑点明显并清晰可见,分离度较好,且无相互干扰,具有比较好的重复性,进一步增强了大黄鉴别的专属性,对清肝解毒胶囊的质量具备了比较好的可控性。
在含量测定项中,采用HPLC法对清肝解毒胶囊的蒽醌类进行含量测定,并进行了方法学考察,以甲醇-2 mL·L-1磷酸(85∶15)为流动相,分离效果好,峰形对称,保留时间适宜,杂质峰达到基线分离,阴性无干扰,通过方法学验证考察,本品的含量测定成分线性关系良好,平均回收率较高,蒽醌类成分含量的测定方法专属性强、精密度高、线性关系良好,可作为清肝解毒胶囊的质量控制方法。
参考文献:
[1]程小丽,魏胜利,刘春生,等.RP-HPLC-DAD同时测定大黄中9种有效成分的含量[J].中国实验方剂学杂志,2013,19(18):99.
[2]熊兴富.中药大黄主要有效成分药理学研究进展[J].中医临床研究,2014,6(10):143-145.
[3]金兰.大黄的药理作用及临床应用进展[J].中国医药指南,2013,11(11):487.
[4]王惠川,张爱军,王华丽.茵陈大黄颗粒的质量标准研究[J]. 西北药学杂志,2008,23(5):288-289.
[5]董昌平.大黄微粉胶囊质量标准研究[J].海峡药学,2014,26(10):70-71.
[6]国家药典委员会. 中国药典2010年版[S]. 一部.北京:中国医药科技出版社,2010:22.
[7]何素琴,欧阳吉德,肖琳.HPLC法测定胆石通胶囊中芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚的含量[J].西北药学杂志,2011,26(3):181-182.
[8]祝忠民,卢晓荣.HPLC法同时测定三黄片中4种成分的含量. [J].西北药学杂志,2008,23(5):300-301.
Research on the quality standard for Qingganjiedu Capsules
LIN Lanlan,HUANG Mutu*,XIE Xinmin,CHEN Qiang,HAN Liping
(Department of Pharmacy,Guangzhou General Hospital of Guangzhou Military Command,Guangzhou 510010,China)
Abstract:ObjectiveTo establish the quality standard for Qingganjiedu Capsules. MethodsRadix Astragali,Rhubarb,Radix paeoniae rubra,Radix Bupleuri were identified by TLC. The contents of the constituents in the preparation were determined by HPLC,and the total amount of emodin,rhubarb and chrysophanol were calculated. ResultsThe spots from the test solutions on the thin layer plate were clear and the negative solution had no interference. The experiment showed good linear relationship in the range of 2.864-143.2 μg·mL-1for emodin (r=0.999 9,n=7).The experiment showed good linear relationship in the range of 3.544-177.2 μg·mL-1for rhubarb (r=0.999 8,n=7).The experiment showed good linear relationship in the range of 3.984-199.2 μg·mL-1for chrysophanol(r=0.999 9,n=7).The average recovery of rhubarb was 99.0%.RSD=1.42%.The average recovery of emodin was 99.5%,RSD=0.88%.The average recovery of chrysophanol was 101.9%,RSD=1.99%. ConclusionThe established methods are highly specific,stable, and reproducible.which can be used to control the quality of Qingganjiedu Capsules.
Key words:Rhubarb;Qingganjiedu Capsules;TLC;HPLC
(收稿日期:2015-07-17)
中图分类号:R284
文献标志码:A
文章编号:1004-2407(2016)03-0231-05
doi:10.3969/j.issn.1004-2407.2016.03.004
*通信作者:黄木土,男,药师,硕士研究生
作者简介:林兰兰,女,药师
基金项目:军队医疗机构制剂标准提高计划项目(编号:14ZJZ15-3); 广州市科技计划项目(编号:201509010012)
