人羊膜间充质干细胞培养方法的改进*
2016-05-27崔冬冰范安然何志旭
崔冬冰, 范安然, 何志旭
(贵州医科大学 组织工程与干细胞实验中心, 贵州 贵阳 550004)
人羊膜间充质干细胞培养方法的改进*
崔冬冰, 范安然, 何志旭**
(贵州医科大学 组织工程与干细胞实验中心, 贵州 贵阳550004)
[摘要]目的: 建立一种高效分离培养人羊膜间充质干细胞的方法。方法: 分别用酶消化法、传统组织块贴壁法和改进的组织块贴壁法分离出hAMSCs,观察3种方法所获得hAMSCs细胞形态、获得时间,流式细胞学检测其免疫表型;并用不同的诱导体系将hAMSCs向成骨细胞、成神经细胞进行诱导分化,鉴定其分化潜能。结果: 改进的组织块贴壁法获得hAMSCs细胞的纯度更高,传代次数更多,相同的培养时间里,获得的细胞数量是酶消化法的3~4倍,是传统组织块贴壁法的1~2倍;hAMSCs细胞高表达CD73、CD90、CD44和CD105,不表达CD11b、CD19、CD34、CD45、HLA-DR;茜素红染色和神经元特异性烯醇化酶检测证实hAMSCs细胞可诱导分化为成骨细胞和神经细胞。结论: 改进的hAMSCs分离培养方法可获得较大数量细胞,且保留了向神经细胞或成骨细胞可分化潜能。
[关键词]人羊膜间充质干细胞; 细胞培养; 鉴定; 诱导
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有高度增殖和多向分化潜能的成体干细胞,来源广泛,可从多个器官或组织中分离获得,因具有低免疫原性等特点,而成为细胞疗法的主要种子细胞,有着广阔的应用前景[1]。目前已从骨髓、脂肪、肌肉、肺、肝、胰腺、羊水、胎盘[2-3]、脐血等组织或器官中分离获得MSCs,胎盘的羊膜组织取材方便、易于分离获得MSCs,不受伦理学限制,MSCs含量丰富等优势受到研究者的青睐。目前,人羊膜间充质干细胞(human amnionmesenchymal stem cells,hAMSCs)的原代培养常采用酶消化法和传统的组织块贴壁法,但常常会因为操作时间长或是组织块不能贴壁而影响hAMSCs的得率。因此,分离方法进行了改进,以求建立一种高效的本实验对hAMSCs的分离培养方法。
1材料与方法
1.1标本
羊膜组织取自健康足月新生儿剖宫产手术后,经家属和产妇知情同意并签署《胎盘处理协议书》后捐献所得。
1.2主要材料与仪器
L-DMEM(美国Gibco公司)、胎牛血清FBS(美国Hyclone公司)、0.25%胰蛋白酶(美国Hyclone公司)、1 g/L Ⅱ型胶原酶(美国Hyclone公司)及双抗(青-链酶素混合液,美国Gibco公司)、Human MSC Analysis Kit(BD 562245)透气式细胞培养瓶(NEST)、细胞计数板、超净工作台(苏州净化)、CO2细胞培养箱( 美国Thermo)、流式细胞仪(美国 Backman MoFlo XDP)、倒置显微镜(Nikon TE-2000)、低温冷冻离心机(德国eppendorf 5810)及正置显微镜(美国Leica)。
1.3hAMSCs分离和培养无菌条件下剥离靠近脐带处的羊膜组织, NS清洗并转移至青霉素小瓶中,眼科剪剪成直径约2.0 mm的组织块。(1)酶消化法:在组织中加入1 g/L Ⅱ型胶原酶,37 ℃,12 h,然后再加入0.25%胰蛋白酶,37 ℃,15 min,吸出上清并加入培养液(L-DMEM+10%FBS+1%双抗)混匀, 1 000 r/min,3 min,沉淀用培养液重悬,转入T75细胞培养瓶,37 ℃ 5% CO2培养箱中培养,隔日换液。(2)传统组织块贴壁法:将组织块放入T75培养瓶中,每瓶放置10~12个,间隔0.5 cm,然后加入培养液培养,隔日换液。待见有细胞从组织块周围爬出时,隔日换液。(3)改进组织块贴壁法:将组织块放入T75培养瓶中,拧松瓶盖,垂直地放在超净工作台上,干燥1~2 h后,加入培养液培养,隔日换液。
1.4观察指标
1.4.1细胞生长情况从第3日起每日进行观察,包括细胞出现的时间、细胞形态、细胞达到90%融合所需的时间,计数P1代hAMSCs培养第15天时的细胞数量。
1.4.2免疫表型鉴定按照流式检测试剂盒使用说明操作,检测P3代hAMSCs细胞膜表面分子:CD73-APC、CD90-FITC、CD44-PE、CD105-Cy5.5和CD11b-PE、CD19-PE、CD34-PE、CD45-PE、HLA-DR-PE。
1.4.3分化潜能及鉴定取P3代hAMSCs细胞按2.0×103/cm2接种于六孔板中,并用神经细胞诱导剂(H-DMEM、 2% DMSO、200 μmoL/L丁羟基茴香醚)和成骨诱导剂(H-DMEM培养基、10 mmoL/L β-甘油磷酸钠、50 mg/L 维生素C、10-8moL/L地塞米松)将hAMSCs分别向神经细胞和成骨细胞进行诱导培养,并用免疫组化法检测神经元特异性烯醇化酶(neuron-specific enolase,NSE)和成骨结节。以未行诱导的hAMSCs作为对照。
1.5统计学方法
2结果
2.1细胞生长情况
2.1.1酶消化法接种后6 h左右有少量hAMSCs细胞贴壁,第3天可见细胞呈长梭形或多角形生长(图1-A),细胞融合达90%需要约18 d,传代后细胞生长速度变缓,P1代培养第15天每T25培养瓶细胞计数为(3.8±0.28)×103个(表1,图1-B)。
2.1.2传统组织块贴壁法接种第15天可见有组织块周围有少量hAMSCs细胞爬出,形态以梭形为主(图1-C),细胞融合达到90%需要约25 d,P1代培养第15天每T25培养瓶细胞计数为(10.3±0.50)×103个(表1,图1-D)。
2.1.3改进组织块贴壁法接种第10天可见hAMSCs细胞爬出,形态特征同上(图1-E),细胞融合达到90%需18 d,传代细胞增殖迅速,P1代培养第15天每T25培养瓶细胞计数为(21.5±0.52)×103个(表1,图1-F)。
2.2免疫表型鉴定
流式细胞学检测结果显示(图2),CD73和CD90表达量为97%、CD44和CD105表达量为95.4%;CD11b、CD19、CD34、CD45、HLA-DR分子表达量为0.02% 。

注:A为酶消化法原代培养第3天;B为酶消化法P1代培养第15天;C为传统组织块贴壁法原代培养第15天;D为传统组织块贴壁法P1代培养第15天;E为改进组织块贴壁法原代培养第10天;F为改进组织块贴壁法P1代培养第15天图1 hAMSCs的生长情况(×100)Fig.1 The growth situation of hAMSCs
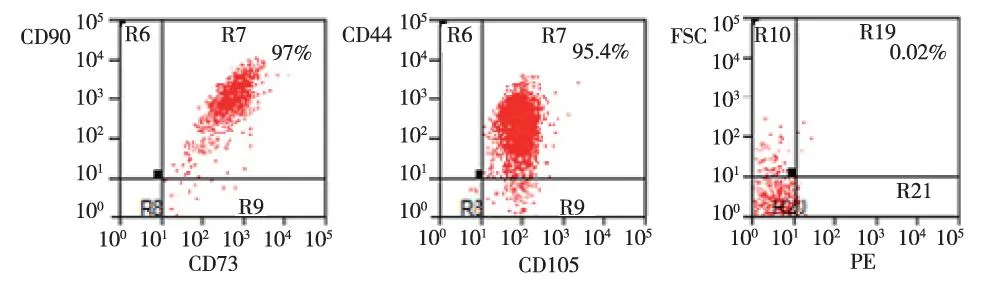
图2 第3代hAMSCs细胞表面分子(流式细胞)Fig.2 The flow cytometry detection of 3rd generation hAMSCs
2.3分化潜能鉴定
2.3.1hAMSCs向神经细胞诱导分化hAMSCs向神经细胞诱导4 h后,细胞形态上由长梭形变成三角形或多角形,并且有多个神经轴突,NSE检测,DAB染色为黄色,表明hAMSCs具有向神经细胞分化的能力(图3-B)。
2.3.2hAMSCs向成骨细胞诱导分化向成骨细胞诱导14 d后,细胞汇合聚集后呈多层重叠生长,形成成骨细胞特有的矿化结节,周围折光性增强,茜素红染色呈红色,表明hAMSCs具有向成骨细胞分化的能力(图3-C)。
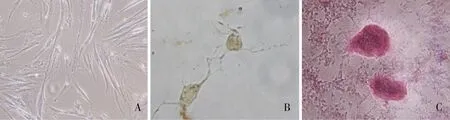
注:A为对照组(100×),B为向神经细胞诱导28 h(DAB,×400),C为向成骨细胞诱导14 d染色(茜素红,×40)图3 hAMSCs诱导分化情况Fig.3 Differentiation experiment of hAMSCs

细胞生长特点hAMSCs酶消化法传统组织块贴壁法改进组织块贴壁法细胞出现时间(d)3.00±0.2215.00±0.3210.00±0.44原代达到90%融合的时间(d)18.00±0.4525.00±0.2420.00±0.13P1代培养15d细胞数量(×103个)3.80±0.2810.30±0.5021.50±0.52
注:组间比较P<0.05
3讨论
目前,关于hAMSCs的分离培养方法,文献报道中各不相同,但主要包括酶消化法和组织块法,这两种方法分离培养出的MSCs形态特征、生长曲线、细胞表面标记物等无明显差异。但各有利弊,酶消化法成本较高,操作比较繁琐,污染概率大;消化过程时间过短,细胞很难爬出;消化时间过长易损伤细胞,影响细胞的增殖传代能力[4]。
本研究通过采用酶消化法、传统组织块法和改进组织块贴壁法从人胎盘羊膜中成功分离、培养出hAMSCs,观察发现,酶消化法虽能在短时间内获得细胞,但混有较多的杂细胞,消化时间难以控制,传代后细胞不易贴壁,影响其增殖能力,相同的传代培养时间能获得的细胞数量较少。传统组织块贴壁法会有大量的组织块不能紧贴在培养瓶底部,而已经爬出的细胞,由于数量少,不具备传代的条件,长时间培养容易致细胞分化,相同的传代培养时间里也不能获得满意的细胞数量。改进组织块贴壁法可以使羊膜组织块紧贴在瓶底,避免了组织块漂浮,增加了细胞爬出的机会,缩短了原代培养的时间,确保了传代细胞的活性和稳定性。
对于hAMSCs第1次传代培养,通常都是按照1∶1或1∶2传代,而这种方法常常因为细胞密度低而导致细胞贴壁难、数量少、需要延长培养时间,容易出现细胞分化现象,影响细胞质量,而本实验用T75培养瓶进行原代培养,P1代传至T25细胞培养瓶中,提高了接种密度,增加了贴壁细胞的数量,更有利于保持细胞的活性,加速细胞的增殖和传代,其原因可能与改善了其生长的微环境,细胞通过自分泌和旁分泌途径分泌相关细胞因子促进其生长[5]。
对于MSCs的鉴定一直没有一个绝对统一标准,目前都是参照骨髓MSCs的鉴定标准来执行的,主要通过一般生物学特性、细胞表面标记物、多向分化潜能等途径进行鉴定。hAMSCs能表达多种细胞表面抗原,包括CD13、CD29、CD44、CD105、CD90、CD73,不表达或是低表达造血干细胞表面抗原[6]。因此,本实验选择了几个常见的标记物,包括:CD73、CD90、CD44、CD105、CD11b、CD19、CD34、CD45、HLA-DR。结果显示,细胞高表达CD44、CD105、CD73和CD90,这与骨髓和其他来源的MSCs表达情况一致[7]。另外,通过诱导剂将其向神经[8]和成骨细胞[9]诱导,提示该细胞具备分化潜能,以上结果说明该细胞符合MSCs的特征[10]。
总之,本研究对hAMSCs原代培养的方法上进行了改进,缩短了培养时间,提高了细胞的得率,为今后其临床应用提供了保障。
4参考文献
[1] Taghrid MG,Rabab EH,Amira O,et al.Comparative characteristics of amniotic membrane, endometrium and ovarian derived mesenchymal stem cells: A role for amniotic membrane in stem cell therapy [J]. Middle East Fertility Society Journal, 2014(19):156-170.
[2] Zhang HY, Yang NL. Biological characteristics of placenta-derived mesenchymal stem cells.Journal of Clinical Rehabilitative Tissue Engineering Research, 2010(1):7535-7538.
[3] Kranz A, Wagner DC, Kamprad M, et al. Transplantation of placenta-derived mesenchymal stromal cells upon experimental stroke in rats. Brain Res, 2010(1315):128-136.
[4] 李昆,于艳秋,李世正.两种分离人胎盘问充质干细胞方法的比较[J].中国医科大学学报, 2010(5):675-676.
[5] Parekkadan B,Milwid JM. Mesenchymal stem cells as therapeutics [J].Annu Rev Biomed Eng, 2010(12): 87-117.
[6] Sakuragawa N, Kakinuma K, Kikuchi A, et al. Human amnion mesenchyme cells express phenotypes of neuroglial progenitor cells [J]. J Neurosci Res, 2004(2):208-214.
[7] 付蒙,张艳梅,王佃亮,等. 人羊膜间充质干细胞的生物学特性及临床前研究 [J]. 中国生物工程杂志, 2011(12):115-119.
[8] Sakuragawa N, Kakinuma K, Kikuchi A, et al. Human amnion mesenchyme cells express phenotypes of neuroglial progenitor cells [J]. J Neurosci Res, 2004(2):208-214.
[9] David B. Kamadjaja,Purwati,et al.The Osteogenic Capacity of Human Amniotic Membrane Mesenchymal Stem Cell (hAMSC) and Potential for Application in Maxillofacial Bone Reconstruction in Vitro Study[J]. J Biomedical Science and Engineering, 2014(7):497-503.
[10]朴正福,张海燕,丁淑芹,等.人羊膜间充质干细胞的生物学特性鉴定[J].国际生物医学工程杂志, 2010(3):157-162.
(2016-02-13收稿,2016-03-27修回)
中文编辑: 刘平; 英文编辑: 赵毅
The Improved Culture Method of Human Amnion Mesenchymal Stem Cells
CUI Dongbing, FAN Anran, HE Zhixu
(TheCenterofStemCellandTissueEngineeringResearch,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To investigate and improve the method of human amnion mesenchymal stem cellsseparation and culture (hAMSCs). Methods: The hAMSCs were established with the methods of trypsin, collagenase II, traditional and improved tissue attachment, respectively. The cell morphology and the growth time of hAMSCs were observed, and the immunophenotype were also detected with flow cytometry. In addition, hAMSCs were induced to differentiate into osteoblast and neuroblast with different system and the derived osteoblast and neuroblast were identified then. Results: The hAMSCs obtained with the improved separation method obtain higher purity and can be passaged more times, and the quantity of obtained hAMSCs can be reached up to 3~4 times of enzyme digestion, and 1~2 times of traditional tissue attachment method within the same culture time; furthermore, the obtained hAMSCs highly express CD73, CD90, CD44 and CD105 while did not express CD11b, CD19, CD34, CD45 and HLA-DR; the alizarin staining and neuron-specific enolase detection demonstrated that hAMSCs could be induced into osteoblast and neuroblast. Conclusions: The methods of hAMSCs separation and culture are improved and will provide the basis for the research and application of hAMSC.
[Key words]human amnion mesenchymal stem cells(hAMSCs); cell culture; identification; induce
[中图分类号]R329.3
[文献标识码]A
[文章编号]1000-2707(2016)04-0414-04
*[基金项目]贵州省科技厅贵州医科大学联合基金[黔科合LH字(2014)7078]
**通信作者 E-mail:hzx@gmc.edu.cn
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1844.046.html
