河蚬或藻存在下组合扰动对内源磷迁移的影响
2016-05-27李大鹏蔡顺智苏州科技学院环境科学与工程学院江苏苏州215009
王 忍,李 勇,李大鹏,蔡顺智,黄 勇 (苏州科技学院环境科学与工程学院,江苏 苏州 215009)
河蚬或藻存在下组合扰动对内源磷迁移的影响
王 忍,李 勇,李大鹏*,蔡顺智,黄 勇 (苏州科技学院环境科学与工程学院,江苏 苏州 215009)
摘要:为阐明河蚬(Corbicula fluminea)或铜绿微囊藻(Microcystis aeruginosa)存在下,物理和摇蚊幼虫组合扰动对内源磷再生和迁移转化的影响,以太湖梅梁湾上覆水和沉积物为研究对象,分析了上覆水、间隙水、沉积物中不同形态磷的变化规律.结果表明,与摇蚊幼虫扰动和组合扰动相比,河蚬或藻类的出现都会使得上覆水中不同形态磷(总磷、溶解性总磷、溶解性磷酸盐、颗粒态磷)显著增加.河蚬或藻类均导致间隙水DIP明显降低,并致使DIP峰值区域向更深处迁移(3~4cm变为4~5cm),而对照试验则相反.与对照试验相比,河蚬或藻存在下组合扰动均导致0~4cm沉积物NH4Cl-P含量及其占总磷百分比降低,Fe/Al-P含量及其占总磷百分比增加,并且河蚬或藻对NH4Cl-P降低和Fe/Al-P增加的影响基本一致.在多种扰动因素存下,摇蚊幼虫对上覆水中DTP和DIP贡献最大,后者可能源于摇蚊幼虫显著降低了间隙水中DIP含量及沉积物中NH4Cl-P含量.这暗示了在组合扰动基础上叠加河蚬或者藻类,均进一步促进了内源磷再生和迁移.
关键词:磷;组合扰动;摇蚊幼虫;河蚬;铜绿微囊藻;太湖
* 责任作者, 教授, ustsldp@163.com
随着外源磷得到不断的控制,内源磷的再生和形态转化对水体富营养化的进程起着越来越重要的作用[1].沉积物扰动是促使内源磷再生和形态转化的关键因素[2-3].通常,底泥扰动分为3 种:物理扰动(风浪、湖流、航运等造成的扰动)、生物扰动(底栖生物扰动)、组合扰动(物理和底栖生物组合扰动).
对于天然水体而言,更多的时候是以组合扰动为主,然而,组合扰动模式下参与扰动的底栖生物种类不同对上覆水和底泥中磷迁移转化的影响也不同[4-5].这种不同主要源于底栖生物对底泥微环境和微界面的改造方式不同.如摇蚊幼虫主要从垂向上改造底泥微环境和微界面,而河蚬则从水平向对表层底泥进行改造.张雷等[6-7]、史晓丹等[8-9]、王忍等[10]已经发现摇蚊幼虫和河蚬均会促进磷从底泥向上覆水迁移.
藻类是水体中磷发生迁移转化的另一个关键因素[11-14].但是,藻类对上覆水磷的影响目前还没有定论.Cyr等[15]认为,扰动下上覆水中磷之所以减少,可归因于藻类等浮游植物对溶解性磷酸盐的吸收.汪明等[16]在对太湖梅粱湾的周年监测中发现,藻类的大量生长并未导致溶解性磷酸盐降低,相反却显著增加.
物理扰动、生物扰动以及藻类的存在均会对上覆水和底泥中磷的迁移转化产生影响,那么,在多种因素共存条件下,磷在泥水界面究竟发生怎样的迁移转化,哪一种因素又是磷迁移转化的关键影响因素,上述因素的存在对磷的迁移转化是否存在叠加效应等尚不清楚.因此,本研究以物理和摇蚊幼虫组合扰动为基础研究对象,通过引入河蚬或藻类,尽可能真实的模拟和反映太湖底泥扰动实际情形,探讨组合扰动下,上覆水磷(TP、DTP、DIP、PP)、间隙水DIP和底泥磷(NH4Cl-P、Fe /Al-P、Ca-P 、Res-P)的变化规律.进而阐明更加复杂、更加符合实际水体的组合扰动下内源磷再生和迁移转化的规律,为丰富浅水湖泊磷迁移转化理论体系提供数据支持.
1 材料与方法
1.1 研究地点与野外采样
2014年4月利用大口径重力采样器(Rigo Co.直径90mm 高500mm)在梅梁湾采样点(N31°31'30.10",E120°10'57.1")采集表层15cm底泥柱样共16根,并保留采样管上端上覆水样,两端用橡胶塞密封后垂直放入特制采样架中,尽可能的无扰动运回实验室.同时采集上覆水50L.采样点底泥及上覆水的理化性质见表1.

表1 采样点底泥和上覆水的理化性质Table 1 Physics-chemical properties of sediments and overlying water from the sampling point
试验用藻类购自中科院水生生物研究所(武汉),品种为铜绿微囊藻(Microcystis aeruginosa),该品种是太湖水华爆发时的优势种群.摇蚊幼虫购自花鸟鱼虫市场,其中主要种为羽摇蚊幼虫(Chironomus plumosus);河蚬(Corbicula fluminea)采集自太湖,并将买回的摇蚊幼虫和采集的河蚬用太湖底泥和上覆水驯化培养1周后用于实验. 1.2 室内培养实验方法
实验用培养单元培养管构造见图1,培养管材料为有机玻璃(长20.5cm,内径ID8.4cm),底端用橡胶塞密封;管壁留有安装Rhizon间隙水采样器(Rhizon core solution sampler)的小孔,使用前用疏水胶带密封.
将采集的上覆水过400目金属筛,截除浮游生物,过滤后的上覆水用作底泥柱样培养的上覆水.采集的底泥柱样进行以下处理:将每个柱样表层10cm底泥切分成5层,每层2cm,相同层的底泥分别收集在同一桶中,将各桶内底泥过60目金属筛除去其中的底栖生物和大颗粒物,将过筛后的底泥混匀,按原来顺序装入培养管中,并用切片将底泥-水界面切成完全平整.然后将滤后上覆水虹吸到底泥上,尽可能不扰动表层底泥且保持底泥-水界面平整.将制得的5根底泥柱样放在培养水槽内,并向水槽内加入滤后上覆水淹没培养管,用曝气沙头对槽内水曝气预培养16d,让底泥稳定.为了去除水中原有藻类对实验造成的影响,整个预培养期间将柱样置于黑暗环境.
在第14d底泥已基本稳定,即底泥-水界面沉降完全,泥面高度保持稳定,上覆水中的各营养盐浓度保持稳定.从培养水槽中取出底泥柱样,将泥样柱上顶至适当位置,使得采样孔位于底泥-水界面以下1.5,2.5,3.5,4.5,5.5cm处(分别采集泥面下1~2,2~3,3~4,4~5,5~6cm段的间隙水,采样分辨率是1cm,由于在0.5cm处插入的Rhizon采样管易在重力作用下将表层泥面开裂,因此原定于0.5cm处抽取1~2cm间隙水的小孔暂时取消),将Rhizon间隙水采样管包扎生料带后插入培养管壁预留的小孔中以保证完全密封,插入时注意采样管的水平.同时取足量预培养水放入棕色瓶中4℃保存,作为实验用上覆水的补充.具体实验分组及编号见表2.实验过程温度为室温.蚬缓慢靠近泥-水界面轻轻放置于底泥表面,尽量避免产生较大扰动.
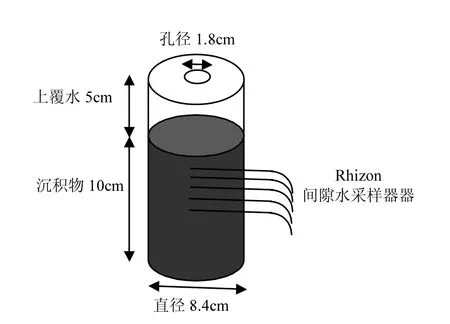
图1 实验培养管Fig.1 Experiment incubation tube
当天20:00,开启恒速搅拌机(IKA RW20digital),在底泥-水界面上方1cm处对组合扰动组底泥柱样扰动10min.在试验期间,发现摇蚊幼虫钻出泥面死亡时,立即用镊子小心挑出,并加入等量的活体.
试验共持续了11d(第17~27d). 每天采集上覆水水样测定TP、DTP和DIP.在沉积物-水界面以下0.5cm处用10mL针管抽取9mL上覆水.采样后,立即用存于棕色瓶中的等量预培养水补充.
间隙水DIP取样时用2mL注射器抽取1mL间隙水.间隙水在15,21,26d采集.试验在第27d结束,从各组(ES1、ES2、ES3、ES4、ES5)分别取1根柱样,取出Rhizon间隙水采样器,并用疏水胶带密封管壁小孔,将底部橡胶塞上顶,切取表层沉积物测定含水率、有机质和沉积物磷形态.取样时,均对上覆水、间隙水样品测试了3次,沉积物分析则是取样3次,即每个数据是有3次采样的测定后的平均值.
1.3 样品分析方法
上覆水中溶解氧(DO)和pH值分别通过便携式溶解氧测定仪(HQ30d)和数显pH计(pHs-3TC)测定.
TP是将水样用过硫酸钾消解后用钼锑抗分光光度法测定; DTP是将水样先过0.45µm滤膜然用过硫酸钾消解后测定; DIP含量是将水样过0.45µm滤膜后直接测定.PP是TP与DTP的差值.
沉积物中形态磷的数量分布参照文献[19]的方法.该法将形态磷分为4种:弱吸附态磷(NH4Cl-P)、铁铝结合态磷(Fe /Al-P)、钙结合态磷(Ca-P)、残渣磷(Res-P).沉积物上总磷(Tot-P)以上述4种形态磷之和表示.
沉积物数据统计分析利用双因素方差分析完成,不同处理与深度作为变量,如不同处理组之间存在显著差异,再利用Tukey事后检验分析各深度不同处理组与对照组之间是否存在显著差异.统计分析利用软件SPSS 22.0 (SPSS,美国)完成.

表2 实验分组Table 2 Situation of the experimental group
在第17d,挑选活性较强的摇蚊幼虫,向生物扰动组(ES2)和组合扰动(ES3、ES4、ES5)组柱样中加入相应条数的摇蚊幼虫,其中主要种为羽摇蚊(Chironomus plumosus)幼虫,绝大多数的摇蚊幼虫能迅速打孔钻入底泥中,半小时过后,将尚未打孔钻入的摇蚊幼虫用镊子轻轻挑出,用新摇蚊幼虫替换,然后将所有培养管放回黑暗房间内开启试验.以同样的的方法加入相应数量的河蚬和藻类.河蚬密度选择参照文献[17],铜绿微囊藻浓度选择参照文献[18].加入河蚬时用筷子夹住河
2 结果与讨论
2.1 实验过程观察结果
摇蚊幼虫引入后,能够在沉积物表面迅速打洞钻入沉积物,并构筑U型或J型廊道;河蚬引入沉积物后,慢慢在沉积物表面挖穴,一段时间后,河蚬完全钻入沉积物,只露出吸管进行摄食.进一步观察发现,摇蚊幼虫构筑的廊道周围颜色由黑色逐渐转变为了棕黄色,这主要是因为摇蚊幼虫的生物引灌作用导致溶解氧渗透深度增加,在廊道周围形成了氧化层;河蚬的活动使得表层部分黑色的沉积物暴露在富氧的上覆水,被氧化成棕黄色,从纵向来看,由于河蚬的活动增大了溶解氧渗透深度,使得棕黄色氧化层向沉积物深处迁移,而河蚬在适应环境后穴居起来,有时会伸出斧足,偶尔观察到它们进行水平活动的痕迹.另外,有河蚬的处理组,上覆水浊度很低,清澈见底.藻类的加入,使得上覆水稍微带绿色,是所有处理组中最浑浊的,并持续了整个实验过程.
2.2 上覆水不同形态磷的变化规律
在摇蚊幼虫和物理组合扰动的基础上加入河蚬或藻类,上覆水不同形态磷(TP、DTP、DIP、PP)发生了显著变化,并且河蚬的存在和藻类的存在对组合扰动体系的上覆水不同形态磷的影响是不同的.实验结束时,不同处理组上覆水不同形态磷的变化规律见图2.
图2(a)显示出了TP大概的变化趋势,与空白组(ES1)对比,其他4个处理组TP先逐渐增大,在第7d达到最大值,ES2、ES3、ES4、ES5各组最大值分别为0.25,0.31,0.35,0.20mg/L,随后立即大幅减小,但从第9d开始TP有小幅“回升”的趋势.
图2(b)显示了上覆水DTP的变化趋势,先缓慢减小,后增大,在第7d达到最大值,之后呈逐渐降低趋势.与物理和摇蚊幼虫组合扰动相比,河蚬和藻类的存在都增大了DTP的最大值,并且都要明显大于空白对照组.不同的是在第9d之后,河蚬组(ES4)DTP含量一直处于较高水平,并显著大于其他处理组;而藻类组(ES5)与其他处理组相差不大.说明了组合扰动下河蚬的存在,对DTP的影响较大,这主要归因于河蚬的排泄物,河蚬的磷排泄中,DTP在TP中所占的比例在83.01%~ 100%之间,DIP占TP比例在36.60%~96.59%之间[20].
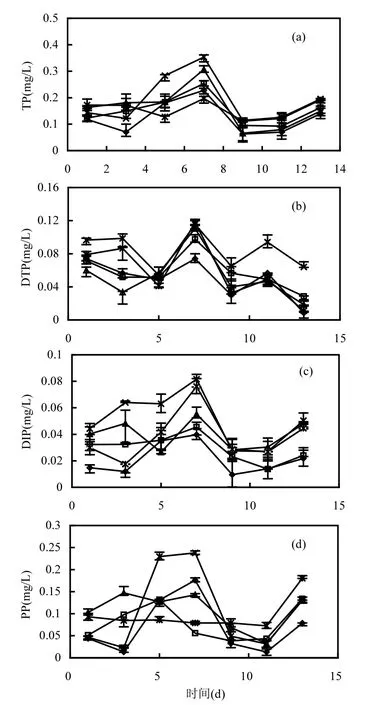
图2 不同处理组上覆水中各形态磷的变化规律Fig.2 Variation of different phosphorus forms in the overlying water under different treatmentsES1、ES2、ES3、ES4、ES5分别代表空白对照组、摇蚊幼虫扰动组、物理和摇蚊幼虫组合扰动组(简称组合扰动组)、河蚬存在下物理和摇蚊幼虫组合扰动组(简称河蚬组)、藻类存在下物理和摇蚊幼虫组合扰动组(简称藻类组)

从图2(c)和图2(d)可以看出,DIP和PP的变化趋势与TP基本一致,先逐渐增大,在第7d达到最大值,之后立即大幅减小,从第9d开始有增大的趋势.
各处理组DIP最大值按照空白组(ES1)、摇蚊幼虫组(ES2)、组合扰动组(ES3)、藻类组(ES5)、河蚬组(ES4)的顺序依次增大,分别达到0.039, 0.046,0.055,0.076,0.082mg/L,这说明了组合扰动下,河蚬和藻类存在,都显著增大了上覆水DIP的含量.
由于河蚬的扰动改变了沉积物表层原有结构,增大了含水率,加大了溶解性磷酸盐在沉积物-水界面向上覆水释放的速率[21],同时河蚬摄食有机质,并通过新陈代谢将有机磷转化为DIP以排泄物的形式排入到水体中[20],这也是河蚬导致DIP增大的原因.另外,根据文献[8]物理和摇蚊幼虫组合扰动会增大上覆水DIP含量,河蚬的出现,与原有的物理扰动、摇蚊幼虫扰动会形成多种新型组合扰动形式—物理-河蚬组合扰动、河蚬-摇蚊幼虫组合扰动、物理-河蚬-摇蚊幼虫组合扰动,根据物理和生物组合对内源磷再生和迁移转化的协同作用理论,可以推测新形式的组合扰动的出现会进一步增大上覆水DIP的含量.铜绿微囊藻能够显著增加沉积物磷的释放量,引起上覆水中可溶性磷酸盐的增加,为其生长繁殖提供了必要的营养条件[15],当铜绿微囊藻死亡时即迅速释放出其所蓄积的磷[23],而这释放出磷大部分是DIP[24],所以藻类的出现同样促进了DIP的增大.这与汪明等[16]研究结果一致.从第7d各处理组最大值数据来看,藻类组(0.082mg/L)比河蚬组(0.076mg/L)更大,说明了组合扰动下,藻类的出现对增大上覆水DIP的含量更显著,这也暗示了实际水体防治水华必须要严格控制藻类生长.
图2(d)显示,在第7d最大值时,河蚬组PP(0.238mg/L)含量最大;藻类组PP(0.079mg/L)比空白组(0.176mg/L)和组合扰动组(0.143mg/L)都明显更小.说明了组合扰动下河蚬和藻类的出现对PP的影响显著不同,河蚬通过滤食上覆水中的悬浮物获取有机物,使得上浮水颗粒态物质大量减少,这与实验过程观察到河蚬组上覆水非常清澈的结果相一致.
2.3 间隙水DIP的变化规律
间隙水是溶解态物质在沉积物与上覆水之间交换的中介,间隙水DIP既可以释放到上覆水中以补充上覆水磷,也可以转化为沉积物磷沉积在底泥中,所以间隙水DIP的变化规律反映了整个泥-水体系磷的转化和归趋.本实验利用Rhizon间隙水采样技术分析了间隙水DIP的变化规律,为上覆水磷和沉积物磷之间的相互迁移转化提供依据.各处理间隙水DIP含量的变化规律如图3.

图3 不同处理组间隙水DIP剖面Fig.3 DIP profiles in the pore water sampled on day 0, day 5 and day 10 under different treatments
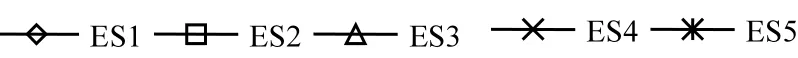
由图3(a)可知,在引入摇蚊幼虫、河蚬、藻类前(0d),空白组(ES1)、摇蚊幼虫扰动组(ES2)、组合扰动(ES3)、河蚬组(ES4)和藻类组(ES5)中DIP剖面相似,无显著性差异(P>0.05).在0-4cm, DIP浓度随深度的增加而增加,各处理组(ES1、ES2、ES3、ES4、ES5)DIP浓度从0.89,1.30, 0.99,0.90,0.98mg/L分别增大到4.09,3.53,4.19, 3.78,4.48mg/L;深度大于4cm后,DIP浓度随深度的增加而减小,分别降低至2.28,2.41,2.38,2.14, 2.50mg/L.对比图3(b)与图3(a)发现ES2、ES3、ES4和ES5沉积物间隙水中DIP的峰值区域由3~4cm迁移至4~5cm,而空白组(ES1)并无此现象,说明摇蚊幼虫和河蚬的引入使得DIP再生的优势区域更深入泥层,这与底栖生物打洞、筑穴、构筑廊道、摄食排泄等生物活动密切相关.此外,空白组(ES1)沉积物纵向剖面DIP浓度未见明显减小,这是因为在该浓度梯度下,间隙水与上覆水之间DIP已达到动态平衡.图3(c)也显示了上述相类似规律.
图3(b)和3(c)中组合扰动组(ES3)间隙水中DIP浓度明显低于摇蚊幼虫组(ES2)和空白组(ES1),主要是因为物理和生物组合扰动的协同作用,这与前人研究结果一致[9].组合扰动的基础上,河蚬和藻类的出现都进一步降低了间隙水DIP浓度.
河蚬扰动促进沉积物溶解氧渗透深度,促进了间隙水中的Fe2+的氧化成水合铁氧化物,使得 DIP与水合铁氧化物结合并沉积到沉积物中,间隙水DIP浓度的降低会减小DIP向上覆水扩散的浓度梯度,进而减小间隙水DIP向上覆水的释放通量,甚至产生沉积物对上覆水中DIP的吸附[25-26].但是也有研究表明河蚬不仅没有减缓DIP向上覆水的释放,反而促进了DIP向上覆水释放.这是因为在产生这些抑制间隙水DIP向上覆水释放的同时,河蚬制造了一些促使DIP向上覆水释放的的过程,如河蚬的挖掘、生物引灌、滤食等[27-29].
2.4 沉积物中磷赋存形态数量分布的变化规律
沉积物中磷赋存形态数量与上覆水磷和间隙水磷的变化规律紧密相关.各处理组沉积物表层0~2cm和2~4cm的磷形态数量的变化规律见图4~7.
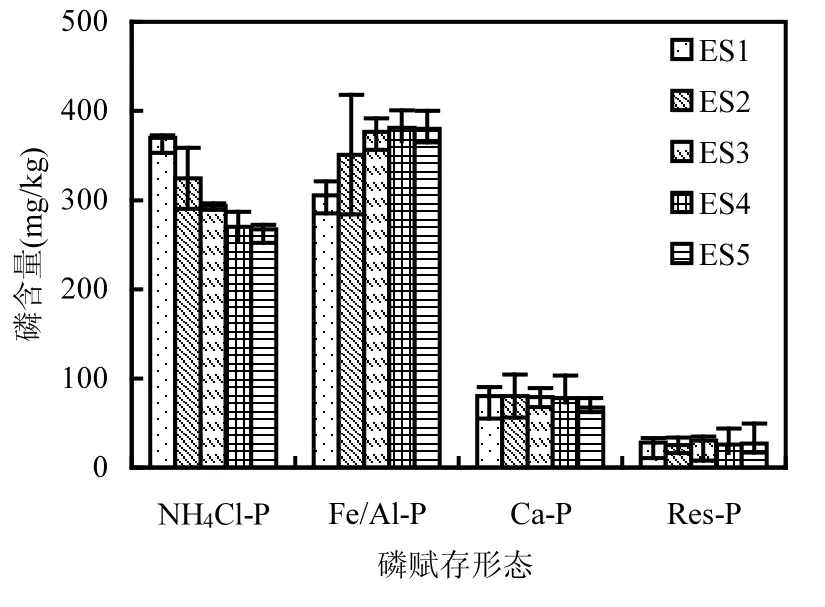
图4 0~2cm沉积物磷赋存形态数量分布Fig.4 Distributions of phosphorus forms in 0~2cm sediment from different treatments
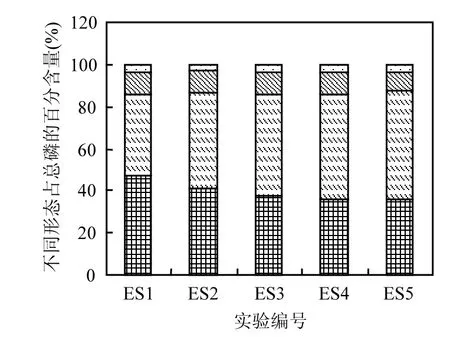
图5 0~2cm沉积物不同形态磷占总磷的百分比Fig.5 Percentage of different phosphorus forms of TP in the 0~2cm sediment
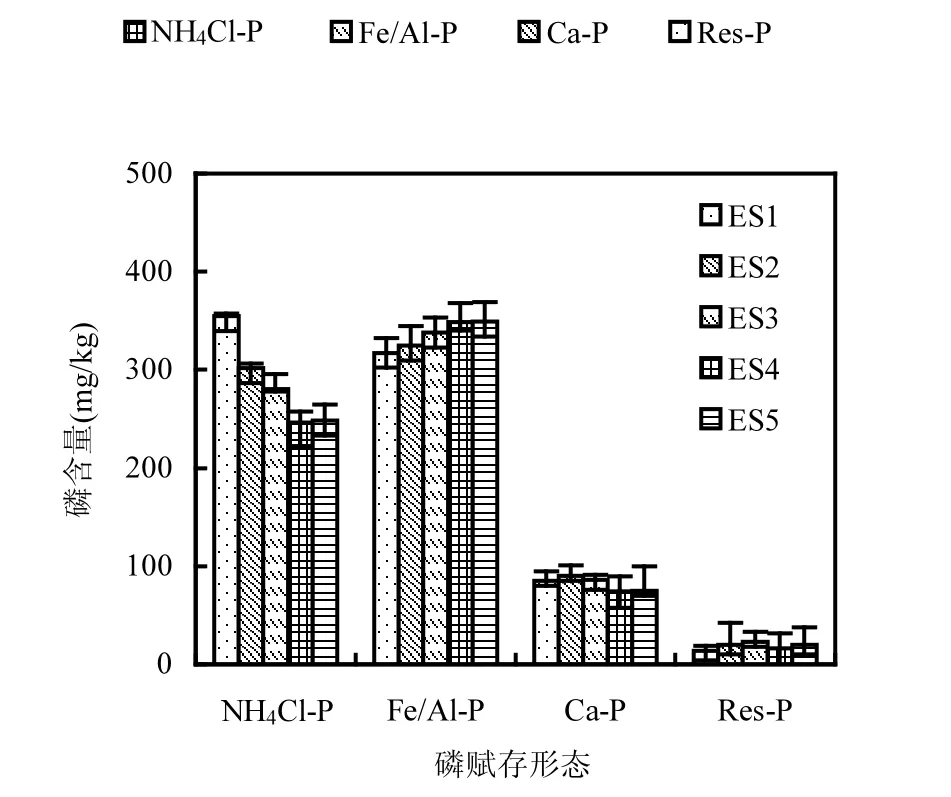
图6 2~4cm沉积物磷赋存形态数量分布Fig.6 Distributions of phosphorus forms in 2~4cm sediment from different treatments

图7 2~4cm沉积物不同形态磷占总磷的百分比Fig.7 Percentage of different phosphorus forms of TP in the 2~4cm sediment

图4和图6显示,不同组合扰动状态以及对照组沉积物中不同形态磷(NH4Cl-P、Fe/Al-P、Ca-P和Res-P)数量分布规律明显不同.通过计算可知,对于沉积物表层0~2cm和2~4cm,对照组(ES1)、摇蚊幼虫组(ES2)、组合扰动组(ES3)中总磷(Tot-P)依次逐渐减小,当河蚬或藻类出现时总磷比组合扰动更小,说明了二者的出现都使得底泥磷向上覆水释放,这与上覆水总磷变化规律(图2a)相符合.沉积物表层0~2cm, ES1、ES2、ES3沉积物中的NH4Cl-P含量逐渐减小,占总磷的百分比也逐渐较小(图5),呈释放趋势.由于生物引灌作用、组合扰动协同作用,改变了沉积物氧环境,在好氧层/缺氧层/厌氧层的交替作用下以及微生物作用下,转化成间隙水DIP或其它形态磷(如Fe/Al-P).而这3组Fe/Al-P变化规律与NH4Cl-P相反,其含量(图4)及其占Tot-P百分比(图5)依次增加,与组合扰动相比,河蚬组(ES4)和藻类组(ES5)都进一步降低了NH4Cl-P含量和增加了Fe/Al-P含量,但这两组之间并无显著差别. 而Ca-P和Res-P含量变化不显著.说明了相比于空白对照组其他处理组都促进了NH4Cl-P向Fe/Al-P的进一步转化.这归因于生物引灌作用增大了沉积物溶解氧含量,使间隙水中的Fe2+和廊道附近沉积物中的Fe2+被氧化成Fe3+及铁氧化物,它们对DIP有专属吸附,因此显著降低了间隙水中DIP含量,藉此增加了Fe/Al-P含量[25,30-31].同时,叠加物理扰动后,NH4Cl-P降低幅度以及Fe/Al-P增加幅度明显大于单纯的底栖生物扰动.这是因为这可能NH4Cl-P很容易被较大的水动力(物理搅拌)破坏分子间的吸附力,从而使其解析释放.在组合扰动协同作用下, Fe/Al-P增加显著[32-33].河蚬挖穴和水平活动使得表层含黑色厌氧沉积物暴露在富氧的上覆水环境中,这些被迫移动到表面的沉积物中含有NH4Cl-P和Fe2+,而NH4Cl-P被物理扰动破坏从而解析释放, Fe2+被氧化后吸附水中DIP形成Fe/Al-P,因此河蚬的出现进一步降低了沉积物NH4Cl-P含量和增大了Fe/Al-P含量.藻类的出现造成了与河蚬相类似的结果,但它们原因是截然不同.一是藻类本身会通过“泵吸”作用加快底泥中磷释放,从而来满足自身生长的需要[15],加大了NH4Cl-P的释放量.二是在藻类和扰动共同作用下,打破了附着在沉积物上的藻类通过光合作用改变沉积物表面氧环境所造成的沉积物磷释放量降低的局面[34],使得更多的NH4Cl-P转化为DIP.所以藻类的出现使NH4Cl-P含量进一步降低.而藻类的光合作用释放的大量氧气使得增大了沉积物溶解氧渗透深度(OPD),使得有更多的Fe2+被氧化成Fe3+及铁氧化物吸附磷从而增大了Fe/Al-P,另外,被解析释放的NH4Cl-P有一部分也转化成Fe/Al-P.因此,藻类的出现同样降低了NH4Cl-P含量和增大了Fe/Al-P含量.
3 各扰动因素对磷迁移转化的贡献
以摇蚊幼虫扰动、物理扰动、河蚬、藻类为影响因子,分析它们分别对磷迁移转化的贡献.根据表2,ES1为空白组, ES2与ES1相比仅多了摇蚊幼虫的影响,则ES2-ES1可认定为摇蚊幼虫扰动所导致.类似, ES3-ES2为物理扰动所导致,ES4-ES3为河蚬导致,ES5-ES3为藻类所导致. 图8、图9、图10分别是各因素对第7天最大值时上覆水磷变化量、实验结束时间隙水DIP减少量、实验结束时底泥磷变化量(NH4Cl-P减少量和Fe/Al-P增加量)的贡献.其中图8中正值表示增大,负值表示减小.

图8 各因素对上覆水磷的贡献Fig.8 The contribution of 4factors on the phosphorus in the overlying water
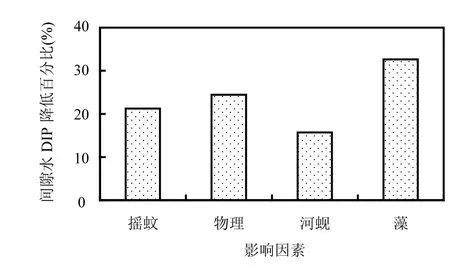
图9 各因素对间隙水DIP的贡献Fig.9 The contribution of 4factors on the DIP in the pore

图10 各因素对底泥磷的贡献Fig.10 The contribution of 4 factors on the phosphorus in the sediment water图8~10数据是全部计算出来的,没有误差线
图8显示,物理扰动(21%)对增大TP的贡献最大,依次大于河蚬扰动(15%)、摇蚊幼虫扰动(11%),而藻类减少TP的量达(-36%),从变化幅度上看,藻类对上覆水TP影响程度最大.DTP的增大主要受摇蚊幼虫扰动(32%)和物理扰动(13%)的影响,而河蚬和藻类的影响都较小,增幅都在10%以下.而各因素对DIP与DTP的影响明显不同.从对增大DIP贡献来看,摇蚊幼虫扰动(48%)和物理扰动(38%)的影响比河蚬(14%)和藻类(21%)的大得多.从PP的变化来看,各因素的贡献都很大,而且明显大于其他3种磷(TP、DTP、DIP),说明了PP很容易与其他磷形态发生迁移转化.
从图9可以看出, 摇蚊幼虫扰动、物理扰动、河蚬、藻类4因素中藻类对减少间隙水DIP的贡献最大(33%),河蚬的贡献最小(16%).
图10呈现了沉积物表层0~2、2~4cm深度中NH4Cl-P减少量和Fe/Al-P增加量与4个因素的关系.其中,0~2cm沉积物,摇蚊幼虫对NH4Cl-P减少量的贡献(12%)稍大于其他因素,相差不大,都在10%左右;而对Fe/Al-P增加量的贡献(15%)显著大于其他因素(物理7%、河蚬1%、藻类1%).2~4cm沉积物,对NH4Cl-P减少量的贡献中摇蚊幼虫依然是最大的(15%),但相比于0~2cm,河蚬和藻类的贡献都有小幅增大,都达到了12%;摇蚊幼虫扰动和物理扰动对Fe/Al-P增加量的贡献大幅降低,而河蚬和藻类的贡献有小幅增加.
4 结论
4.1 与组合扰动相比,河蚬或藻类均导致上覆水磷(TP、DTP、DIP、PP)显著增加 (除藻类组PP增大不明显外),并且致使间隙水DIP浓度进一步减小.
4.2 与组合扰动相比,河蚬和藻类出现进一步降低了沉积物NH4Cl-P含量和增大了Fe/Al-P含量,而Ca-P和Res-P变化不明显.
4.3 摇蚊幼虫扰动显著增加上覆水中DTP和DIP,这与摇蚊幼虫导致间隙水中DIP含量降低及沉积物中NH4Cl-P含量降低贡献率最高有关.
参考文献:
[1] 秦伯强,杨柳燕,陈非洲,等.湖泊富营养化发生机制与控制技术及其应用 [J]. 科学通报, 2006,51(16):1857-1866.
[2] Neal C, Neal M, Leeks G J L, et al. Suspended sediment and particulate phosphorus in surface waters of the upper ThamesBasin, UK [J]. Journal of Hydrology, 2006,330(1/2):142-154.
[3] 尤本胜,王同成,范成新等.太湖草型湖区沉积物再悬浮对水体营养盐的影响 [J]. 环境科学, 2008,29(1):26-31.
[4] Luoto T P, Ojala A E K. Paleolimnological assessment of ecological integrity and eutrophication history for Lake Tiiläänjärvi (Askola, Finland) [J]. Journal of Paleolimnology, 2014,51(4):455-468.
[5] Ilarri M I, Souza A T, Antunes C, et al. Influence of the invasive Asian clam Corbicula fluminea (Bivalvia: Corbiculidae) on estuarine epibenthic assemblages [J]. Estuarine Coastal & Shelf Science, 2014,143(4):12–19.
[6] 张 雷,古小治,邵世光,等.河蚬(Corbicula fluminea)扰动对湖泊沉积物性质及磷迁移的影响 [J]. 环境科学, 2011,32(1):88-95.
[7] 张 雷,商景阁,王兆德,等.河蚬扰动沉积物界面效应及其在水中代谢速率 [J]. 中国环境科学, 2011,31(6):1001-1006.
[8] 史晓丹,李大鹏,王 忍,等.物理和摇蚊幼虫组合扰动对内源磷再生和形态转化的协同作用 [J]. 环境科学, 2015,36(3):955-962.
[9] 史晓丹,李 勇,李大鹏,等.摇蚊幼虫扰动下沉积物微环境和微界面对物理扰动强度的响应 [J]. 环境科学, 2015,36(5):1622-1629.
[10] 王 忍,李大鹏,黄 勇,等.物理和生物组合扰动对底泥微界面过程的影响 [J]. 环境科学, 2015,36(11):4112-4120.
[11] 武晓飞,李大鹏,汪 明,等.反复扰动下加藻对不同形态磷相互转化的影响 [J]. 中国环境科学, 2015,35(4):1187-1196.
[12] 陈 俊,李大鹏,李 勇,等.底泥扰动下藻类对不同形态磷在水体中分布的影响 [J]. 中国环境科学, 2015,35(9):2787-2793.
[13] Douglas E J, Haggitt T R, Rees T. Relationship between tissue phosphorus and seawater phosphate in the brown alga Hormosira banksii [J]. New Zealand Journal of Marine & Freshwater Research, 2014,49(1):64-68.
[14] Sung K, Lee G J, Munster C. Effects of Eichhornia crassipes and Ceratophyllum demersum on Soil and Water Environments and Nutrient Removal in Wetland Microcosms [J]. International Journal of Phytoremediation, 2015,17:0-0.
[15] Cyr H, MaCabe S K, Nǖrnberg G K. Phosphorus sorption experiments and the potential for internal phosphorus loading in littoral areas of a stratified lake. Water Research, 2009,43(6): 1654-1666.
[16] 汪 明,武晓飞,李大鹏,等.太湖梅梁湾不同形态磷周年变化规律及藻类响应研究 [J]. 环境科学, 2015,36(1):80-86.
[17] 蔡 炜,蔡永久,龚志军,等.太湖河蚬时空格局 [J]. 湖泊科学, 2010,22(5):714-722.
[18] 耿 磊,郁 凡,李亚春.基于MODIS资料的太湖蓝藻浓度监测[J]. 气象科学, 2010,30(6):827-831.
[19] Hieltjes A H M, Lijklema L. Fractionation of inorganic phosphates in calcareous sediments [J]. Journal of Environmental Quality, 1980,9(6):405-407.
[20] 薛庆举,蔡永久,许 浩,等.温度对河蚬(Corbicula fluminea)氮、磷排泄影响的初步研究 [J]. 湖泊科学, 2014,26(6):864-870.
[21] 张 雷,古小治,邵世光,等.河蚬(Corbicula fluminea)扰动对湖泊沉积物性质及磷迁移的影响 [J]. 环境科学, 2011,32(1):88-95.
[22] 刘冬梅,姜 霞,金项灿,等.太湖藻对水-沉积物界面磷交换过程的影响 [J]. 环境科学研究, 2006,19(4):8-13.
[23] 张胜花,葛芳杰,王红强,等.不同氮磷营养条件下铜绿微囊藻(Microcystis aeruginosa)对正磷酸盐的蓄积效果 [J]. 长江流域资源与环境, 2008,17(6):909-913.
[24] 杨柳燕,王 勤,史小丽,等.铜绿微囊藻磷代谢过程研究 [J]. 农业环境科学学报, 2005,24(4):686-689.
[25] Lewandowski J, Hupfer M. Effect of macrozoobenthos on twodimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments: A laboratory study [J]. Limnology and Oceanography, 2005,50(4):1106-1118.
[26] Mortimer R J G, Davey J T, M.D. Krom, et al. The Effect Of Macrofauna On Porewater Profiles And Nutrient Fluxes In The Intertidal Zone Of The Humber Estuary [J]. Estuarine Coastal & Shelf Science, 1999,48(6):683-699.
[27] Hakenkamp C C, Palmer M A. Introduced bivalves in freshwater ecosystems: the impact of Corbicula on organic matter dynamics in a sandy stream [J]. Oecologia, 1999,119(3):445-451.
[28] Lauritsen D, Mozley S. Nutrient excretion by the Asiatic clam Corbicula fluminea [J]. Journal of the North American Benthological Society, 1989,8(2):134-139.
[29] Mermillod-Blondin F. Biodiversity of benthic invertebrates and organic matter processing in shallow marine sediments: an experimental study [J]. Journal of Experimental Marine Biology & Ecology, 2005,315(2):187–209.
[30] Matisoff G, Fisher J, Matis S. Effects of benthic macroinvertebrates on the exchange of solutes between sediments and freshwater [J]. Hydrobiologia, 1985,122:19-33.
[31] 尤本胜.太湖沉积物再悬浮和沉降过程中物质的动态迁移及其定量化 [D]. 南京:中国科学院南京地理与湖泊研究所, 2007:75-96.
[32] House W A, Denisort F H. Factors influencing the moflsurement of equilibrium phosphate concentration in fiver sediments [J]. Warter Research, 2000,34(4):1187-1200.
[33] 范成新,张 路,包先明,等.太湖沉积物-水界面生源要素迁移机制及定量化-2磷释放的热力学机制及源汇转换 [J]. 湖泊科学, 2006,18(3):207-217.
[34] 张 强,刘正文.附着藻类对太湖沉积物磷释放的影响 [J]. 湖泊科学, 2010,22(6):930-934.
Impacts of Corbicula fluminea or algae under combined disturbance on internal phosphorus migration.
WANG Ren, LI Yong, LI Da-peng*, CAI Shun-zhi, HUANG Yong (School of Environmental Science and Engineering, University of Science and Technology of Suzhou, Suzhou 215009, China). China Environmental Science, 2016,36(4):1226~1234
Abstract:It was to clarify the effect of Corbicula fluminea or algae under physical and Chironomus plumosus combined disturbance on regeneration and transformation of internal phosphorus (P), using the sediment and overlying water from Meiliang Bay, Tai Lake. The variation of P forms in the overlying water, pore water and sediments was analyzed. The results showed that the concentration of Total P (TP), Dissolved total P (DTP), Dissolved inorganic P (DIP), Particulate P (PP) in the overlying water under combined disturbance with the Corbicula fluminea or algae were obviously higher, compared with that under combined disturbance, and they could result in the decrease marked for DIP in the pore water. In addition, the peak area of DIP migrated deep (from 3~4 cm to 4~5 cm under 0 cm) dued to Corbicula fluminea or algae, but the control was not. The content of NH4Cl-P and the percentage of Fe/Al-P to Total P in the sediment (0~4cm) decreased and the Fe/Al-P increased due to Corbicula fluminea or algae, and the effect of Corbicula fluminea or algae on the NH4Cl-P decreased and Fe/Al-P increased was the same nearly. Under different disturbance factors, the contribution of Chironomus plumosus on the DTP and DIP in the overlying water was big. One explanation was it reduced the DIP in the pore water and the NH4Cl-P in the sediment. It was suggested that Corbicula fluminea or algae under combined disturbance could improve the internal P release and migration.
Key words:phosphorus;combined disturbance;Chironomus plumosus;Corbicula fluminea;Microcystis aeruginosa;Tai Lake
作者简介:王 忍(1990-),男,湖北黄石人,苏州科技学院硕士研究生,主要研究方向为水体修复.发表论文2篇.
基金项目:国家自然科学基金(51178284,51278523);江苏省第四期“333”工程;江苏省“六大人才高峰”项目(2013-JNHB-022)
收稿日期:2015-09-23
中图分类号:X131.2
文献标识码:A
文章编号:1000-6923(2016)04-1226-09
