UASB反应器中产甲烷菌对温度胁迫的响应
2016-05-27张立国班巧英李建政山西大学环境与资源学院山西太原030006哈尔滨工业大学市政与环境工程学院黑龙江哈尔滨50090
张立国,班巧英*,李建政(.山西大学环境与资源学院,山西 太原 030006;.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 50090)
UASB反应器中产甲烷菌对温度胁迫的响应
张立国1,班巧英1*,李建政2(1.山西大学环境与资源学院,山西 太原 030006;2.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090)
摘要:采用间歇培养方式探讨了升流式厌氧污泥床(UASB)反应器中不同营养类型产甲烷菌对温度胁迫的响应规律.研究结果表明,产甲烷螺旋菌(Methanospirillum)是该反应器的主要氢营养型产甲烷菌,而主要乙酸营养型产甲烷菌为产甲烷丝状菌(Methanosaeta).在35℃条件下,氢营养型和乙酸营养型产甲烷菌的累计甲烷产量分别为24.7, 11.7mL,而最大产甲烷速率分别为0.74, 0.18mL/h.当温度从35℃分别降低至30, 25, 20, 15℃时,导致氢营养型产甲烷菌的累计产甲烷量分别减少了14.2%, 34.0%, 47.0%, 57.5%,而乙酸营养型产甲烷菌的累计产甲烷量分别减少了5.1%, 23.9%, 45.3%, 95.7%.由此可见,在20~30℃时氢营养型产甲烷菌对温度胁迫更加敏感,而在15℃以下时乙酸营养营养型产甲烷菌对温度胁迫更加敏感.
关键词:UASB反应器;产甲烷菌;温度胁迫;产甲烷量
* 责任作者, 讲师, banqiaoying@163.com
有机物厌氧生物处理是在一系列微生物的协同代谢作用下完成的,包括水解发酵菌群,产氢产乙酸菌,同型产乙酸菌和产甲烷菌[1-3].其中,产甲烷菌位于食物链的最末端,在产甲烷系统中占有独特的生态位[4].由于产甲烷菌只能利用H2/CO2,乙酸,甲酸,甲胺等简单的底物进行生长代谢,且增殖缓慢,对环境因子变化亦较敏感,因此通常被认为是厌氧生物处理过程的限速步骤[5-6].温度是厌氧微生物重要生态因子之一,它不仅能够影响微生物的生长速率,同时可能会改变微生物的活性、丰富度等[7-8].另外,温度变化可能会引起系统pH值下降和游离氨浓度的增加,进而影响水解,产酸发酵和产甲烷效率,最终影响到厌氧生物处理反应器效能及其稳定性[9-10].
目前,关于温度变化对厌氧反应器中不同营养型产甲烷菌活性影响的报道较少,本研究考察了产甲烷菌群对温度胁迫的响应规律,为厌氧生物处理反应器运行调控提供参考.
1 材料与方法
1.1 接种污泥
接种污泥取自本实验室正在运行的升流式厌氧污泥床反应器(UASB),该反应器长期处理丙酸合成废水(以丙酸为唯一碳源).UASB的运行情况,温度35℃,水力停留时间(HRT)10h,进水COD 3000mg/L,比COD去除率和比甲烷生成率分别为1.4kgCOD/(kgVSS·d)和285.3LCH4/ (kgCODremoved· d).
1.2 静态摇瓶试验
静态摇瓶试验采用间歇培养方式进行,实验容器为150mL血清瓶.每个血清瓶中加入10mLUASB反应器中的厌氧颗粒污泥(MLVSS为2.4g/L)和40mL液体培养基,其中碳源分别为H2/CO2(150mL,体积比4:1)或乙酸(500mg/L).将培养液pH值用1mol/L HCl 或1mol/L NaOH调至7.0.然后将血清瓶分别置于5个恒温空气浴摇床(15,20,25,30,35℃)进行静态摇甁试验.每个温度梯度做3个平行样,数据分析取其平均值.每12h测定一次产气量,气体组成,每24h测定一次挥发酸组成.
1.3 DNA提取和qPCR分析
取0.15g污泥样品用磷酸缓冲液冲洗若干次进行DNA提取.基因组DNA提取采用DNA提取试剂盒(MO Bio Laboratories,Inc.,Carlsbad,CA, USA).以前的研究发现,该UASB反应器中的产甲烷菌主要来自产甲烷丝状菌属(Methanosaeta)和产甲烷螺旋菌属(Methanospirillum)[11].因此,对这两个属的产甲烷菌进行定量分析.所用引物分别为,Methanosaeta,5′-GCATCGAGATTTAAAG CTC-3′,5′-AGCCAGATTTGTAACCTGGC-3′;M ethanospirillum,5′-AACGGCCCAACAAGCCT GTC-3′,5′-GGACTTGTATATCCAGCA CG-3′.
本实验中的定量分析采用绝对定量方式.标准样品为含目的基因序列的重组pMD18-T质粒.将标准样品进行10倍梯度稀释(101~107).标准样品和待测样品同时进行实时荧光定量PCR检测(qPCR).qPCR在荧光定量分析系统(Model 7500,ABI,Foster,CA,USA)中完成,所用荧光染料为SYBR green.反应体系:引物1μmol/L,SYBR Green Mix 10μL(Toyobo Co.,LTD.,Japan),H2O 5.96μL,ROX 0.04μL,DNA模板3μL.反应程序:94℃预变性1min,94℃ 15s,58℃ 30s,72℃ 35s数据采集,40个循环.每个qPCR反应设置3个重复.以达到对数增长时的循环数(Ct值)为横坐标,标准质粒数目的对数值为纵坐标绘制标准曲线,得到关于Methanospirillum和Methanosaeta的一元线性回归方程分别为y=-0.3051x+11.626 (R2= 0.9929),y=-0.2669x+10.455 (R2=0.9982).
1.4 分析项目及方法
生物量(挥发性悬浮固体总量MLVSS)采用标准方法测定[12],甲烷发酵产气量通过10~50mL的玻璃注射器排气计量.发酵气体的组分和挥发酸浓度分别采用山东鲁南瑞虹化工仪器有限公司的SP-6800A型(TCD检测器)和SP-6890型(FID检测器)气相色谱测定.累计甲烷产量参照Owen法进行计算[13].
1.5 动力学分析
不同温度下的产甲烷动力学分析参照Gompertz模型.公式如式(1):
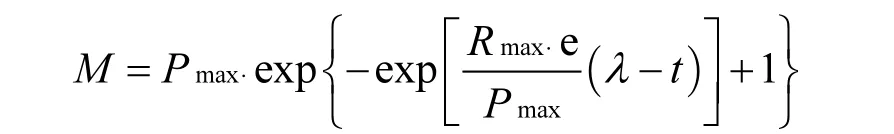
其中:M为反应t(h)累计甲烷产量,mL;Pmax为最大产甲烷量,mL;Rmax为最大产甲烷速率,mL/h;,λ为延迟时间,h.将累计甲烷产量和相应反应时间代入公式,用统计软件Origin 8.0计算出Pmax、Rmax、λ[14].
2 结果与讨论
2.1 产甲烷菌的定量分析
在进水COD 3000mg/L和35℃条件下, UASB 的COD去除率为95%,比产甲烷速率为0.26L/g CODremoved,说明一些较高活性的产甲烷菌存在于该系统中.基于16S rRNA基因序列的PCR-DGGE分析表明,产甲烷丝状菌属(Methanosaeta)为该系统中优势乙酸营养型产甲烷菌,而优势氢营养型产甲烷菌为产甲烷螺旋菌属(Methanospirillum)[11].产甲烷丝状菌只能利用乙酸作为底物,而产甲烷螺旋菌只能利用H2/CO2作为底物[15-16].为了考察UASB中这两类产甲烷菌的数量,对它们进行了qPCR分析.结果表明,Methanosaeta的数量为2.7×10516SrRNA基因拷贝数/ngDNA.Methanospirillum的数量比Methanosaeta少了2个数量级,只有1.8×10316S rRNA基因拷贝数/ng DNA.已有研究结果表明,在乙酸含量较低的生物反应器中Methanosaeta为优势乙酸营养型产甲烷菌,而且Methanosaeta在颗粒污泥中的含量要高于絮状污泥[17-18].这可能是由于产甲烷丝状菌特殊的形态有利于颗粒污泥形成的原因.
2.2 甲烷生成对温度胁迫的响应规律
定量分析的结果表明,氢营养型产甲烷菌和乙酸营养型产甲烷菌分别来自产甲烷螺旋菌属和产甲烷丝状菌属.H2/CO2和乙酸不仅是产甲烷菌可利用的主要底物,而且是有机物厌氧生物处理过程中重要的中间代谢产物.为了了解温度对不同营养类型产甲烷菌活性的影响,本研究分别以H2/CO2和乙酸作为底物考察温度降低对氢营养型产甲烷菌和乙酸营养型产甲烷菌活性的影响.图1表明,在35℃条件下,接种培养60h后累计产甲烷量就达到了最大值24.7mL.当温度从35℃分别降低至30℃和25℃时,甲烷生成速率降低,最终累计产甲烷量比对照(35℃)减少了14.2%和34.0%(表1).
当温度分别降低至20℃和15℃时(图1),甲烷的生成出现了明显的停滞期,该停滞期约为24~28h,表明低温对氢营养型产甲烷菌代谢活性造成了显著抑制作用.经过24~28h的停滞期后,累积产甲烷量开始逐渐增加,表明氢营养型产甲烷菌经过24h的适应,其代谢活性缓慢恢复.累计产甲烷量最后分别稳定在13.1,10.5mL左右.值得注意的是,20和15℃时的累积产甲烷趋势与35,30,25℃时的累积产甲烷趋势明显不同.20℃和15℃时出现了明显的停滞期,更重要的是累积产甲烷量呈线性增加趋势,而35,30,25℃时的累积产甲烷量呈现的是先线性增加,后缓慢增加(平台期)的趋势.这2种累积产甲烷趋势的不同,意味着在20℃和15℃继续延长培养时间,产甲烷量会持续增加,而在35,30,25℃条件下产甲烷量则不会持续增加.由此可以看出,低温对氢营养型产甲烷菌的胁迫是通过控制半速度常数Ks来实现的.随着温度的下降,Ks迅速增加,使得氢营养型产甲烷菌对H2/CO2转化速率显著下降,最终导致甲烷产量的下降.
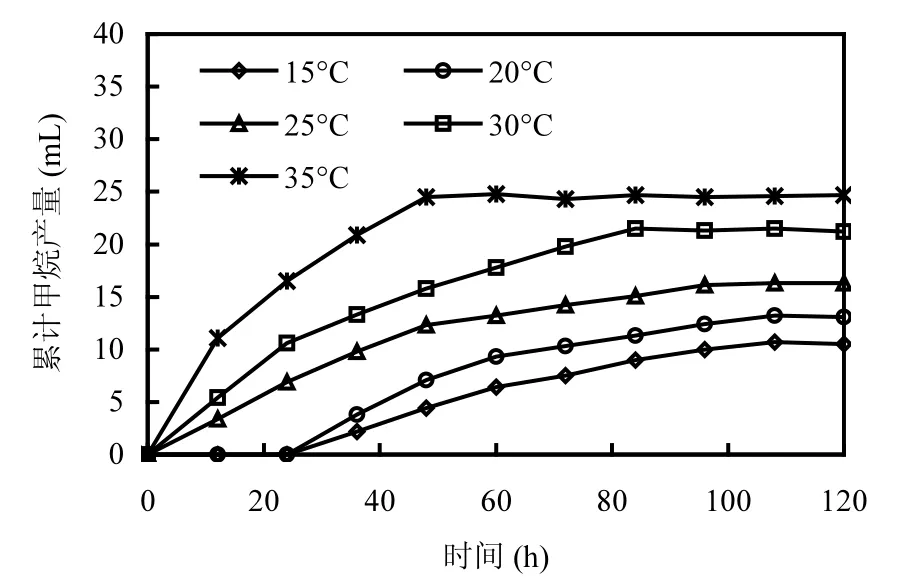
图1 不同温度条件下氢营养型产甲烷菌甲烷产量Fig.1 CH4 production of hydrogenotrophic methanogens at different temperature conditions
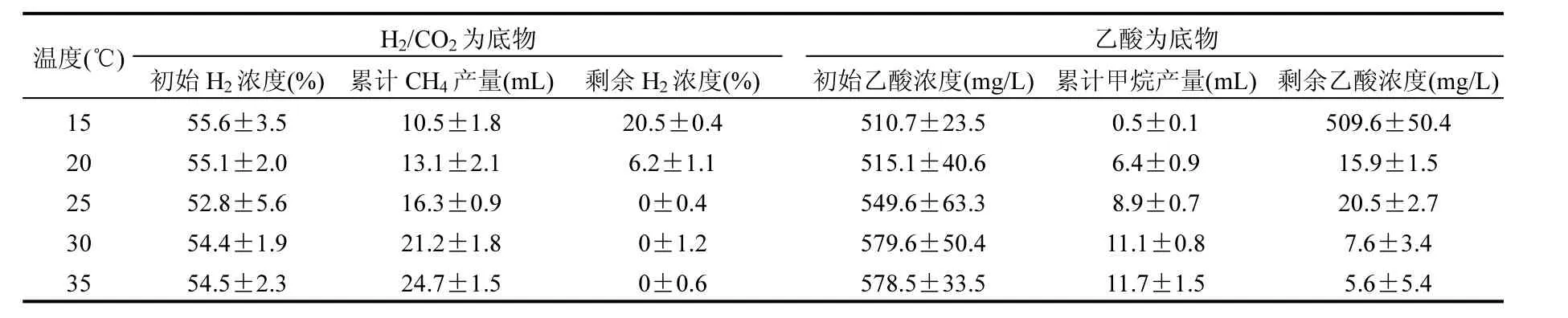
表1 不同温度条件下的产甲烷特征Table 1 Methanogenic characteristics at different temperature conditions
如图2所示,当以乙酸为底物时,产甲烷菌在35℃条件下表现出良好的活性,在接种培养84h后累计产甲烷量达到最大值11.7mL.温度从35℃降低至30,25,20,15℃导致产甲烷速率显著降低.在30,25,20℃,15℃条件下的累计产甲烷量比对照(35 ℃)分别减少了5.1%,23.9%,45.3%,95.7%(表1).
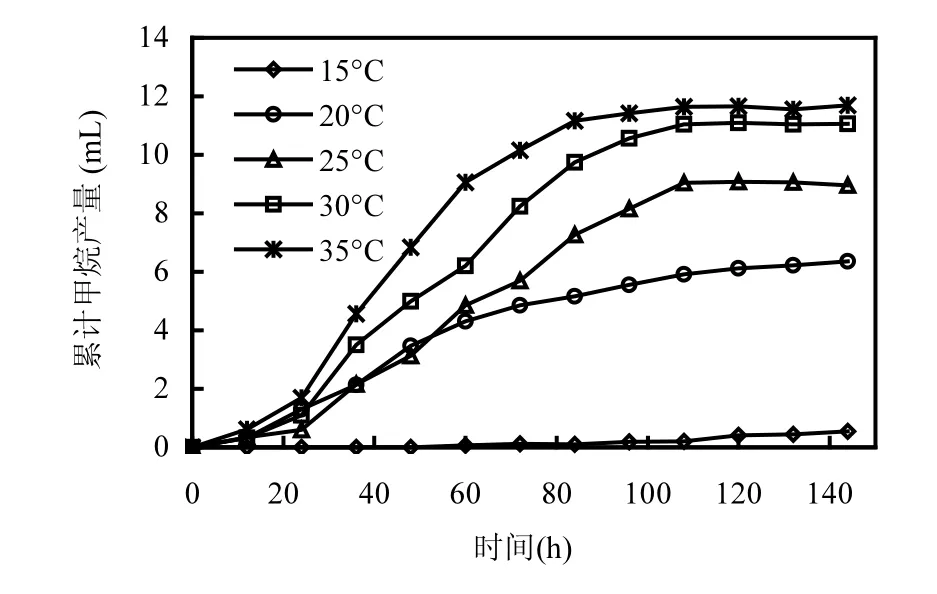
图2 不同温度条件下乙酸营养型产甲烷菌甲烷产量Fig.2 CH4 production of acetotrophic methanogens at different temperature conditions
当温度降低至15℃时(图2),甲烷的生成出现了明显的停滞期,并且该停滞期长达96h,表明低温对乙酸营养型产甲烷菌代谢活性造成了严重的抑制作用.尽管经过了96h的停滞期,累积产甲烷量有所增加,但甲烷产量与35℃时相比,减少了95.7%.可见,低温(15℃)对乙酸营养型产甲烷菌代谢活性造成了长期的抑制作用.与氢营养型产甲烷菌累积产甲烷趋势相似,乙酸营养型产甲烷菌在35,30,25,20℃时的累积产甲烷量也是先线性增加,后缓慢增加(平台期),而在15℃时出现了96h的停滞期,且随后累积产甲烷量呈线性增加趋势.由此可见,低温对乙酸营养型产甲烷菌的胁迫也是通过控制半速度常数Ks来实现的,温度的下降导致Ks迅速增加,使得乙酸营养型产甲烷菌利用乙酸的速率显著下降,导致甲烷产量的迅速下降.尽管在15℃条件下,乙酸营养型产甲烷菌的活性一直比较低,但如果延长培养时间,乙酸营养型产甲烷细菌可能适应低温环境后仍会表现出一定的产甲烷性能.在以前的研究中,也证实了这一点[11].
结合图1和图2可以看出,温度降低对2种营养类型的产甲烷菌的代谢活性都产生了抑制作用,这是因为任何自发反应总是朝着吉布斯自由能减小的方向进行,而吉布斯自由能是温度的状态函数,温度下降会使吉布斯自由能增加,进而导致反应速率的下降.从不同温度条件下累积产甲烷趋势上可以进一步看出,低温对两类产甲烷菌的胁迫是通过控制半速度常数Ks来实现的,温度的下降导致Ks迅速增加,使得两类产甲烷菌代谢速率显著下降,导致甲烷产量的迅速下降. Lawrence等[18]研究发现,当温度从35℃降至20 ℃,乙酸盐转化为甲烷的Ks值从164mg/L增加到了2130mg/L,与本研究的结果一致.
另外,本研究还发现温度降低对不同营养类型产甲烷菌代谢活性的抑制程度存在差异.在20~30℃时乙酸营养营养型产甲烷菌表现出更好的耐受性,而在15℃以下时氢营养型产甲烷菌则表现出更好的耐受性,这可能与温度降低对2种营养类型的半速度常数Ks影响程度不同.在20~30℃时,温度降低对乙酸产甲烷Ks的影响程度弱于H2/CO2产甲烷Ks,而在15℃以下时氢营养型产甲烷菌则表现出更好的耐受性.换言之,乙酸营养营养型产甲烷菌在低温条件下微生物活性丧失更快.
2.3 动力学分析
如表2所示,拟合系数(R2)均大于0.98,表明该模型用来描述累计产甲烷量的进程是合理的. 在35℃条件下,氢营养型产甲烷菌的最大产甲烷速率(Rmax)为0.74mL/h,而最大甲烷产量(Pmax)为24.5mL.温度从35℃分别降至30,25,20,15℃,导致Rmax和Pmax分别减少了58.1%~63.3%和29.5%~58.9%.当温度≥30℃,甲烷生成没有被延迟,但是温度≤25℃时,甲烷生成推迟了1.7~28.7h.对于乙酸营养型产甲烷菌而言,当温度从35℃降低至30,25,20,15℃时,Pmax和Rmax减少2.5%~65.8%和13.5%~92.6%.与对照(35℃)相比,温度下降导致λ增加了0.4~7.4倍.
甲烷生成动力学的结果表明,氢营养型产甲烷菌对温度下降具有更好的适应性.因此,在相同温度条件下,氢营养型产甲烷菌的甲烷生成速率高于乙酸营养型产甲烷菌.尽管在15℃条件下,2类产甲烷菌的甲烷生成速率都比较低,但乙酸营养型产甲烷菌表现出了更长的迟滞期.该结果很好解释了在15~20℃时UASB反应器中氢分压不会增加而乙酸出现短时间积累的原因,这与Høj等[19]前期研究结果一致.
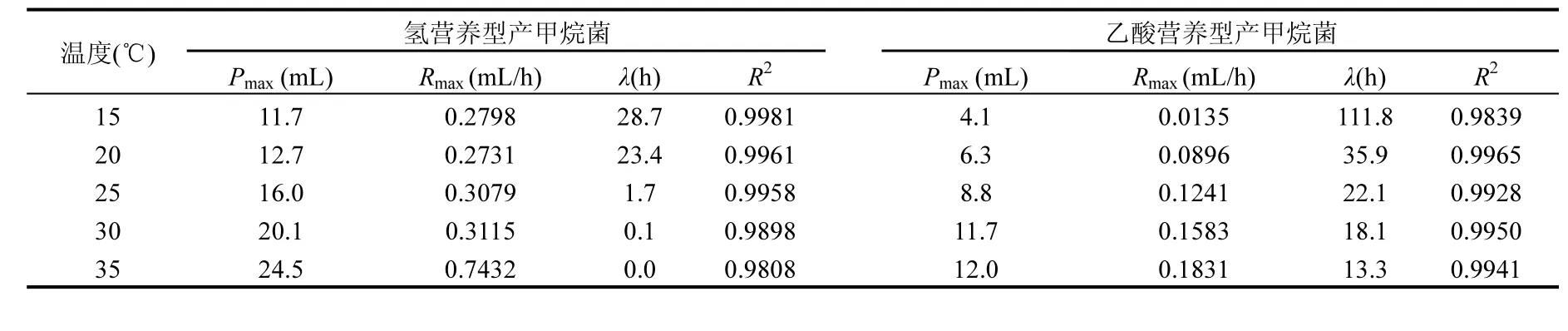
表3 不同温度条件下产甲烷动力学分析Table 3 Kinetic parameters of methane production under different temperatures
3 结论
3.1 温度下降可导致氢营养型产甲烷菌和乙酸营养型产甲烷菌活性受到抑制,并且温度降低对不同营养类型产甲烷菌活性的抑制程度存在显著差别.在20~30℃时乙酸营养营养型产甲烷菌对温度胁迫表现出更好的耐受性,而在15℃以下时氢营养型产甲烷菌则表现出更好的耐受性.
3.2 温度降低使两类产甲烷菌的Pmax和λ发生了显著变化.氢营养型产甲烷菌的Pmax由35℃时的24.5mL逐渐降低至15℃时的11.7mL,λ被延长了1.7~28.7h.而乙酸营养型产甲烷菌Pmax比35
℃条件下减少了2.5%~92.6%,λ被显著延长,特别是在15℃时λ达到了111.8h.
参考文献:
[1] 何 强,孙兴福,艾海男,等.两相一体式污泥浓缩消化反应器运行效能及其微生物特性 [J]. 中国环境科学, 2012,32(11):2039-2046.
[2] 张立国,李建政,班巧英,等.pH对UASB运行效能及产甲烷互营菌群的影响 [J]. 哈尔滨工业大学学报, 2013,45(8):44-49.
[3] 张立国,李建政,班巧英,等.升流式厌氧污泥床和连续流搅拌槽式反应器的废水处理效能及产甲烷菌群组成的对比分析 [J].科技导报, 2012,30(31):23-27.
[4] Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea [J]. Annals of the New York Academy of Sciences, 2008,1125:171-189.
[5] 陈广银,郑 正,常志州,等.不同氮源对麦秆厌氧消化过程的影响 [J]. 中国环境科学, 2011,31(1):73-77.
[6] 宋佳秀,任南琪,钱东旭,等.醌呼吸影响厌氧消化产CO2/CH4及转化有毒物质的研究 [J]. 中国环境科学, 2014,34(5):1236-1241.
[7] Glissmann K, Chin K J, Casper P, et al. Methanogenic pathway and archaeal community structure in the sediment of eutrophic lake dagow: effect of temperature [J]. Microbial Ecology, 2004,48:389-399.
[8] Leitão R C, van Haandel A C, Zeeman G, et al. The effects of operational and environmental variations on anaerobic wastewater treatment system: A review [J]. Bioresource Technology, 2006, 97:1105-1118.
[9] Borja R, Bank C J. Responses of an anaerobic fluidized bed reactor treating ice-cream wastewater to organic, hydraulic, temperature and pH shocks [J]. Journal of Biotechnology, 1995, 36:251-259.
[10] El-Mashad H E M H. Solar thermophilic anaerobic reactor (STAR) for renewable energy production [D]. Ph.D. Thesis. Wageningen University, 2003.
[11] Ban Q, Li J, Zhang L, Jha A K, et al. Syntrophic propionate degradation response to temperature decrease and microbial community shift in an UASB Reactor [J]. Journal of Microbiology and Biotechnology, 2013,23:382–389.
[12] APHA. Standard methods for the examination of water and wastewater [M]. American Public Health Association (Ed). Washington, 1995.
[13] Owen W F, Stuckey D C, Healy J B, et al. Bioassay for monitoring biochemical methane potential and anaerobic toxicity [J]. Water Research, 1979,13:485-492.
[14] Chang S, Li J, Liu F. Evaluation of different pretreatment methods for preparing hydrogen-producing seed inocula from waste activated sludge [J]. Renewable Energy, 2011,36:1517-1522.
[15] Demirel B, Scherer P. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass methane: a review [J]. Reviews in Environmental Science and Bio/Technology, 2008,7:173-190.
[16] Ferry J G, Smith P H, Wolfe R S. Methanospirillum, a new genus of methanogenic bacteria, and characterization of Methanospirillum hungatei sp. nov [J]. International Journal of Systematic Bacteriology, 39(1974):10-13.
[17] Zheng D, Raskin L. Quantification of Methanosaeta species in anaerobic bioreactors using genus- and species-specific hybridization probes [J]. Microbial Ecology, 2000,39:246-262.
[18] Lawrence A W, McCarty P L. Kinetics of methane fermentation in anaerobic treatment [J]. Water Pollution Control Federation. 1969, 41(2):1-17.
[19] Høj L, Olsen R A, Torsvik V L. Effects of temperature on the diversity and community structure of known methanogenic groups and other archaea in high arctic peat [J]. ISME Journal, 2008,2:37-48.
水厌氧生物处理研究.
Response of methanogens on temperature stress in an UASB reactor.
ZHANG Li-guo1, BAN Qiao-ying1*, LI Jian-zheng2(1.College of Environment and Resource, Shanxi University, Taiyuan 030006, China;2.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2016,36(4):1082~1086
Abstract:The effects of temperature stress on different nutrition type methanogens in an upflowed anaerobic sludge blanket (UASB) reactor was investigated by batch culture. The results showed that the dominant hydrogenotrophic and acetotrophic methanogens in this reactor were Methanospirillum and Methanosaeta, respectively. Under 35℃ condition, the accumulative methane production from hydrogenotrophic and acetotrophic methanogens were 24.7 and 11.7mL, separately. And the maximum methane production rate (Rmax) were 0.74 and 0.18mL/h, respectively. Temperature decreases, from 35℃ to 30, 25, 20, 15℃, resulted in accumulative methane productions from hydrogenotrophic methanogens were decreased by 14.2%, 34.0%, 47.0%, 57.5%, respectively. While those from acetotrophic methanogens were reduced by 5.1%, 23.9%, 45.3%, 95.7%, separately. These results indicated that hydrogenotrophic methanogens are more sensitive to temperature tress at 20~30℃, while acetotrophic methanogens are more sensitive at ≤15℃.
Key words:UASB reactor;methanogens;temperature stress;methane production
作者简介:张立国(1980-),男,河南安阳人,讲师,博士,主要从事废
基金项目:国家自然科学基金项目(51508316);山西省基础研究项目(2015021136,2015021134)
收稿日期:2015-09-18
中图分类号:X703.5
文献标识码:A
文章编号:1000-6923(2016)04-1082-05
