长期储存亚硝化颗粒污泥的活化及菌群结构变化
2016-05-27钱飞跃王建芳王书永沈耀良苏州科技学院环境科学与工程学院江苏苏州25009江苏省环境科学与工程重点实验室江苏苏州25009江苏省水处理技术与材料协同创新中心江苏苏州25009
钱飞跃,王 琰,王建芳*,王书永,沈耀良(.苏州科技学院环境科学与工程学院,江苏 苏州25009;2.江苏省环境科学与工程重点实验室,江苏 苏州 25009;3.江苏省水处理技术与材料协同创新中心,江苏苏州 25009)
长期储存亚硝化颗粒污泥的活化及菌群结构变化
钱飞跃1,2,3,王 琰1,王建芳1,2,3*,王书永1,沈耀良1,2,3(1.苏州科技学院环境科学与工程学院,江苏 苏州215009;2.江苏省环境科学与工程重点实验室,江苏 苏州 215009;3.江苏省水处理技术与材料协同创新中心,江苏苏州 215009)
摘要:采用无机人工配水,通过逐级提高进水氨氮负荷(0.32~0.64kg/(m3⋅d))和设定合适的初始游离氨浓度(3.7~7.2mg/L),在SBR反应器中对常温(24~29℃)下储存1a的亚硝化颗粒污泥(NGS)进行了活化,并使用Miseq高通量测序技术分析了污泥中微生物多样性的变化情况.结果表明, NGS的亚硝化性能可在短时间内恢复.运行8d后,反应器的氨氮去除率达到95%以上,亚硝态氮累积率超过了80%,但污泥粒径持续减小,胞外聚合物(EPS)含量明显降低.活化至第20d,NGS的氨氮比去除速率和亚硝态氮比累积速率分别达到24.6mg/(gVSS⋅h)、23.8mg/(gVSS⋅h),平均粒径稳定在0.5mm左右.在活化期间,绝大部分厌氧、异养菌属被洗脱,污泥的微生物多样性显著降低.Nitrosomonas等氨氧化菌的相对丰度由活化前的1%上升至约58%,同时,Nitrospira等硝化菌的生长受到了选择性抑制.这意味着即使经历长期的常温储存,NGS仍可作为SBR的接种污泥,实现反应器的快速启动.
关键词:亚硝化颗粒污泥;活化;微生物多样性;优势菌群
* 责任作者, 副教授, wjf302@163.com
有研究表明,通过培养具有规则三维结构、优良沉降性能和极高氨氧化菌(AOB)丰度的亚硝化颗粒污泥(NGS),可获得高效的亚硝态氮累积,有助于实现OLAND、CANON等新型生物脱氮工艺的稳定运行[1-3].由于AOB等自养菌的世代时间较长,自凝聚能力偏弱,对环境变化较为敏感,因此,基于絮状污泥培养高性能的NGS存在很大难度[4-5].相比之下,利用存储污泥的快速活化,可显著缩短反应器的启动周期,有效突破限制NGS工程化应用的技术瓶颈[6-7].然而,好氧颗粒污泥经历长期闲置或储存后,会出现优势菌衰减、厌氧内核水解、丝状菌过度生长等功能结构的破坏性变化,该过程受到储存时间、营养基质和环境温度等因素的影响[8-9].与冷藏(4℃)和冷冻(<-25℃)条件相比,好氧颗粒污泥在常温下储存更易发生解体和失活,活化难度更高[10-11].
为进一步探明储存污泥的活化性能,本研究将常温下储存1a的NGS作为接种污泥,并选取合适的运行工况启动SBR反应器,在系统考察污泥亚硝化性能恢复、外观形态与胞外聚合物(EPS)组成变化的同时,采用Miseq高通量测序技术对活化前后NGS的菌群结构进行了分析.
1 材料与方法
1.1 实验装置与运行条件
实验装置采用圆柱形SBR反应器,有效容积为4L(高径比10/1),由有机玻璃制成.反应器底部装有曝气头,反应期间控制曝气量为3L/min(表面上升流速1cm/s),以提供充足的溶解氧(DO)和水力剪切力.反应器排水比设为1/2,接种污泥量(MLSS)约4100mg/L.采用时间程序控制器实现对间歇操作的自动控制,单个周期为3h,其中,7min进水,排水和闲置共3min,曝气时间和沉降时间的设置如表1所示.活化期间,SBR始终置于恒温水浴箱中,温度控制在28~30℃.
1.2 接种污泥性质
接种污泥为常温条件下长期储存的亚硝化颗粒污泥.NGS在储存前呈规则的棕黄色颗粒,氨氮容积负荷2.0kg/(m3·d),亚硝态氮累积率可达(85±5)%,形态特征如表2所示[12].以无机磷酸盐缓冲溶液(pH约7.6)为基质,NGS在24~29℃下储存1a后,大部分颗粒依旧呈现光滑的圆球状结构,但平均粒径和MLVSS/MLSS均明显下降,污泥体积指数(SVI)略有增加,颜色由存储前的棕黄色变为灰色(上层)和黑色(下层).污泥经历长时间内源呼吸和厌氧消化后,无机化程度提高,可能会产生甲烷、硫化氢等气体,因而带有轻微的臭鸡蛋气味[11,13].

表1 SBR反应器的操作运行参数Table 1 Operating parameters of SBR reactor

表2 不同状态下,亚硝化颗粒污泥的性状特征Table 2 Characteristics of the nitrosation granular sludge under different conditions
1.3 反应器进水
进水采用人工配制的无机含氮废水,以氯化铵为氮源(80~160mgN/L).通过投加碳酸氢钠,调节溶液pH至8.0.其他成分还包括磷酸二氢钾/磷酸氢二钾(18mgP/L)、硫酸镁(49mg/L)、氯化钙(60mg/L)、氯化铁(1.5mg/L)及必需微量元素.
1.4 常规分析方法
MLSS、MLVSS、SVI、NH4+-N、NO2--N、NO3--N等指标采用国标法测定.溶液pH、DO分别使用PB-10型pH计(Sartorius,Germany)和H1946N型溶解氧测定仪(WTW,U.S.)测定.污泥形态通过CX41型显微镜(OLYMPUS,Japan)进行观察.
粒径分布采用筛分法测算.定期从反应器中取出污泥样品,经生理盐水反复清洗后,依次通过孔径2.50mm,1.60mm,1.25mm,0.80mm,0.50mm 和0.30mm的分样筛,并计算各粒径区间样品占总质量的百分比.
采用甲醛-NaOH法[14]对颗粒污泥的EPS进行提取,其主要包含蛋白质(PN)和多糖(PS)组分.PN、PS含量分别采用苯酚-硫酸法和改进Lowry法测定.
1.5 微生物高通量测序分析
取适量污泥样品,使用E.Z.N.A Soil DNA 试剂盒(Omega Bio-tek,Norcross,GA,U.S.)提取微生物总DNA.以16S rRNA V3~V4区内338F (5'-ACTCCT ACGGGAGGCAGCA-3')和806R (5'-GGACTAC HVGGGTWTCTAA T-3')为特征引物, 采用20µL混合反应体系,在GeneAmp 9700 (ABI) 型PCR扩增仪上完成目标片段扩增.反应程序为95℃预变性2min,95℃变性30s, 55℃退火30s, 72℃延伸30s,25个循环后,72℃延伸5min.每个样品重复3次.
使用AxyPrepDNA凝胶回收试剂盒(Axygen,Union City,CA,U.S.)对PCR扩增产物进行回收.基于Illumina Miseq PE300平台,委托上海美吉生物医药科技有限公司完成对PCR扩增产物的高通量测序.在多样性评估的基础上,采用Qiime软件进行微生物分类学分析.
2 结果与讨论
2.1 亚硝化性能的恢复
考虑到接种污泥中微生物长期处于内源代谢状态,活性较低,因此,采用较低的进水氨氮负荷(0.32kg/(m3·d))启动SBR反应器,不投加任何有机物,保持DO在4mg/L以上,水温为28℃.同时,控制进水pH值为8.0~8.1,确保各周期初始的游离氨(FA)浓度在3.7~6.4mg/L之间,以选择性抑制Nitrobacter、Nitrospira等硝化菌(NOB)的生长[15-17].如图1所示,在第1~8d内,反应器对氨氮去除率逐渐增大,最终达到95%以上,亚硝态氮累积率超过80%.此后,分阶段将进水氨氮负荷提高至0.64kg/(m3·d),初始FA浓度升至约7.2mg/L,反应器出水中亚硝态氮浓度逐级增大,剩余氨氮和硝态氮浓度分别低于0.5mg/L和15mg/L, 亚硝态氮累积率稳定在90%以上.

图1 颗粒污泥亚硝化性能的变化Fig.1 Ammonia oxidizing performance of nitrosation granular sludge

图2 活化20d后,NGS在批次实验中的氮转化性能Fig.2 Nitrogen transformation after 20days reactivation of NGS
氨氮比去除速率、亚硝态氮比累积速率等是表征污泥亚硝化性能的重要参数.本研究通过批次试验(初始NH4+-N 85mg/L,pH 8.0,水温28℃),对活化20d后的NGS性能进行了考察,结果如图2所示.反应75min后,NGS对氨氮的去除率接近100%.在此期间,氨氮去除与亚硝态氮、硝态氮累积过程符合零级动力学特性,这与Cydzik-Kwiatkowska[18]的研究结果一致.NGS的氨氮比去除速率[μ(NH4+-N)]、亚硝态氮比累积速率[μ(NO2--N)]和硝酸氮比累积速率[μ(NO3--N)]分别为24.6mg/(gVSS·h)、23.8mg/(gVSS·h)、1.5mg/ (gVSS·h),亚硝态氮累积率达到95%.这意味着NGS的亚硝化性能已得到良好的恢复.需要指出的是,本研究采用无机人工配水作为NGS的活化基质,更有利于实现AOB的高度富集,其氨氮去除效能要远优于郑照明等[19]基于城市生活污水培养的亚硝化颗粒污泥[µ(NH4+-N)=9.8mg/ (gVSS·h)].
2.3 污泥形态与EPS组成的变化
在活化过程中,颗粒污泥的外观形态也发生了显著变化.反应器启动仅2d,污泥颜色便由长期放置后的黑灰色变为淡棕黄色.如图3所示,颗粒解体现象明显,在第0~12d内,污泥平均粒径由1.50mm迅速降至0.80mm以下,随后稳定在0.5mm左右.

图3 亚硝化颗粒污泥的形态变化Fig.3 Morphological variation of nitrosation granular sludge
由图4可知,接种污泥中粒径在1.25mm以上的颗粒质量百分比为61.2%,粒径小于0.3mm的污泥量极少.活化12d后,粒径在0.3~0.8mm的污泥占到总量的69.4%,粒径在1.6mm以上的颗粒基本消失.活化20d后,粒径在0.3~0.5mm的污泥量超过了50%. Gao等[20]从改善氧传质条件的角度认为,好氧颗粒污泥的最佳尺寸应小于0.5mm.对于NGS而言,AOB等自养菌的生长速度缓慢,形成的颗粒结构更加致密,传质受限更为严重,因此,最佳的粒径尺寸相对较小[6].

图4 亚硝化颗粒污泥粒径分布的变化Fig.4 Variation of particle size distribution of nitrosation granular sludge

图5 亚硝化颗粒污泥MLSS和SVI值的变化Fig.5 Variation of MLSS and SVI values of nitrosation granular sludge
Gao等[10]的研究表明,好氧颗粒污泥在常温条件下储存时,微生物较强的内源呼吸会导致大量细胞水解,胞外聚合物含量增多,颗粒结构变得松散.在水力剪切和高选择压的共同作用下,污泥解体产生的絮体和沉降性较差的颗粒将随水流排出,反应器内MLSS在初始阶段快速降至约3000mg/L,SVI值有所增大,见图5.另外,洗脱过量的EPS(尤其是凝胶型多糖)将有助于降低基质传递阻力,促进AOB在颗粒表面的进一步富集[21-22].随着污泥活性的逐渐恢复,EPS总量有所减少,最终将至初始值的72.6%,PN/PS约为1.4,如表3所示.与异养微生物相比,AOB等自养菌分泌EPS的能力较弱,因此,NGS的EPS总量势必低于普通好氧颗粒污泥的水平[23-24].
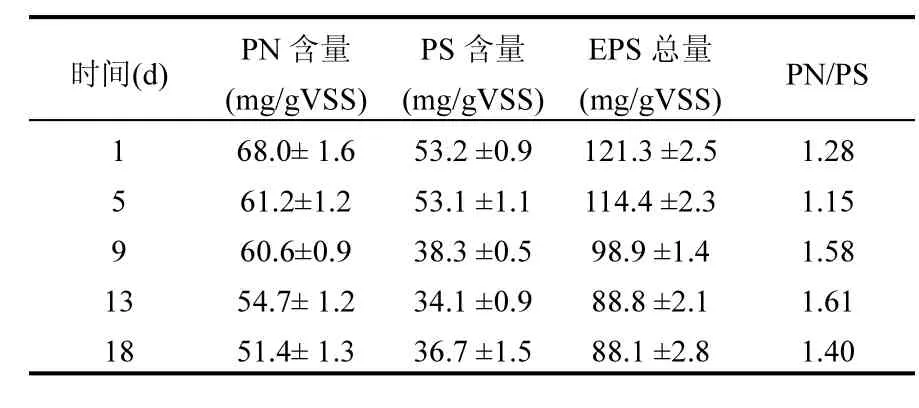
表3 亚硝化颗粒污泥EPS组成的变化情况Table 3 Variation of EPS composition of nitrosation granular sludge
2.3 微生物菌群结构的变化
利用Miseq高通量测序平台对颗粒污泥中微生物多样性进行分析.高达99.89%的覆盖率表明,测序结果能真实反映样品中的菌群分布情况.在活化前后,NGS中的细菌分别从属于24个门、47个纲、116个属和18个门、40个纲、107个属.由Chao1和ACE指数可知,活化20d的污泥拥有更高的微生物物种丰度.同时,随着亚硝化性能的恢复与提升,NGS中微生物多样性有所降低,表现为Shannon指数的减小和Simpson指数的增大,如表4所示.
由图6可知,活性污泥中常见的Proteobacteria门在两组样品中均占居主导地位,但长期储存的颗粒污泥中属嗜盐异养菌的α-proteobacteria纲和γ-proteobacteria纲比例更高,活化后NGS中β-proteobacteria纲则占到了真细菌总量的61.6%,后者几乎覆盖了所有类型的AOB[7,25].在活化过程中,接种污泥经历了由厌氧储存到好氧反应、内源呼吸到硝化增殖的环境剧变,颗粒结构发生了明显解体,部分微生物以絮体的形式随水流排出,优势菌群完成了更替.活化20d后,厌氧微生物Synergistia纲[26]、Anaerolineae 纲[27]、Phycisphaerae纲[28]、vadinHA17纲[29]和Acidobacteria纲[30]等的相对丰度大幅降低,甚至呈现未检出状态,同时,与EPS分泌密切相关的Flavobacteria[7]明显增多,丰度值由0.07%升至3.84%.

表4 活化前后,NGS中微生物丰度与多样性情况(相似度97%)Table 4 Microbial abundance and diversity of NGS before and after the reactivation (similarity degree 97%)

图6 活化前后,亚硝化颗粒污泥中各菌群在纲级别上的相对丰度Fig.6 Relative abundances of different microbial classes in NGS before and after the reactivation
在贫营养条件下,AOB、NOB等自养菌的维持能更低、酶活性更高、衰减速率更慢,有利于在与异养菌的生存竞争中占据优势[2].Wang等[21]发现,当C/N=200/80时,好氧颗粒污泥中氨氧化细菌Nitrosomonas和硝化细菌Nitrospira的活化速度明显快于异养微生物,前者仅需11d即可完全恢复至储存前的状态.表5给出了活化前后污泥样品中主要菌属的相对丰度.由于采用无机含氮配水,以Nitrosomonas和Nitrosomonadaceae_ uncultured为代表的AOB取代Synergistaceae、Pseudorhodobacter、Anaerolineaceae、Thiobacillus、Limnobacter和Comamonadaceae等厌氧异养型菌属,成为颗粒污泥中的优势菌群. AOB的相对丰度由活化前的1%上升至58%左右,高于大多数硝化颗粒污泥中AOB的丰度值19.0%~ 60.6%[18,24,27,31].同时,Nitrospira等NOB的生长得到了有效抑制.

表5 活化前后,颗粒污泥中主要菌属的相对丰度Table 5 Relative abundances of main microbial genera in NGS before and after the reactivation
总之,本研究通过采取逐级提高进水氨氮负荷、设定合适的初始FA浓度、控制水力剪切和高选择压等措施,较好地实现了富集AOB功能菌、抑制NOB生长和优化颗粒结构等多重目标.
3 结论
3.1 通过采取逐级提高进水氨氮负荷(0.32~ 0.64kg/(m3·d))、设定合适的FA浓度(3.7~ 7.2mg/L)、控制水力剪切和高选择压等措施,在20d内成功活化了常温(24~29℃)下放置1a的亚硝化颗粒污泥.最终,NGS的氨氮比去除速率(µ(NH4+-N))和亚硝态氮比累积速率(µ(NO2--N))分别达到了24.6mg/(gVSS·h)、23.8mg/(gVSS·h),反应器出水中亚硝态氮累积率超过了90%.
3.2 在活化过程中,颗粒污泥出现解体现象,EPS总量持续减少.活化20d后,污泥平均粒径稳定在0.50mm左右,粒径在0.3~0.5mm的污泥量超过了50%,EPS总量减少至初始值的72.6%, PN/PS约为1.4.
3.3 随着NGS亚硝化性能的恢复与提升,微生物多样性显著降低.在厌氧、异养菌洗脱和氨氧化菌增殖的共同作用下,Nitrosomonas成为了优势菌属,其相对丰度由活化前的1%上升至58%左右,同时,Nitrospira等硝化菌的生长得到了有效抑制.
参考文献:
[1] 刘文如,丁玲玲,王建芳,等.低C/N比条件下亚硝化颗粒污泥的培养及成因分析 [J]. 环境科学学报, 2013,33(8):2226-2233.
[2] Okabe S, Oshiki M, Takahashi Y, et al. Development of long-term stable partial nitrification and subsequent anammox process [J]. Bioresource Technology, 2011,102:6801-6807.
[3] Vlaeminck S E, Geets J, Vervaeren H, et al. Reactivation of aerobic and anaerobic ammonium oxidizers in OLAND biomass after long-term storage [J]. Applied Microbiology and Biotechnology, 2007,74(6):1376-1384.
[4] 刘文如,阴方芳,丁玲玲,等.选择性排泥改善颗粒污泥亚硝化性能的研究 [J]. 中国环境科学, 2014,34(2):396-402.
[5] Dytczak M A, Londry K L, Oleszkiewicz J A. Activated sludge operational regime has significant impact on the type of nitrifying community and its nitrification rates [J]. Water Research, 2008, 42(8):2320-2328.
[6] 刘文如,沈耀良,丁玲玲,等.接种好氧颗粒污泥快速启动硝化工艺的过程研究 [J]. 环境科学, 2013,34(6):2302-2308.
[7] Wan C L, Zhang Q L, Lee D J, et al. Long-term storage of aerobic granules in liquid media: Viable but non-culturable status[J]. Bioresource Technology, 2014,166:464-470.
[8] Lee D J, Chen Y Y, Show K Y, et al. Advances in aerobic granule formation and granule stability in the course of storage and reactor operation [J]. Biotechnology Advances, 2010,28(6):919-934.
[9] Zhao Z W, Wang S, Shi W X, et al. Recovery of Stored Aerobic Granular Sludge and Its Contaminants Removal Efficiency under Different Operation Conditions [J]. BioMed Research International, 2013,2013(1):1-8.
[10] Gao D W, Yuan X J, Liang H. Reactivation performance of aerobic granules under different storage strategies [J]. Water Research, 2012,46(10):3315-3322.
[11] Liu Q S, Liu Y, Tay S T L, et al. Startup of pilot-scale aerobic granular sludge reactor by stored granules [J]. Environmental Technology, 2005,26(12):1363-1370.
[12] 刘文如,阴方芳,王建芳,等.限量曝气进水时间对硝化颗粒污泥的影响特性研究 [J]. 环境科学, 2014,35(8):3038-3043.
[13] Zhu J R, Wilderer P A. Effect of extended idle conditions on structure and activity of granular activated sludge [J]. Water Research, 2003,37(9):2013-2018.
[14] Liang Z, Li W, Yang S, et al. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge [J]. Chemosphere, 2010,81(5):626-632.
[15] Anthonisen A C, Loehr R C, Prakasam T B S, et al. Inhibition of nitrification by ammonia and nitrous acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852.
[16] Vadivelu V M, Yuan Z, Fux C, et al. The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched Nitrobacter culture [J]. Environment Science and Technology, 2006,40(14):4442-4448.
[17] Vadivelu V M, Keller J, Yuan Z G. Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched nitrosomonas culture [J]. Biotechnology and Bioengineering, 2006,95(5):830-839.
[18] Cydzik-Kwiatkowska A, Wojnowska-Baryła I. Nitrifying granules cultivation in a sequencing batch reactor at a low organics-to-total nitrogen ratio in wastewater [J]. Folia Microbiologica, 2011,56(3):201-208.
[19] 郑照明,李泽兵,刘常敬,等.城市生活污水SNAD工艺的启动研究 [J]. 中国环境科学, 2015,35(4):1072-1081.
[20] Gao D W, Liu L, Liang H, et al. Aerobic granular sludge: characterization, mechanism of granulation and application to wastewater treatment [J]. Critical Reviews in Biotechnology, 2011,31(2):137-152.
[21] Wang X, Zhang H, Yang F, et al. Long-term storage and subsequent reactivation of aerobic granules [J]. Bioresource Technology, 2008,99(17):8304-8309.
[22] 钱飞跃,王 琰,王建芳,等.好氧颗粒污泥中凝胶型聚多糖的特性研究进展 [J]. 化学通报, 2015,78(4):320-324.
[23] Tsuneda S, Nagano T, Hoshino T, et al. Characterization of nitrifying granules produced in an aerobic upflow fluidized bed reactor [J]. Water Research, 2003,37(20):4965-4973.
[24] Wu L, Peng C Y, Peng Y Z, et al. Effect of wastewater COD/N ratio on aerobic nitrifying sludge granulation and microbial population shift [J]. Journal of Environmental Sciences, 2012, 24(2):234-241.
[25] 张 楠,初里冰,丁鹏元,等.A/O生物膜法强化处理石化废水及生物膜种群结构研究 [J]. 中国环境科学, 2015,35(1):80-86.
[26] Yogananda M, Zhou Y, Guo C H, et al. Determination of the archaeal and bacterial communities in two-phase and singlestage anaerobic systems by 454pyrosequencing [J]. Journal of Environmental Sciences, 2015,36(10):121-129.
[27] Tian M, Zhao F Q, Shen X, et al. The first metagenome of activated sludge from full-scalle anaerobic/anoxic/oxic (A2O) nitrogen and phosphorus removal reactor using Illumina sequencing [J]. Journal of Environmental Sciences, 2015,35(9): 181-190.
[28] 唐霁旭,王志伟,马金星,等.454高通量焦磷酸测序法鉴定膜生物反应器膜污染优势菌种 [J]. 微生物学通报, 2014,41(2): 391-398.
[29] 张会敏,李天婵,孙美青,等.利用非培养技术初步研究古井贡酒窖泥细菌群落结构 [J]. 食品工业科技, 2014,35(13):200-228.
[30] 王伏伟,王晓波,李金才,等.施肥及秸秆还田对砂姜黑土细菌群落的影响 [J]. 中国生态农业学报, 2015,23(10):1302-1311.
[31] Matsumoto S, Katoku M, Saeki G, et al. Microbial community structure in autotrophic nitrifying granules characterized by experimental and simulation analyses [J]. Environmental Microbiology, 2010,12(1):192-206.
Reactivation performance of nitrosation granular sludge after long-term storage and microbial community variation.
QIAN Fei-yue1,2,3, WANG Yan1, WANG Jian-fang1,2,3*, WANG Shu-yong1, SHEN Yao-liang1,2,3(1.School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, China;2.Jiangsu Key Laboratory of Environmental Science and Engineering, Suzhou 215009, China;3.Jiangsu Collaborative Innovation Center of Technology and Material of Water Treatment, Suzhou 215009, China). China Environmental Science, 2016,36(4):1052~1058
Abstract:The reactivation performance of nitrosation granular sludge (NGS), which had been stored at 24~29℃ for a long-term of 1a, was investigated in a sequencing batch reactor (SBR) fed with inorganic synthetic wastewater, via the gradually increasing of the influent ammonia nitrogen loading from 0.32 to 0.64kg/(m3·d) and initial concentration of free ammonia from 3.7 to 7.2mg/L. High throughput sequencing technology of Miseq was also employed to analyze the variation of microbial community before and after the reactivation. Results showed that the stored NGS could be reactivated in a short period of 8days, since the removal effciency of ammonia nitrogen and the accumulation ratio of nitrite nitrogen were higher than 95% and 80%, respectively. Meanwhile, both sludge particle size and extracellular polymer substances (EPS) contents decreased significantly. After 20days reactivation, the specific ammonia nitrogen removal rate of 24.6mg/(gVSS·h) and the specific nitrite accumulation rate of 23.8mg/(gVSS·h) were observed, while average particle size of NGS remained at 0.5mm. During this period, the microbial diversity of NGS decreased obviously, ascribed to the washing out of most of anaerobic and heterotrophic bacteria. The relative abundance of ammonia-oxidizing bacteria, such as Nitrosomonas ect., increased from 1% to 58%, and the growth of nitrite-oxidizing bacteria was inhibited selectively. It indicated that the NGS after a long-term storage could be inoculated in SBR to achieve its rapid start-up.
Key words:nitrosation granular sludge;reactivation;microbical diversity;dominant bacteria community
作者简介:钱飞跃(1986-),男,江西省玉山县人,讲师,博士,主要从事水污染控制化学领域的研究.发表科技论文10余篇..
基金项目:国家自然科学基金(51308367);江苏省高校自然科学研究基金(15KJB610013);校级研究生创新项目(SKCX14_031);校级科研基金(XKY201006);江苏高校优势学科建设工程
收稿日期:2015-09-23
中图分类号:X703
文献标识码:A
文章编号:1000-6923(2016)04-1052-07
