九龙江西陂库区沉积物甲藻孢囊的分布
2016-05-23苏玉萍游雪静钟燕平顾海峰
苏玉萍,薛 铖,游雪静,,钟燕平,顾海峰
1 福建师范大学环境科学与工程学院,福州 350007 2 福建师范大学福建省污染控制与资源循环重点实验室,福州 350007 3 国家海洋局第三海洋研究所,厦门 361005
九龙江西陂库区沉积物甲藻孢囊的分布
苏玉萍1,2,*,薛铖1,游雪静1,3,钟燕平1,顾海峰3
1 福建师范大学环境科学与工程学院,福州3500072 福建师范大学福建省污染控制与资源循环重点实验室,福州3500073 国家海洋局第三海洋研究所,厦门361005
摘要:孢囊在甲藻的生活史中发挥重要作用,福建省九龙江从2009年起,暴发多次拟多甲藻水华事件。采用显微镜观察和单细胞PCR技术,对九龙江西陂库区2012—2013年不同月份沉积物中的甲藻孢囊进行种属判定,并对甲藻孢囊的分布及其影响因素进行分析。结果表明,西陂库区沉积物中的甲藻孢囊主要为拟多甲藻属,约占80%,其次为裸甲藻属,发现了2009年水华的优势种佩式拟多甲藻(Peridiniopsis penardii)孢囊。库区沉积物中甲藻孢囊的丰度在(13.7±1.2)—(105.2±8.3)个/g干重之间。多元相关分析结果显示甲藻孢囊的丰度与含水率呈现显著正相关性(P<0.05),反映了甲藻孢囊沿水流方向逐渐积累。本研究结果填补了国内水库甲藻孢囊鉴定和萌发的研究空白,为九龙江甲藻水华的防治提供科学参考。
关键词:甲藻孢囊;沉积物;分布;九龙江
随着经济和社会发展的需要,福建省多数河流建设梯级水电站,大坝的建设使得水流变缓,氮、磷等营养物质滞留,尤其是在作为饮用水源的水库暴发藻类水华事件[1- 2]。国际上20世纪对淡水甲藻水华事件已有报道,近年来,我国频频发生甲藻水华事件引起了人们广泛关注和众多学者的研究。国内外淡水甲藻水华事件主要是由多甲藻目(Peridiniales)的拟多甲藻属(Peridiniopsis) 以及多甲藻属(Peridinium)的甲藻引起的,其中拟多甲藻属水华事件最为常见,影响最大[3]。甲藻是一类具有休眠细胞的藻类,其休眠细胞称为孢囊,目前研究中所提及的“孢囊”多指休眠性孢囊。休眠性孢囊是用于应对长时间的不良环境所产生的,它由两个游动的配子互相结合产生,经过有性繁殖后形成一个合子。休眠性孢囊在适宜的环境条件下,就会迅速启动萌发机制,并在短时间内大量增殖,甚至形成甲藻水华[4]。甲藻孢囊萌发为水体提供新的营养细胞,从而为甲藻水华暴发提供“种源”;而水华后期,环境条件不适宜时,又会大量形成孢囊,降低水体中营养细胞的数量。所以,甲藻孢囊在甲藻水华的发生和消亡中具有重要作用。全球范围内均有暴发甲藻水华,但多数研究集中在海洋、海峡或是河口地区[5- 7]。郑磊等研究表明,沉积物营养盐含量对于甲藻孢囊的分布具有一定影响,大鹏湾表层沉积物的甲藻孢囊值水平分布上更趋于分布在活性磷含量高但氮磷比值较低的沉积物中[8];王朝晖等人发现甲藻孢囊的种类和数量在与甲藻孢囊粒径相仿的沉积物中较多出现[9];Anderson等人提出,甲藻孢囊的分布与所研究区域的水动力条件、水文和选择性沉积条件相关[10- 11];方琦等人研究了闽江口海域表层沉积物的甲藻孢囊分布情况,沉积物的主要类型为砂-粉砂-粘土,砂质的沉积物中几乎没有甲藻孢囊[12];黄海燕等通过对长江口表层沉积物进行分析,得出沉积物类型是影响甲藻孢囊分布的重要因素[13];Posepelova研究了温度、盐度、生产力以及近海上升流作用下的东北太平洋表层沉积物的甲藻孢囊分布,通过CCA分析得出,海底沉积物温度、生产力是甲藻孢囊分布的主要影响因素[14- 16]。多项研究表明,甲藻孢囊的分布是多种因素综合影响的结果[13,15,17-18]。
研究沉积物中甲藻孢囊的种类,有助于全面认识研究区域中浮游的甲藻,为研究甲藻水华的发生机理及预测提供参考资料[19]。甲藻孢囊的分布会对甲藻水华暴发的位置分布造成影响,通过对沉积物中甲藻孢囊丰度和分布的研究,可以摸清环境条件对于甲藻孢囊的形成及空间分布的影响,有助于掌握当地环境的变化,用于指示人类活动对环境的影响[20- 23]。近年来,福建省主要饮用水源地山仔水库、东张水库、安砂水库、山美水库、东圳水库等均呈现不同程度富营养化趋势,九龙江北溪流域于2009年暴发过佩氏拟多甲藻(Peridiniopsispenardii)水华。因此本研究选取九龙江西陂库区沉积物作为研究对象,研究沉积物中甲藻孢囊的分布和丰度及影响因素,为防治九龙江甲藻水华提供科学的参考,对保障饮用水安全,实现水资源的可持续利用具有重要的意义。
1研究区域概况
九龙江是福建省仅次于闽江的第二大河流,发源于龙岩市王母山西南的麓孟头村,干支流流经龙岩、漳平、南靖等13县、市, 由厦门港入海(图1),流域面积14741km2,河流干线长度285km。九龙江分北、西、南三溪,北溪为主流,溪流全长274 km,流域面积9640 km2,年均流量为252m3/s,是所经流域的重要饮用水源,为近400万人提供生活必须的饮用水。由于北溪属于丰水带河流,水力资源丰富,是开发的重点。根据北溪流域综合规划,干流河段从上游到下游共规划11个梯级水电站,其中西陂电站位于北溪干流河段上,华安县湖林乡西陂村上游1.1 km,距华安县城约19km,呈狭长型,为径流式开发电站,正常蓄水位125.30 m,相应库容891.3万m3,总库容1640万m3。
2样品采集与分析
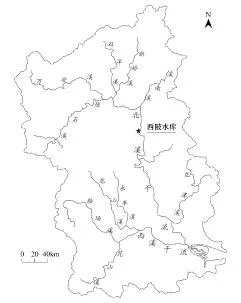
图1 九龙江西陂库区地理位置图[2]Fig.1 Location ofXiPi Reservoir in Jiulong River
本文于2012年12月,2013年4月、6月、11月,使用抓斗采集西陂电站库区表层沉积物,采集断面采用GPS进行定位,地理位置如图1,采样断面经纬位置见表1。对沉积物的TC、TN、TP及各形态磷进行测定,并分析沉积物中甲藻孢囊的丰度和分布。
2.1表层沉积物样品的采集
采集获得的表层沉积物均匀混合后迅速装入自封袋中,排气后密封,运回后4℃避光冷藏以备后期实验分析。全过程保持黑暗、低温。每次测试分析取样前,将表层沉积物样品再次混合均匀,以消除取样误差。沉积物采集的同时,用德国WTW多功能水质分析仪测量同断面同点位上覆水水温、溶解氧含量、pH值。
2.2表层沉积物的含水率测定
沉积物含水率测定采用烘干法,称取沉积物样品,放入已知重量的称量瓶内烘干后取出干燥冷却再次称重,重复操作至恒重。沉积物样品含水率[24]为称量瓶与样品烘干前后重量差与样品烘干前重量之比。
2.3表层沉积物各形态磷和沉积物碳、氮含量测定
各形态磷采用SMT法分级提取[25],经处理后,用钼锑抗分光还原光度法进行含量测定[26],数据结果用平均值±标准偏差表示。表层沉积物碳、氮含量的测定使用元素分析仪(德国Elementar Vario EL III)进行测定。
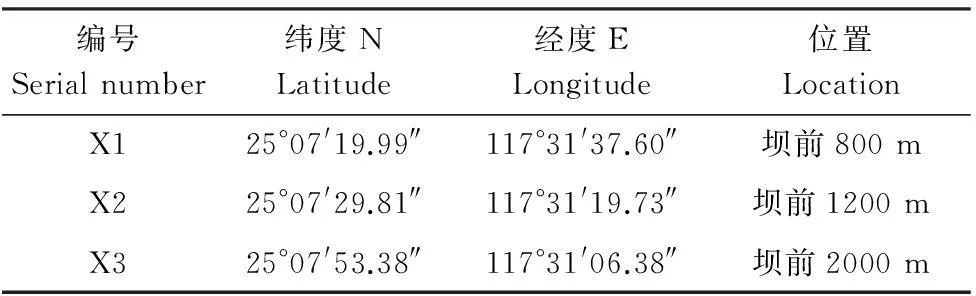
表1 九龙江西陂库区采样断面经纬位置
2.4甲藻孢囊丰度与分布分析
称取一定量均匀混合后的沉积物,加入一定量的蒸馏水后经超声波细胞粉粹机(JY96-Ⅱ)粉碎1 min,均匀倒在100 μm孔径的筛绢上,用灭菌后的蒸馏水反复冲洗筛上物,收集过筛后的液体均匀倒在20m孔径筛绢上,反复冲洗多次,收集筛上物,即得到甲藻孢囊富集样品[27]。
对甲藻孢囊形态进行判断,并进行计数统计。甲藻孢囊的丰度分析采用显微镜镜检法,分次吸取已完成预处理的甲藻孢囊富集样品1 mL置于1 mL(20 mm×40 mm)计数框内,利用倒置显微镜(NikonTS100)在10×40倍下进行全视野计数,每个样品作3次平行处理。以样品中总甲藻孢囊数除以沉积物干重计算得到该断面的表层沉积物的甲藻孢囊丰度。根据淡水甲藻孢囊图谱以及结合孢囊萌发后营养细胞的PCR结果对甲藻孢囊的种属进行判定[28]。
2.5甲藻孢囊萌发实验分析2.5.1甲藻单个孢囊萌发
将孢囊富集样品置于倒置显微镜下观察,通过毛细吸管将周围的杂质清理后吸取单个孢囊。在显微镜(Olympus BX51,400倍)下观察形态并保存图片。将单个孢囊吸到96孔培养板中,板内每个孔提前加入300 μL Carefoot′s medium[29],放入培养箱中进行孢囊孵化,温度设置为20℃、光照强度为2500lx、光暗比为12h∶12h,定期观察孢囊萌发情况。
2.5.2单细胞PCR(LSU)
利用毛细吸管吸取萌发后的单个营养细胞到干净的载玻片上,加入灭菌后的蒸馏水,用干净的尖头镊子对细胞进行物理破碎,使得孢囊内的遗传物质流出,将破碎的细胞吸出后放于PCR管中直接进行PCR扩增[30]。PCR产物在1%的琼脂糖凝胶上跑电泳,产物用1%EB染色,电泳结束后,将胶放在紫外灯下检测是否有目的条带。
表2PCR扩增的引物及其序列
Table 2Oligonucleotide primers used for amplification and sequencing
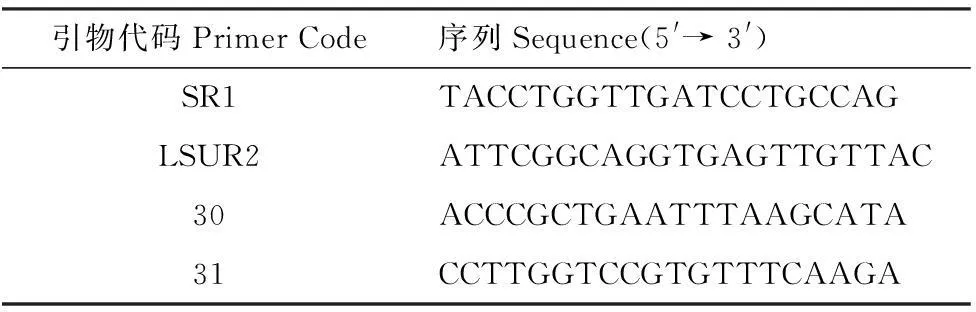
引物代码PrimerCode序列Sequence(5'→3')SR1TACCTGGTTGATCCTGCCAGLSUR2ATTCGGCAGGTGAGTTGTTAC30ACCCGCTGAATTTAAGCATA31CCTTGGTCCGTGTTTCAAGA
PCR反应体系为5U ExTaq酶,250 μmol/L dNTP,1×PCR Buffer。大亚基先用引物(表2)SR1和LSUR2[31]进行第一步扩增,程序为94℃预变性3 min 30 s ,94℃变性45 s,55℃退火60 s,72℃延伸2 min 30 s,34个循环后72℃延伸6 min。以第一步PCR产物为模板,用引物30和31进行第二步扩增,程序为94℃预变性3 min 30 s ,94℃变性30 s,58℃退火30 s,72℃延伸2 min 30 s,30个循环后72℃延伸6 min。
2.5.3系统发育分析
将序列导入网站http://www.ncbi.nlm.nih.gov/,点击BLAST进行序列的比对。使用Dnaman 5.2.2.0软件对测序得到的结果进行编辑,并与基因库中相关种的LSU序列通过Mafft(http://mafft.cbrc.jp/alignment/server/)进行比对。比对后生成的文件通过Bioedit 7.0.9.1软件进行编辑剪切再进行最大相似度(ML)及贝叶斯(Bayesian)分析。在ML分析中,使用JModelTest[32]程序中的AIC功能选择最适合的分子进化模型,测试结果选择GTR+G模型。使用MEGA 5.05[33]构建ML树,bootstrap值设置为1000。基于贝叶斯的数据矩阵的构建是使用MrBayes 3.1.2[34],选择的最适合替换模型为GTR+G。四条MCMC链运行1000000代,每10000代进行一次取样。
3实验结果与讨论
3.1九龙江西陂库区甲藻孢囊种属3.1.1九龙江西陂库区甲藻孢囊的主要形态
在九龙江西陂库区的表层沉积物中发现不同形态的孢囊(图2),主要种属为拟多甲藻属(图2a—f),所占比例约为80%,其他主要为裸甲藻属(图2g—h)。
TSJL01:孢囊为椭圆形,长宽为40×45 μm,一头较尖,一头较圆,深褐色,孢囊壁明显,有小横沟,孢囊表面覆盖着许多长10 μm左右的刺状突起,长短不一,刺的末端较钝。
GEJL01:孢囊为圆形,平均直径为29 μm,白色,孢囊的非中央位置有明显的色素体,为红褐色,另有许多明显的小颗粒。
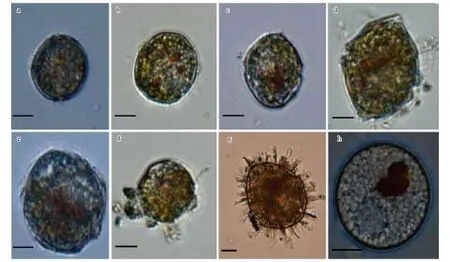
图2 九龙江西陂库区沉积物主要甲藻孢囊形态Fig.2 Main dinoflagellates cysts in the sediments of XiPi Reservoir in Jiulong Rivera: PSJL01, b:PSJL02, c:PSJL03, d:PSJL04, e: PSJL05, f: PSJL06, g:TSJL01, h:GEJL01 Scales: 10 μm
3.1.2九龙江西陂库区拟多甲藻属孢囊系统发育分析
经单细胞PCR结果判定,6种孢囊属于拟多甲藻属(图2a—f),以其营养细胞的LSU序列进行ML和BI分析,建立了系统发育树(图3)。此系统发育树以Karlodiniummicrum作为outgroup,按比例绘制分枝长度,比例尺表示每个位点的碱基替换数。分枝上的数据是聚类的数据支撑,左侧值是ML bootstrap,右侧为贝叶斯分析的pp值。
系统发育分析显示,6种形态的拟多甲藻属孢囊萌发出来的营养细胞分成了4个分支,其中PSJL04和PSJL05聚在一个小分支上,支持度很高,为100/1.00,序列相似度为98.40%(相差9bp),而PSJL02和PSJL03聚在同一个小分支上,支持度为85/0.98,序列相似度为99.37%(相差1bp)。PSJL01和PSJL06分别聚在一个小分支上。从系统发育树分析可以判定,这6种形态的拟多甲藻孢囊至少可以分成4种拟多甲藻属孢囊。具体种的判定还需根据萌发增殖的营养细胞的板块数量及板块排列,具体分类信息有待进一步研究。
拟多甲藻属营养细胞的LSU序列建立的基于ML和BI分析的系统发育树上可以看出PSJL06与Peridiniopsispenardii聚在同一个大分支上[35],支持度为91/1.00。PSJL06聚在PeridiniopsispenardiiNW(HM596558)、PeridiniopsispenardiiSZ(HM596557)、PeridiniopsispenardiiJLJ(HM596556)之间。PSJL06与PeridiniopsispenardiiJLJ(HM596556)序列相似度为94.57%,与PeridiniopsispenardiiSZ(HM596557)序列相似度为94.69%,与PeridiniopsispenardiiNW(HM596558)序列相似度为93.81%。从PSJL06的孢囊和营养细胞形态上,发现它与Peridiniopsispenardii的形态较为相似[36],因此判定PSJL06为九龙江2009年暴发的甲藻水华的优势种Peridiniopsispenardii。

图3 拟多甲藻属营养细胞的LSU序列建立的基于ML和BI分析的系统发育树Fig.3 Phylogeny of the Peridiniopsis cell from LSU rDNA sequences based on maximum-likelihood (ML) and Bayesianinference (BI) analyses

图4 2012—2013年九龙江西陂库区甲藻孢囊丰度与分布Fig.4 Distribution and abundance of dinoflagellate cysts in Xipi Reservoir in Jiulong River from 2012 to 2013
3.2九龙江西陂库区甲藻孢囊的丰度与分布3.2.1九龙江西陂库区甲藻孢囊丰度与分布差异性分析
2012—2013年,九龙江西陂库区沉积物甲藻孢囊丰度与分布如图4所示,甲藻孢囊丰度在(13.7±1.2)—(105.2±8.3)个/g干重之间。通过对4个月份进行两两比较,2013年11月的甲藻孢囊丰度与2012年12月、2013年4月、6月的甲藻孢囊丰度都有显著的差异(P<0.05),而另外3个月份间的甲藻孢囊丰度没有显著差异,由于本研究未测定水体悬浮物质的沉积速率,甲藻孢囊的丰度是否有显著季节差异有待进一步的研究确定。 从空间分布上看,甲藻孢囊在沿水流方向上的总体趋势是增加,最高值出现在2013年4月坝前800米断面。2013年4月份最高,2013年11月最低,高值是低值的5.6倍。
3.2.2九龙江西陂库区甲藻孢囊丰度影响因素分析
为研究甲藻孢囊的丰度环境影响因素,使用“SPSS 17.0”软件对甲藻孢囊与表层沉积物样品的TP、IP、OP、Fe/Al-P、Ca-P、TN、TC、含水率以及上覆水的水温、pH、溶解氧等进行双变量相关性分析。结果表明(表3):含水率与甲藻孢囊丰度呈现显著的相关性(P<0.05),相关系数为0.629。当含水率高时甲藻孢囊的丰度高。研究表明,该区域表层沉积物平均粒径在4—10m之间,大部分为粉砂质粘壤土, 当沉积物中粉粒含量较高且砂粒含量低时,该区域的甲藻孢囊丰度会高于其他区域,而表层沉积物的含水率也是沉积物粒径的一个反映,沉积物颗粒物越小,颗粒的比表面积越大,能够吸附的水量越大,沉积物含水率较高。本研究结果表明,孢囊分布与沉积物含水率呈现显著相关,也反映了沉积物粒径与孢囊的分布的关系。如果表层沉积物断面主要以细颗粒为主,此处水流速度较慢,有利于孢囊沉降,反映了甲藻孢囊的分布沿水流方向上的积累趋势。
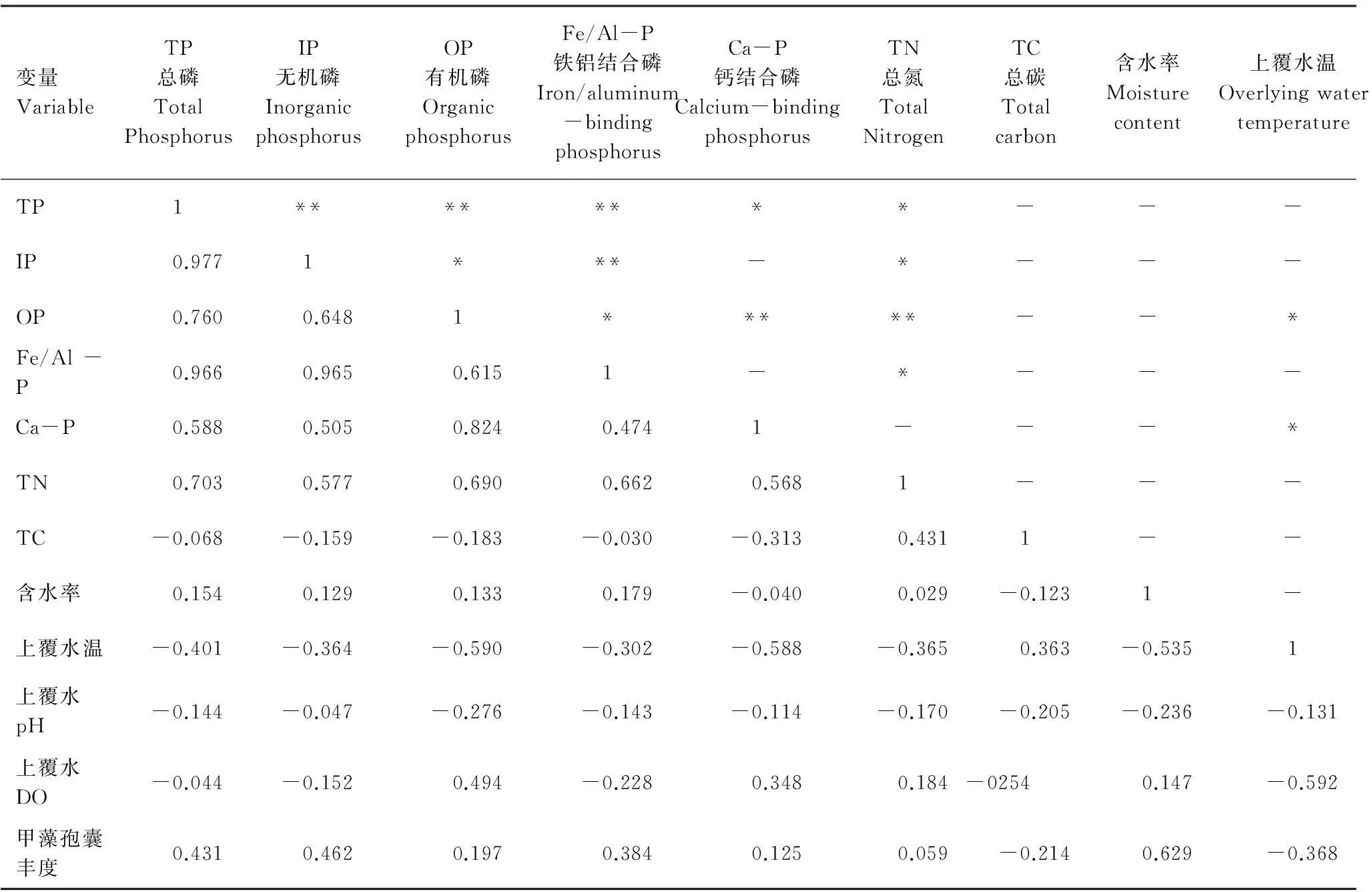
表3 2012—2013年九龙江西陂库区甲藻孢囊丰度与环境因子相关分析
**P<0.01,为极显著相关;*P<0.05 ,为显著相关
4结论
本研究采用显微观察和单细胞PCR技术,对九龙江西陂库区2012—2013年不同月份沉积物中的甲藻孢囊进行种属判定,结果表明,库区沉积物中的甲藻孢囊主要种属是拟多甲藻属,约占80%的比例,其次为裸甲藻属,并发现了2009年水华优势种佩式拟多甲藻(Peridiniopsis penardii)孢囊。
九龙江西陂库区2012—2013年不同月份沉积物中甲藻孢囊丰度在(13.7±1.2)—(105.2±8.3)个/g干重之间,多元相关分析结果表明,甲藻孢囊丰度与含水率呈现显著的正相关性(P<0.05),当含水率高时,甲藻孢囊的丰度高。从空间分布上看,甲藻孢囊的分布沿水流方向逐渐积累。
致谢:感谢厦门大学生态与环境学院陈能汪教授、研究生吴杰忠和陈朱虹在野外采样工作中给予的支持与帮助。
参考文献(References):
[1]赵孟绪, 韩博平. 汤溪水库蓝藻水华发生的影响因子分析. 生态学报, 2005, 25(7): 1554- 1560.
[2]林佳,钟燕平,苏玉萍等.九龙江西陂库区沉积物碳氮磷水平与微藻分布.福建师范大学学报(自然科学版),2015,9:63-69.
[3]张琪, 缪荣丽, 刘国祥, 胡征宇. 淡水甲藻水华研究综述. 水生生物学报, 2012, 36(2): 352- 360.
[4]Kazumi M, Yasuwo F. Technical guide for modernDinoflagellateCyst study. Tokyo: Japan Society for the Promotion of Science, 2000.
[5]Blanco E P, Lewis J, Aldridge J. The germination characteristics ofAlexandriumminutum(Dinophyceae), a toxicdinoflagellatefrom the Fal estuary (UK). Harmful Algae, 2009, 8(3): 518- 522.
[6]Shin H H, Yoon Y Y, Kim Y O, Matsuoka K. Dinoflagellate Cysts in surface sediments from southern coast of Korea. Estuaries and Coasts, 2011, 34(4): 712- 725.
[7]Tobin E D, Horner R A. Germination characteristics ofAlexandriumcatenellacysts from surface sediments in Quartermaster Harbor, Puget Sound, Washington, USA. Harmful Algae, 2011, 10(2): 216- 223.
[8]郑磊, 齐雨藻. 南海大鹏湾甲藻孢囊分布研究. 热带亚热带植物学报, 1997, 5(3): 10- 15.
[9]王朝晖, Matsuoka K, 齐雨藻, 辜小莲. 大亚湾澳头海域表层沉积物中甲藻孢囊的垂直分布. 海洋环境科学, 2003, 22(4): 5- 8.
[10]Anderson D M, Fukuyo Y, Matsuoka K. Cyst methodologies // Hallegraeff G M, Anderson D M, Cembella A D, eds. Manual on Harmful Marine Microalgae. UNESCO, Paris, 1995.
[11]Stéphanie G, Suzanne R, Michel S. Spatial distribution and viability ofAlexandriumtamarenseresting cysts in surface sediments from the St. Lawrence Estuary, Eastern Canada. Estuarine, Coastal and Shelf Science, 2013, 121- 122: 20- 32.
[12]方琦, 蓝东兆, 顾海峰, 李超. 闽江口海域表层沉积物中甲藻休眠孢囊的初步研究. 海洋通报, 2004, 23(6): 21- 25.
[13]黄海燕, 陆斗定, 夏平, 王红霞. 2006- 2007年冬季长江口海域甲藻孢囊的分布及其与环境的关系. 生态学报, 2010, 30(20): 5569- 5576.
[14]Pospelova V, de Vernal A, Pedersen T F. Distribution ofdinoflagellatecysts in surface sediments from the northeastern Pacific Ocean (43-25°N) in relation to sea- surface temperature, salinity, productivity and coastal upwelling. Marine Micropaleontology, 2008, 68(1/2): 21- 48.
[15]Candel M S, Radi T, de Vernal A, Bujalesky G. Distribution ofdinoflagellatecysts and other aquatic palynomorphs in surface sediments from the Beagle Channel, Southern Argentina. Marine Micropaleontology, 2012, 96- 97: 1- 12.
[16]Shin H H, Lim D, Park S Y, Heo S, Kim S Y. Distribution ofdinoflagellatecysts in Yellow Sea sediments. Acta Oceanologica Sinica, 2013, 32(9): 91- 98.
[17]Natsuike M, Nagai S, Matsuno K, Saito R, Tsukazaki C, Yamaguchi A, Imai I. Abundance and distribution of toxicAlexandriumtamarenseresting cysts in the sediments of the Chukchi Sea and the eastern Bering Sea. Harmful Algae, 2013, 27: 52- 59.
[18]Radmacher W, Tyszka J, Mangerud G. Distribution and biostratigraphical significance ofHeterosphaeridiumbelliisp.nov. and other Late Cretaceousdinoflagellatecysts from the southwestern Barents Sea. Review of Palaeobotany and Palynology, 2014, 201: 29- 40.
[19]石雅君, 刘东艳, 邵红兵, 邸宝平, 董志军, 王玉珏. 北黄海表层沉积物中甲藻孢囊的分布特征. 海洋通报, 2011, 30(3): 320- 327.
[20]孙爱梅. 福建近岸海域甲藻孢囊及环境变化记录[D]. 厦门: 厦门大学, 2006.
[21]汤宏波, 胡圣, 胡征宇, 况琪军, 刘国祥. 武汉东湖甲藻水华与环境因子的关系. 湖泊科学, 2007, 19(6): 632- 636.
[22]S Y, Moon C H, Cho H J, Lim D I .DinoflagellateCysts in Coastal Sediments as Indicators of Eutrophication: A Case of Gwangyang Bay, South Sea of Korea. Estuaries and Coasts, 2009, 32(6): 1225- 1233.
[23]Triki H Z, Daly-Yahia O K, Malouche D, Komiha Y, Deidun A, Brahim M, Laabir M. Distribution of resting cysts of the potentially toxic dinoflagellateAlexandriumpseudogonyaulaxin recently-deposited sediment within Bizerte Lagoon (Mediterranean coast, Tunisia). Marine Pollution Bulletin, 2014, 84(1/2): 172- 181.
[24]全国农业技术推广服务中心. 土壤分析技术规范 (第二版). 北京: 中国农业出版社, 2006.
[25]金相灿, 庞燕, 王圣瑞, 周小宁. 长江中下游浅水湖沉积物磷形态及其分布特征研究. 农业环境科学学报, 2008, 27(1): 279- 285.
[26]Ruban V, López- Sánchez J F, Pardo P, Rauret G, Muntau H, Quevauviller P. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments: A synthesis of recent works. Fresenius′ Journal of Analytical Chemistry, 2001, 370(2/3): 224- 248.
[27]Matsuoka K, Fukuyo Y. Technical guide for moderndinoflagellatecyst study. Tokyo: Japan Society for the Promotion of Science, 2000.
[28]Mertens K N, Rengefors K, Moestrup Ø, Ellegaard M. A review of recent freshwaterdinoflagellatecysts: taxonomy, phylogeny, ecology and palaeocology. Phycologia, 2012, 51(6): 612- 619.
[29]Holt J R, Pfiester L A. A survey of auxotrophy in five freshwaterdinoflagellates(Pyrrhophyta). Journal of Phycology, 1981, 17(4): 415- 416.
[30]Gu H F, Zeng N, Xie Z X, Wang D Z, Wang W G, Yang W D. Morphology, phylogeny, and toxicity ofAtamacomplex(Dinophyceae) from the Chukchi Sea. Polar Biology, 2013, 36(3): 427- 436.
[31]Takano Y, Horiguchi T. Acquiring scanning electron microscopical, light microscopical and multiple gene sequence data from a singledinoflagellatecell. Journal of Phycology, 2005, 42(1): 251- 256.
[32]Posada D. jModeltest: Phylogenetic model averaging. Molecular Biology and Evolution, 2008, 25(7): 1253- 1256.
[33]Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. Mega5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731- 2739.
[34]Ronquist F, Huelsenbeck J P. Mrbayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics, 2003, 19(12): 1572- 1574.
[35]张晓东, 顾海峰, 罗肇河, 孙军. 佩氏拟多甲藻及其硅藻共生体的分析. 海洋湖沼通报, 2013, (1): 97- 104.
[36]张琪, 刘国祥, 胡征宇. 中国淡水拟多甲藻属研究. 水生生物学报, 2012, 36(4): 751- 764.
Research on the distribution of dinoflagellate cysts in the surface sediments of the XiPi Reservoir in the Jiulong River
SU Yuping1,2,*, XUE Cheng1, YOU Xuejing1,3, ZHONG Yanping1, GU Haifeng3
1EnvironmentalScienceandEngineeringCollegeofFujianNormalUniversity,Fuzhou350007,China2FujianKeyLaboratoryofPollutionControlandResourceRecycling,Fuzhou350007,China3ThirdInstituteofOceanography,Xiamen361005,China
Abstract:Resting cysts play a major role in the life history of dinoflagellates. Peridiniopsis blooms have occurred many times in the Jiulongjiang River (Fujian province) since February 2009. This study investigates the characteristics of dinoflagellate cysts found in the sediments of the Xipi Reservoir in the Jiulongjiang River during different months, from 2012 to 2013. We used microscopy and single-cell Polymerase Chain Reaction (PCR) technology to identify the species of dinoflagellate cysts in a germination experiment. The results show that Peridiniopsis forms the dominant genus among the dinoflagellate cysts found in these sediments, and accounts for 80% of the total population while the rest belong to the genus Gymnodinium. We identified the cysts of Peridiniopsis penardii, the dominant bloom species in 2009. We also assessed the distribution and abundance of dinoflagellate cysts and investigated the driving factors of these population characteristics. The abundances of dinoflagellate cysts in sediments during different months are between (13.7 ± 1.2) to (105.2 ± 8.3) cysts/g DW. The multiple correlation analysis demonstrated that the abundance of dinoflagellate cysts is significantly positively correlated with moisture (P < 0.05). It showed that the distribution of dinoflagellate cysts gradually increased along the direction of the river flow. These results provide new insight into freshwater dinoflagellate cyst characterization and germination in this reservoir, and provide a scientific background for efforts aimed at the prevention of dinoflagellate blooms in the Jiulongjiang River.
Key Words:dinoflagellate cysts; sediment; distribution; Jiulongjiang River
DOI:10.5846/stxb201408041554
*通讯作者
Corresponding author.E-mail: ypsu@fjnu.edu.cn
收稿日期:2014- 08- 04; 网络出版日期:2015- 07- 29
基金项目:国家自然科学基金项目(41101060); 福建省自然科学基金项目(2014J01154)
苏玉萍,薛铖,游雪静,钟燕平,顾海峰.九龙江西陂库区沉积物甲藻孢囊的分布.生态学报,2016,36(6):1728- 1736.
Su Y P, Xue C, You X J, Zhong Y P, Gu H F.Research on the distribution of dinoflagellate cysts in the surface sediments of the XiPi Reservoir in the Jiulong River.Acta Ecologica Sinica,2016,36(6):1728- 1736.
