分子结构与性质重点剖析
2016-05-14雷范军银代智
雷范军 银代智
分子结构与性质是物质结构与性质模块的主干和核心内容,也是近年高考的热点之一。下面根据考试说明的要求提炼该部分的重要考点,并精选例题阐释该考点高考的考查方式和类型。
点评:从电子云看,头碰头重叠为σ键,肩并肩重叠为π键;从键型看,共价单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两个π键;从成键轨道看,s轨道形成的共价键全是σ键,杂化轨道形成的共价键全为σ键。等电子体是原子数和价电子数均分别相同的两种分子或离子,这些分子或离子所含共价键的类型、立体构型相似,借助简单分子或离子的电子式或结构式可推断另一种分子或离子的电子式或结构式等。
考点二:价层电子对互斥、杂化轨道理论和分子或离子的立体构型
该考点主要涉及中心原子的孤对电子对数、共价单键或σ键数、价层电子对数、杂化轨道类型、键角等与分子或离子的立体构型的关系,常考某分子或离子的立体构型和中心原子的杂化类型。
例2 (1)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是____;分子中处于同一直线上的原子数目最多为____。
(2)用价层电子对互斥理论推断SnBr2分子中Sn-B键的键角____120°(填“>”“<”或“=”)。
(3)NO-3的空间构型是____(用文字描述),气态SeO3分子的立体构型为____,SO2-3的立体构型为____。
(4)SO2-4的立体构型是____,其中S原子的杂化轨道类型是____。
解析:(1)H2C=CH-C≡N含有双键C和三键C原子,不含单键C原子,因而碳原子不能采用sp3杂化,只能采用sp和sp2杂化;两个双键C一定共线,中间的双键C与三键C一定共线,则H2C=CH-C≡N中最多有3个C共面。(2)中心Sn原子周围有1对孤对电子对和2对成键电子对,孤对电子对与成键电子对之间的斥力大于成键电子对之间的斥力,则Sn-Br键的键角小于120°。(3)中心N原子周围有3对斥力相等的成键电子对,则NO-3的空间构型为平面三角形;中心Se原子周围有3对斥力相等的成键电子对,则SeO3的立体构型是平面三角形;中心S原子周围有3对成键电子对和1对孤对电子对,则SO2-3的立体构型是三角锥形。(4)中心S原子周围含有4对斥力相等的成键电子对,则SO2-4的立体构型为正四面体形,S原子采用sp3杂化。
答案:(1)sp和sp2杂化 3 (2)< (3)平面三角形 平面三角形 三角锥形 (4)正四面体形 sp3
点评:价层电子对数=中心原子周围的原子数+中心原子的孤电子对数,中心原子的价层电子对互相排斥,尽可能远离,且孤电子对的排斥作用较成键电子对强,由此可得价层电子对空间构型,再去掉孤电子对所占空间,就是该分子或离子的空间构型。杂化轨道数=中心原子的孤电子对数+中心原子的σ键数,中心原子的杂化轨道尽可能均分空间,由此可得杂化轨道的立体结构,然后去掉孤电子对所占空间,就是分子或离子的空间构型。
考点三:配位键及配合物的结构
该考点主要涉及配位键的形成规律、实质以及配位化合物结构的辨认、表示方法等。
例3 (1)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的化学方程式为____。
(2)肼(N2H4)能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在____(填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(4)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是____,氮镍之间形成的化学键是____。
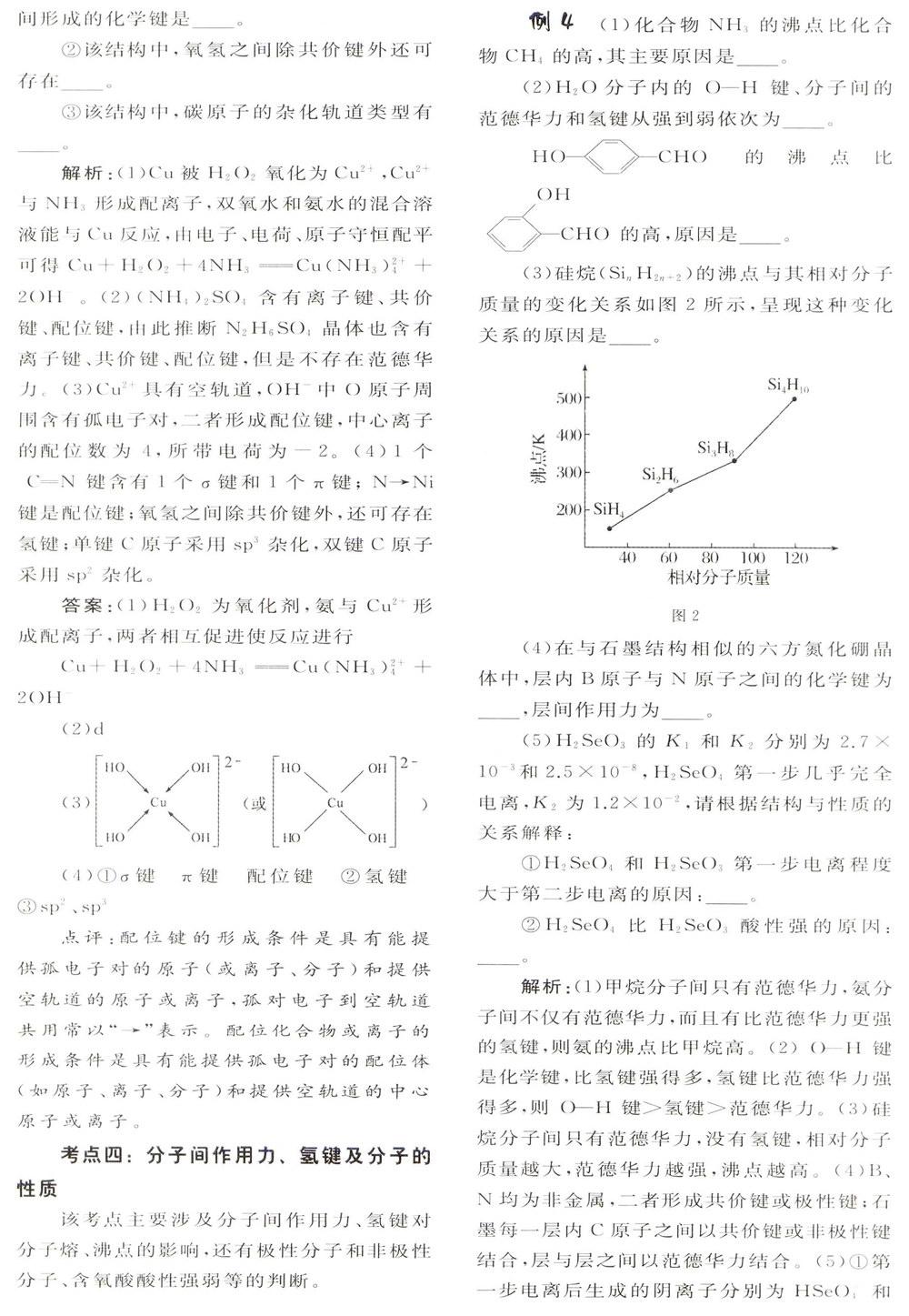
解析:(1)甲烷分子间只有范德华力,氨分子间不仅有范德华力,而且有比范德华力更强的氢键,则氨的沸点比甲烷高。(2)O-H键是化学键,比氢键强得多,氢键比范德华力强得多,则O-H键>氢键>范德华力。(3)硅烷分子间只有范德华力,没有氢键,相对分子质量越大,范德华力越强,沸点越高。(4)B、N均为非金属,二者形成共价键或极性键;石墨每一层内C原子之间以共价键或非极性键结合,层与层之间以范德华力结合。(5)①第一步电离后生成的阴离子分别为HSeO1和HSeO-3,它们较难进一步电离出带正电荷的氢离子。②H2SeO4和H2SeO3可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性越高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+。
答案:(1)NH3分子间存在氢键
(2)O-H键、氢键、范德华力
邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键,分子间氢键比分子内氢键强
(3)硅烷的相对分子质量越大,分子间范德华力越强(或其他合理答案)
(4)共价键(或极性共价键) 分子间力
(5)①第一步电离后生成的阴离子较难进一步电离出带正电荷的氢离子②H2SeO4和H2SeO3可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性越高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+
点评:组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高,如熔、沸点:F2