物质结构试题中元素的推导依据及要点
2016-05-14王开山
王开山
元素推导往往是解答物质结构试题的第一步。元素推导主要依据的信息是元素在周期表中的位置、元素原子或离子的核外电子排布、元素的典型性质或用途等。本文总结了元素常见的推导依据和解答要点,并解析了近年部分元素推导试题,供大家参考。
一、元素的推导依据
依据1:依据元素在周期表中的位置及原子序数关系。
(1)前四周期除第四周期第ⅡA族与第ⅢA族原子序数相差11外,其他相邻主族原子序数都相差1。
(2)前四周期同主族相邻周期原子序数相差2(H与Li)、8(绝大多数)或18(第三、四周期第ⅢA族至第ⅦA族)。
(3)同主族相邻周期原子序数存在2倍关系的为()和S,3倍关系的是Be和Mg。
(4)在元素周期表前四周期中周期序数等于主族序数的有:H、Be、Al、Ge。
(5)在元素周期表中既处于同一周期又位于同一族的元素为第四周期第Ⅷ族的元素。
(6)根据元素在周期表中的位置关系可以设某元素原子序数为x,建立起原子序数之间的方程式进行原子序数的推导。
依据2:依据元素原子或离子核外电子排布。
(1)熟记1至4层分别对应的字母为K、L、M、N。
(2)核外电子排布式结合核外电子排布图能解决核外单电子或成对电子问题。
(3)记住一些特殊的元素:核外电子总数等于周期数的元素为H;核外L层电子数是K层电子数2倍的元素为C等。
(4)简单阴、阳离子的核外电子排布主要是和稀有气体原子核外电子排布进行比较。
依据3:依据元素的化合价。
(1)主族元素的最高正价等于主族序数,非金属元素最低负价等于主族序数减去8,最高正价与最低负价的绝对值之和为8。
注意:F无正价,O除与F结合外也无正价,H的最低负价为-1价。
(2)最高正价为最低负价绝对值7倍的元素位于第ⅦA族。
(3)最高正价为最低负价绝对值3倍的元素位于第ⅥA族。
(4)最高正价与最低负价绝对值相等的元素位于第ⅣA族。
依据4:依据元素原子或简单离子的半径变化。
(1)同周期主族元素原子半径最大的在第ⅠA族。
(2)同周期元素原子简单离子的半径先减小后增大。
依据5:依据元素单质及其化合物的典型应用或典型性质等。
(1)氧化物为红棕色气体的元素是N,单质为黄色粉末状的元素为S,单质在空气中燃烧发出黄色火焰的元素为Na,单质在空气中燃烧透过蓝色钴玻璃片观察到紫色火焰的元素为K。
(2)非金属性最强或电负性最大的元素为F;最高价氧化物对应水化物酸性最强的元素是Cl。
(3)单质广泛用作半导体材料的元素为Si,最高价氧化物可用于制造光导纤维的元素为Si,日常生活中常见的金属材料为Fe或Al。
(4)最高价氧化物对应水化物有强脱水性的元素为S,氧化物或氢氧化物有两性的元素为Al,两种金属元素各自的最高价氧化物对应的水化物可以反应生盐和水,则其中有一种必为Al元素,气态氢化物水溶液呈碱性的元素为N。
(5)单质在自然界硬度最大的是C,地壳中含量最高的元素是O,地壳中含量最高的金属元素是Al,形成化合物种类最多的元素为C。
(6)工业上通过分离液态空气获得其单质的元素是O2或N2。
(7)短周期两种元素形成A2B2类型,有可能是H2O2、Na2O2或C2H2等。
(8)组成单质为空间网状晶体,具有很高的熔、沸点的元素为C或si。
二、典型试题赏析
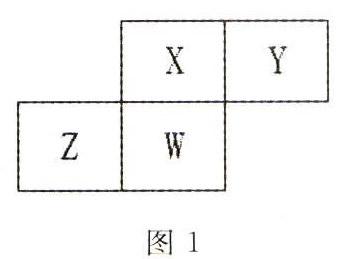
例1 短周期元素X、Y、Z、W在元素周期表中的相对位置如图1所示,其中W原子的质子数是其最外层电子数的3倍,则X、Y、Z、W分别为____。
解析:W原子的质子数是其最外层电子数的3倍,则W为P,根据元素在周期表中的位置关系可确定X为N,Y为O,Z为Si。
点评:根据四种元素在周期表中的位置关系,只要确定出任意一种元素,其他三种元素就可知。
例2 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图2所示。
试确定八种元素的名称。
解析:从图2中原子半径可知x为第一周期,y、z、d在第二周期,e、f、g、h在第三周期。再根据化合价可以推出x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。
点评:熟练掌握常见元素的最高正价和最低负价,以及短周期元素半径的变化规律,是解答该试题的关键。
例3 短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。则X、Y、Z、W分别为____。
解析:短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,则X为O;Y是至今发现的非金属性最强的元素,则Y为F;Z元素位于第3周期,其周期序数等于族序数,则Z为Al;W的单质广泛用作半导体材料,则W为Si。
点评:部分元素及其单质或化合物的特殊性质、用途等是解答该试题的突破口。
例4 周期表前四周期的元素a、b、c、d、c,原子序数依此增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。则a、b、c、d、e分别为____。
解析:题目所给的信息“周期表前四周期的元素a、b、c、d、c,原子序数依此增大”。a的核外电子总数与其周期数相同,则a是H;b的价电子层中的未成对电子有3个,画出电子排布图可知b为N;c的最外层电子数为其内层电子数的3倍,则c是O;d与c同族,则d是S元素;e的最外层只有1个电子,但次外层有18个电子,则e是Cu元素。
点评:a元素可通过周期序数代入法得到,画出b的核外电子排布图可求得b,画出e的电子排布式可快速求得e。
例5 X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z可以分别与钠元素形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则X、Y、Z、R分别为____。
解析:根据X的单质与氢气可以化合生成气体G,其水溶液pH>7可知X为N;Y单质是一种黄色晶体,Y为S;R基态原子3d轨道的电子数是4s轨道电子数的3倍,则R的电子排布式为1s22s22p63s23p63d64s2,R为Fe;J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L,则J中含有Cl,Z为Cl。
点评:部分元素及其单质或化合物的特殊性质常常是解答的突破口。
例6 X、Y、Z、w是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。则X、Y、Z、W分别为____。
解析:工业上通过分离液态空气获得的单质有O2和N2,所以X为N或O;Y元素原子最外电子层上s、p电子数相等,其电子排布为ns2np2,Y为C或Si;z元素+2价阳离子的核外电子排布与氖原子相同,则Z为Mg;W元素原子的M层有1个未成对的p电子,其排布为3s23p1或3s23p5,即W为Al或Cl。
点评:对该题,通过信息只能确定X、Y、W的范围,不能确定出它们具体是什么元素。
(责任编辑 谢启刚)