人胰岛素MIP融合蛋白在大肠杆菌中表达条件的优化
2016-05-14黄旋陈婷张云龙陆昌瑞
黄旋 陈婷 张云龙 陆昌瑞


摘 要:MIP即人胰岛素B27赖氨酸去三肽胰岛素 (B27K-DTrI)的前体。B27K-DTrI是一种新型单体速效胰岛素类似物,其单体性质好,生物活性高,是潜在的速效人胰岛素药物。将构建好的重组质粒ppSUMO-MIP转入大肠杆菌BL21(DE3)菌株,利用IPTG进行诱导表达。对MIP融合蛋白的诱导表达时间进行一系列的优化,结果表明:重组质粒在大肠杆菌BL21(DE3)中最优的表达条件为TB培养基、0.1 mM IPTG,15 ℃诱导过夜。通过表达条件的优化,每升菌液可获得30.1 mg的融合蛋白粗品。为进一步制备单体胰岛素B27K-DTrI打下了基础。
关键词:速效胰岛素;SUMO-MIP融合蛋白;表达优化
中图分类号:Q78 文献标识码:A DOI:10.11974/nyyjs.20160333046
糖尿病是一组以高血糖为特征的代谢性疾病,它现已成为威胁人类健康的最大杀手之一[1]。胰岛素是由胰腺β细胞分泌产生的一类多肽类激素,是体内重要的降低血糖激素[2-3]。胰岛素从问世至今经历了从动物胰岛素、人胰岛素到胰岛素类似物的3大跨越[4-6]。20世纪90年代,人们利用基因工程技术对人胰岛素的氨基酸序列及结构进行局部修饰,合成了人胰岛素类似物,改变了胰岛素的药代动力学特征。速效胰岛素是一类通过基因工程方式获得,与餐后正常人体内胰岛素分泌代谢最为接近的胰岛素类似物[7]。近年来,速效胰岛素以其吸收快、安全性好等特点受到越来越多研究者的关注。
MIP即人胰岛素B27赖氨酸去三肽胰岛素(B27K-DTrI)的前体,是2005年由丁金国等人利用甲醇酵母表达系统成功制备的单体速效胰岛素类似物[8]。B27K-DTrI具有单体性质好,生物活性高等特点,是一种新型的速效胰岛素类似物。但是,由于其产量较低限制了B27K-DTrI的产业化。在前期研究中,研究者尝试使用甲醇酵母表达系统和大肠杆菌IMPACT-TWIN系统进行重组制备B27K-DTrI。研究结果表明利用甲醇酵母表达系统进行制备其纯化过程繁琐,得率较低,而大肠杆菌IMPACT-TWIN系统进行制备必须经历复性过程,不仅降低最终产量,而且对蛋白的生理活性也会产生潜在的影响 [9]。因此,试图通过增加MIP前体表达量的方法来提高B27K-DTrI的最终产量。
利用大肠杆菌ppSUMO表达系统制备B27K-DTrI。ppSUMO表达系统是大肠杆菌表达系统的一种,通过融合表达SUMO肽可以明显提高重组蛋白的可溶性[10-11],避免在表达过程中出现包涵体,从而增加蛋白的可溶性表达量。在制备B27K-DTrI前体MIP融合蛋白的过程中,对MIP融合蛋白在大肠杆菌E.coli BL21(DE3)中的表达条件进行优化,改善了表达过程中的诱导温度、诱导剂浓度以及培养基条件,使得MIP融合蛋白产量得到提高(30.1 mg/L),为进一步制备单体胰岛素B27K-DTrI打下了基础。
1 材料和方法
1.1 材料
菌株和载体:大肠杆菌BL21(DE3)细胞、ppSUMO-MIP质粒(经测序、鉴定无误)均为本实验室保存。
主要试剂:异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、NC膜、Terrific Broth(TB)、Ni-NTASefinoseTM Resin、蛋白质Marker均为生工生物产品,Yeast extra、Tryptone购自Oxoid公司,抗体6*His单克隆抗体购自proteintech。其他试剂均为国产分析纯。
主要仪器:摇床、Western转膜、凝胶成像仪(Bio-Rad)等。
1.2 方法
1.2.1 不同IPTG浓度对融合蛋白表达的影响
阳性克隆经测序鉴定正确后,接种到5 mL含50 μg/mL卡那霉素的LB培养基(1 % tryptone, 0.5 % yeast extract, 1 % NaCl, w/v)中,于37℃、225rpm条件下振荡培养过夜,次日按体积比l:100的比例接种到5 mL新鲜的LB培养基中(含50 μg/mL卡那霉素),37℃,225 rpm摇床培养2 h,分别加人终浓度为0.1 mM,0.5 mM, 1 mM的诱导剂IPTG。37 ℃继续培养4 h。诱导前后样品进行12 % SDS-PAGE鉴定。
1.2.2 不同诱导温度对融合蛋白表达的影响
细胞与37 ℃摇床培养至OD600=0.5后,加入终浓度为0.1 mM的IPTG,分别在37℃诱导8 h,在15 ℃条件下诱导过夜,离心收集菌体,高压破碎细胞后离心分离上清和沉淀,进行12 %SDS-PAGE及western鉴定。
1.2.3 不同培养基对融合蛋白表达的影响
分别使用LB及TB(4.76 % Terrific Broth, w/v)培养基中,在0.1 mM IPTG条件下,15 ℃诱导过夜。离心收集菌体,高压破碎细胞后离心分离上清和沉淀,进行12 %SDS-PAGE鉴定。
1.2.4 融合蛋白的亲和纯化
诱导培养的细胞离心收集后,高压破碎细胞,10000×g ,30 min离心细胞裂解液。将上清样品上样至预先平衡好的Ni-NTA SefinoseTM resin中,依次用5倍柱体积(5 CV)的漂洗缓冲液 (25mM Tris-HCl,200mM Nacl,20 mM咪唑,pH8.0),5 CV 洗脱缓冲液 (25mM Tris-HCl,200mM Nacl,250 mM咪唑,pH8.0) ,5 CV再生缓冲液(25mM Tris-HCl,200mM Nacl,1 M咪唑,pH8.0) 处理柱子。所有样品使用12 %SDS-PAGE鉴定分析。
1.2.5 浓度计算
使用Bradford试剂测定亲和纯化的蛋白样品,计算蛋白浓度。
2 结果与讨论
2.1 SUMO-MIP重组蛋白在大肠杆菌的表达
对重组质粒进行快速诱导表达,实验结果如图1(条带1和4)所示。图中可以看到构建的质粒可表达,但是融合蛋白的表达量偏低,所以在后续的实验中需要对融合蛋白的诱导表达条件进行优化。
2.2 SUMO-MIP重组蛋白在大肠杆菌中的表达条件的优化
从快速诱导结果得出质粒可表达,但是融合蛋白表达量偏低,无法满足后续的实验要求,所以对诱导温度、诱导剂浓度以及培养基条件做一系列的优化。
2.2.1 不同IPTG浓度对融合蛋白表达的影响
融合蛋白在37 ℃诱导温度,不同浓度IPTG(0.1 mM, 0.5 mM, 1 mM)诱导下,全部都有表达。诱导剂浓度的增加并不增加目的蛋白的表达量,反而有下降的趋势(图1)。这可能是因为过高浓度的IPTG影响了细胞的生长状态,从而影响融合蛋白的表达。根据上述实验结果,确定SUMO-MIP融合蛋白诱导表达的最佳IPTG浓度是0.1 mM。
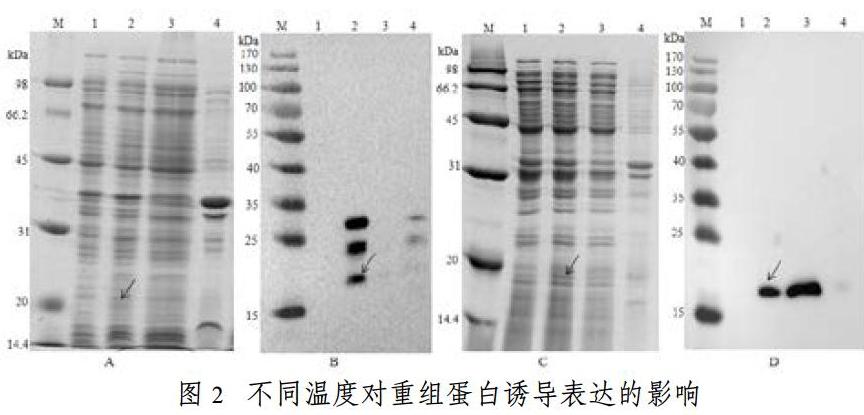
2.2.2 不同诱导温度对融合蛋白表达的影响
在0.1 mM IPTG诱导下,分别在15 ℃和37℃诱导重组蛋白。诱导样品分别进行SDS-PAGE及wetern blot鉴定。从图2可以看到,SUMO-MIP融合蛋白的大小约为20kDa,与理论值一致。在0.1 mMIPTG浓度下,37 ℃和15 ℃均有融合蛋白的表达。特别是在15 ℃诱导条件下,western检测到的目的蛋白条带单一,均存在于破菌上清液中,说明在此条件下,融合蛋白具有很高的可溶性。所以SUMO-MIP融合蛋白的最优诱导温度为15 ℃。
2.2.3 不同培养基对融合蛋白表达的影响
为了提高蛋白表达量,使用不同的培养基去诱导表达蛋白。分别使用LB及TB培养基,在0.1mM IPTG条件下,15 ℃过夜诱导融合蛋白,并进行亲和纯化。从SDS-PAGE电泳结果(图3)分析,使用TB培养基后,在破菌上清和沉淀中均有融合蛋白的出现,通过亲和纯化洗脱下来的蛋白量,TB培养基远远高于LB培养基。所以融合蛋白诱导表达的最优培养基是TB培养基。
2.2.4 亲和纯化
在TB培养基,0.1 mM IPTG浓度下,15 ℃诱导过夜的条件下,对蛋白进行了初步的亲和纯化。通过亲和纯化的电泳图(图4)分析,得到了纯度约70 %的融合蛋白粗产物(条带7),通过Bradford发测定蛋白浓度,1 LTB培养基诱导,可以得到30.1 mg的融合蛋白粗产物。基本满足后续的实验需求。
3 结 论
B27K-DTrI是一种新型单体速效胰岛素类似物,其单体性质好,生物活性高,是潜在的速效人胰岛素药物。MIP是B27K-DTrI胰岛素的前体。提高MIP的表达量、简化纯化操作是实现B27K-DTrI产业化的实验基础。
利用ppSUMO表达系统,通过对ppSUMO-MIP诱导表达条件摸索及优化,得到了SUMO-MIP融合蛋白的最佳诱导表达条件:使用TB培养基,0.1 mM IPTG浓度下,15 ℃诱导过夜。其大大提高了蛋白的表达量,1 L细胞可以得到约30.1 mg纯度约75 %的粗产物。融合蛋白的可溶性大大提高,在后续的实验中无需对蛋白进行复性。
参考文献
[1] “Update 2014”. IDF. International Diabetes Federation. Retrieved 29 November 2014.
[2] Wright JR, Yang H, Hyrtsenko O, et al. A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a “humanized” tilapia insulin.[J]. Xenotransplantation. 2014,21(6):485-495.
[3] Sonksen P ,, Sonksen J ,. Insulin: understanding its action in health and disease.[J]. British Journal of Anaesthesia, 2000, 85(1):69-79(11).
[4] 李玉珍.胰岛素制剂的发展与安全[C].2011紫禁城国际药师论坛暨中日药师研讨会,2011.
[5] 杨兆军,杨文英.胰岛素制剂的发展[J].中国糖尿病杂志,2013(5).
[6] 王战强.胰岛素及其合成技术应用与发展[J].中国医药导报,2011, 08(13):11-12.
[7] Mooradian A D, Marla B, Albert S G. Narrative review: a rational approach to starting insulin therapy.[J]. Annals of Internal Medicine, 2006, 145(2):125-134.
[8] Ding J G, Jian F, Gui D F, et al. Expression of Monomeric Insulin Precursor in Pichia pastoris and Its Conversion into Monomeric B27 Lys Destripeptide Insulin by Tryptic Hydrolysis[J]. Acta Biochimica Et Biophysica Sinica, 2005, 37(4):234–240.
[9] Ting C, Lujuan L, Helong H, et al. Preparation of monomeric B27 Lys destripeptide insulin by intein mediated expression in Escherichia coli[J]. Protein Expression & Purification, 2011, 80(1):152-156.
[10] Malakhov M P, Mattern M R, Malakhova O A, et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J]. Journal of Structural & Functional Genomics, 2004, 5(1-2):75-86.
[11] Marblestone J G, Edavettal S C, Lim Y, et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO.[J]. Protein Science, 2006, 15(1):182-189.
作者简介:黄旋(1989-),江苏南通人,东华大学化学化工与生物工程学院在读硕士研究生,研究方向:蛋白质结构与功能;通讯作者:陆昌瑞(1983-),上海人,东华大学化学化工与生物工程学院,教授,研究方向:核酸与结构生物学。
