miRNA146a对软骨细胞VEGF表达的影响
2016-05-10张清杨静陈经勇李钟张鹏毕梦娜张上上朱江伟鲁丽莎四川省骨科医院老年骨科四川成都610000
张清,杨静,陈经勇,李钟,张鹏,毕梦娜,张上上,朱江伟,鲁丽莎(四川省骨科医院老年骨科,四川成都 610000)
miRNA146a对软骨细胞VEGF表达的影响
张清,杨静*,陈经勇,李钟,张鹏,毕梦娜,张上上,朱江伟,鲁丽莎
(四川省骨科医院老年骨科,四川成都610000)
摘要:目的研究在正常软骨细胞及中期和晚期骨关节炎(osteoarthritis,OA)软骨细胞中激活或抑制miRNA146a后血管内皮生长因子(vascular endothelial groxth factor,VEGF)表达的变化规律,探索miRNA146a在OA发生、发展中的作用。方法收集正常人膝关节软骨4例,OA患者膝关节软骨12例。OA组又依据Kellgren-Lawrence的放射学诊断标准分为中期和晚期OA。通过化学转染的方法转染miRNA146amimic或miRNA146a inhibitor于各组软骨细胞,测定激活或抑制miRNA146a后,VEGF蛋白水平表达的变化。结果正常人软骨细胞中激活miRNA146a后,VEGF的蛋白水平较对照组及抑制组均出现明显的上升,结果具有统计学意义(P<0.05);抑制miRNA146a后,VEGF蛋白水平下降,结果没有统计学意义(P≥0.05)。中期OA软骨细胞表达VEGF水平高于晚期OA软骨细胞,差异具有统计学意义(P<0.05)。中期OA软骨细胞激活miRNA146a后,VEGF的蛋白水平上升,结果具有统计学意义(P<0.05);抑制miRNA146a后,VEGF的蛋白水平下降,结果具有统计学意义(P<0.05)。晚期OA软骨细胞激活miRNA146a后,VEGF的蛋白水平上升,结果具有统计学意义(P<0.05);晚期OA软骨细胞抑制miRNA146a后,VEGF的蛋白水平下降,结果不具有统计学意义(P≥0.05)。结论miRNA146a可调控软骨细胞VEGF表达,从而参与OA的发生、发展。
关键词:骨关节炎;miRNA146a;血管内皮生长因子;RNA干扰
骨关节炎(osteoarthritis,OA)是由全身易感因素和局部机械因素相互作用导致的一种以关节软骨退变为主的常见老年性骨与关节退行性疾病。其主要的临床表现为:关节疼痛、肿胀、畸形、活动受限,X线片的主要表现为关节间隙变窄、软骨下骨硬化、周围骨赘形成。在软骨发育过程中,血管内皮生长因子(vascular endothelial groxth factor,VEGF)在促进新生血管形成、维持软骨细胞存活和软骨基质代谢等方面具有十分重要的作用。
近年来,生物医学研究发现真核生物普遍存在miRNAs的转录后调控作用。研究显示[1]成人关节软骨细胞中激活miRNA146a后可以引起VEGF表达水平升高,并且诱导软骨细胞肥大化最终发生凋亡,促使软骨退变。miRNA146a调控VEGF与人类OA软骨细胞退变的作用机制尚不明确。本研究旨在探讨miRNA146a调控VEGF在正常软骨细胞及不同阶段OA软骨细胞中的作用及机制,对探索OA的发病机理及为将来基因治疗提供理论依据。
1资料与方法
1.1对象于因外伤行截肢的患者取膝关节正常软骨4例,根据病史、X线片、术中肉眼观察、术后镜下病理学排除标本退行性变、肿瘤、结核、感染、明显骨质疏松以及合并免疫系统疾病、糖尿病等全身性疾病。根据美国风湿病学会1995年修订的膝关节OA诊断标准诊断为膝关节OA需行全膝关节置换术患者股骨髁软骨12例,并根据Kellgren-Lawrence的放射学诊断标准分为中期OA组(3级)6例和晚期OA组(4级)6例。
收集患者一般资料,其中正常组男性4例,平均32.2岁(29~37岁),左侧1例,右侧3例;OA组12例,男4例,女8例,平均68.1岁(57~85岁),左侧8例,右侧4例。
1.2方法
1.2.1软骨细胞培养用含青霉素(100 U/mL)、链霉素(100μg/mL)的PBS缓冲液冲洗膝关节软骨组织数次后,在盛有DMEM/F12培养基的无菌培养皿中将软骨修剪至1mm3大小;软骨碎片放入50mL离心管中,低温离心(1 000 r/min)5min;去除上清液,加入3倍体积的胰蛋白酶,于37℃消化振荡40min,去除上清液,加双抗的PBS液冲洗3次;然后添加3倍体积的Ⅱ型胶原酶消化,于37℃振荡4~6 h后,低温离心(2 800 r/min)5 min,去除上清液,再用DMEM/F12培养液冲洗3次;加入含10%胎牛血清的DMEM/F12培养基终止消化,用吸管轻轻吹打,使细胞悬液分布均匀;将细胞接种于25 cm2培养瓶内(5mL/瓶),将培养瓶置于37℃,5% CO2,饱和湿度培养箱内培养。此后定期于倒置相差显微镜下观察细胞形态和贴壁生长情况,待细胞贴壁后换液,以后每2~3天换液一次。原代培养细胞的覆盖面积超过瓶子底部的80%时即可传代。传代时,PBS液清洗2次,加入0.25%胰蛋白酶1.5mL,在室温下振荡2~5 min;倒置相差显微镜下观察贴壁细胞有收缩,成圆形,一些细胞开始漂浮时即加入含胎牛血清培养液终止消化;加入新的培养液,轻轻吹打以使细胞分布均匀,从培养瓶的底壁使细胞完全脱落,收集细胞混合液,低温离心(1 000 r/min)3min;去除上清液,PBS液清洗两次,转入含有10%胎牛血清DMEM/F12培养基,将细胞悬浮液接种于培养瓶内继续培养以用于进一步实验。
1.2.2转染转染前一天,于细胞培养板接种适当数量的细胞,细胞培养板每孔中加入不含抗生素的培养基,使细胞密度达到30%~50%,以便转染;在1 500μL培养基含有细胞的培养孔中加入miRNA146amimic/inhibitor-lipo 2 000混合液混合均匀;培养6 h后将含mimic/inhibitor-lipo 2 000混合液的培养基移去,更换新鲜培养基;于37℃的CO2培养箱中培养48~96 h。
各组使用的试剂及剂量:对照组:含10%FBS的DMEM (L)培养基培养;上调组:miRNA146a mimic 2.5μg+Lipo2000 5μg+10%的DMEM(L)2 mL;下调组:miRNA146a inhibitor 75pmol+Lipo2000 7.5μL+10%的DMEM(L)2mL。1.2.3 Western-Blot检测VEGF蛋白表达每条泳道以40 μg蛋白量上样,行7.5%SDS-聚丙烯酰胺凝胶电泳分离蛋白,湿法转移将蛋白电转到聚偏二氟乙烯(polyvinylidene di fluoride,PVDF)膜上,用5%脱脂奶粉封闭1 h,加入指定的一抗4℃孵育过夜,杂交反应。以GADPH为内参。
1.3统计学分析每组实验均重复3次及以上,所有数据均以(±s)表示,采用SPSS17.0统计学软件进行方差分析,P<0.05表示差异有统计学意义。
2结 果
2.1正常软骨细胞干扰miRNA146a后VEGF的表达变化正常人类软骨细胞中,上调miRNA146a后,VEGF的蛋白水平较正常及抑制组均出现明显的上升,结果具有统计学意义;抑制miRNA146a后,VEGF蛋白水平下降,结果没有统计学意义(见图1)。
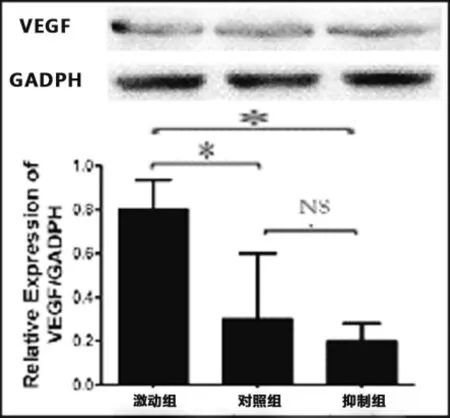
图1 干扰正常软骨细胞miRNA146a后VEGF变化
2.2中期和晚期OA软骨细胞干扰miRNA146a后VEGF的表达变化中期OA软骨细胞表达VEGF水平高于晚期OA软骨细胞,差异具有统计学意义(见图2)。中期和晚期OA软骨细胞中,上调miRNA146a后,VEGF的蛋白水平较对照组及抑制组均出现相应的上升,结果具有统计学意义。且晚期OA软骨细胞的VEGF的上升幅度大于中期OA软骨细胞。中期OA软骨细胞中,抑制miRNA146a后,VEGF的蛋白水平较对照组及激活组均出现相应的下降,结果具有统计学意义。晚期OA软骨细胞中,抑制miRNA146a后,VEGF的蛋白水平叫对照组下降,结果不具有统计学意义(见图3)。

图2 上调中期、晚期OA软骨细胞miRNA146a后VEGF变化
3讨 论
Taganov等[2]通过筛查人单核细胞中表达的200个miRNAs,发现miRNA146a/b是内毒素响应性基因,可被微生物基质和前炎症因子等所诱导;通过启动子的分析,发现miRNA146a是依赖NF-κB的基因;通过miRNAs数据库预测miRNA146a/b与IL-1受体相关激酶1(Interleukin 1 receptor related kinases,IRAK1)和TNF受体相关因子6(tumor necrosis factor receptor-associated factor,TRAF6)的3'端不翻译区(untranslated region,UTRs)匹配,这些UTRs抑制了相连报告基因的表达,它们编码了两个关键衔接分子:Toll样受体和细胞因子受体的下游区,同时发现IRAK1和TRAF6基因是miRNA146a/b体内转录后抑制的靶点。另外,Yamasaki等[3]对OA患者软骨细胞miRNA146a的基因表达谱的研究发现,miRNA146a在患轻度OA的软骨细胞有很高的表达,并且miRNA146a的表达同样受白介素1(interleukin-1,IL-1)的影响。高表达miRNA146可以减少IL-1β调控的表达产物肿瘤坏死因子(tumor necrosis factor,TNF),炎症因子作为分解代谢因子在OA软骨的退变中发挥着重要的作用。因此,miRNA146a在OA软骨中表达,并参与了OA软骨的分解代谢与合成代谢平衡。研究结果表明,miRNA146a是OA发生中软骨病变的基因作用靶点。此外,Li[4]研究还证实miRNA146a对维持膝关节软骨和滑膜的代谢平衡起着重要作用,并且通过调节炎症反应对OA所产生的疼痛起着重要作用,从而认为miRNA146a是OA软骨退变和关节疼痛的潜在治疗靶点。
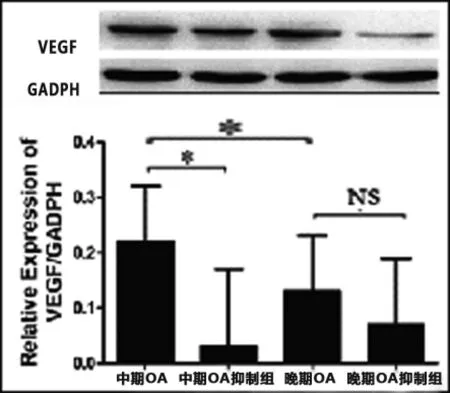
图3 下调中期、晚期OA软骨细胞miRNA146a后VEGF变化
有研究显示,VEGF参与了OA中软骨细胞的退变。VEGF在较低Mankin评分(Mankin评分小于8分)的OA患者胫骨平台软骨的浅表层中存在较高表达,而在较高Mankin评分(Mankin评分9~14分)的OA患者软骨中却极少发现由VEGF诱导的血管化[6],这一表达规律与miRNA146a的表达规律相符合。那么,miRNA的能否影响VEGF的表达水平呢?我们的结果显示,上调正常软骨细胞miRNA146a后,[5]VEGF的蛋白水平较正常及抑制组均出现明显的上升;中期和晚期OA软骨细胞中,上调miRNA146a后,VEGF的蛋白水平出现相应的上升;而抑制miRNA146a后,中期OA软骨细胞VEGF的蛋白水平出现相应的下降。从而说明miRNA146a可以影响VEGF水平,进一步提示miRNA46a可以通路此途径对OA的一系列病理过程产生影响。
有学者通过动物实验发现,软骨内VEGF表达水平与OA的严重程度成正比[7]。同时Saito发现,VEGF是OA病理过程中骨赘形成的最主要调节因子之一[8]。VEGF能促进内皮细胞分化、增生、迁移、浸润,维持内皮细胞功能,调控血管生成,并可增加血管通透性等。在OA软骨中可以检测出大量促炎因子和血管形成因子,这些因子作用于血管内皮细胞诱导产生水解酶并使血管基底膜降解,这一过程是新生血管形成的最基本过程,其中VEGF是最重要的调控血管形成因子[9]。
正常的成熟关节软骨少量VEGF表达。而OA患者的软骨和滑膜中VEGF及其受体的表达均明显升高,参与血管化和炎症反应[9]。当发生OA时,关节软骨中抗血管生成因子的数量明显减少,促血管生成因子如VEGF的数量明显增加。关节软骨中抗血管生成因子和促血管生成因子之间的平衡被破坏,导致血管从软骨下骨长入到关节软骨中,进一步加剧了OA的发展。我们的实验结果证实,VEGF在中期OA软骨细胞的表达水平高于晚期OA,这可能是因为OA的较早阶段,炎症反应剧烈,VEGF等因子大量表达,参与血管化进程,而到了OA晚期,软骨已发生不可逆转的变化,相关因子数量下降。miRNA146a调控的VEGF可能在OA病理过程中的炎症反应和病理性血管化具有重要作用[10]。
许多因子均可影响VEGF水平,例如LI-1、IL-17、TNFα、一氧化氮、活性氧等[11],这些因子可能通过不同的途径调节VEGF的表达。除了血管内皮细胞和软骨细胞,成骨细胞也是VEGF的靶点,其诱导成骨细胞趋化运动和增殖[12],从而参与OA骨赘形成。Hashimoto[13]使用免疫组化检测得出骨赘中的肥大软骨细胞表达VEGF,也得出VEGF在骨赘形成的血管化中产生作用。另有文献报道,VEGF可在体外水平上调软骨细胞基质金属蛋白酶-1、3、13水平,下调基质金属蛋白酶抑制剂-1、2水平,引起细胞外基质降解增加[14]。
VEGF在OA患者的滑膜和软骨细胞中表达升高。一方面,升高的VEGF参与了OA病程的炎症反应和病理性血管化;另一方面,VEGF也可导致软骨细胞肥大化、软骨基质降解和软骨细胞凋亡,这些均是OA的重要病理表现。肥大软骨细胞高表达VEGF,参与调控血管侵入软骨、分泌MMPs和细胞外基质重建,最终导致软骨细胞凋亡。可见VEGF可上调基质金属蛋白酶并参与了骨赘的生成,在此低氧、机械应力等情况下,抑制VEGF有望成为OA治疗的途径。本次试验结果也得出,miRNA146a可对VEGF的表达产生影响,可能具有重要的意义。抑制miRNA146a后,中期OA软骨细胞VEGF的蛋白水平出现相应的下降,为miRNA146a通过VEGF干预OA的病程提供了依据,探索了OA的基因治疗的可能性。
参考文献:
[1]Li J,Huang J,Dai L,et al.miRNA146a,an IL-1βresponsive miRNA,induces vascular endothelial growth factor and chondrocyte apoptosis by targeting Smad4 [J].Arthritis research&therapy,2012,14(2):75.
[2]Taganov KD,Boldin MP,Chang KJ,et al.NF-kappaB-dependent induction ofmicroRNAmiR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103(33): 12481-12486.
[3]Yamasaki K,Nakasa T,Miyaki S,et al.Expression of microRNA‐146a in osteoarthritis cartilage[J].Arthritis&Rheumatism,2009,60(4):1035-1041.
[4]Li X,Gibson G,Kim JS,etal.MicroRNA-146a is linked to pain-related pathophysiology of osteoarthritis[J].Gene,2011,480(1-2):34-41.
[5]Murata M,Yudoh K,Masuko K.The potential role of vascular endothelial growth factor(VEGF)in cartilage:how the angiogenic factor could be involved in the pathogenesis of osteoarthritis?[J].Osteoarthritis Cartilage,2008,16(3):279-286.
[6]Smith JO,Oreffo RO,Clarke NM,et al.Changes in the antiangiogenic properties of articular cartilage in osteoarthritis[J].JOrthop Sci,2003,8(6):849-857.
[7]Yamairi F,UtsumiH,Ono Y,etal.Expression of vascular endothelial growth factor(VEGF)associated with histopathological changes in rodent models of osteoarthritis[J].J toxicologic pathology,2011,24(2):137.
[8]Saito T,Fukai A,Mabuchi A,et al.Transcriptional regulation of endochondral ossification by HIF-2alpha during skeletal growth and osteoarthritis development[J].Nat Med,2010,16(6):678-686.
[9]Fransès RE,McWilliams DF,Mapp PI,et al.Osteochondral angiogenesis and increased protease inhibitor expression in OA[J].Osteoarthritis and Cartilage,2010,18(4):563-571.
[10]Walsh DA,McWilliams DF,Turley MJ,et al.Angiogenesis and nerve growth factor at the osteochondral junction in rheumatoid arthritis and osteoarthritis[J].Rheumatology(Oxford),2010,49(10):1852-1861.
[11]Murata M,Yudoh K,Nakamura H,etal.Dis-tinctsignaling pathways are involved in hypoxia-and IL-1-induced VEGF expression in human articular chondrocytes[J].JOrthop Res,2006,24(7):1544-1554.
[12]Pufe T,Scholz-Ahrens KE,Franke A,et al.The role of vascular endothelial growth factor in glucocorticoid-induced bone loss:evaluation in a minipig model[J].Bone,2003,33(6):869-876.
[13]Hashimoto S,Creighton-Achermann L,Takahashi K,et al.Development and regulation of osteophyte formation during experimentalosteoarthritis[J].Osteoarthritis and cartilage,2002,10(3):180-187.
[14]Pais H,Nicolas FE,Soond SM,etal.AnalyzingmicroRNA expression identifies Smad3 as amiRNA-140 target regulated only at protein level[J].RNA,2010,16(3): 489-494.
The M echanism ofm iRNA 146a Regulating VEGF in the Degenerative Process of OA Chondrocyte
Zhang Qing,Yang Jing,Chen Jingyong,et al
(Department of Elderly Orthopaedics,Sichuan Orthpaedics Hospital,Chengdu 610000,China)
Abstract:Objective To Study the expression changes of VEGF after up-regulated or down-regulated themiRNA146a in the normal chondrocytes and themiddle and late stage of the OA chondrocytes.To explore the role ofmiRNA146a in the development and progression of osteoarthritis.Methods We collected 4 cases of normal cartilage and 12 cases of arthritic cartilage which were divided intomiddle stage and late stage by Kellgren-Lawrence Imaging protocol.miRNA146amimic ormiRNA146a inhibitorwas chemically transfected to every group of chondrocyes.Then,we studied the changes of VEGF after up-regulating or down-regulating themiRNA146a chondrocytes.Results miRNA146a mimic increased the expression level of VEGF in the normal chondrocytes.The resultwas stastically significant(P<0.05).While miRNA146a inhibitor acted in a conversemanner.The resultwas not statistically significant(P≥0.05).The protein expression level of VEGFwas higher in themiddle stage OA chondrocytes than that of the late OA stage chondrocytes,and the resultwas statistically significant(P<0.05).miRNA-book=238,ebook=50146amimic increased the expression level of VEGF inmiddle and late stage of the OA chondrocytes.The resultwas stastically significant(P<0.05).While miRNA146a inhibitor acted in a converse manner,and the result was stastically significant in middle stage of OA chondrocytes but isn't stastically significant in late stage of OA chondrocytes.ConclusionmiRNA146a may contribute to OA pathogenesis by regulating VEGF levels in chondrocytes.
Key words:osteoarthritis;miRNA146a;vascular endothelial groxth factor;RNA interference
作者简介:张清(1987-),男,医师,四川省骨科医院老年骨科,610000。
收稿日期:2015-07-06
中图分类号:R329.2+5
文献标识码:A
基金项目:四川省科技厅科技支撑项目(2011FZ0040);*本文通讯作者:杨静
