水稻半显性矮秆基因Si-dd 1的表型分析和精细定位
2016-05-09崔永涛吴立文胡时开任德勇葛常伟叶卫军董国军郭龙彪胡兴明
崔永涛 吴立文 胡时开 任德勇 葛常伟 叶卫军 董国军 郭龙彪胡兴明
(中国水稻研究所水稻生物学国家重点实验室,杭州310006;*通讯联系人,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
水稻半显性矮秆基因Si-dd 1的表型分析和精细定位
崔永涛 吴立文 胡时开 任德勇 葛常伟 叶卫军 董国军 郭龙彪*胡兴明*
(中国水稻研究所水稻生物学国家重点实验室,杭州310006;*通讯联系人,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
崔永涛,吴立文,胡时开,等.水稻半显性矮秆基因Si-dd1的表型分析和精细定位.中国水稻科学,2016,30(2):152-160.
摘 要:以粳稻品种日本晴在组织培养过程中分离出来的一个半显性矮秆突变体Si-dd1为研究对象,通过形态学分析,发现与野生型日本晴相比,矮秆Si-dd1(AA)和半矮秆Si-dd1(Aa)植株的株高降低。结实率下降,生育期延长,一次枝梗和二次枝梗增加。激素处理结果表明突变体Si-dd1(AA)与野生型对油菜素内酯反应基本相同,而在高浓度赤霉素处理下,突变体Si-dd1(AA)表现为一定程度上的钝感。Western blot对GID2表达量分析也确定这一结果。组织切片实验表明,突变体Si-dd1(AA)相对于野生型叶片主脉气孔变小,叶肉细胞增多,茎维管束数目增加。遗传分析结果表明该突变体基因受一对核基因控制。进一步利用分子标记将该基因定位在水稻第6染色体约244kb区间内,目前该区段并未发现已报道的矮秆相关基因。
关键词:水稻;半显性;矮秆;遗传分析;图位克隆
株高是作物的重要农艺性状之一,与作物抗倒伏、产量等性状密切相关。绿色革命是植株半矮化成功利用的典范。目前在水稻育种中广泛利用的sd1[1]编码一个缺陷的GA20氧化酶,该酶突变后植株内源赤霉素含量降低,导致了植株半矮化,通过抗倒伏提高了产量。迄今为止在水稻、小麦、玉米等农作物中发现了很多矮秆突变体,虽然大多数矮秆突变体无法直接应用到育种中,但是人们通过研究矮秆材料,对水稻矮秆的理化机制有了新的认识。
水稻矮秆突变体的类型非常丰富,迄今为止已经发现了很多矮秆基因,其中大多和激素如赤霉素、油菜素内酯、独脚金内酯等相关。例如D1、SD1、SUI3、SUI1、DGL1、DBS1、D18、OsCPS1、GID2、GID 1、OsGA 20OX 1、SLR 1、D 35等属于与赤霉素途径相关的矮秆突变体[1-11];基因D1、D61、D-2、SDG725、BRD2、TUD1、BRD1、D11、OsBZR1等参与油菜素内酯的合成与信号传递[12-20];基因D3、D10、D-14、HTD1、D53、D-27、FC1等参与独脚金内酯的合成与信号传递[21-27];而基因OsGH3-2、TDD1等属于生长素途径的突变体[28-29]。此外也发现了一些与激素不相关的矮秆基因,例如与细胞壁合成相关的矮秆基因D50、OsNST1、OsCD1,突变后都会导致植物矮化或半矮化[30-32]。这些现象说明了水稻的株高受到很多因素的影响,因此,通过研究水稻矮秆突变体有助于人们更好地了解植株的生长发育和形态建成。
本研究利用在日本晴组织培养过程中得到的一个稳定遗传的半显性矮秆突变体(semi-dominant dwarf1,Si-dd1),对该突变体的形态学特征、对激素的反应以及细胞形态进行了分析,同时对突变基因进行了遗传分析和精细定位,从而为Si-DD1基因的进一步克隆与功能研究奠定了基础。
1 材料与方法
1.1 实验材料
本研究选用的突变体是粳稻品种日本晴在组织培养过程中分离出来的一个半显性矮秆突变体Sidd1。收获突变体种子,持续多代自交种植,确定该突变体能够稳定遗传,分别收获矮秆突变体和半矮秆突变体。矮秆突变体是纯合体,结实率低,产生的后代为完全显性矮秆;半矮秆突变体是杂合体,结实率正常,后代可分离。所有材料均于正季种植于中国水稻研究所富阳实验基地,种植与管理方法同大田生产。在半矮秆突变体产生的分离群体中随机选取野生型(WT)、半矮秆(Si-dd1,Aa)和矮秆(Sidd1,AA)各15株,调查株高、结实率、分蘖数、一次枝梗数、二次枝梗数等农艺性状。每次实验重复3次,取平均值。
1.2 遗传分析和基因定位群体的构建
在富阳正季用Si-dd1(AA)分别与籼稻品种9311、南京6号(NJ06)正反交,同年冬天在海南种植F1,收获F2种子,次年在富阳种植F2群体。在F2群体中,分别调查显性矮秆、半显性矮秆和野生型植株的数目,同时用半显性矮秆植株(Si-dd1,Aa)与9311、南京6号正反交,在F1中调查显性矮秆、半显性矮秆和野生型植株的数目。利用SAS软件进行相关数据的分析,收取F2群体中高秆和显性矮秆全部叶片,提取DNA用于分子标记分析。
1.3 赤霉素和油菜素内酯处理
收获显性矮秆Si-dd1(AA)和野生型植株的种子,用湿润的毛巾包好放到37℃培养箱暗培养1~2 d。露白后,选取长势一致的Si-dd1(AA)和野生型的种子均匀播种于沙土中(不添加激素),待水稻幼苗长至3叶期时,分别选取长势一致的水稻用于水培实验。水培营养液中加入不同浓度的GA3(最终浓度分别为0μmol/L、1×10-8μmol/L、1×10-7μmol/L、1×10-6μmol/L、1×10-5μmol/L、1×10-4μmol/L),以加入等量蒸馏水作对照,调pH值至5.0,每隔3d换一次培养液,并用同样方法添加不同浓度的GA3,依次处理10d后,测量不同浓度处理后的水稻株高。另随机挑选显性矮秆Si-dd1 (AA)和野生型植株的种子,催芽后播种于沙土中,一周后用不同浓度的油菜素内酯(最终浓度分别为0μmol/L、1×10-7μmol/L、1×10-6μmol/L、1× 10-5μmol/L)点于第1叶叶夹角处,一周后观察第1叶叶夹角变化情况。
1.4 GA处理后GID2的蛋白表达分析
为了进一步探究该突变体在GA信号传导途径中是否起到作用,我们选取了GA信号传导途径中的一个相关蛋白GID2作为研究对象,探究GA处理后GID2的表达量是否发生变化。对不同浓度GA3处理过后的WT和Si-dd1(AA)分别取样,并提取蛋白,分别选取0mol/L、1×10-6mol/L、1× 10-4mol/L GA3处理后的WT和Si-dd1(AA)进行Western blot分析,方法见文献[34]。
1.5 石蜡切片分析观察
在分蘖盛期选取新鲜、生长正常且有代表性的矮秆Si-dd1(AA)和野生型植株的剑叶以及倒2节间,用锋利的刀片用力均匀地切割材料,避免组织破裂,分别将水稻的叶和茎切割成3 mm左右大小。将切下来的材料立刻置于FAA固定液中(70%酒精∶冰醋酸∶36%甲醛的体积比为18∶1∶1)固定,此后石蜡切片具体操作方法见文献[35]。
1.6 Si-DD1基因的精细定位
利用本实验室保存的均匀分布于水稻12条染色体的SSR引物对突变体Si-dd1与9311、NJ06进行多态性筛选,分别挑选Si-dd1/9311、Si-dd1/NJ06的F2植株中的高秆和矮秆叶片,提取DNA对Si-DD1展开定位研究。首先用21个Si-dd1/NJ06中F2高秆单株进行连锁分析,初步确定目标基因所在的染色体位置。进一步在连锁标记附近开发标记,以2000个高秆和1200个矮秆材料进行精细定位。基因组DNA采取CTAB法提取[33]。PCR体系如下:模板DNA 1μL,正反向引物(10 μmol/L)0.5μL,dNTPs(10μmol/L)0.1μL,10× PCR缓冲液1μL,Taq酶0.2μL,加ddH2O补足10μL。PCR扩增程序如下:94℃下预变性2min;94℃下30s,56℃下30s(复性温度根据引物Tm值作相应调整),72℃下30s,进行35次循环;72℃下延伸10min。PCR产物使用相应浓度的琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 突变体Si-dd1的表型分析
在大田条件下,本研究中的半矮秆和矮秆材料在3叶期前与野生型并无太大差别。此后,株高差距开始显现,至抽穗后,差距达到最大。选取抽穗之后的野生型、Si-dd1(Aa)和Si-dd1(AA)植株进行表型观察。相比野生型(WT),Si-dd1(Aa)和Sidd1(AA)基因型的植株株高都有所降低,其中Sidd1(Aa)材料株高相对于野生型下降20cm,而Sidd1(AA)材料株高明显变矮,株高平均为40cm,约为野生型的一半(图1-A、C、D,表1),Si-dd1(Aa)和Si-dd1(AA)都呈现包穗表型(图1-A)。此外,突变体生育期延长,其中Si-dd1(Aa)生育期比野生型长5d左右,Si-dd1(AA)生育期比野生型长15 ~20d。3种表型植株分蘖数并无明显差异,但是突变体穗颈节明显缩短,穗粒明显变密(图1-B),并伴随包穗的表型。野生型、Si-dd1(Aa)和Si-dd1 (AA)的一次枝梗数、二次枝梗数依次升高,结实率依次下降,Si-dd1(AA)下降尤为明显(表1)。因此,该基因的突变除了影响株高外,对穗部产量性状也产生了很大的影响。值得一提的是,Si-dd1(Aa)虽然结实率有所下降,但其总粒数有所增加,而且由于它为半矮秆,因此可能具有一定的育种价值。
2.2 突变体的遗传分析
Si-dd1(Aa)F2群体植株的株高统计分析结果表明,其后代分离比WT∶Si-dd1(Aa)∶Si-dd1 (AA)呈现出1∶2∶1的分离比。用Si-dd1(AA)与9311、NJ06分别进行正反交后发现F1代都呈现出半矮秆表型(表2)。F2群体中植株株高仍呈现出1∶2∶1的分离比;此外,用Si-dd1(Aa)作为母本与9311、NJ06杂交,F1群体并无Si-dd1(AA)的出现,只出现高秆和半矮秆,且比例呈1∶1(表3)。因此,本研究中的突变性状是由半显性、单基因控制的质量性状,且无胞质效应。

A-整株表型;B-穗表型;C-茎节间长;D-各节间对比。从左至右依次为野生型、中间型和突变型。A,Whole plant;B,Panicle;C,Internode;D,Comparison of every internode.From left to right,wild type,Si-dd1(Aa)and Si-dd1(AA)in turn.图1 Si-dd1突变体成熟期表型Fig.1.Phenotypes of Si-dd1 at maturation stage.

表1 野生型,Si-dd1(Aa)和Si-dd1(AA)分蘖、株高及穗部性状比较Table 1.Comparison of tiller,plant height and panicle traits among wild type,Si-dd1(Aa)and Si-dd1(AA).

表2 Si-dd1(AA)与NJ06、9311组合F2的遗传分析Table 2.Genetice analysis of F2population of Si-dd1(AA)/NJ06(9311).

表3 杂合Si-dd1(Aa)与NJ06、9311组合F1遗传分析Table 3.Genetice analysis of F1population of Si-dd1(Aa)/NJ06and Si-dd1(Aa)/9311.
2.3 目的基因的精细定位
我们对Si-dd1与9311、NJ06两个籼稻品种杂交的4组F2群体表型进行了观察记录以及分析,最终选用这4个F2群体中表现稳定的高秆和矮秆用于后续的图位克隆。我们所用的标记引物是本试验室现有的均匀分布于水稻12条染色体上的SSR引物,共计216对。对矮秆、高秆、F1以及F2混池DNA进行连锁筛选(由于F2代呈1∶2∶1比例分布,因此,我们选取F2中显性矮秆和野生型高秆作为定位群体取样)。在以Si-dd1(AA)/NJ06显性矮秆表型的F2混池进行初定位时发现,在第6染色体的引物标记M1、M2以及M3处(表4),F1电泳呈现双带,而混池偏扩增于Si-dd1(AA)的带型;以高秆表型的F2混池进行初定位时发现,在同样的引物标记处,F1电泳条带呈现双带,而混池偏扩增于野生型带型。利用这3对引物对Si-dd1(AA)/9311中 F2突变体表型群体的93个高秆单株进行检测,进一步确认了该突变基因位于第6染色体的引物标记M2和M3之间。
为进一步对突变体基因进行精细定位,我们扩大了F2群体的数量,并且继续在F2代植株中选取高秆和矮秆作为定位群体。根据NCBI(http://www.ncbi.nlm.nih.gov/)、RGP(http://rice.plantbiology.msu.edu/index.shtml)和Gramene(http://www.gramene.org/)数据库公布的9311序列和日本晴序列第6染色体上的序列开发出若干位于M2和M3之间的多态性标记(表5)。以初定位结果为基础,筛选了以Si-dd1(AA)和9311为双亲的F2分离群体中高秆和矮秆个体用于基因的精细定位和物理作图。最终将基因Si-DD1定位在标记P3和P4之间,物理距离约为244kb(图2)。此区间内未发现已报道的矮秆相关基因。

表4 Si-DD1基因初定位的标记Table 4.Makers for primary mapping of Si-DD1.
表5 Si-DD1基因精细定位的部分标记Table 5.Makers for fine mapping of Si-DD1.
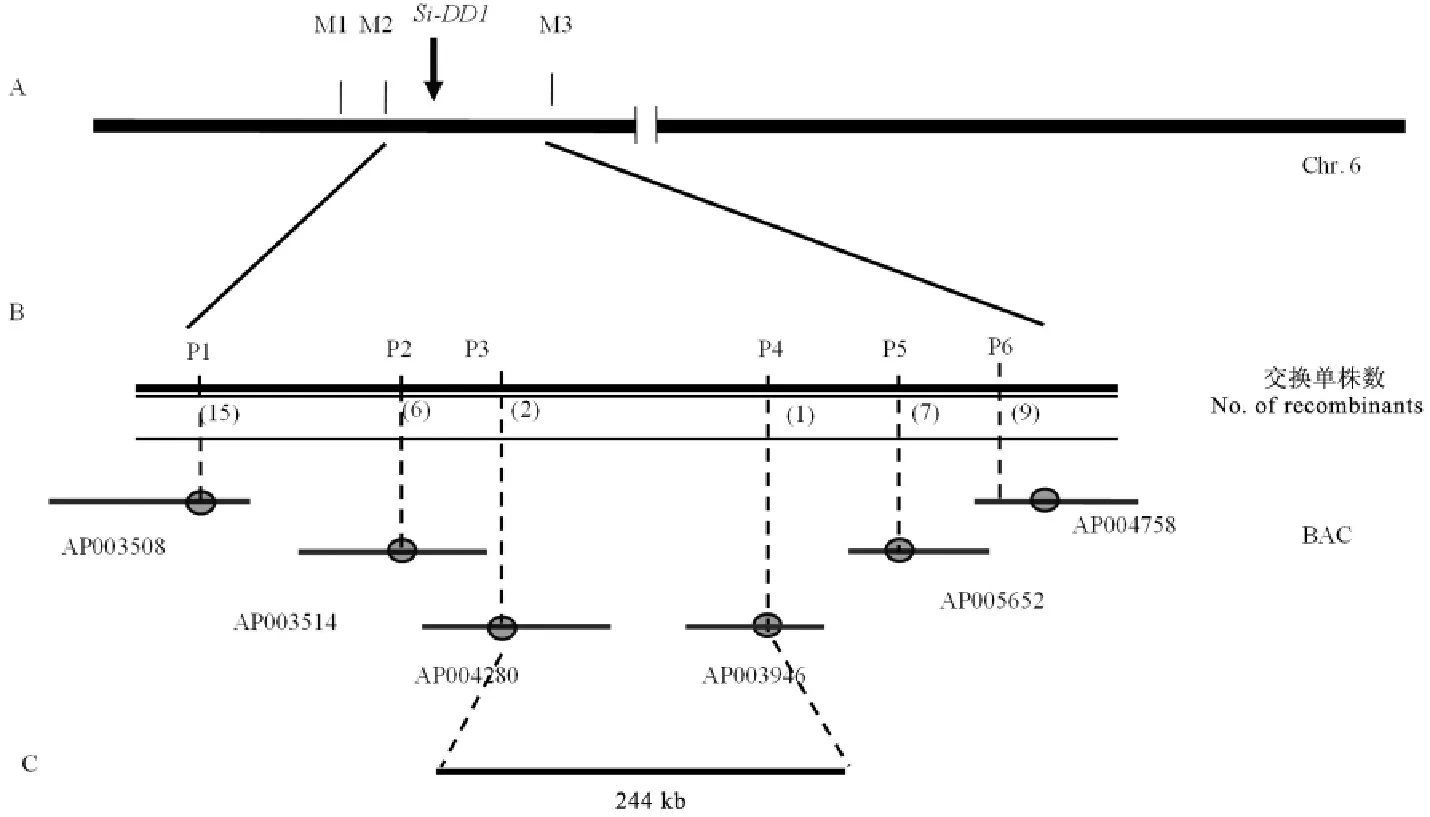
A-Si-DD1与标记M2和M3连锁;B-利用4500个分离单株将Si-DD1定位到244kb区段内。A,Si-DD1 was linkaged with M2and M3;B,Si-DD1 was mapped to 244kb genome region based on 4500separated plants.图2 Si-DD1的精细定位Fig.2.Fine mapping of Si-DD1.
2.4 激素处理结果
水稻植株变矮很多都是由于激素合成或信号传导出现问题,为了验证该突变体是否也是由于体内某类激素反应异常所致,我们选取了赤霉素和油菜素内酯两种激素作为研究对象,来探究该突变体是否和这两种激素相关。激素处理结果表明不同浓度GA3处理WT和Si-dd1(AA)后,WT和Si-dd1 (AA)的株高都呈现逐日增高的趋势,而当GA3浓度增加到1×10-4mol/L后,WT和Si-dd1(AA)则出现一定程度的生长抑制,说明突变体与野生型在一定浓度的外源赤霉素处理条件下,两者对赤霉素的反应是基本相同的。值得指出的是,当GA3浓度增加到1×10-4mol/L后,突变体受抑制程度相比野生型小(图3-A、B),暗示在高浓度下,突变体对赤霉素表现为钝感。用BR处理后发现不同浓度BR处理WT和Si-dd1(AA),无论是WT还是Sidd1(AA)除了叶夹角都随BR浓度增加而增加,而且增幅一致,说明了该基因对BR反应与野生型类似。此外,我们在对该突变体形态分析时发现,该突变体突变类型与已经发现的BR类型突变体大不相同,节间突变属于sh类型,而不是dm这种典型的BR类突变体,因此,我们基本排除该突变体是BR类突变体(图1-D,图3-C)。
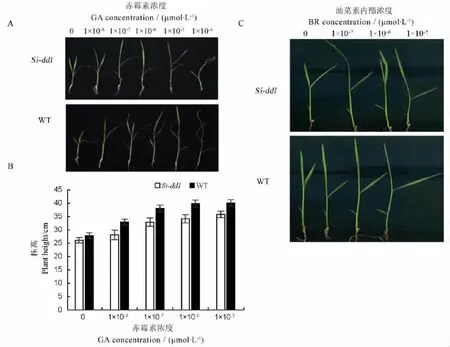
A-不同浓度赤霉素(GA)处理后表型;B-不同浓度GA处理后株高;C-不同浓度油菜素内酯(BR)处理后叶夹角。WT,Wild type;GA,Gibberellic acid;BR,Brassinolide.A,Plant phenotype after GA treatment at different concentrations;B,Plant height after GA treatment at different concentrations;C,Leaf angle after BR treatment at different concentrations.图3 Si-dd1突变体的GA,BR激素处理结果Fig.3.Si-dd1 exposed to GA and BR.
2.5 GID2蛋白表达量分析
为了进一步探究该突变体在GA信号传导途径中是否起作用,我们选取了GA信号传导途径中的一个相关蛋白GID2作为研究对象,探究GA处理后GID2的表达量是否发生变化。对不同浓度GA3处理过后的野生型(WT)和Si-dd1(AA)分别取样,并提取蛋白,分别选取0 mol/L、1×10-4mol/L、1×10-6mol/L GA处理后的WT和Si-dd 1(AA)进行Western blot分析,结果表明,WT和Si-dd1 (AA)中GID2蛋白表达量在0mol/L和1×10-6mol/L GA处理下并无太大差异,而随着GA浓度升高,GID2蛋白在野生型中的表达量比突变体中少,说明相对于野生型该突变体在高浓度条件下对GA3反应钝感(图4)。

图4 GID2蛋白表达量分析Fig.4.Expression analysis of GID2.
2.6 组织切片的观察结果
为了探究突变体矮化的生理特征,我们分别选取了野生型、Si-dd1(Aa)和Si-dd1(AA)植株的剑叶和倒2节间作为研究对象进行细胞学观察。对剑叶的观察发现,突变体Si-dd1(Aa)和Si-dd1(AA)主叶脉气腔和薄壁细胞等部位与野生型相比有差异。其中Si-dd1(Aa)和Si-dd1(AA)中脉气腔相比野生型变小;但是两气腔之间的薄壁细胞明显变大,最终导致总面积增加,而其两侧的薄壁细胞并未出现明显变化(图5-A~C)。茎纵切分析表明Sidd1(Aa)和WT的细胞都呈规则形状(矩形),而Si-dd1(AA)的细胞呈不规则排列,在单位面积下,WT、Si-dd1(Aa)、Si-dd1(AA)的细胞数目依次增多,细胞大小依次变小,但是变化并不明显。根据WT、Si-dd1(Aa)、Si-dd1(AA)倒2节间长度(图1-D)推测,虽然突变体单位面积细胞数目增多,而整个倒2节间细胞数目却明显变少,因此,我们推测是细胞数目减少导致突变体的茎秆变矮(图5-D~F)。茎的横切面结构一般由薄壁细胞和维管束组成,维管束均匀分布于薄壁细胞之间。对倒2节间的观察表明,在Si-dd1(Aa)和Si-dd1(AA)的外层薄壁细胞层数明显比WT多;且维管束数目相比WT也有所增加(图5-G~I)。
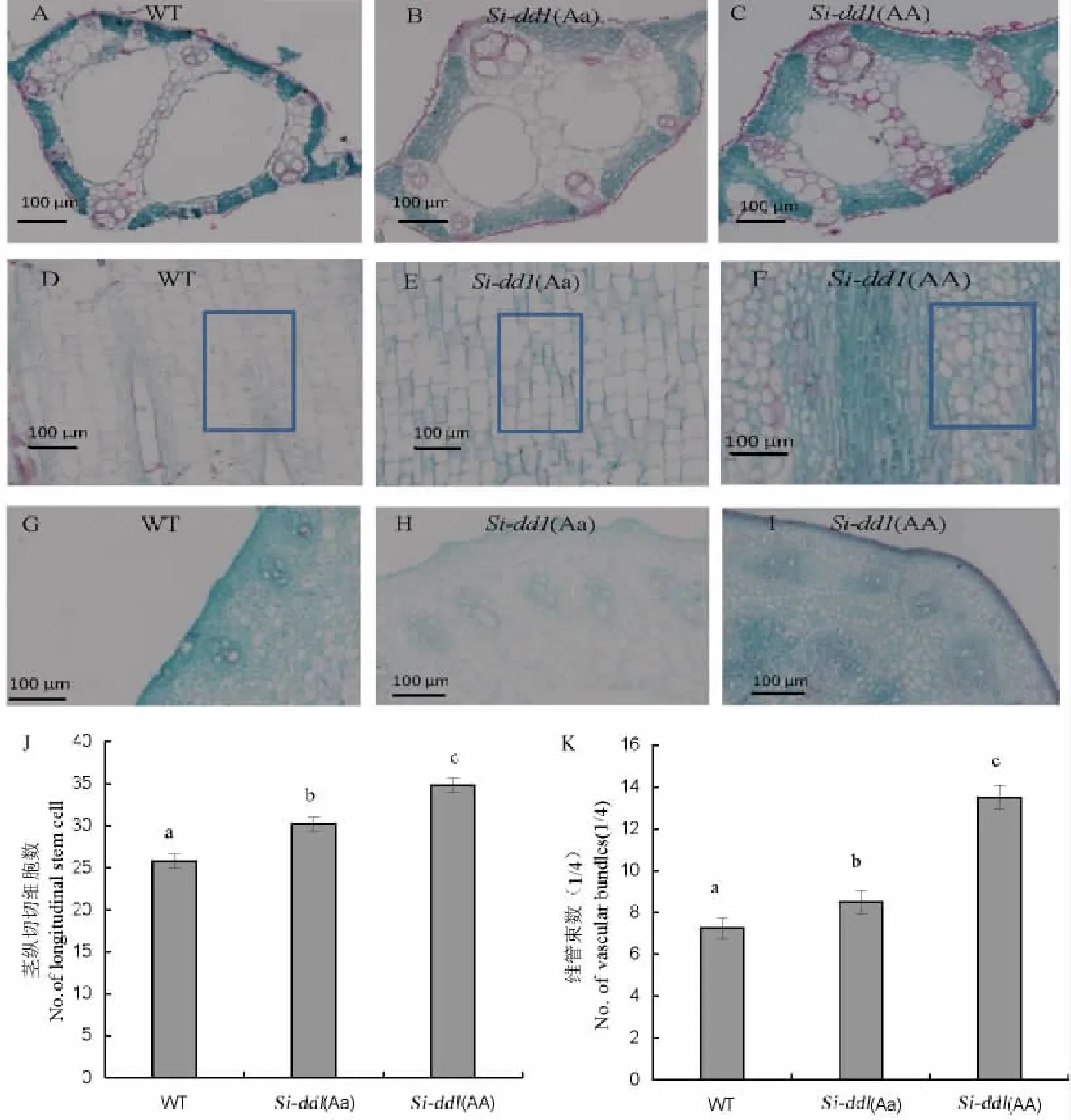
A,B,C-野生型(WT),Si-dd1(Aa)和Si-dd1(AA)叶主脉横切;D,E,F-野生型,Si-dd1(Aa)和Si-dd1(AA)倒2节间纵切;G,H,I-野生型,Si-dd1(Aa)和Si-dd1(AA)倒2节间横切;J,K-维管束(1/4)和茎纵切细胞数统计。A,B,C,Cross sections of leaf main vein of WT,Si-dd1(Aa)and Si-dd1(AA);D,E,F,Longitudinal section of the second internode from the top of WT,Si-dd1(Aa)and Si-dd1(AA);G,H,I,Cross sections of the second internode from the top of WT,Si-dd1(Aa)and Si-dd1(AA).J,K,Numbers of vascular bundles and longitudinal stem cells.图5 野生型,Si-dd1(Aa)和Si-dd1(AA)茎和叶的显微结构比较Fig.5.Comparison of microscopic structure among WT,Si-dd1(Aa)and Si-dd1(AA).
3 讨论
迄今为止,发现的矮秆突变体大部分和激素直接相关,例如赤霉素、油菜素内酯、独脚金内酯等,但也有与激素不直接相关的矮秆突变体,如细胞壁合成相关突变体D50、OsNST1、OsCD1[30-32]。外源施用激素处理敏感的突变体一般属于激素合成突变体,不敏感的属于激素信号突变体。本研究中,激素处理和蛋白分析结果表明,半显性矮秆突变体可能不属于赤霉素或油菜素内酯相关途径突变体,这为矮秆资源又提供了一份宝贵的材料。我们对半显性矮秆突变体进行遗传分析和分子标记定位,把该矮秆基因定位在第6染色体短臂上的分子标记P3和P4之间,物理距离约为244kb,该区段尚未有矮秆基因的报道。
本研究中,突变体和野生型对比,两者地上节间数相同,除倒1节间缩短比例较小外,其余节间缩短的比例都很大,属于典型的sh突变类型。根据石蜡切片观察结果来看,相对于野生型,突变体倒2节细胞数目变少,说明了突变体变矮可能是由细胞数目变少导致,在突变体生长过程中细胞分裂速度受到了一定程度的抑制。
株高是作物重要的农艺性状之一,与作物的产量、抗倒伏、光合效率等密切相关。因此,株高一直受到育种家的重视,水稻第一次绿色革命就是水稻矮化运用的典范,水稻半矮化协调了较高的水肥条件与易倒伏之间的矛盾,从而提高了收获指数。然而,目前鉴定的大部分矮秆基因除了植株矮化外,都会伴随一些不良性状,很难在生产上广泛应用。如小粒矮秆基因d1[11]、矮秆包穗基因eui2等[36-37]。本研究中虽然显性突变体伴随着很多不良性状,如生育期延长,着粒密度变密,结实率严重下降等,但其半矮秆突变体除株高降低外,其茎秆比野生型粗壮,且结实率下降不明显,可以提高种植密度从而解决结实率问题。因此可以考虑将该半显性矮秆材料转化为不育系,或许可以扩大恢复系选择范围,提高配组效率,获得更多优良杂交组合。当然在育种实践中,该基因是否能够为生产提供效益还需要进一步研究。
参考文献:
[1] Spielmeyer W,Ellis M H,Chandler P M.Semidwarf(sd-1),“green revolution”rice,contains a defective gibberellin 20-oxidase gene.Proc Natl Acad Sci USA,2002,99:9043-9048.
[2] Yin H F,Gao P,Liu C W,et al.SUI-family genes encode phosphatidylserine synthases and regulate stem development in rice.Planta,2013,237:15-27.
[3] Komorisono M,Ueguchi-Tanaka M,Aichi I,et al.Analysis of the rice mutant dwarf and gladius leaf 1,aberrant katanin-mediated microtubule organization causes up-regulation of gibberellin biosynthetic genes independently of gibberellin signaling.Plant Physiol,2005,138:1982-1993.
[4] Iwamoto M,Kiyota S,Hanada A,et al.The multiple contributions of phytochromes to the control of internode elongation in rice.Plant Physiol,2011,157:1187-1195.
[5] Toyomasu T,Kagahara T,Hirose Y,et al.Cloning and characterization of cDNAs encoding ent-copalyl diphosphate synthases in wheat:Insight into the evolution of rice phytoalexin biosynthetic genes.Biosc Biotech Biochem,2009,73:772-775.
[6] Hirano K,Asano K,Tsuji H,et al.Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice.Plant Cell,2010,22:2680-2696.
[7] Ueguchi-Tanaka M,Nakajima M,Katoh E,et al.Molecular interactions of a soluble gibberellin receptor,GID1,with a rice DELLA protein,SLR1,and gibberellin.Plant Cell,2007,19:2140-2155.
[8] Oikawa T,Koshioka M,Kojima K,et al.A role of Os-GA20ox1,encoding an isoform of gibberellin 20-oxidase,for regulation of plant stature in rice.Plant Mol Biol,2004,55:687-700.
[9] Hirano K,Kouketu E,Katoh H,et al.The suppressive function of the rice DELLA protein SLR1is dependent on its transcriptional activation activity.Plant J,2012,71:443-453.
[10]Yang M F,Qi W W,Sun F,et al.Overexpression of rice LRK1 restricts internode elongation by down-regulating Os-KO2.Biotech Lett,2013,35:121-128.
[11]Ueguchi-Tanaka M,Fujisawa Y,Kobayashi M,et al.Rice dwarf mutant d1,which is defective in theαsubunit of the heterotrimeric G protein,affects gibberellin signal transduction.Proc Natl Acad Sci USA,2000,97:11638-11643.
[12]Wang L,Xu Y,Ma Q,et al.Heterotrimeric G proteinαsubunit is involved in rice brassinosteroid response.Cell Res,2006,16:916-922.
[13]Hu X,Qian Q,Xu T,et al.The U-box E3ubiquitin ligase TUD1functions with a heterotrimeric Gαsubunit to regulate brassinosteroid-mediated growth in rice.PLoS Gene,2013,9:e1003391.
[14]Sakamoto T,Morinaka Y,Inukai Y,et al.Auxin signal transcription factor regulates expression of the brassinosteroid receptor gene in rice.Plant J,2013,73:676-688.
[15]Hong Z,Ueguchi-Tanaka M,Umemura K,et al.A rice brassinosteroid-deficient mutant,ebisu dwarf(d2),is caused by a loss of function of a new member of cytochrome P450.Plant Cell,2003,15:2900-2910.
[16]Zhi H,Miyako U,Shozo F,et al.The rice brassinosteroid-deficient dwarf2 Mutant,defective in the rice homolog of Arabidopsis DIMINUTO/DWARF1,is rescued by the endogenously accumulated alternative bioactive brassinosteroid,dolichosterone.Plant Cell,2005,17(8):2243-2254.
[17]Thirumurugan T,Ito Y,Kubo T,et al.Identification,characterization and interaction of HAP family genes in rice.Mol Genet Genom,2008,279:279-289.
[18]Hong Z,Ueguchi-Tanaka M,Shimizu-Sato S,et al.Loss-offunction of a rice brassinosteroid biosynthetic enzyme,C-6oxidase,prevents the organized arrangement and polar elongation of cells in the leaves and stem.Plant J,2002,32:495-508.
[19]Tanabe S,Ashikari M,Fujioka S,et al.A novel cytochrome P450is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf11,with reduced seed length.Plant Cell,2005,17:776-790.
[20]Bai M Y,Zhang L Y,Gampala S S,et al.Functions of Os-BZR1and 14-3-3proteins in brassinosteroid signaling in rice.Proc Natl Acad Sci USA,2007,104:13839-13844.
[21]Sang D J,Chen D Q,Liu G F,et al.Strigolactones regulate rice tiller angle by attenuating shoot gravitropism through inhibiting auxin biosynthesis.Proc Natl Acad Sci USA,2014,111:11199-11204.
[22]Ito S,Kitahata N,Umehara M,et al.A new lead chemical for strigolactone biosynthesis inhibitors.Plant Cell Physiol,2010,51:1143-1150.
[23]Arite T,Umehara M,Ishikawa S,et al.d14,a strigolactoneinsensitive mutant of rice,shows an accelerated outgrowth of tillers.Plant Cell Physiol,2009,50:1416-1424.
[24]Zou J H,Zhang S Y,Zhang W P,et al.The rice HIGHTILLERING DWARF1encoding an ortholog of Arabidopsis MAX3is required for negative regulation of the outgrowth of axillary buds.Plant J,2006,48:687-696.
[25]Jiang L,Liu X,Xiong G S,et al.DWARF 53 acts as a repressor of strigolactone signalling in rice.Nature,2014,506:401-405.
[26]Liu W,Kohlen W,Lillo A,et al.Strigolactone biosynthesis in medicago truncatula and rice requires the symbiotic GRAS-type transcription factors NSP1 and NSP2.Plant Cell,2011,23:3853-3865.
[27]Guo S Y,Xu Y Y,Liu H H,et al.The interaction between OsMADS57 and OsTB1 modulates rice tillering via DWARF14.Nat Comm,2013,4(3):1566.
[28]Du H,Wu N,Fu J,et al.A GH3family member,OsGH3-2,modulates auxin and abscisic acid levels and differentially affects drought and cold tolerance in rice.J Exp Bot,2012,63:6467-6480.
[29]Sazuka T,Kamiya N,Nishimura T,et al.A rice tryptophan deficient dwarf mutant,tdd1,contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos.Plant J,2009,60:227-241.
[30]Sato-Izawa K,Nakaba S,Tamura K,et al.DWARF50 (D50),a rice(Oryza sativa L.)gene encoding inositol polyphosphate 5-phosphatase,is required for proper development of intercalary meristem.Plant Cell Environ,2012,35:2031-2044.
[31]Zhang B C,Liu X L,Qian Q,et al.Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice.Proc Natl Acad Sci USA,2011,108:5110-5115.
[32]Luan W J,Liu Y Q,Zhang F X,et al.OsCD1encodes a putative member of the cellulose synthase-like D sub-family and is essential for rice plant architecture and growth.Plant Biotech J,2011,9:513-524.
[33]Rogers S O,Bendich A J.Extraction of DNA from milligram amountsof fresh,herbarium and mummified plant tissues.Plant Mol Biol,1985,5:69-76.
[34]Huang L M,Sun Q W,Qin F J,et al.Down-regulation of a SILENT INFORMATION REGULATOR2-related histone deacetylase gene,OsSRT1,induces DNA fragmentation and cell death in rice.Plant Physiol,2007,144:1508-1519.
[35]Zhang Q,Xu J,Li Y,et al.Morphological,anatomical and genetic analysis for a rice mutant with abnormal hull.J Genet Genom,2007,34:519-526.
[36]Yang D L,Li Q,Deng Y W,et al.Altered disease development in the eui mutants and Eui overexpressors indicates that gibberellins negatively regulate rice basal disease resistane.Mol Plant,2008,1:528-537.
Phenotypical Analysis and Fine Mapping of a Semi-dominant Dwarfism Gene Si-dd 1in Rice
CUI Yong-tao,WULi-wen,HUShi-kai,RENDe-yong,GEChang-wei,YE Wei-jun,DONGGuo-jun,GUOLong-biao*,HUXing-ming*
(State Key Laboratory of Rice Biology,China National Rice Research Institute,Hangzhou 310006,China;*Corresponding authors,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
CUI Yongtao,WU Liwen,HU Shikai,et al.Phenotypical analysis and fine mapping of a semi-dominant dwarfism gene Si-dd1 in rice.Chin J Rice Sci,2016,30(2):152-160.
Abstract:A semi-dominant dwarf rice mutant(termed as Si-dd1)was obtained from japonica rice variety Nipponbare by tissue culture mutagenesis.Morphological analysis showed that Si-dd1(AA)and Si-dd1(Aa)exhibited shorter plant height,decreased seed-setting rate,delayed heading,increased number of primary rachis branch and secondary rachis branch compared to the wild type(WT,Nipponbare).Physiological test results showed Si-dd1 had similar response to 24-Epibrassinosteroid to the WT,while it was insensitive to Gibberellin at 10(-4)μmol/L.Moreover,Western blot results also confirmed GID2expression level in Si-dd1 differed greatly from WT.The cytological analysis showed that Si-dd1 had smaller stomas in the leaf midrib,increased mesophyll cells and stem vascular bundles compared to WT.Genetic analysis and map-based clone showed that the Si-dd1 is controlled by a single semi-dominant gene,and locates in a 244kb region on chromosome 6.
Key words:rice;semi-dominant;dwarf;genetic analysis;map-based clone
中图分类号:Q755;S511.01
文献标识码:A
文章编号:1001-7216(2016)02-0152-09
基金项目:深圳市科技计划资助项目(JCYJ20140504111101999);国家自然科学基金资助项目(31271700,31461143014)。
收稿日期:2015-07-13;修改稿收到日期:2015-10-18。
