细菌血红蛋白及在生物工程领域的应用研究进展
2016-04-26杨江科
熊 炜,许 力,杨江科
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
细菌血红蛋白及在生物工程领域的应用研究进展
熊炜,许力,杨江科
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
摘要:在需氧发酵的过程中,溶解氧是细胞生长的主要限制性因素。在生物工程领域,为维持溶液中合适浓度的溶解氧,则需要有复杂的生物反应器和严谨的发酵参数控制。在发酵条件下,提高细胞的氧的利用效率是克服生物反应器中的氧气不足的一种新型、高效的解决方案。细菌血红蛋白是氧结合蛋白,它能从环境中主动转运氧至代谢过程,并允许细菌即使在微需氧条件下生长。因此,通过细菌血红蛋白的异源表达可获得氧利用率高的“底盘”细胞,提高生产效率。阐述了细菌血红蛋白的分类和分布,重点综述了三类细菌血红蛋白的结构与功能,以及其在生物工程领域的应用状况及进展,拟为后续研究和广泛应用提供参考与借鉴。
关键词:细菌血红蛋白;分类;结构;功能;应用
1引言
氧是需氧微生物生长所必须的要素。氧参与微生物的新陈代谢,可使细胞能最高水平利用底物产生能量,并在细胞内通过改变特定蛋白的功能和影响细胞内转录子进而影响蛋白质的生物合成来参与多种细胞功能的调节[1]。由于气(氧气)/液(水相)传质阻力,氧的水溶解度非常低。在生物反应器中,由于对最高的生产效率的追求,微生物和培养的细胞的对氧气的需求很高,尤其是在大规模和高细胞密度的生产工艺中,溶解氧已成为细胞生长的主要限制性因素。在工程领域中,通常通过改进发酵工艺参数和生物反应器的构型来满足和缓解细胞对氧的高需求[2]。这不仅需要复杂的系统设计和工艺设定,而且通过改变发酵参数和反应器等条件只能在有限范围内适用。因此,生产菌对氧的需求量与发酵设备供氧仍是目前在微生物发酵工业中普遍存在的矛盾。
在生物体内,血红蛋白(hemoglobin)是与氧的利用率最密切相关的蛋白质分子。无论是在功能还是在分子结构上,它是最具有典型特征的氧结合蛋白质。很早以前,血红蛋白被认为只存在于哺乳动物,但最近的研究结果表明它不仅存在于哺乳动物,还存在于无脊椎动物、植物和细菌中。
2细菌血红蛋白的起源和VHb
目前,在细菌中共发现有三类血红蛋白,即单结构域血红蛋白、黄素血红蛋白和截断血红蛋白。
1953年Keilin和他的合作者在酵母中发现含黄素部分的血红蛋白样细胞色素,并将之定义为“酵母血红蛋白”[3]。1979年Probst 等将Ralstoniaeutropha中含黄素部分的血红蛋白正式定名为黄素血红蛋白[4]。截断血红蛋白最早是在草履虫中发现的,通过光谱学实验证明了它属于血红蛋白,但是它比一般的非脊椎动物血红蛋白少20—40个氨基酸,后来被命名为截断血红蛋白。透明颤菌血红蛋白(VitreoscillaHemoglobin, VHb)是目前研究最为透彻的细菌血红蛋白。1966年Webster和Hackett发现透明颤菌(Vitreoscilla)中存在一类种氧结合蛋白,即VHb[5]。但VHb一直被误认为是终端呼吸氧化酶或者细胞色素o。1983年DeMaio等在透明颤菌中发现了另一种与膜结合的细胞色素o,它与CO配体结合在细胞膜上,并被证明是真正的终端氧化酶[6]。1986年Wakabayashi等[7]将VHb的氨基酸序列与其他物种的血红蛋白序列对比发现VHb与血红蛋白序列相似性很高;进一步实验又证明在有氧条件下,该蛋白的CO结合物和氧结合物都会光解,这与终端氧化酶和细胞色素c功能不同,而与氧结合蛋白如血红蛋白、肌动血红蛋白的功能类似,从而最终证明了VHb不是细胞色素o,而是血红蛋白。
黄素血红蛋白和单结构域血红蛋白的分布比较集中,黄素血红蛋白主要分布在贪铜菌属、伯克氏菌属、假单胞菌菌属和芽孢杆菌属。单结构域血红蛋白主要分布在贝日阿托氏菌属、梭形杆菌属、芽孢杆菌属和动物性球菌属。截断血红蛋白的分布比较分散,存在的菌属比较多样,基本属于放线菌目和根瘤菌目,如图1所示(图中所列序列来源于GenBank;序列的Multi-alignment分析采用Cluster W程序进行分析;系统发育关系Mega 4.0软件的辅助下,采用Neighbour-jioning法进行分析)。
由图1可知,细菌血红蛋白在系统发育上分为两大类群:黄素血红蛋白和单结构域血红蛋白组成群I,截断血红蛋白单独聚为群II。这表明,截断血红蛋白并不仅仅单纯的在一级结构上比单结构域血红蛋白截短一部分或在三级结构上比单结构域血红蛋白少一个α-螺旋组成,而且更重要的是在系统发育和进化关系上显著不同于后者。
所有的细菌血红蛋白都可以追溯到同一祖先,Scott和Lecomte曾分析现有血红蛋白的氨基酸和基因序列,发现所有的血红蛋白都是从古老的血红素蛋白进化而来,而且早在大气出现之前这些蛋白已经存在[8]。之后分化成截断血红蛋白和黄素血红蛋白,部分黄素血红蛋白进一步进化成单结构域血蛋白。
3细菌血红蛋白的结构与功能
通常,血红蛋白分为脊椎动物和无脊椎生物血红蛋白。脊椎动物的血红蛋白主要是人血红蛋白(human hemoglobin)。人血红蛋白是杂四聚体,由2个α亚基和2个β亚基构成,分子形态近似球型,如图2[9]所示。人血红蛋白含有4个血红素,能结合4个O2分子,作为氧结合部位的空穴有两个关键的组氨酸残基(E7和F8)和两个疏水残基(Phe CD1和Leu F4)。无脊椎生物血红蛋白包括在植物,真菌,原生动物和细菌中发现的血红蛋白。所有血红蛋白的共同特点是它们能可逆地结合氧。对各种来源的血红蛋白的蛋白质序列的比对分析发现尽管血红蛋白一级氨基酸序列高度可变但均具有功能性保守Motif。如在Phe-CD1和 Trp-H7周围均有疏水氨基酸簇,而这对蛋白的折叠和稳定至关重要;His-F8、 Tyr-G5和Glu-p3形成了氢键网络,可能调节血红素铁原子性质[10]。血红蛋白的三级结构是典型的球蛋白结构,此高度保守的结构由短的中间环连接的6至8个α-螺旋组成,分别为A、B、C、D、E、F、G、H螺旋,进而形成three-over-three折叠的夹芯状组件。而血红素则被疏水性残基包围在这种夹芯状组件中[1]。

图1 细菌血红蛋白系统发育树

图2 人血红蛋白结构图
根据其结构不同,细菌血红蛋白主要分为三类:单结构域血红蛋白(Single domain Hemoglobin,sdHb),只有一个结合氧的结构域;黄素血红蛋白(flavohemoglobins,flavoHb),比sdHb多一个还原酶结构域;截断血红蛋白(Truncated Hemoglobin,trHb)。三种血红蛋白的结构示意图及典型氨基酸序列如图3和图4[1,11-12]所示。
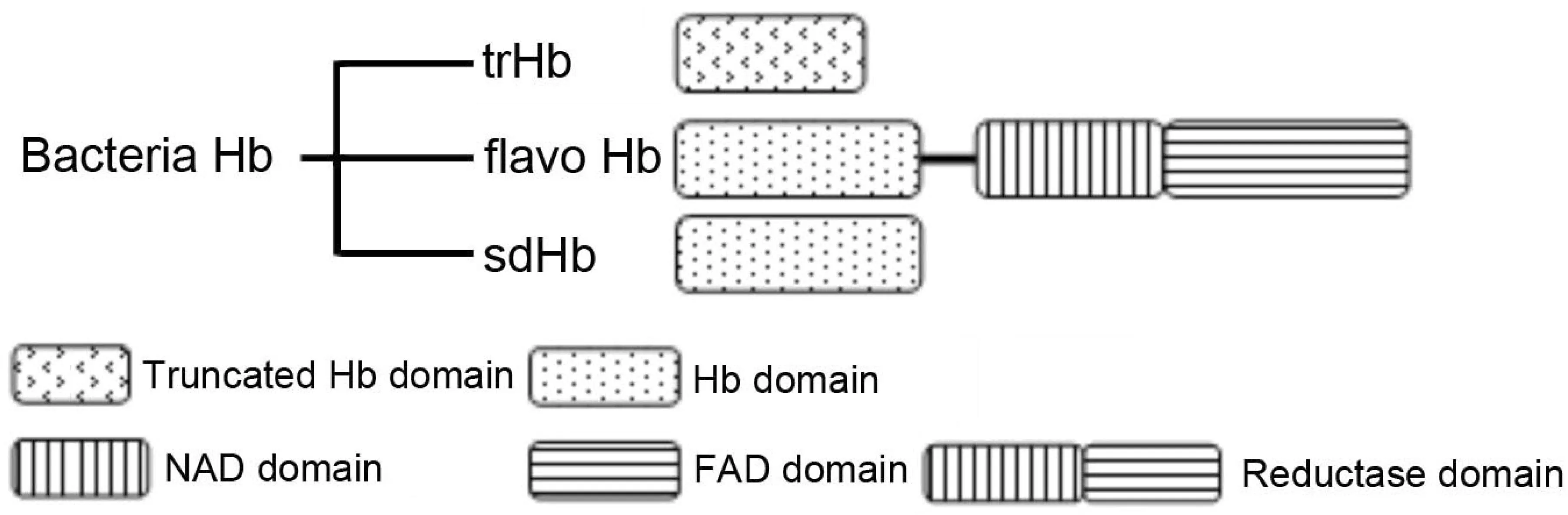
图3 三类细菌血红蛋白的结构特征

FHP是R. eutropha血红蛋白属于黄素血红蛋白;VHb是Vitreoscilla血红蛋白属于单结构域血红蛋白;trHbN是Mycobacterium Tuberculosis血红蛋白,属于截断血红蛋白图4 三种典型血红蛋白的氨基酸序列比较
3.1单结构域血红蛋白
透明颤菌血红蛋白是典型的单结构域的血红蛋白,也是目前研究最为透彻的细菌血红蛋白。
VHb的晶体结构(图5[11])显示,它是由经典的three-over-three折叠的球蛋白和结合在保护残基(Phe-CD1,His-F8)上的血红素构成。通常VHb是以同型二聚体的形式存在的,这在球蛋白家族中未曾观察到过,是基于螺旋F与螺旋H两个亚基分子相互作用和涉及的两个亚基之间的范德华力缔合。两个血红素铁原子相互距离为34 Å[13]。但是它的亚单体缔合的功能比较弱,在某种条件下VHb也能以具有功能的单体形式存在。VHb在近端和远端有独特的通过氢键和TyrB10、GlnE7、ProE8及LysE11四个残基形成的血红素端囊,可能与螺旋F与螺旋E的干扰有关。另外,大多数血红蛋白的末端E7位点都是His残基,该残基通过氢键与氧结合,而VHb端囊为Gln-E7。定点突变表明,E7位点是Gln残基而不是His残基对VHb三维结构影响很大,这也是VHb对配体氧亲和力小传送氧速度快的原因[14]。VHb在细胞中主要分布在细胞质和细胞周质,分布在细胞周质是由于它N末端16个氨基酸序列所致[15]。

图5 VHb结构图
3.2黄素血红蛋白
黄素血红蛋白(flavoHb)是由N-末端球蛋白结构域(Hb结构域)和一个C-末端还原酶结构域组成(图6[16])。与VHb相比,黄素血红蛋白多了一个分子内还原酶结构域。还原酶结构域可以划分成两个功能独立的蛋白质模块:FAD结合域(FAD)和NAD(P)H的结合域(NAD)。flavoHb和VHb的Hb区域是经典的球蛋白折叠。血红素分子嵌入由B,C,E,F,G,H螺旋形成的疏水裂缝间。多肽链与卟啉环之间的结合力主要是由血红素分子附近的疏水性侧链提供的。flavoHb和VHb结构与哺乳动物Hb很明显的差异就是缺乏D螺旋;C螺旋和E螺旋的氨基酸残基不是采取通常的α螺旋构象,而是形成一个环。该环状结构可能是FAD还原酶结构域和球蛋白结构域相互作用位点。

图6 FHP结构图
相对于经典蛋白折叠结构,flavoHb在结构重排后,近端具有类似于细胞色素c过氧化物酶的催化性质, 这为不同生理功能的flavoHb储存氧和传递氧提供强有力的支持。根据拉曼光谱数据,由于与Glu-p3形成强烈的氢键,近端的咪唑环的His-F8拥有咪唑酯的性质[9]。与单结构域的血红蛋白相比,flavoHb有一个包含NAD(P) H和FAD结合域的C末端还原酶的结构域。还原酶结构域属于NADP+铁氧还原蛋白家族[17]。还原酶结构域可以细分成两个结构上和功能上独立的结构域:FAD结合结构域(FHP中153-258残基,HMP中151-251)和NAD(P) H结合结构域(FHP中266-403残基,HMP中259-396残基)。FAD结合结构域是由一个六股反向平行β-桶结构(β- barrel)组成,而NAD(P) H结合结构域是由五股平行的β-折叠组成。FAD与FHP的全部的三个结构域都以非共价键的方式接触。血红素和FAD分子相互距离分别为6.3 Å(FHP)和5.9 Å(HMP),在由几个氨基酸侧链形成的极性环境中,有利于电子从FAD结构域转移到血红素[11]。然而,作为NADP+铁氧还原蛋白家族的成员,FAD结合结构域和NAD(P) H结合结构域的相对空间重排可能会有差异,但不会影响功能[17]。
flavoHb的还原酶结构域的一些氨基酸残基是高度保守的。Tyr(FHP:208,HMP:206)联合Lys-F7,Glu(FHP:394,HMP:388)和FAD的异咯嗪环; Gln(FHP:207,HMP:205),稳定连接FAD和血红素的水分子。Arg(FHP:206,HMP:204)、Tyr(FHP:208,HMP:206)和Ser(FHP:209,HMP:207)稳定FMN部分。在NAD结合结构域,Glu(FHP:394,HMP:388)是高度保守的,且其侧链与Lys-F7形成盐桥。Lys-F7和Glu(FHP:394,HMP:388),是极性氨基酸,其主要的大型侧链是所有三个结构域的一部分。这些氨基酸残基可能会影响血红素和FAD基团的电化学电势[9],并且在将电子从FAD传递到血红素的结合铁的过程中是必不可少的。Fery 等在2000年构建含有Vhb-NAD(P)H-FAD 的融合蛋白,并检测在宿主细胞中的活力,结果证明这些融合蛋白可以提高在低氧条件下E.coli菌体生长,比仅含Vhb的E.coli增加50%—70%[18]。
flavoHb 能结合各种血红素配体,如O2、CO、NO和CN-。HMP能通过FAD将电子给血红素结合配体(氧气或NO)或外部电子受体[1]。无论在体外还是在体内,在存在氧和NADH时,HMP具有NADH氧化酶的活性,且能快速消耗超氧化物和过氧化氢[19]。
无论在有氧还是厌氧条件下,flavoHb 都有NO解毒作用。Gardner[20]和Hausladen[21]指出有氧条件下在NO解毒过程中,HMP在NO的诱导产生,消耗O2和NADH,与一氧化氮双加氧酶将NO转化为硝酸盐。在厌氧条件下,伴随着NAD(P)H的消耗,NO与HMP的反应产生一氧化二氮(N2O)。NO结合在HMP的活性位点还原为硝酰基,然后经由二聚中间体反应形成一氧化二氮(N2O)。此反应进行的速率比在需氧条件下的速率低几个数量级[22]。
3.3截断血红蛋白
截断血红蛋白(trHb)氨基酸序列比与它不同源的无脊椎动物的少20—41个氨基酸。晶体结构(图7[12])显示trHb的结构主要是two-over-two螺旋折叠,这种三维空间折叠模式是经典球蛋白折叠(three-over-three折叠)的一部分,也是trHb的显著特征[23]。
图7 trHbN 结构图
在trHb的two-over-two螺旋折叠中,B/E、G/H形成反向双螺旋对,是该折叠的主要二级结构元件。在trHb折叠中,N端A螺旋几乎完全被删除,整个CD-D区调整到只有3个残基,可能是最小的连接C和E螺旋之间的多肽桥梁。此外在延伸构象中,大部分trHb的近端的F螺旋被多肽片段取代。因此,trHb多肽链并不是一个常规的经典球蛋白折叠的简单截断版本,而是通过特定位点残基的删除或替换来维持构象的稳定。trHb多肽链的严格保守氨基酸比较少,包括近端的His-F8残基和Phe-B9-Tyr-B10残基对。其中Tyr-B10是参与血红素配体的稳定。在非脊椎动物的血红蛋白中CD1都是Phe[23]。此外,从分子表面到血红素的远端位点穿过蛋白矩阵形成几个连续的疏水通道,是配体扩散到血红素的主要途径[24-25]。trHbs内部配体扩散通道是由细长蛋白基质隧道和一个封闭的末端构成,与肌动血红蛋白基于E7的远端门形成的内部配体扩散通道不同。trHbs蛋白基质隧道不仅会使氧气更易接近血红素,也对氧气的固定极为关键。这种球蛋白折叠结构的可塑性,给我们展现了一种新的血红蛋白结构和潜在的新功能。
有学者认为,trHbs显著简化的two-on-two球蛋白折叠结构,决定它的生物功能不是氧气储存或运输。因此trHb具有非常高的氧亲和力,而不具有传递和运输氧的能力,这可能有利于结合了氧的血红素与NO转化为硝酸盐从而达到解毒NO的作用[23]。研究发现,单细胞绿藻Chlaymydomonas.eugametos的trHbs受光合作用的诱导,且有部分trHbs结合在叶绿体类囊体膜, 念珠藻属的藻青菌trHB被固定在细胞膜的胞质面上并且只在低氧的环境下表达。此外,编码trHB的基因与固氮复合物的基因是共表达的[26]。trHB的潜在功能可能很多,但大多都鲜为人知。
4细菌血红蛋白在生物工程领域的应用
血红蛋白在生物工程领域的研究最早始于1988年,Khosla和Bailey将vgb基因放在大肠杆菌中表达,有效提高了大肠杆菌的生长水平[27]。随后,VHb被广泛应用于众多宿主细胞中,既包括原核细胞,也包括真核的宿主细胞,如人细胞和烟草细胞。研究均表明vhb基因可以提高宿主细胞的各种性质,包括:总菌量,总蛋白,单独的蛋白,抗生素以及发酵的产物。如有研究者将vgb基因通过染色体整合到火木层孔菌。在摇瓶中,含vgb基因的表达菌细胞干重增加1.32倍,总黄酮产量增加1.78倍,胞外多糖增加1.33倍;在发酵罐中,含vgh的工程菌的细胞干重从5.40 g/L增加到10.90 g/L,总黄酮和胞外多糖最大生产分别达到11.43 g/L和1.33 g/L。此外,与对照相比,工程菌中在烧瓶中乙酸含量从1.54 g/L降低至1.19 g/L,而在发酵罐中从1.78 g/L降至1.27 g/L[28]。
所有研究VHb功能的都是把其作为氧气结合蛋白。VHb功能可取决于其与各种“伴侣蛋白”(终端呼吸氧化酶,加氧酶,还原酶等)的相互作用。在低氧的环境下,VHb将氧气传递给终端呼吸氧化酶,增强细胞的呼吸作用,从而提高ATP的产量[29]。VHb的作用除了可以把氧气传递给加氧酶,还可以与还原酶结构域形成一个嵌合体共表达,具有解毒NO的作用,在另一方面也可以提高核糖体翻译水平和tRNAs的转运水平[30]。VHb可以影响300多种基因的表达,即有积极的影响,也有消极的影响。有趣的是,VHb也可以作为终端呼吸氧化酶[31]。最近研究表明,VHB可以与转录因子直接相互作用[32]。因此,VHb对细胞新陈代谢的影响是复杂的。
5结束语
目前,在细菌中共发现单结构域血红蛋白、黄素血红蛋白和截断血红蛋白等三类血红蛋白。在系统发育上和结构上,单结构域血红蛋白与黄素血红蛋白的血红蛋白结构域关系密切而与截断血红蛋白关系较远。尽管血红蛋白广泛分布于细菌中,但目前研究最为透彻,在生物工程领域应用最多的仅有来自透明颤菌的单结构域的血红蛋白(VHb),而对黄素血红蛋白和截断血红蛋白的研究较少。现有的研究表明,后者可能具有更丰富、更多样功能,在生物工程和生物技术领域具有更广泛的潜在用途。这为研究工作者开发新的血红蛋白系统,以缓解生产菌对氧的需求量与发酵设备供氧的矛盾,从而推动微生物工业发酵的发展开辟了新的空间。细菌血红蛋白及在生物工程领域中的应用实例如表1所示。
表1细菌血红蛋白及在生物工程领域中的应用实例
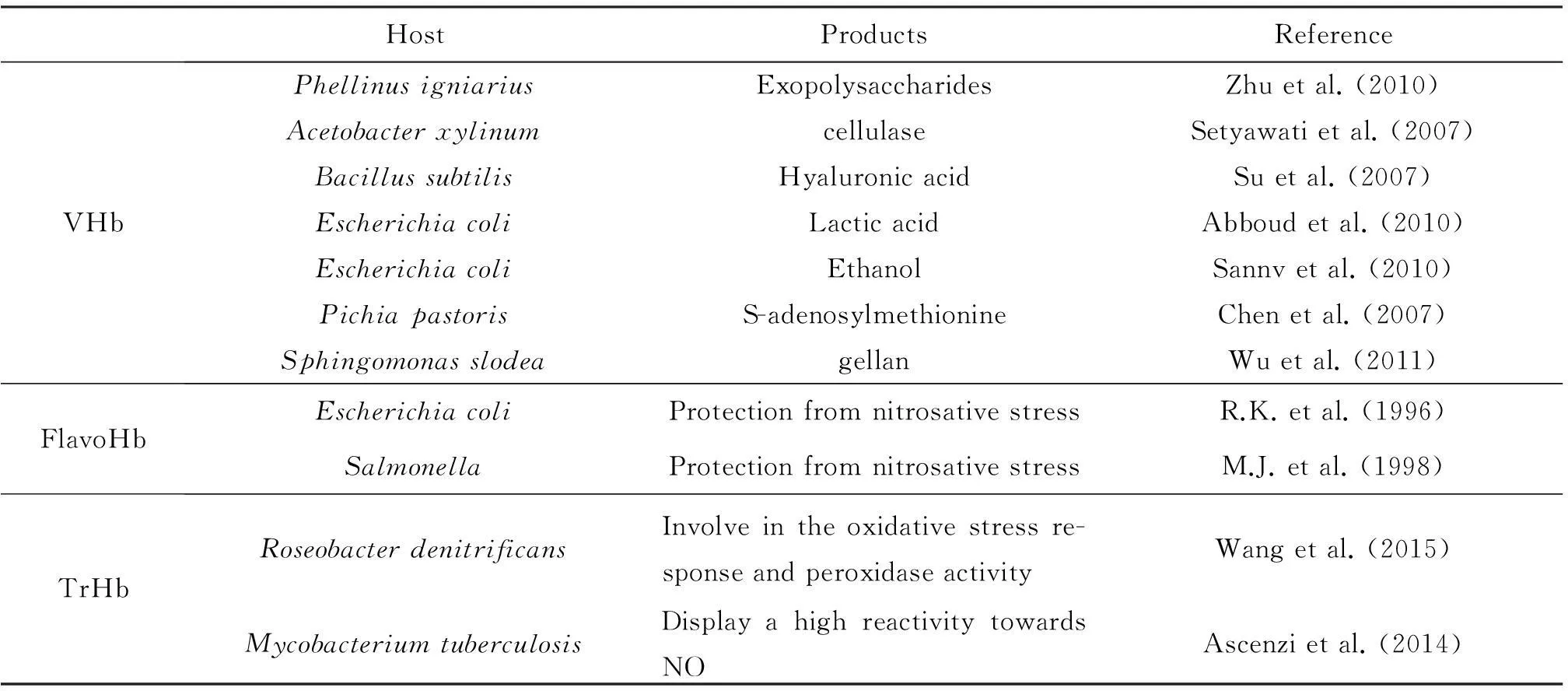
HostProductsReferenceVHbPhellinusigniariusExopolysaccharidesZhuetal.(2010)AcetobacterxylinumcellulaseSetyawatietal.(2007)BacillussubtilisHyaluronicacidSuetal.(2007)EscherichiacoliLacticacidAbboudetal.(2010)EscherichiacoliEthanolSannvetal.(2010)PichiapastorisS-adenosylmethionineChenetal.(2007)SphingomonasslodeagellanWuetal.(2011)FlavoHbEscherichiacoliProtectionfromnitrosativestressR.K.etal.(1996)SalmonellaProtectionfromnitrosativestressM.J.etal.(1998)TrHbRoseobacterdenitrificansInvolveintheoxidativestressre-sponseandperoxidaseactivityWangetal.(2015)MycobacteriumtuberculosisDisplayahighreactivitytowardsNOAscenzietal.(2014)
参考文献:
[1]Frey A D, Kallio P T. Bacterial hemoglobins and flavohemoglobins: versatile proteins and their impact on microbiology and biotechnology [J]. FEMS Microbiol Rev, 2003, 27(4):525-545.
[2]Konz J O, King J, Cooney C L. Effects of oxygen on recombinant protein expression [J]. Biotechnol Prog, 1998, 14(3): 393-409.
[3]Keiln D.Haemolobin in fungi; occurrence of haemoglobin in yeast and the supposed stabilization of the oxygenated cytochrome oxidase The purification and properties of cytochrome o fromVitreoscilla[J]. Nature, 1953,172(4374):390-393.
[4]Probst I, Wolf G, Schlegel H G. An oxygen-binding flavohemoprotein fromAlcaligeneseutrophus[J]. Biochim Biophys Acta, 1979, 576(2):471-478.
[5]Webster D A, Hackett D P. The purification and properties of cytochrome o fromVitreoscilla[J]. J Biol Chem, 1966, 241:3308-3315.
[6]DeMaio R A, Webster D A, Chance B. Spectral evidence for the existence of a second cytochrome o in whole cells ofVitreoscilla[J]. J Biol Chem, 1983, 258: 13768-13771.
[7]Wakabayashi S, Matsubara H, Webster D A. Primary sequence of a dimeric bacterial haemoglobin fromVitreoscilla[J]. Nature, 1986, 322(6078):481-483.
[8]Scott N L, Lecomte J E. Cloning, expression,purification and preliminary characterization of a putative hemoglobin from the cyanobacterium Synechocystissp. PCC 6803[J]. Protein Sci, 2000, 9:587-597.
[9]Birukou I, Soman J, Olson J S. Blocking the gate to ligand entry in human hemoglobin [J]. J Biol Chem, 2011, 286(12):10515-10529.
[10]Ermler U, Siddiqui R A, Cramm R, et al. Crystal structure of the flavohemoglobin fromAlcaligeneseutrophusat 1.75 A resolution [J]. EMBO J, 1995, 14(24):6067-6077.
[11]Ratakonda S, Anand A, Dikshit K, et al. Crystallographic structure determination of B10 mutants ofVitreoscillahemoglobin: role of Tyr29 (B10) in the structure of the ligand-binding site [J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2013, 69(3):215-222.
[12]Milani M, Ouellet Y, Ouellet H, et al. Cyanide binding to truncated hemoglobins: a crystallographic and kinetic study [J].Biochemistry, 2004, 43(18):5213-5221.
[13]Tarricone C, Galizzi A, Coda A, et al. Unusual structure of the oxygen-binding site in the dimeric bacterial hemoglobin fromVitreoscillasp [J]. Structure, 1997, 5(4):497-507.
[14]Dikshit K L, Orii Y, Navani N, et al. Site-direeted mutagenesis of bacterial henloglobin:the role of glutamine (E7)in oxygen-binding in the distal heme poeket [J]. Arch Bioellem BioPhys, 1998, 349(1):161-166.
[15]Khosla C, Bailey J E. Evidence for partial export of Vitreoseilla hemoglobin into the periplasmic space inEseheriehiacoli.Implieations for protein function [J]. J Mol Biol, 1989, 210(1):79-89.
[16]El Hammi E, Warkentin E, Demmer U, et al. Structure ofRalstoniaeutrophaflavohemoglobin in complex with three antibiotic azole compounds [J]. Biochemistry, 2011, 50(7):1255-1264.
[17]Karplus P A, Daniels M J, Herriott J R. Atomic structure of ferredoxin-NADP+ reductase: prototype for a structurally novel flavoenzyme family [J]. Science, 1991, 251(4989):60-66.
[18]Frey A K, Bai ley J E , Kallio P T. Expression ofAlcaligeneseutrophusflavohemoglobin and engineered Vitreoscilla hemogeobin-reductase fusion protein for improved hypoxic growth of Escherichia coli [J]. Appl Environ Microbiol, 2000 , 66:98 -104.
[19]Mills C E, Sedelnikova S, Soballe B, et al.Escherichiacoliflavohaemoglobin (Hmp) with equistoichiometric FAD and haem contents has a low affinity for dioxygen in the absence or presence of nitric oxide [J]. Biochem J, 2001, 353(2):207-213.
[20]Gardner P R, Costantino G, Salzman A L. Constitutive and adaptive detoxification of nitric oxide inEscherichiacoli. Role of nitric-oxide dioxygenase in the protection of aconitase [J]. J Biol Chem, 1998, 273(41):26528-26533.
[21]Hausladen A, Gow A J, Stamler J S. Nitrosative stress: metabolic pathway involving the flavohemoglobin [J]. Proc Natl Acad Sci U S A, 1998, 95(24):14100-14105.
[22]Kim S O, Orii Y, Lloyd D, et al. Anoxic function for theEscherichiacoliflavohemoglobin (Hmp): reversible binding of nitric oxide and reduction to nitrous oxide [J]. FEBS Lett, 1999, 445(2-3):389-394.
[23]Wittenberg J B, Bolognesi M, Wittenberg B A, et al. Truncated hemoglobins: a new family of hemoglobins widely distributed in bacteria, unicellular eukaryotes, and plants [J]. J Biol Chem, 2002, 277(2):871-874.
[24]Pesce A, Couture M, Dewilde S, et al. A novel two-over-two alpha-helical sandwich fold is characteristic of the truncated hemoglobin family [J]. EMBO J, 2000, 19(11):2424-2434.
[25]Milani M, Pesce A, Ouellet Y, et al.Mycobacteriumtuberculosishemoglobin N displays a protein tunnel suited for O2 diffusion to the heme [J]. EMBO J, 2001, 20(15):3902-3909.
[26]Thorsteinsson M V, Bevan D R, Potts M, et al. A cyanobacterial hemoglobin with unusual ligand binding kinetics and stability properties [J]. Biochemistry, 1999, 38(7):2117-2126.
[27]Khosla C, Bailey J E. Heterologous expression of a bacterial hemoglobin improves the growth properties of recombinantEscherichiacoli[J]. Nature, 1988, 331:633-635.
[28]Zhu H, Sun S, Zhang S. Enhanced production of total flavones and exopolysaccharides viaVitreoscilla hemoglobin biosynthesis inPhellinusigniarius[J]. Bioresour Technol, 2011, 102(2):1747-1751.
[29]Ramandeep, Hwang K W, Raje M, et al.Vitreoscillahemoglobin: intracellular localization and binding to membranes [J]. J Biol Chem, 2001, 276:24781-24789.
[30]Stark B C, Dikshit K L, Pagilla K R. Recent advances in understanding the structure, function, and biotechnological usefulness of the hemoglobin from the bacteriumVitreoscilla[J]. Biotechnol Lett, 2011, 33(9):1705-1714.
[31]Dikshit R P, Dikshit K L, Liu X Y, et al. The bacterial hemoglobin from Vitreoscilla can support the aerobic growth ofEscherichiacolilacking terminal oxidases [J]. Arch Biochem Biophys, 1992, 293:241-245.
[32]Anand A, Duk B T, Singh S, et al. Redox mediated interactions of VHb (Vitreoscillahemoglobin) with OxyR: novel regulation of VHb biosynthesis under oxidative stress [J]. Biochem J, 2010, 426:271-280.
Proceeding on the bacteria hemoglobins and their application in biological engineering field
XIONGWei,XULi,YANGJiang-ke
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:In aerobic cultivation process, dissolved oxygen in aqueous solution is critical for the efficient operation of bioreactors. In the field of biological engineering, it needs complex biological reactor design and strict control of fermentation parameters to maintain an appropriate concentration of dissolved oxygen in aqueous solution. Under the fermentation conditions, improving the oxygen utilization efficiency of cells is a novel and efficient solution to overcome the oxygen shortage in bioreactor. Bacteria hemoglobin is an oxygen-binding protein that transfers oxygen from the environment to the metabolism process, and allows bacteria to grow even under microaerophilic conditions. Thus, high oxygen utilization cell can be obtained to improve production efficiency by the expression of heterologous bacterial hemoglobin. This review describes the classification and distribution of bacterial hemoglobin, and focuses on the structure and function of the three bacterial hemoglobins. We also discussed the applications of three bacterial hemoglobins in the field of bioengineering, which will provides reference for the follow-up bio-application and researches.
Key words:bacterial hemoglobin; classification; structure;function
中图分类号:Q 939.9
文献标识码:A
DOI:10.3969/j.issn.2095-7386.2016.01.001
文章编号:2095-7386(2016)01-0001-09
基金项目:湖北省科技厅科技支撑计划项目(2014BBB007);武汉轻工大学2013年研究生创新基金(2013CX019).
作者简介:熊炜(1991-),女,硕士研究生,E-mail:xiongwei910702@126.com.通信作者:杨江科(1972-),男,博士,E-mail:yangjiangke@yahoo.com.
收稿日期:2015-12-02.
