瘤荔枝螺室内人工育苗试验
2016-04-23浙江省嵊泗县海洋科技研究所浙江嵊泗202450
黄 继 (浙江省嵊泗县海洋科技研究所,浙江嵊泗 202450)
瘤荔枝螺室内人工育苗试验
黄 继(浙江省嵊泗县海洋科技研究所,浙江嵊泗 202450)
摘要[目的]通过室内人工育苗试验,探索瘤荔枝螺的人工育苗技术。[方法]采用低温干运法将亲螺从嵊泗县嵊山镇运回试验基地,控制培育池水深55~65 cm,海水比重1.016~1.019,水温26~30 ℃,保持连续充气,投喂鲜活的紫贻贝、菲律宾蛤仔、蓝蛤等低值贝类。收集亲螺产出的卵囊,冲洗消毒后放入孵化池孵化。培育单细胞微藻作为瘤荔枝螺幼体的饵料,用虾片、长牡蛎卵细胞、新鲜缢蛏碎块(200目筛绢网过滤)培育稚螺。[结果]共孵化出瘤荔枝螺面盘幼体800万粒,培育出平均壳高3.56 mm的稚螺58.6万粒,培育成活率为7.3%。瘤荔枝螺胚胎发育是在卵囊内完成,胚胎发育成面盘幼虫后破膜而出,进入浮游生长阶段,期间摄食单胞藻。附着变态后,幼虫开始摄食动物性饵料。[结论]附底栖硅藻波纹板采苗率最高。
关键词瘤荔枝螺;亲螺培育;人工育苗
Indoor Artificial Breeding ofThaisbronni
HUANG Ji
(Shengsi Research Institute of Marine Science and Technology, Shengsi, Zhejiang 202450)
Abstract[Objective] Indoor artificial breeding experiment was conducted to explore artificial breeding technology forThaisbronni. [Method] Snails were carried out in the dry and low temperature environment from Shengshan Town, Shengsi County to test base. They were kept living in the water depth of 55-65 cm, proportion of sea water 1.016-1.019, water temperature 26-30 ℃, adequate oxygen, enough fresh low value shellfish. The sterilized oocysts of relatives were collected and put into the culture pool after washing and disinfecting. Taking single cell microalgae as bait for the larvae ofThaisbronni, young snails were cultivated with prawn crackers, egg cell of long oyster, fresh meat loaf ofSinonvaculaconstricta(200 mesh screen filtering). [Result] The test hatched 8 million grain veligers, cultivated 0.586 million grain juvenile snails with the average shell height of 3.56 mm, survival rate was 7.3%. The embryonic development ofThaisbronniwas completed within the oocyst, broken membrane and out after became veliger larvae, then access to planktonic growth phase, feeding with single cell algae. [Conclusion] The seedling rate of benthic diatom corrugated plate is the highest.
Key wordsThaisbronni; Parent snail cultivating; Artificial breeding
瘤荔枝螺(Thaisbronni)隶属软体动物门腹足纲骨螺科荔枝螺属,分布于我国东南沿海,俗称“黄螺”,是一种栖息在潮间带的岩石上或石砾间的肉食性螺类[1]。瘤荔枝螺的贝壳呈纺锤形,壳面为淡黄色或带黑灰色,壳表具有较大的瘤状突起[2]。它生长速度快,肉质鲜美,营养和经济价值极高,是加工嵊泗特产“螺浆”的上等原料。近年来,由于过度捕捞,嵊泗海域中瘤荔枝螺自然资源量衰退,采捕量大大减少,导致价格不断上升,售价约为160元/kg。目前,人们已对瘤荔枝螺的齿舌形态分析[3]和分类学研究[4]进行了报道,但对其人工育苗则鲜未见报道。为了修复嵊泗海域中瘤荔枝螺自然资源和开发瘤荔枝螺养殖品种,笔者于2015年6月在金平繁育基地进行了瘤荔枝螺人工育苗试验,旨在为其繁育和资源恢复提供理论依据和技术支持。
1材料与方法
1.1试验条件试验在育苗室中进行,育苗室内有育苗池12个和饵料培养池10个。育苗池大小为3.8 m×6.5 m×1.2 m,饵料培养池大小规格为3 m×5 m×1 m。室外有2个暗沉淀池,总容积为720 m3。海区海水经暗沉淀池沉淀24 h后,流入砂滤池,经过2次砂滤后,由水泵提至蛋白分离器,经处理后入育苗室。育苗系统由1台10 kW罗茨鼓风机供气。育苗池中散气石保持1个/m2,室内光照强度控制在500~1 000 lx,育苗所用海水比重为1.016~1.019,水温为26~30 ℃,pH 7.8~8.6。
1.2试验方法
1.2.1亲贝来源与运输。亲螺于2015年6月20日购自嵊泗县嵊山海区,个体重量为(20±0.11)g,壳高为(4.20±0.09)cm,共计2 250粒,总重45 kg。采用低温干运法将亲螺运回试验基地。具体运输方法为:将冰袋放入泡沫箱中,亲螺用湿的筛绢网包裹紧放在冰袋的周围,每个泡沫箱可运亲螺20 kg。
1.2.2亲螺培育。亲螺洗刷后,用浓度20 mg/L的KMnO4溶液药浴2~3 min,将其均匀铺撒在沉水式网箱内,移入产卵池(闲置的藻类培养池),控制池中水位在60~70 cm,刚好没过网箱顶端。亲螺培育期间,海水比重控制在1.016~1.019,水温26~30 ℃,保持池水连续充气。每天17:00投喂足量的鲜活的紫贻贝、菲律宾蛤仔、蓝蛤等低值贝类。每天上午清除掉死亡的亲螺,吸污后进行换水,换水量为池水的30%~50%,每个星期倒池1次。
1.2.3亲螺的交配、产卵和孵化。亲螺入池26~28 d,陆续出现交尾现象,此时及时投放消毒过的PVC管,作为附卵器。亲螺交尾后1~2 d,雌螺在管壁上产出黄色菊花瓣状卵囊,多个卵囊聚集成卵簇,卵囊长1.6~2.6 cm。
将附有卵囊的PVC管用砂滤海水冲洗干净,放入20 mg/L的聚维酮碘浸泡消毒2~3 min,然后移入育苗池中孵化。孵化期间,保持池中水位在80~100 cm,换水1次/d,换水量为水体的1/2。孵化用水的比重为1.015~1.018,温度21~23 ℃。
1.2.4幼虫培育和采苗。待卵囊孵化完毕,用筛绢网条密集水体中面盘幼虫,移入新池开始幼虫培育。幼虫培育密度控制在0.1~0.3个/mL。培育期间,换水1次/d,每次换水1/2。幼体采用单胞藻混合投喂方式进行饲养。饵料为金藻+扁藻+小球藻。每天9:00、15:00和22:00各投喂1次,日投喂量为1×104~6×104个/mL,具体分段投喂量根据残饵、水色及镜检肠胃含物的量随时调整,一般以3/4的幼虫达到满胃即可。
幼体经过20 d左右生长,发育至3螺层幼虫,头部触角和眼可伸出壳外,前后足蹠面宽平,幼虫用足和面盘共同运动。此时,应及时投放采苗器进行采苗。分别用清洁波纹板、附着底栖硅藻的波纹板、聚乙烯网片作为附苗基,进行采苗效果对比试验。
1.2.5稚螺培育。投放附着基8~10 d后,水体中已无浮游幼体,波纹板上可见大量黑色稚螺,稚螺为3层,足发达,运动较快,能以足为基点,身体左右旋转与翻身。此时,进入稚螺培育阶段。稚螺培育期间,全量换水1次/d,每隔3 d倒池1次,并投喂1次抗生素,可轮流使用青霉素0.5 mg/L、氟哌酸0.5 mg/L、头孢曲松钠1.0 mg/L。换水或倒池后,应立即投喂虾片、长牡蛎卵细胞、新鲜缢蛏碎块(200目筛绢网过滤)。稚螺有爬壁习性,如不能自己掉回池中便会干死。可用白布贴挂在水面的池壁上,每天早晚用水将池壁和白布上
的螺冲回池中。
2结果与分析
2.1瘤荔枝螺的个体发育过程由表1、表2可以看出,水温25~27 ℃,卵囊内受精卵发育成孵化的面盘幼虫大约需要12~15 d。从图1可以看出,卵囊颜色刚开始为乳黄色,逐渐变为乳黄色带灰、浅灰色,最后变为灰黑色。待面盘幼虫孵出后,卵囊颜色变白。幼虫生长发育经历4个阶段,依次为初期面盘幼虫、蝶形幼虫、后期面盘幼虫、变态幼虫;幼虫浮游期为27~30 d,变态期为15~18 d;附着后为4螺层稚螺,吻基部形成齿舌带,能刮食动物性饵料;附着变态后31 d,稚螺平均壳高为3 560 μm。
表1瘤荔枝螺胚胎在卵囊内的发育状况
Table 1The development status ofThaisbronniembryo in oocysts
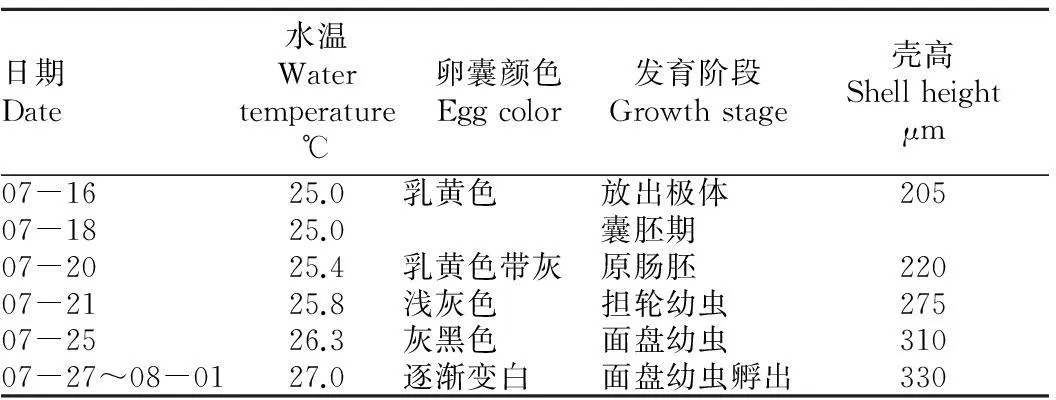
日期Date水温Watertemperature℃卵囊颜色Eggcolor发育阶段Growthstage壳高Shellheightμm07-1625.0乳黄色 放出极体 20507-1825.0囊胚期 07-2025.4乳黄色带灰 原肠胚 22007-2125.8浅灰色 担轮幼虫 27507-2526.3灰黑色 面盘幼虫 31007-27~08-0127.0逐渐变白 面盘幼虫孵出330
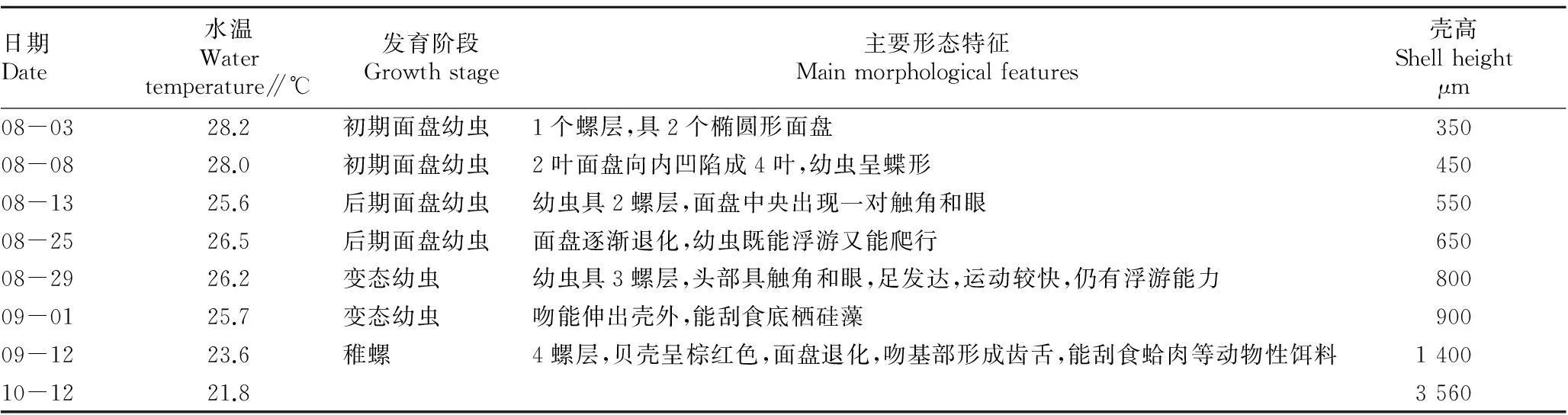
表2 瘤荔枝螺的幼虫发育状况
2.2不同附着基采苗效果的比较由表3可知,附着底栖硅藻波纹板的采苗率为18.08%,远高于清洁波纹板(4.76%)和聚乙烯网片(4.09%)。
2.3人工育苗情况于2015年进行人工育苗试验,获得受精卵约961万粒,初期面盘幼虫800万个,后期面盘幼虫385万个,变态稚螺58.6万粒。面盘幼虫孵化率达到83.2%,浮游幼虫成活率达48.1%,稚螺变态成活率达7.3%。
3讨论与结论
3.1浮游幼体的培育瘤荔枝螺的人工育苗中,浮游幼虫的成活率是人工育苗成功的基础。瘤荔枝螺幼虫在水温26~28 ℃下浮游27~30 d,浮游期较长。此时正值高温多雨时期,海水比重、水质和饵料成为幼体培育的限制因素。生产实践证明,育苗海水比重在1.015以上时,瘤荔枝螺浮游幼体活力好,游动快,面盘伸展开。良好的水质是幼体培育成功的首要因素。育苗用水最好经过2次砂滤,再经蛋白分离器处理,有条件的育苗单位还可使用紫外线对入池海水进行消毒。饵料选择金藻、扁藻和小球藻,投喂时要检查饵料密度和纯度。金藻饵料密度不低于200万个cell/mL,扁藻饵料密度不低于30万个cell/mL,小球藻饵料密度不低于50万个cell/mL,且在100倍显微视野中,原生动物数量不超过3个,菌膜团数量不超过5个[5]。投喂时,采用混合投喂。浮游幼虫发育至后期面盘幼虫时,随着幼虫的长大,加大扁藻投喂量,由开始金藻投喂量的10%逐渐增加至金藻投喂量的60%,并投喂少量的小球藻。
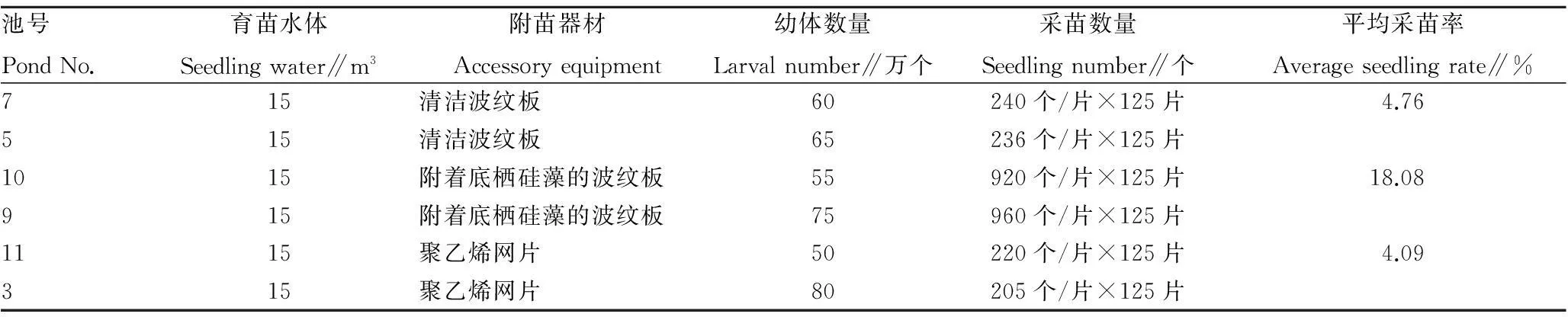
表3 不同附苗器采苗效果的比较

注:a.刚产出的卵囊(乳黄色);b.产出6 d后的卵囊;c.产出10 d后卵囊;d.刚孵出的面盘幼虫(壳高330 μm);e.初期面盘幼虫(壳高350 μm);f.初期面盘幼虫(壳高450 μm);g.后期面盘幼虫(壳高550 μm);h.后期面盘幼虫(壳高600 μm);i.变态幼虫(壳高800 μm);j.变态幼虫(壳高900 μm);k.稚螺(壳高1 425 μm);l.稚螺(平均壳高3 560 μm)。Note:a.A newly produced oocysts(cream-like color);b.Oocysts after produced 6 d;c.Oocysts after produced 10 d;d.The newly hatched larvae(shell height 330μm );e.The larvae at initial stage(shell height 350 μm);f.The larvae at initial stage(shell height 450μm );g.The larvae at later stage(shell height 550 μm);h.The larvae at later stage(shell height 600 μm);i.Metamorphosis larva(shell height 800μm );j.Metamorphosis larva(shell height 900 μm);k.Juvenile(shell height 1 425 μm);l.Juvenile(shell height 3 560 μm).图1 瘤荔枝螺的个体发育过程Fig.1 The individual growth process of Thais bronni
3.2食性转换瘤荔枝螺浮游幼虫发育至变态期,摄食习性从植物性饵料转变为动物性饵料。这与一些海产螺类幼体发育过程相似[6-7]。瘤荔枝螺产卵不同步,导致幼虫发育不同步、到达变态期也不同步,为此在幼虫附着后要在投喂单胞藻的基础上增投动物性饵料。待育苗池水中没有浮游幼虫时,幼虫完全变态为稚螺,停止投喂单胞藻,只投喂动物性饵料[7]。但是,由于幼体食性转换和动物性残饵易腐烂、变质等原因,瘤荔枝螺幼体变态期会发生大量死亡。该试验中食性转换期间通过向附着基投撒虾片、长牡蛎卵细胞、新鲜缢蛏碎块的方法,虽然稚螺摄食性较好,但由于育苗水温过高,附着基上的残饵和粪便容易变质,常造成育苗水质和附着幼体栖息环境的恶化,病原菌大量繁殖,影响到附着幼体的存活。因此,培养适口的鲜活动物饵料,提高食性转化期间瘤荔枝螺幼体成活率,将是今后研究的重点。
3.3附着基的选择在贝类人工育苗中,及时提供合适的附着基可以促进足面盘幼虫(匍匐幼虫)附着变态,如果没有合适的附着基,幼虫将推迟附着变态,一旦幼虫长期不附着就会造成大量死亡[8]。为了筛选出瘤荔枝螺幼体适宜的附着基,笔者对不同附着基的采苗效果进行了比较,结果发现附着底栖硅藻的波纹板采苗效果最好。瘤荔枝螺幼虫的这种附着变态习性与脉红螺较为相似[7]。究其原因,一是瘤荔枝螺变态时面盘退化,摄食能力减弱,附着基上底栖硅藻可为幼体变态发育提供营养,二是底栖硅藻胞外分泌物对瘤荔枝螺幼虫的变态可能具有诱导和促进作用[9]。另外,附着基的投放标志是当瘤荔枝螺大部分浮游幼虫发育到足频繁伸出,幼虫以足和面盘共同运动时[10]。
参考文献
[1] 尤仲杰,陈志云.浙江沿海荔枝螺属(腹足纲:骨螺科)分类学研究[J].浙江海洋学院学报(自然科学版),2010,29(4):306-317.
[2] 张素萍,张福绥.中国近海荔枝螺属的研究(腹足纲:骨螺科)[J].海洋科学,2005,29(8):75-83.
[3] 黄建荣,丁少雄,王德祥,柯才焕.中国沿岸13瘤荔枝螺的齿舌形态分析[J].海洋科学,2013(8):73-77.
[4] 黄建荣.中国沿岸荔枝螺的系统分类学及疣荔枝螺群体遗传结构研究[D].厦门:厦门大学,1983:55-57.
[5] 王国福.贝类单胞藻培养技术[J].中国水产,2005(2):69-70.
[6] 徐华森,蓝魏星,金景华.泥东风螺(Babylonialutosa)的人工育苗技术[J].水产科技,2003(5):27-30.
[7] 杨辉,任福海,袁甜.脉红螺人工育苗技术研究[J].河北渔业,2014(9):53-55.
[8] 吴伟军,谢达祥,阮志德,姚久祥.方斑东风螺室内人工育苗试验[J].水产科技情报,2005,32(1):18-20.
[9] 胡金梅,魏东.底栖硅藻中诱导鲍鱼幼体附着和变态的物质研究进展[J].水利渔业,2005,25(6):15-17.
[10] 高霄龙,李莉,邱兆星,等.不同附着基对毛蚶幼虫附着变态影响的研究[J].海洋科学,2013,37(8):61-66.
中图分类号
文献标识码A
文章编号0517-6611(2016)06-087-04
收稿日期2016-02-14
作者简介黄继(1984- ),男,湖北麻城人,工程师,硕士,从事海洋生物学研究。
