不同绿藻浓度下铜绿微囊藻对轮虫生活史的影响
2016-04-22耿红,孟希,贺萌
耿 红,孟 希,贺 萌
(中南民族大学 生命科学学院, 武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
不同绿藻浓度下铜绿微囊藻对轮虫生活史的影响
耿红,孟希,贺萌
(中南民族大学 生命科学学院, 武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
摘要利用生命表实验,研究了不同斜生栅藻浓度下,铜绿微囊藻对萼花臂尾轮虫和红臂尾轮虫生活史的影响.结果表明:当斜生栅藻浓度较高(105,106 cells/mL)时,铜绿微囊藻对萼花臂尾轮虫的存活和繁殖有抑制作用,对照组轮虫的rm、R0均显著高于铜绿微囊藻组中的值(p<0.01);当斜生栅藻浓度较低(104 cells/mL)时,铜绿微囊藻对萼花臂尾轮虫种群则有一定的促进作用.任一斜生栅藻浓度下,铜绿微囊藻对红臂尾轮虫种群存活和繁殖及生活史特征参数均有抑制作用,且这种抑制作用随斜生栅藻浓度的升高而减弱.说明铜绿微囊藻对轮虫的作用受其他可食性绿藻食物浓度的影响,且这种影响随轮虫种类的不同而有差异.
关键词斜生栅藻;铜绿微囊藻;轮虫;存活;繁殖
Effect ofMicrocystisaeruginosaon the Rotifer Life History at Different Concentrations of Green Algae
GengHong,MengXi,HeMeng
(Hubei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China,College of Life Sciences,South-Central University for Nationalities,Wuhan 430074,China)
AbstractThe effect ofMicrocystisaeruginosaon the life history ofBrachionuscalyciflorusandB.rubensat different concentrations ofScenedesmusobliquuswas investigated by using the life table experiments. The results showed thatM.aeruginosasuppressed the survivorship and reproduction ofB.calyciflorusat the high concentration ofS.obliquus(105and 106cells/mL). The intrinsic increase rate (rm) and net reproductive rate (R0) ofB.calyciflorusin control group were significantly higher than those in the group withM.aeruginosa(p<0.01). However,M.aeruginosacould stimulate the rotifer population at the low concentration ofS.obliquus(104cells/mL).M.aeruginosasuppressed the survivorship, reproduction and demographic parameters ofB.rubensat any concentration ofS.obliquusand this inhibition was relieved with the increase of concentration ofS.obliquus. These results indicate that the effects ofM.aeruginosaon the rotifer population may be influenced by the other food availability and this influence may be different with the different rotifer species.
KeywordsScenedesmusobliquus;Microcystisaeruginosa; rotifer; survivorship; reproduction
湖泊、水库等的水体富营养化及伴随的蓝藻水华发生是全球范围内的重大水环境问题,在我国,大约有85%的湖泊已经富营养化且比率呈增加趋势[1]. 铜绿微囊藻Microcystisaeruginosa是蓝藻水华的主要种类,在富营养化水体中有着广泛的分布. 这种藻类可以产生一种有毒的次生代谢物质即微囊藻毒素(MC),对包括鱼和浮游动物等在内的水生生物产生毒害作用[2,3].
轮虫是淡水浮游动物中的重要组成类群之一,由于分布广泛、繁殖速率快,在水体生态系统结构、功能和生物生产力的研究中具有重要意义. 轮虫也是大多数经济水产品的开口饵料,在渔业生产上有很大的应用价值;而且,轮虫还被认为是很好的指示生物,在环境监测和生态毒理研究中被广泛采用. 目前已有相关实验研究铜绿微囊藻对轮虫实验种群的影响[4-7],但结果不相一致. 此外,外界环境因子的变化会影响铜绿微囊藻对轮虫种群的作用,已有研究表明水体温度的升高会加剧铜绿微囊藻对轮虫种群的抑制作用[8,9]. 而在自然水体中,不仅水温会发生变化,水体中其他可食性藻类食物的浓度也会发生变化,这也将影响到铜绿微囊藻对轮虫种群的作用. 目前,有关这方面的研究工作却非常少[10]. 因此,本实验以斜生栅藻Scenedesmusobliquus为绿藻食物,研究不同斜生栅藻浓度下,铜绿微囊藻PCC7820对两种轮虫生活史的影响,探讨环境中其他可食性食物在铜绿微囊藻对轮虫影响中所起的作用及机理等.
1材料与方法
1.1轮虫的来源与培养
实验所用的萼花臂尾轮虫(B.calyciflorus)和红臂尾轮虫(B.rubens)均采自武汉东湖自然水体中,其个体体长分别为180±3 μm和140±4 μm(平均体长±标准误,n=25). 实验室内于温度25±1℃的恒温光照培养箱中进行单个体培养,光照强度约300 lux,光照周期为L∶D=16∶8. 培养液采用EPA配方[11],所用饵料为处于指数增长期的斜生栅藻(S.obliquus).
1.2藻种及其培养
实验中所用的绿藻为斜生栅藻S.obliquus,蓝藻为铜绿微囊藻M.aeruginosaPCC7820,两种藻类均由中国科学院水生生物研究所淡水藻种库提供,所用培养液分别为HB-4[12]和BG11[13]. 实验室内于温度25±1℃的恒温光照培养箱中进行充气培养.
1.3生命表实验
依斜生栅藻浓度的不同,两种轮虫均设三个浓度梯度,分别为104,105和106cells/mLS.obliquus,每个浓度下再依据铜绿微囊藻的有无设两种处理即对照组(C组)和铜绿微囊藻组(M组),其微囊藻浓度分别为:萼花臂尾轮虫-C组:0 cells/mLM.aeruginosa,M组:1.0×106cells/mLM.aeruginosa;红臂尾轮虫-C组:0 cells/mLM.aeruginosa,M组:1.0×105cells/mLM.aeruginosa. 每组3个重复,每个重复含有10个轮虫幼体(龄长<6 h);培养容器为5 mL特制的玻璃培养杯,培养液体积为3 mL,共用36个培养杯(2 轮虫 × 3 浓度 × 2 处理 × 3重复);实验时的温度、光照等条件同上. 实验时,每12 h观察和记录母体的携卵数,存活数以及孵化的幼体数,并移去产出的幼体;在观察的同时用玻璃微吸管轻轻悬浮沉积于水底的藻类食物,每间隔24 h更换培养液并喂食. 实验持续至所有个体全部死亡为止.
1.4生活史各参数的定义和计算方法
依据生命表实验所观察到的数据可以计算出以下生活史各参数.
1.4.1特定年龄存活率(lx)
x年龄组开始时存活个体的百分数.
1.4.2特定年龄繁殖率(mx)
x年龄组平均个体所产的雌性后代数.
1.4.3净生殖率(R0)
1.4.4内禀增长率(rm)

1.4.5世代时间(T)
1.4.6出生时的生命期望(e0)
相应的参数在Excel中算得,所用公式参考Krebs[14]和Lotka[15]. 对实验数据所进行的方差分析、多重比较以及回归分析等均在统计软件SPSS11.5中进行.
2结果与分析
2.1萼花臂尾轮虫特定年龄存活率和繁殖率
相同斜生栅藻浓度下,比较两种处理组中轮虫的存活率曲线,可以看出,铜绿微囊藻组的轮虫存活率开始下降的时间早于对照组的轮虫,下降的速度也较快于对照组,这在斜生栅藻浓度为105和106cells/mL时尤为明显(图1),说明铜绿微囊藻的存在抑制了轮虫的存活.比较同种处理不同斜生栅藻浓度下轮虫的存活率曲线,可以看出,随栅藻浓度的升高,两组轮虫存活率变化是一致的,即轮虫的存活率随栅藻浓度的升高而逐渐增大.
图2显示了不同斜生栅藻浓度下,萼花臂尾轮虫在两种处理组中的特定年龄繁殖率. 从图中可以看出,当斜生栅藻浓度为104cells/mL时,对照组轮虫无后代产出,而处理组轮虫则有一定的繁殖率;说明在栅藻浓度较低时,萼花臂尾轮虫能从铜绿微囊藻中获取一定的营养用于繁殖后代. 当栅藻浓度升高至106cells/mL时,处理组轮虫的繁殖率明显低于对照组,表明铜绿微囊藻对轮虫繁殖的抑制作用.

图1 不同斜生栅藻浓度下萼花臂尾轮虫在两种处理组中的特定年龄存活率Fig.1 Age-specific survivorships of Brachionus calyciflorus in two treatments at different concentrations of Scenedesmus obliquus
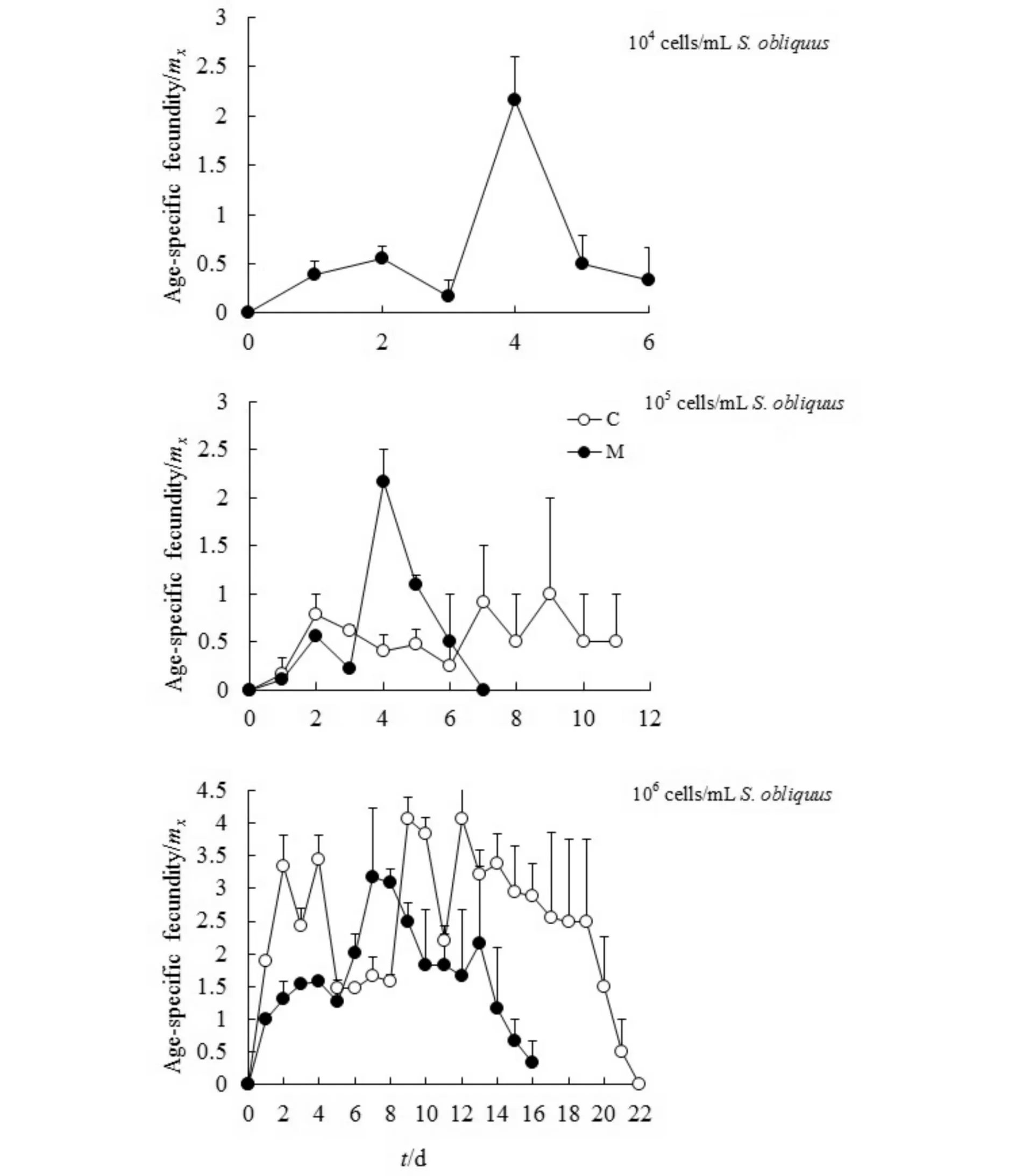
图2 不同斜生栅藻浓度下萼花臂尾轮虫在两种处理组中的特定年龄繁殖率Fig.2 Age-specific fecundities of Brachionus calyciflorus in two treatments at different concentrations of Scenedesmus obliquus
由此可见,铜绿微囊藻对轮虫繁殖率的影响比较复杂,随栅藻浓度的不同而有所变化. 比较同种处理不同栅藻浓度下轮虫的繁殖率曲线,可以看出,两组轮虫繁殖率均随栅藻浓度的升高而增大.
2.2红臂尾轮虫特定年龄存活率和繁殖率
图3显示了不同斜生栅藻浓度下,红臂尾轮虫在两种处理组中的特定年龄存活率. 从图中可以看出,不同栅藻浓度下,铜绿微囊藻的加入都使得轮虫的存活率明显下降,表现为铜绿微囊藻组的轮虫存活率开始下降的时间均早于对照组的轮虫,且下降的速度也快于对照组;说明铜绿微囊藻的存在明显抑制了红臂尾轮虫的存活. 比较同种处理不同斜生栅藻浓度下轮虫的存活率曲线,发现两组轮虫的存活率均随栅藻浓度的升高而呈增大趋势.

图3 不同斜生栅藻浓度下红臂尾轮虫在两种处理组中的特定年龄存活率Fig.3 Age-specific survivorships of Brachionus rubens in two treatments at different concentrations of Scenedesmus obliquus
当斜生栅藻浓度为104cells/mL时,对照组和铜绿微囊藻组的轮虫均无后代个体产出;当栅藻浓度为105cells/mL时,对照组轮虫有后代产生,其繁殖率曲线见图4所示,但在铜绿微囊藻组中,由于加入105cells/mL铜绿微囊藻,轮虫的繁殖受抑制,无后代个体产出;栅藻浓度为106cells/mL时,对照组和铜绿微囊藻组的轮虫均有繁殖,但铜绿微囊藻组的轮虫繁殖率明显低于对照组的轮虫(图4). 说明铜绿微囊藻的存在也抑制了红臂尾轮虫的繁殖. 此外,比较不同斜生栅藻浓度下对照组轮虫的繁殖率曲线,可以看出,轮虫繁殖率随栅藻浓度的升高而增大.

图4 不同斜生栅藻浓度下红臂尾轮虫在两种处理组中的特定年龄繁殖率Fig.4 Age-specific fecundities of Brachionus rubens in two treatments at different concentrations of Scenedesmus obliquus
2.3萼花臂尾轮虫和红臂尾轮虫的生活史参数
不同斜生栅藻浓度下,萼花臂尾轮虫在两种处理组中的生活史各参数见表1所示. 当斜生栅藻浓度为104cells/mL 时,由于对照组轮虫无后代产出,故无rm、R0等参数值;而加入106cells/mL铜绿微囊藻后,轮虫出现繁殖,有较低rm值,表明了铜绿微囊藻为萼花臂尾轮虫提供了一定的营养. 在斜生栅藻浓度为105和106cells/mL时,t检验的结果显示,对照组轮虫的rm、R0均显著高于铜绿微囊藻组中的值(p<0.01),而T在两种处理组间无显著差异,说明在栅藻浓度较高时,铜绿微囊藻的存在抑制了萼花臂尾轮虫种群的rm,且这种抑制作用是通过降低轮虫种群的R0来实现的. 对同种处理不同斜生栅藻浓度下轮虫种群的rm、R0和T进行方差分析,结果表明,相同处理组中,斜生栅藻浓度对轮虫种群的rm和R0均有显著影响(ANOVA,p<0.01),而对世代时间T无显著影响;相同处理组中轮虫种群的rm和R0随斜生栅藻浓度的升高而增大.
表2列出了不同斜生栅藻浓度下,红臂尾轮虫在两种处理组中的生活史各参数值. 当斜生栅藻浓度为106cells/mL时,对两种处理组轮虫种群的rm等参数进行t检验,结果表明,铜绿微囊藻组轮虫种群的rm和R0均显著低于对照组中的值(p<0.01),而世代时间T在两种处理间无显著差异.对照组轮虫种群的rm和R0受斜生栅藻浓度的影响也具有显著性(ANOVA,p<0.01),随栅藻浓度的升高而逐渐增大.

表1 不同斜生栅藻浓度下萼花臂尾轮虫在两种处理组中的生活史参数
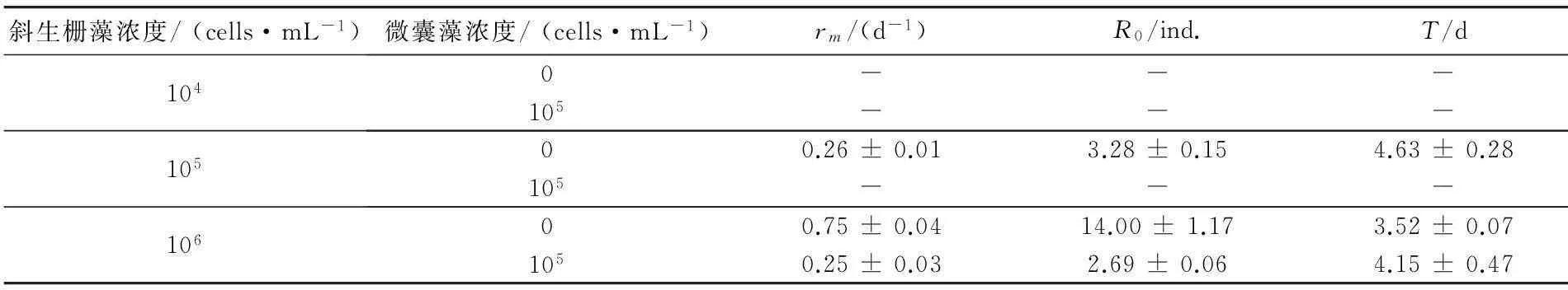
表2 不同斜生栅藻浓度下红臂尾轮虫在两种处理组中的生活史参数
3讨论
食物是影响轮虫种群的重要生物因子,有关食物浓度对轮虫种群增长的影响已被广泛研究. Guisande和Mazuelos认为,高食物浓度下,轮虫幼体能较快地发育为成熟个体,从而提高种群增长率[16]. Dumont等研究也表明,食物浓度升高可导致轮虫种群增长率的增加[17]. 本研究中我们也得到了相似的结论,两种轮虫种群的存活率、繁殖率以及内禀增长率等均随栅藻食物浓度的升高而增大.
本研究中任一斜生栅藻食物浓度下,铜绿微囊藻的存在都明显抑制了红臂尾轮虫的存活和繁殖,进而降低了轮虫种群的内禀增长率和净生殖率. 这与Rothhaupt[18]以及我们之前的研究结果[6]是一致的,充分说明了铜绿微囊藻对红臂尾轮虫种群的毒害作用. 而铜绿微囊藻对萼花臂尾轮虫种群的影响则较为复杂,随栅藻食物浓度的不同有所变化. 当栅藻食物浓度较低,提供不了足够的营养使轮虫繁殖时,铜绿微囊藻对轮虫种群非但没有抑制作用,反而促进了轮虫的种群增长;说明萼花臂尾轮虫能够从铜绿微囊藻中获取一定的营养以用于其繁殖后代. Fulton和Paerl的研究也表明,仅喂食铜绿微囊藻(单细胞以及群体)时,萼花臂尾轮虫种群的存活较长于饥饿对照组;且饥饿对照组轮虫种群无繁殖,而轮虫种群在群体铜绿微囊藻组中则有一定的繁殖能力;因此他们认为,与实验中所研究的其他浮游动物种类不同,萼花臂尾轮虫能够利用铜绿微囊藻作为辅助食物来源[4]. 此外,DeMott等也提出,尽管铜绿微囊藻PCC7820含有藻毒素,其有毒细胞仍能提供一定的营养[2].
蓝藻对浮游动物种群的影响与众多因素有关,如蓝藻种类和浓度[3]、浮游动物种类[19]以及温度[8,9]等. 此外,水体中其他可食性藻类如绿藻的浓度也是重要的影响因子之一. Reinikainen等通过急性毒性实验,研究了不同浓度的栅藻Scenedesmusobtusiusculus条件下,铜绿微囊藻PCC7820对蚤状溞Daphniapulex存活率的影响,发现栅藻食物浓度的升高会削弱铜绿微囊藻对蚤状溞存活率的抑制作用[20]. 本研究中,我们也发现,随斜生栅藻食物浓度的升高,有毒铜绿微囊藻对红臂尾轮虫种群的存活率、繁殖率以及平均寿命等的抑制作用减弱. Reinikainen等提出了两个可能的原因以解释食物浓度对铜绿微囊藻毒害作用的削弱,一方面,随栅藻浓度的升高,浮游动物获取的食物中有毒铜绿微囊藻所占的比例相对下降,因而毒害作用也减弱;另一方面,较高栅藻浓度下,浮游动物的生理状态也较好,因而抵抗铜绿微囊藻毒素的能力也增强[20]. 此外,我们认为,也有可能是藻毒素的性质部分被绿藻细胞内的化合物所改变,从而降低毒性.
然而,本研究中,这种栅藻食物浓度的升高对铜绿微囊藻毒害作用的减弱在萼花臂尾轮虫中并没有明显体现出来,表明这种减弱作用随轮虫种类的不同而具有特异性. Gilbert的研究结果也发现,有毒水华鱼腥藻的存在降低了梳状疣毛轮虫Synchaetapectinata的寿命及繁殖,且在较低隐藻食物浓度Cryptomonaserosa下,这种抑制作用更加剧烈;但对于萼花臂尾轮虫而言,水华鱼腥藻对轮虫寿命及繁殖的抑制作用随隐藻食物浓度的升高无明显变化[10]. 造成这种差异的原因可能是由于轮虫种类的不同,如上所述,铜绿微囊藻对萼花臂尾轮虫种群的影响较为复杂,在一定条件下,萼花臂尾轮虫能够利用铜绿微囊藻,从中获取营养[6].
在野外自然水体中,当蓝藻水华爆发时,水温常较高且浮游植物群落中蓝藻占优势,其他可食性食物种类及数量都较少. 我们也发现,温度的升高常会加剧铜绿微囊藻对轮虫种群的抑制作用[9]。因此,如果温度与其他可食性食物对铜绿微囊藻-轮虫所起的作用发生协同或拮抗,轮虫种群的结构就会发生很大的变化,从而也会影响其高营养级的其他生物种类;所以,有必要进一步研究两种或两种以上环境因子同时变化时,铜绿微囊藻及其他蓝藻种类对轮虫等浮游动物种群的影响.
参考文献
[1]Gan N,Mi L,Sun X,et al.Sulforaphane protects Microcystin-LR-induced toxicity through activation of the Nrf2-mediated defensive response [J]. Toxicol Appl Pharmacol, 2010, 247(2):129-137.
[2]DeMott W R, Zhang Q X, Carmichael W W. Effects of toxic cyanobacteria and purified toxins on the survival and feeding of a copepod and three species of Daphnia [J]. Limnol Oceanogr, 1991, 36(7): 1346-1357.
[4]Fulton R S III, Paerl H W. Toxic and inhibitory effects of the blue-green algaMicrocystisaeruginosaon herbivorous zooplankton [J]. J Plankton Res, 1987, 9(5): 837-855.
[5]Smith A D,Gilbert J J. Relative susceptibilities of rotifers and cladocerans toMicrocystisaeruginosa[J]. Arch Hydrobiol, 1995, 132: 309-336.
[6]Geng H, Xie P. Experimental studies on the effects of toxicMicrocystisaeruginosaPCC7820 on the survival and reproduction of two freshwater rotifersBrachionuscalyciflorusandBrachionusrubens[J]. Ecotoxicology, 2008, 17(8): 709-715.
[7]Soares M C S, Lurling M, Huszar V L M. Responses of the rotiferBrachionuscalyciflorusto two tropical toxic cyanobacteria (CylindrospermopsisraciborskiiandMicrocystisaeruginosa) in pure and mixed diets with green algae [J]. J Plankton Res, 2010, 32(7): 999-1008.
[8]Gilbert J J. Effect of temperature on the response of planktonic rotifers to a toxic cyanobacterium [J]. Ecology, 1996, 77(4):1174-1180.
[9]Zhang X, Geng H. Effect ofMicrocystisaeruginosaon the rotiferBrachionuscalyciflorusat different temperatures [J]. Bull Environ Contam Toxicol, 2012, 88(1): 20-24.
[10]Gilbert J J. Effect of food availability on the response of planktonic rotifers to a toxic strain of the cyanobacteriumAnabaenaflos-aquae[J]. Limnol Oceanogr, 1996, 41(7): 1565-1572.
[11]USEPA. Methods for measuring the acute toxicity of effluents to freshwater and marine organisms [M]. Washington D C: U S Environ Protec Agency, 1985: 216.
[12]黎尚豪, 朱 惠, 夏宜琤, 等. 单细胞绿藻的大量培养试验[J]. 水生生物学集刊,1959(4): 462-472.
[13]Stanier R Y,Kunisawa R,Mandel M,et al. Purification and properties of unicellular blue-green algae (order Chroococcales) [J]. Bact Rev,1971,35(2): 171-205.
[14]Krebs C J. Ecology: the experimental analysis of distri-
bution and abundance [M]. New York:Harper and Row,1985: 800.
[15]Lotka A J. A natural population norm [J]. J Washington Acad Sci,1913,3: 241-248.
[16]Guisande C,Mazuelos N. Reproductive pattern ofBrachionuscalyciflorusPallas at different food concentrations [J]. J Plankton Res,1991,13(2): 279-286.
[17]Dumont H J,Sarma S S ,Ali A J. Laboratory studies on the population dynamics ofAnuraeopsisfissa(Rotifera) in relation to food density [J]. Freshwater Biol,1995,33(1): 39-46.
[18]Rothhaupt K O. The influence of toxic and filamentous blue-green-algae on feeding and population-growth of the rotiferBrachionusrubens[J]. Internationale Revue Der Gesamten Hydrobiologie. 1991,76(1):67-72.
[19] Geng H, Xie P, Xu J. Effect ofMicrocystisaeruginosaPCC7820 in combination with a green alga on the experimental population ofBrachionuscalyciflorusandB.rubens[J]. Bull Environ Contam Toxicol,2006,76 (6): 963-969.
[20]Reinikainen M,Ketola M,Walls M. Effects of the con-centrations of toxicMicrocystisaeruginosaand an alternative food on the survival ofDaphniapulex[J]. Limnol Oceanogr,1994,39(2): 424-432.
中图分类号Q178
文献标识码A
文章编号1672-4321(2016)01-0044-06
基金项目国家自然科学基金资助项目(31200361);横向项目基金(HZY14009);国家留学基金委青骨项目[留金发(2013)3050号]
作者简介耿红(1979-),副教授,博士,研究方向:水生生物学,E-mail:genghong@mail.scuec.edu.cn
收稿日期2015-02-15
