去乙酰化酶抑制剂VPA对巨噬细胞极化过程的影响①
2016-04-15张文兰尹学红庞春艳王永福
张 颖 白 力 张文兰 尹学红 张 伟 庞春艳 王永福
(内蒙古科技大学包头医学院第一附属医院,包头014040)
·基础免疫学·
去乙酰化酶抑制剂VPA对巨噬细胞极化过程的影响①
张颖白力张文兰尹学红张伟庞春艳王永福
(内蒙古科技大学包头医学院第一附属医院,包头014040)
[摘要]目的:本研究通过分析去乙酰化酶抑制剂对巨噬细胞极化过程中组蛋白修饰的影响,以及对巨噬细胞极化过程的影响,分析去乙酰化酶抑制剂是否可以通过改变巨噬细胞的组蛋白修饰,进而影响巨噬细胞极化的过程,旨在为治疗自身免疫性疾病提供新的思路。方法:利用脂多糖(Lipopolysaccharide,LPS)和干扰素γ(Interferon-γ,IFN-γ)诱导J774.1巨噬细胞24 h,白细胞介素4(Interleukin-4,IL-4)诱导J774.1巨噬细胞24 h,并在诱导过程中加入2 mmol/L丙戊酸(Valproic acid,VPA),收集巨噬细胞,实时免疫荧光定量PCR和ELISA法检测巨噬细胞极化的特异性标记基因的表达,流式细胞术和细胞免疫荧光法检测组蛋白修饰情况。结果:J774.1细胞经LPS和IFN-γ诱导24 h极化为M1型巨噬细胞;经IL-4刺激24 h极化为M2型巨噬细胞,VPA处理后的M1型巨噬细胞组蛋白H3K9的乙酰化程度升高,标记基因白细胞介素6(Interleukin-6,IL-6)、诱导性一氧化氮合酶(Inducible nitric oxide synthase,iNOS)、CC趋化因子配体2[Chemokine(C-C motif) ligand 2,CCL2]的表达量降低,CD86的表达量升高;VPA处理后的M2型巨噬细胞组蛋白H3K9的乙酰化程度也升高,标记基因精氨酸酶(Arginase-1,Arg-1)、Fizz-1(Found in inflammatory zone-1,Fizz-1)、甘露糖受体(CD206)、Ym1的表达量升高。结论:巨噬细胞的极化状态和组蛋白的修饰具有一定的相关性,VPA在M1型巨噬细胞诱导体系中可以促使M1型巨噬细胞向M2型巨噬细胞转化,但是在M2型巨噬细胞诱导体系中,却抑制了M1型巨噬细胞的特异性基因的表达。
[关键词]组蛋白修饰;巨噬细胞极化;去乙酰化酶抑制剂;M1型巨噬细胞;M2型巨噬细胞
巨噬细胞几乎存在于机体的各个器官与组织,在免疫应答、宿主防御、维持内环境稳定中发挥极其重要的作用,并且作为主要的抗原递呈细胞在启动适应性免疫应答过程中起着至关重要的作用。巨噬细胞具有高度异质性,分布组织、器官的不同或局部微环境的改变,甚至体外刺激的差异,都会导致巨噬细胞表现出不同的免疫应答,从而获得不同的功能表型[1,2]。根据巨噬细胞活化后的不同表型,巨噬细胞被分为M1 型巨噬细胞和M2型巨噬细胞。M1型巨噬细胞又称经典活化巨噬细胞(Classically activated macrophages,CA-Mφ),M2型巨噬细胞又称替代活化巨噬细胞(Alternatively activated macrophages,AA-Mφ)[3]。目前常采用IFN-γ或是LPS、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)和粒细胞巨噬细胞刺激因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF)刺激诱导M1型巨噬细胞。M1型巨噬细胞具有IL-12hi、IL-23hi、IL-10low的表型,同时分泌一系列的可以诱导Th1细胞免疫反应的效应分子,例如活性氧化物(Reactive oxygen ,ROX)以及炎性细胞因子IL-1、TNF-α和IL-6[4-8]。与M1型巨噬细胞相对应的是由IL-4和IL-13诱导产生的M2型替代活化巨噬细胞[9-11]。M2型巨噬细胞具有IL-12low、 IL-23low的表型,并且高表达清道夫受体和甘露糖类型的受体[12]。M2型巨噬细胞诱导Th2型免疫应答,产生抗炎性细胞因子,具有促进组织修复和重建的能力,并且具有改善Th1型免疫应答反应诱导的自身免疫性疾病的能力[1]。已公认的M1型特异性表达的基因为TNF-α、IL-6、iNOS、CCL-2、CD86,M2型特异性表达基因为CD206、Arginase、Fizz-1、Ym1[13]。
目前已有的研究表明,去乙酰化酶抑制剂有抗炎的特性[1]。VPA是Ⅰ类去乙酰化酶抑制剂,它在组蛋白修饰、转录、核小体重塑中起着作用[14]。VPA首先被应用于癌症治疗的领域,研究证明可以通过抑制组蛋白去乙酰化酶(Histone deacetylase,HDAC)的作用,使核小体组蛋白乙酰化,改变HDAC参与的基因表达。
本研究在小鼠巨噬细胞极化过程中加入去乙酰化酶抑制剂VPA,分析VPA是否通过改变巨噬细胞的组蛋白修饰,进而使巨噬细胞极化方向发生改变,最终改变巨噬细胞的细胞因子的分泌。
1材料与方法
1.1材料CD86/B7-2 抗体、Mannose Receptor/CD206 Antibody、Rat IgG 2a Isotype Control、Goat Anti-rat IgG/PE(ebioscience,USA);Rabbit IgG Isotype Control Alexa Fluor® 488 Conjugate(Cell signal,USA);反转录试剂盒RR037A、Trizol、荧光定量试剂盒DR041A(TaKaRa,China);Recombinant Mouse IL-4/Interleukin-4、Recombinant Mouse Interferon-γ(Sino Biological,USA);LPS(Sigma,USA);TNF-α、IL-6、CD206细胞因子检测试剂盒(新启迪,China);Acetyl-Histone H3K9抗体(Invitrogen,USA);VPA、StemoleculeTMValproic Acid(STEMGENT,USA)。
仪器:荧光定量PCR仪(BIOER,LineGene 9640,China),流式细胞仪(BD FACSCantoTMⅡ,USA),酶标仪(Rayto,RT-6500,China)。
1.2方法
1.2.1M1型和M2型巨噬细胞的诱导方法取J774.1巨噬细胞用DMEM/F12+10%FBS培养体系培养细胞至90%汇合度后用胰酶消化细胞3 min,1 600 r/min离心,细胞计数。用DMEM/F12+10%FBS培养体系将J774.1巨噬细胞稀释成1×105ml-1细胞浓度并接种于6.0 cm培养皿中(作为对照组C组);用100 ng/ml LPS+30 ng/ml IFN-γ M1型诱导培养体系将J774.1巨噬细胞稀释成1×105ml-1细胞浓度并接种于6.0 cm培养皿中(作为M1型巨噬细胞组);用100 ng/ml IL-4 M2型诱导培养体系将J774.1巨噬细胞稀释成1×105ml-1细胞浓度并接种于6.0 cm培养皿中(作为M2型巨噬细胞组),放置于37℃、5%CO2的恒温培养箱中培养24 h。
1.2.2MTT法检测VPA处理巨噬细胞的最适浓度①接种细胞:以每孔1 000~10 000个细胞接种到96孔板,每孔体积200 μl。②培养细胞:培养细胞24 h。③呈色:培养24 h后,每孔加MTT溶液(5 mg/ml用PBS配制,pH=7.4)20 μl,继续孵育4 h,终止培养,然后每孔加150 μl DMSO,振荡10 min,使结晶物充分融解。④比色:选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果。计算IC50,计算方法:lgIC50=Xm-I[(P-(3-Pm-Pn)/4],其中Xm:lg 最大剂量,I:lg(最大剂量/相临剂量),P:阳性反应率之和,Pm:最大阳性反应率,Pn:最小阳性反应率。
1.2.3去乙酰化酶抑制剂(VPA)处理极化巨噬细胞C组、M1组、M2组按前面所述方法培养,用M1型诱导培养体系加2 mmol/L浓度VPA,将J774.1巨噬细胞稀释成1×105ml-1细胞浓度并接种于6.0 cm培养皿中(作为M1+VPA组);用M2型诱导培养体系加2 mmol/L浓度VPA,将J774.1巨噬细胞稀释成1×105ml-1细胞浓度并接种于6.0 cm培养皿中(作为M2+VPA组),放置于37℃、5%CO2的恒温培养箱中培养24 h。培养完成后,收集细胞上清液和细胞。
1.2.4流式鉴定J774.1巨噬细胞细胞表面标记物收集VPA处理极化的巨噬细胞,各组分别经过4%多氯甲醛、体积分数为90%甲醇(提前4℃预冷)处理后,分别加入300 μl一抗(CD86、CD206),轻轻混匀,室温避光孵育1 h;5 min,1 600 r/min离心,收集细胞,再分别加入300 μl二抗,室温避光孵育30 min;上流式细胞仪检测。
1.2.5实时荧光定量PCR检测巨噬细胞特异性基因的表达利用RNAiso Plus方法提取细胞内总RNA,之后反转录成cDNA,4 ℃保存,备用。引物由上海生工合成,具体引物序列见表1。
将配置好的PCR反应液放入PCR仪中,设置程序和条件为:95℃预变性30 s;95℃ 5 s,60℃ 30 s,40循环;95℃反应15 s,60℃ 1 min,95℃ 15 s,60℃ 15 s 进行扩增,qRT-PCR 由荧光定量 PCR仪自动采集目的基因与内参基因的Ct值。各个基因的基因表达量根据公式计算。实验组/对照组目的基因相对表达量△Ct=Ct(实验组/对照组目的基因)-CT(β-actin);△△CT=实验组△CT-对照组△CT;目的基因实验组和对照组间的相对表达量(即实验组目的基因相对表达量相对于对照组的倍数)=2-△△CT。
表1实时定量PCR引物序列
Tab.1Primer sequences for real-time PCR analysis

PrimernamePrimersequenceIL-6Forward:5'-TGATGGATGCTACCAAACTGG-3'Reverse:5'-TGGTCTTGGTCCTTAGCCACT-3'TNF-αForward:5'-TGGGAGTAGACAAGGTACAACCC-3'Reverse:5'-CATCTTCTCAAAATTCGAGTGACAA-3'CCL2Forward:5'-AAGAGGATCACCAGCAGCAG-3'Reverse:5'-GGTCAGCACAGACCTCTCTCTT-3'CD86Forward:5'-ACGGACTTGAACAACCAGAC-3'Reverse:5'-TGCAGTCCCATTGAAATAAG-3'Arg-1Forward:5'-CAGAAGAATGGAAGAGTCAG-3'Reverse:5'-CAGATATGCAGGGAGTCACC-3'CD206Forward:5'-GGAAACGGGAGAACCATCAC-3'Reverse:5'-GGCGAGCATCAAGAGTAAAG-3'Fizz-1Forward:5'-TGATGGTCCCAGTGAATAC-3'Reverse:5'-GGCCCATCTGTTCATAGTC-3'Ym1Forward:5'-AGCAATCCTGAAGACACC-3'Reverse:5'-CCCTTCTATTGGCCTGTC-3'β-actinForward:5'-ACCGTGAAAAGATGACCCAG-3'Reverse:5'-AGCCTGGATGGCTACGTACA-3'
1.2.6流式细胞术检测细胞乙酰化变化收集各组已用极化因子和VPA处理24 h后的巨噬细胞,每组细胞分别用多聚甲醛、 90%的甲醇处理,用1 ml PBS+5/1 000牛血清白蛋白(BSA)洗涤;对照组中加入200 μl PBS+5/1 000 BSA,同型对照组中加入200 μl PBS+5/1 000 BSA+Rabbit IgG Isotype Control(AlexalR)488,其余各组中加入200 μl一抗H3K9 Ace,孵育后收集细胞,同型对照组中加入150 μl PBS+5/1 000 BSA,其余各组中加入150 μl二抗[1 ml PBS+PBS+5/1 000 BSA +Anti-rabbit IgG Fab2 Alexa Fluor(R)488],孵育30 min;将各组细胞分别加入到各检测管中,上机。
1.2.7免疫荧光方法检测细胞乙酰化变化取VPA处理的极化巨噬细胞,用PBS洗一次,再用100%甲醇浸没细胞,在甲醇中-20℃孵育10 min,然后用PBS冲洗5 min;将样品在封闭液中封闭60 min;加入稀释的一抗,4℃孵育过夜;用PBS冲洗3次,将样品与用抗体稀释液稀释的荧光标记二抗在室温下避光孵育1~2 h;盖上玻片;立即在显微镜下用相应波长激发光观察样品。
1.2.8ELISA法测定巨噬细胞上清中细胞因子TNF-α、IL-6、CD206的表达情况收集VPA处理极化的巨噬细胞上清液,分别将标本或不同浓度标准品加入相应孔中(100 μl/孔),封反应孔,加入生物素小鼠抗体工作液(100 μl/孔),之后除空白孔外,加入酶结合物工作液(100 μl/孔),再加入TMB显色工作液(100 μl/孔),最后加入终止液(100 μl/孔),混匀后即刻测量OD(450nm)值(10 min内)。

2结果
2.1MTT法测定VPA对巨噬细胞活性的影响用IC50计算公式计算IC50得出为2.961,IC50值的1/3~1/2为VPA的最适浓度,可以得出2 mmol/L浓度的VPA为合适的处理浓度(见表2)。
2.2不同刺激条件下J774.1细胞的形态从图1中可以看出,巨噬细胞极化成M1型巨噬细胞时,细胞梭形,多触角形态,极化成M2型巨噬细胞时,细胞圆润,呈聚团现象,VPA处理的M1型巨噬细胞体积明显变大,变长,呈条索样形态,VPA处理的M2型巨噬细胞聚团现象消失,细胞体积变大,部分细胞出现触角,呈星形,单纯VPA处理的巨噬细胞体积变大,成多触角毛刺样形态。
2.3流式鉴定J774.1巨噬细胞细胞表面标记物CD86/CD206CD86流式鉴定结果显示:C、IS、M2、M2+VPA组CD86为阴性,而M1和M1+VPA组CD86为阳性,且M1+VPA组阳性率高于M1组(见图2)。
CD206流式鉴定结果显示:C、IS、M1组CD206为阴性,而M1+VPA、M2、M2+VPA组CD206为阳性(见图3)。


VPA(mmol/L)ODvalues00.2672±0.019410.2737±0.027120.2517±0.025230.2399±0.02673)40.2320±0.02692)50.2486±0.02513)60.2264±0.02471)70.2232±0.02283)80.2118±0.02323)IC502.961
Note:Compared with the control group,1)P<0.05,2)P<0.010,3)P<0.005.

图1 不同刺激条件下J774.1细胞的形态Fig.1 Morphology of J774.1 cells under different stimulation conditionsNote: A.J774.1 cells;B.M1 macrophages;C.M1 macrophages with VPA treated;D.M2 macrophages;E.M2 macrophages with VPA treated;F.J774.1 cells with VPA treated.
2.4不同刺激条件下J774.1细胞相关因子的mRNA表达量LPS(100 ng/ml)+IFN-γ(30 ng/ml)+VPA(2 mmol/L)刺激增殖状态的J774.1细胞24 h,或者IL-4(100 ng/ml)+VPA(2 mmol/L)刺激增殖状态的J774.1细胞24 h,分别检测相关因子的mRNA表达量。结果显示:VPA处理后的M1型巨噬细胞中,IL-6(P=0.000 2)、iNOS(P=0.001 3)、CCL-2(P=0.000 7)的表达量明显减少,CD86(P=0.016 8)、Arg-1(P<0.005)、CD206(P<0.005)、Ym1(P=0.000 3)的表达明显升高;VPA处理后的M2型巨噬细胞中,IL-6(P=0.000 6)、iNOS(P=0.023 5)、CCL-2(P=0.008 6)的表达量明显减少,Arg-1(P<0.005)、Fizz-1(P<0.005)、CD206(P=0.000 4)、Ym1(P=0.042 8)的表达量明显增加(见图4)。
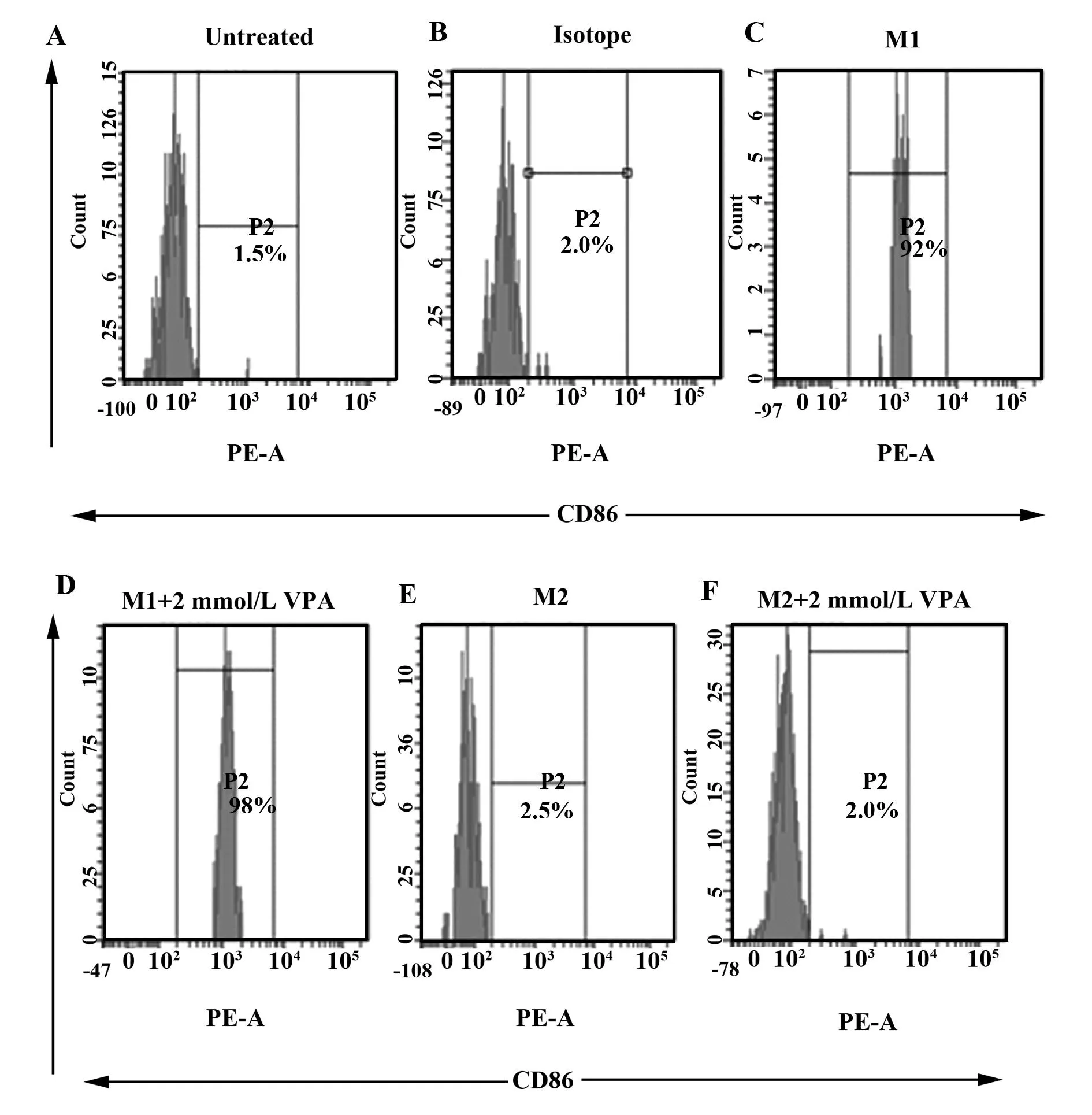
图2 CD86流式鉴定结果Fig.2 Flow identification results of CD86Note: A.Control group;B.Same type control group;C.M1 macrophages group;D.M1 macrophages +VPA group;E.M2 macrophages group;F.M2 macrophages +VPA group.

图3 CD206流式鉴定结果Fig.3 Flow identification results of CD206Note: A.Control group;B.Same type control group;C.M1 macrophages group;D.M1 macrophages +VPA group;E.M2 macrophages group;F.M2 macrophages +VPA group.
2.5不同刺激条件下J774.1细胞上清液细胞因子水平测定VPA处理后的M1型巨噬细胞中,IL-6(P=0.000 2)、TNF-α(P=0.012 0)的表达量明显减少,CD206(P=0.036 1)的表达量明显增加;VPA处理后的M1型巨噬细胞中,IL-6(P=0.010 1)、TNF-α(P=0.014 4)的表达量明显减少,CD206(P<0.005)的表达量明显增加(如图5)。

图4 RT-PCR 法结果显示VPA处理J774.1巨噬细胞后IL-6、iNOS、CCL-2、CD86、Arg-1、CD206、Fizz-1、Ym1 mRNA相对表达量变化Fig.4 RT-PCR shows relative expression of IL-6,iNOS,CCL-2,CD86,Arg-1,CD206,Fizz-1,Ym1 mRNAs in Polarized J774.1 cells treated with VPA for 24 hNote: The levels of cytokines are expressed relative to the levels of β-actin(0.01).
2.6VPA处理极化的巨噬细胞表观遗传学方面的改变免疫荧光方法和流式细胞术方法检测VPA处理极化巨噬细胞后组蛋白H3K9乙酰化的变化,结果显示VPA使巨噬细胞组蛋白H3K9乙酰化水平明显增加(P=0.048 4)(见图6)。A为免疫荧光方法检测VPA对M1型细胞组蛋白H3K9乙酰化的影响,B为流式细胞术检测细胞VPA对M1型细胞组蛋白H3K9乙酰化的影响,C为免疫荧光方法检测VPA对M2型细胞组蛋白H3K9乙酰化的影响,D为流式细胞术检测细胞VPA对M2型细胞组蛋白H3K9乙酰化的影响。

图5 ELISA检测VPA处理后巨噬细胞上清液中IL-6、TNF-α、CD206表达量变化Fig.5 ELISA assay detects expression of IL-6,TNF-α and CD206 in supernatant of macrophages treated by VPA

图6 VPA对巨噬细胞表观遗传学影响Fig.6 Effect of VPA on epigenetics of macrophage
3讨论
众所周知,巨噬细胞的极化现象在自身免疫性性疾病的发生发展过程中广泛存在,其极化调节主要是通过一些核内的信号蛋白发挥作用[15]。巨噬细胞极化的平衡失调能反映局部组织的微环境炎症状态,具有促炎特性的 M1 型巨噬细胞和具有抗炎特性的M2型巨噬细胞间的相互转化,可以使巨噬细胞在不同微环境获得不同的功能表型,这一特点使它在机体不同生理、病理条件下发挥不同的功能,在疾病的发生、发展中发挥重要作用[5]。
在炎症的发生和发展过程中,由于受到不同的细胞信号通路和细胞因子的调控和影响,M1/M2亚型的平衡一直处于动态变化中,向任何一方的倾斜都决定了炎症的最终转归,而M2型巨噬细胞的抗炎作用在多种自身免疫性疾病中都有治疗作用。
去乙酰化酶抑制剂VPA在调控获得性免疫反应中起着多方面的作用,它可以通过调节信号通路使得抗原表达量增加,辅助T细胞(Th)极化,淋巴细胞成熟,并且可以调控共刺激分子表达和细胞因子的产生[16],这可以解释巨噬细胞在自身免疫性疾病中表现出来的巨大的可塑性。即VPA能够缓解由Th1型免疫应答反应引起的自身免疫性疾病的症状[1]。虽然去乙酰化酶抑制剂VPA在治疗自身免疫性疾病等方面的作用已经得到了广泛的认同,但是在巨噬细胞极化过程中组蛋白修饰的机制还存在着很多未知的地方。
有研究表明VPA能够通过组蛋白修饰抑制核转录因子(Nuclear transcription factor ,NF-κB)通道的活性,减少炎性因子的产生[3]。本实验中发现去乙酰化酶抑制剂VPA和极化过程中的J774.1细胞共培养后,可以抑制炎性因子IL-6、iNOS、CCL-2的表达,促进CD86的表达;促进抑炎性因子Arginase、Fizz-1、CD206、Ym1的表达,说明去乙酰化酶抑制剂VPA能够使巨噬细胞的表型发生改变,从M1型向M2型转化。而本实验中也观测到了VPA使M1型巨噬细胞的组蛋白H3K9的乙酰化程度升高。研究表明去乙酰化酶抑制剂使组蛋白H3K9的乙酰化程度升高[17],进而提高干扰素调节因子(Interferon regulatory factor,IRF)介导Ⅰ型干扰素的表达,所以VPA可能通过提高IRF介导Ⅰ型干扰素的表达,导致NF-κB通道活性降低,引起干扰素α(Interfenron-α,IFN-α)、干扰素β(Interferon-β,IFN-β)的表达量升高,从而使信号转导与转录激活因子1(Signal transducer and activator of transcription 1,STAT1)信号通路活性增强,进而引起M1型巨噬细胞的标记基因IL-6、iNOS、CCL-2表达量降低,与此同时,组蛋白H3K9的乙酰化程度升高以后,使STAT6、 IRF4和过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor γ,PPARγ)信号通路活性减弱,进而使M2型巨噬细胞表达的抗炎性基因Arginase、Fizz-1、CD206、Ym1表达量增多。
另一方面,研究表明组蛋白H3K9乙酰化往往与活化基因相关,属促进性修饰,参与基因的转录激活,在巨噬细胞可塑性中起着重要作用。组蛋白修饰和核小体重塑与 T 细胞的基因表达密切相关,其转录后修饰常通过改变染色质结构和染色质的可接近性,从而促进或抑制转录因子与 DNA 的结合,进而调控基因的表达[5]。通过组蛋白修饰引起的染色质重塑,是特异性免疫反应中重要的表观遗传学机制[18]。
与此同时,实验中发现,去乙酰化酶抑制剂VPA作用后的M1型巨噬细胞的标记基因CD86的表达量反而升高。去乙酰化酶依赖性巨噬细胞共刺激分子的表达可能与组蛋白去乙酰化酶11抗体有关,因为有研究已经发现这个去乙酰化酶的异位表达能够促进巨噬细胞中CD40和CD86的表达,但具体机制还不清楚[16]。
总而言之,去乙酰化酶抑制剂可以通过调节多种重要途径来有效规划巨噬细胞平衡的不同方面[15]。这表明组蛋白H3K9的修饰和巨噬细胞的极化过程有着密切的联系,因此我们可以通过控制巨噬细胞的组蛋白修饰,对巨噬细胞极化的某些关键步骤加以合理干预,扭转巨噬细胞已偏移的极化失衡状态,即使其从M1表型向M2表型转化,这将有可能从一些新的思路来治疗多种免疫相关疾病。
参考文献:
[1]Stout RD,Jiang C,Matta B,etal.Macrophages sequentially change their functional phenotype in response to changes in microenvironmental influences[J].J Immunol,2005,175(1):342-349.
[2]Cho D,Kim MR,Jeong H,etal.Mesenchymal stem cells reciprocally regulate the M1/M2 balance in mouse bone marrow-derived macrophages[J].Exp Mol Med,2014,46(7):e70.
[3]谢冰冰,董燕,吴阳阳,等.巨噬细胞极化的信号通路及其与疾病的关系[J].中药新药与临床药理,2014,25(1):107-112.
[4]Dalton DK,Pitts-Meek S.Multiple defects of immune cell function in mice with disrupted interferon-gamma genes[J].Science,1993,259(5102):1739-1742.
[5]Carlin JM,Ozaki Y,Byrne GI,etal.Interferons and indolea mine 2,3-dioxygenase:role in antimicrobial and antitumor effects[J].Experientia,1989,45(6):535-541.
[6]Nathan CF,Murray HW,Wiebe ME,etal.Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity[J].J Exp Med,1983,158(3):670-689.
[7]Goerdt S,Politz O,Schledzewski K,etal.Alternative versus classical activation of macrophages[J].Pathobiology,1999,(5-6):222-226.
[8]Maresz K,Ponomarev ED,Barteneva N,etal.IL-13 induces the expression of the alternative activation marker Ym1 in a subset of testicular macrophages[J].J Reproduct Immunol,2008,78(2):140-148.
[9]Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3(1):23-35.
[10]Solinas G,Schiarea S,Liguori M,etal.Tumor-conditioned macrophages secrete migration-stimulating factor:a new marker for m2-polarization,influencing tumor cell motility[J].J Immunol,2010,185(1):642-652.
[11]Stein M,Keshav S,Harris N,etal.Interleukin 4 potently enhances murine macrophage mannose receptor activity:a marker of alternative immunologic macrophage activation[J].J Exp Med,1992,176(1)::287-292.
[12]DY V,JE G,AW S,etal.Human macrophage polarization in vitro:Maturation and activation methods compared[J].Immunobiology,2014,219(9):695-703.
[13]Kittan NA,Allen RM,Dhaliwal A,etal.Cytokine induced phenotypic and epigenetic signatures are key to establishing specific macrophage phenotypes[J].Plos One,2013,8(10):e78045.
[14]Lee J Y,Kim N A,Sanford A,etal.Histone acetylation and chromatin conformation are regulated separately at the TNF-alpha promoter in monocytes and macrophages[J].J Leukoc Biol,2003,73(6):862-871.
[15]周宪宾.巨噬细胞M1/M2极化分型的研究进展[J].中国免疫学杂志,2012,28(10):957-960.
[16]Shakespear MR,Halili MA,Irvine K,etal.Histone deacetylases as regulators of inflammation and immunity[J].Trends Immunol,2011,32(7):335-343.
[17]Adhya D,Dutta K,Kundu K,etal.Histone deacetylase inhibition by Japanese encephalitis virus in monocyte/macrophages:a novel viral immune evasion strategy[J].Immunobiology,2013,218(10):1235-1247.
[18]Ishii M,Wen H,Corsa CA,etal.Epigenetic regulation of the alternatively activated macrophage phenotype[J].Blood,2009,114(15):3244-3254.
[收稿2015-07-25]
(编辑张晓舟)
Effect of deacetylase inhibitor VPA on polarization of macrophages
ZHANGYing,BAILi,ZHANGWen-Lan,YINXue-Hong,ZHANGWei,PANGChun-Yan,WANGYong-Fu.
TheFirstAffiliatedHospitalofBaotouMedicalCollege,InnerMongoliaUniversityofScienceandTechnology,Baotou014040,China
[Abstract]Objective:By analyzing the effect of deacetylase inhibitors on macrophage polarization process of histone modification,and the influence of the process of macrophage polarization,analysis deacetylase inhibitors whether have the effect on the activity of the macrophage polarization by altered histone modification of macrophages,in order to provide a new perspective for the treatment of autoimmune diseases.Methods: Using lipopolysaccharide(LPS) and interferon-γ(IFN-γ) to stimulate J774.1 cells for 24 h,and interleukin-4(IL-4)to stimulate J774.1 cells for 24 h.And 2 mmol/L valproic acid(VPA) was added in the induction process.Collecting J774.1 cells,fluorescent quantitation PCR assay and ELISA assay was used for the detection of specific markers of gene expression in macrophage polarization,flow cytometry and immunofluorescence assay for the detection of histone modifications.Results: J774.1 cells were polarized into M1 macrophages which were stimulated by LPS and IFN-γ for 24 h;and also J774.1 cells were polarized into M2 macrophages which were stimulated by IL-4 for 24 h.The degree of acetylation of H3K9 for M1 phenotype was increased after VPA treatment,the expression of interleukin-6(IL-6),inducible nitric oxide synthase(iNOS),and chemotactic factor(CCL-2)was decreased,and the expression of CD86 was increased.The degree of acetylation of H3K9 for M1 phenotype was also increased after VPA treatment,and also the expression of Arginase,Fizz-1,mannose receptor(CD206) and Ym1 were increased.Conclusion: The polarization state of the macrophages and histone modification had a certain relevance.VPA could induce the transformation of M1 phenotype to M2 phenotype in the induction system of the M1 macrophages,however,the expression of specific genes in M1 phenotype was inhibited in the induction system of the M2 macrophages.
[Key words]Histone modification;Macrophage polarization;Deacetylase inhibitor;M1 macrophages;M2 macrophages
中图分类号R392.12
文献标志码A
文章编号1000-484X(2016)03-0307-07
作者简介:张颖(1988年-),女,在读硕士,主要从事组蛋白修饰和细胞之间关系的研究,E-mail:1037842189@qq.com。通讯作者及指导教师:王永福(1968年-),男,教授,硕士生导师,主要从事自身免疫性疾病的研究,E-mail:wyf5168@hotmail.com。
doi:10.3969/j.issn.1000-484X.2016.03.003
①本文受2014年度国家自然科学基金委员会资助项目(No.81450040)和2015年度国家自然科学基金委员会资助项目(No.81360464)资助。
