莠去津土壤残留对4种蔬菜生长及叶绿素荧光参数的影响
2016-04-14杨彩宏田兴山
杨彩宏 冯 莉 田兴山
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广东广州 510640)
杨彩宏,硕士研究生,主要从事除草剂抗药性及杂草综合治理方面的研究,E-mail:ych19820808@163.com
莠去津土壤残留对4种蔬菜生长及叶绿素荧光参数的影响
杨彩宏 冯 莉 田兴山*
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广东广州 510640)
杨彩宏,硕士研究生,主要从事除草剂抗药性及杂草综合治理方面的研究,E-mail:ych19820808@163.com
摘 要:为了明确莠去津土壤残留对后茬蔬菜的影响,在室内采用毒土添加法研究了莠去津不同土壤残留量对黄瓜、豇豆、辣 椒和菜薹光合作用和幼苗生长的影响。结果表明:莠去津土壤残留量为0.21、1.84、0.24、0.11 mg·kg-1时,导致黄瓜、豇豆、辣椒和菜薹叶片PSⅡ最大光化学效率(Fv/Fm)下降10%;4种蔬菜分别在接近此有效成分剂量时(黄瓜0.2 mg·kg-1、豇豆2 mg·kg-1、辣椒0.2 mg·kg-1、菜薹0.1 mg·kg-1),电子传递速率(ETRⅡ)显著下降,且单株鲜质量抑制率达到50%;4种蔬菜对莠去津土壤残留的敏感性顺序为:菜薹>黄瓜>辣椒>豇豆;Fv/Fm可作为早期预知轮作蔬菜是否受到莠去津残留潜在药害的指标,Fv/Fm的ID10为轮作蔬菜是否受药害的临界值。
关键词:莠去津;土壤残留;蔬菜生长;叶绿素荧光参数
莠去津(2-氯-4-乙氨基-6-异丙氨基-1,3,5-三嗪)是一种选择性除草剂,在全球范围内广泛应用于防除玉米、高粱、甘蔗等作物田间多种阔叶和部分禾本科杂草(苏少泉,2010)。莠去津主要是通过与D1蛋白结合并阻断植物光合电子流的方式发挥作用,尤其是在强光照条件下会导致活性氧的集结,从而对光系统Ⅱ产生破坏(Schreiber et al.,1994)。莠去津在土壤中残留时间较长,而在水中可缓慢降解(Gojmerac et al.,2006)。Taylor (1995)研究表明,田间土壤中残留的莠去津1个月仅被降解5%以下;Giardina等(1980,1985)、Behki和Kahn(1986)、Anderson和Georgeson (1989)研究发现,虽然土壤中的生物和非生物因素均可降解莠去津,但莠去津的半衰期仍介于4~57周之间。Eagle(1978)、Frank等(1983)研究发现,土壤中莠去津残留剂量超过0.1 mg·kg-1将严重影响敏感作物的生长。频繁和过度使用该除草剂对人类健康和环境存在诸多负面影响,如杂草产生抗药性、作物发生药害、环境污染等(Solomon et al.,1996;叶常明 等,1997,1999;Flores et al.,2013;Heap,2014)。
广东省具有日照充足、气候温和、雨量充沛等亚热带气候特点,一年可种植甜玉米2~3茬。截至2012年底,甜玉米种植面积约32万hm2,占全球甜玉米种植面积的22.7%(罗军 等,2014)。同一田块一年内多次使用莠去津,长期的除草剂选择压导致田间一些难防恶性杂草逐年增多,如牛筋草〔Eleusine india(L.)Gaertn〕。为了缓解杂草危害及改变杂草群落单一的结构,农民通常采用蔬菜与甜玉米进行轮作。但是,由于蔬菜本身较敏感,无法代谢莠去津,除草剂在蔬菜植株内积聚,最终导致严重药害发生。尽管针对土壤中莠去津残留的研究报道已有许多,但是关于在玉米和蔬菜轮作过程中莠去津对蔬菜药害的相关研究报道却较少。因此,本试验重点开展了模拟莠去津土壤残留对黄瓜、豇豆、辣椒、菜薹幼苗生长及叶绿素荧光参数的影响,旨在明确一项能在植物生长早期用来判断其受药害风险指标的参数,为田间合理安全使用除草剂提供理论依据。
1 材料与方法
1.1试验材料
供试黄瓜(Cucumis sativus L.)品种为粤秀3号,豇豆〔Vigna unguiculata(L.)Walp.〕品种为亮青豆角,菜薹〔Brassica campestris L. ssp. chinensis (L. )var. utilis Tsen et Lee〕品种为粤蔬碧绿粗薹菜心,辣椒(Capsicum annuum L.)品种为粤蔬2号尖椒,均购于广东省农业科学院蔬菜研究所。
除草剂:90%莠去津水分散粒剂,购自浙江中山化工集团有限公司。
1.2试验方法
试验于2015年1~9月在广东省农业科学院植物保护研究所杂草室进行。
1.2.1莠去津土壤残留对4种蔬菜幼苗生长的影响
采用土壤添加法配制药土。土壤采自多年未耕作的休闲农田,于室外自然风干,基本理化性质为:pH值6.1,氮90 mg·kg-1,磷70 mg·kg-1,钾300 mg·kg-1。在直径9.5 cm、高28 cm的塑料杯中,加入500 g风干土,分别加入预先配制的不同浓度的莠去津药液60 mL,使莠去津在土壤中的最终有效成分剂量为:黄瓜,0(CK)、0.025、0.05、0.1、0.2、0.4、0.8 mg·kg-1;豇豆,0(CK)、0.025、0.05、0.1、0.2、2、4、8 mg·kg-1;辣椒,0(CK)、0.025、0.05、0.1、0.2、0.4、0.8 mg·kg-1;菜薹,0(CK)、0.006 25、0.012 5、0.025、0.05、0.1、0.2、0.4、0.8 mg·kg-1。将大小一致并经催芽露白的种子播于塑料杯中,每杯4粒,每处理10次重复。然后置于生长箱中,光照时间12 h/12 h(昼/夜),光照强度8 000 lx;温度白天30 ℃,晚上28 ℃。处理20 d后,采用直尺和天平分别测定4种蔬菜幼苗的株高和单株鲜质量,计算其抑制率、10%抑制浓度(ID10)及50%抑制浓度(ID50),根据ID50确定不同蔬菜对莠去津土壤残留的敏感性。
1.2.2莠去津土壤残留对4种蔬菜叶绿素荧光参数的影响 前期处理方法同1.2.1。处理7 d后,每处理随机选择1株测定叶绿素荧光参数。先将待测植株暗适应30 min,采用调制荧光成像系统(IMAGING-PAM,德国WALZ公司生产)观察植物受药害情况;选择伸展开的叶片,采用光纤型双通道PAM-100(DUAL-PAM-100,德国WALZ公司生产)先照射1个小于1 μmol·m-2·s-1的测量光,再照射饱和脉冲光(10 000 μmol·m-2·s-1),然后使用133 μmol·m-2·s-1的内源光化光测量4.3 min。PSⅡ最大光化学效率(Fv/Fm)、PSⅡ有效量子产率(YⅡ)、PSⅡ电子传递速率(ETRⅡ)均由仪器自动给出。分别计算4种蔬菜Fv/Fm、YⅡ的10%抑制浓度(ID10)及50%抑制浓度(ID50)。
1.3数据处理
采用SPSS(16.0)软件分别求出莠去津土壤残留剂量对不同蔬菜的毒力回归方程、相关系数、ID10和ID50值;采用Excel软件作图。

表1 莠去津不同土壤残留量对4种蔬菜幼苗生长的影响
2 结果与分析
2.1莠去津土壤残留对4种蔬菜幼苗生长的影响
由表1可知,莠去津处理20 d后,4种蔬菜单株鲜质量的受抑制程度均明显大于株高。从对株高的影响来看,土壤中残留0.8 mg·kg-1莠去津时,对菜薹、黄瓜、辣椒和豇豆株高的抑制率分别为40.33%、2.82%、29.14%、<1.32%,说明菜薹对莠去津的敏感性最高;从对单株鲜质量的影响来看,土壤中残留0.05 mg·kg-1莠去津时,对菜薹、黄瓜、辣椒和豇豆单株鲜质量的抑制率就分别达到30.95%、22.99%、7.69%、19.41%。随着莠去津土壤残留量的增加,对4种蔬菜株高和单株鲜质量的抑制作用总体呈上升趋势。
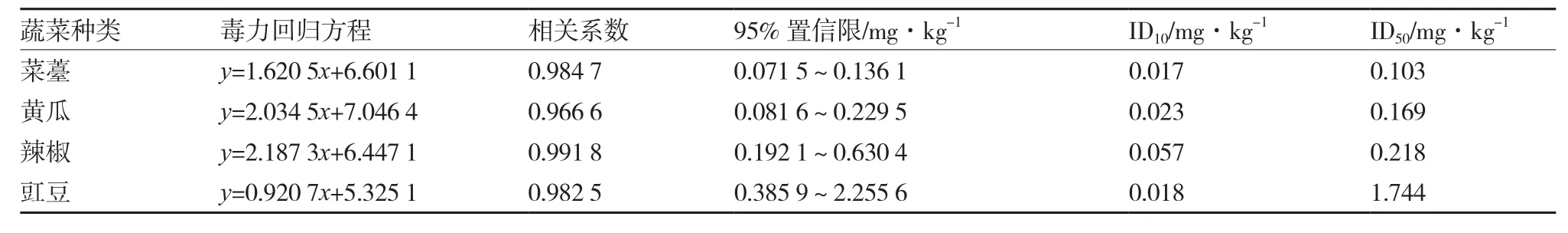
表2 莠去津土壤残留对4种蔬菜单株鲜质量的抑制作用
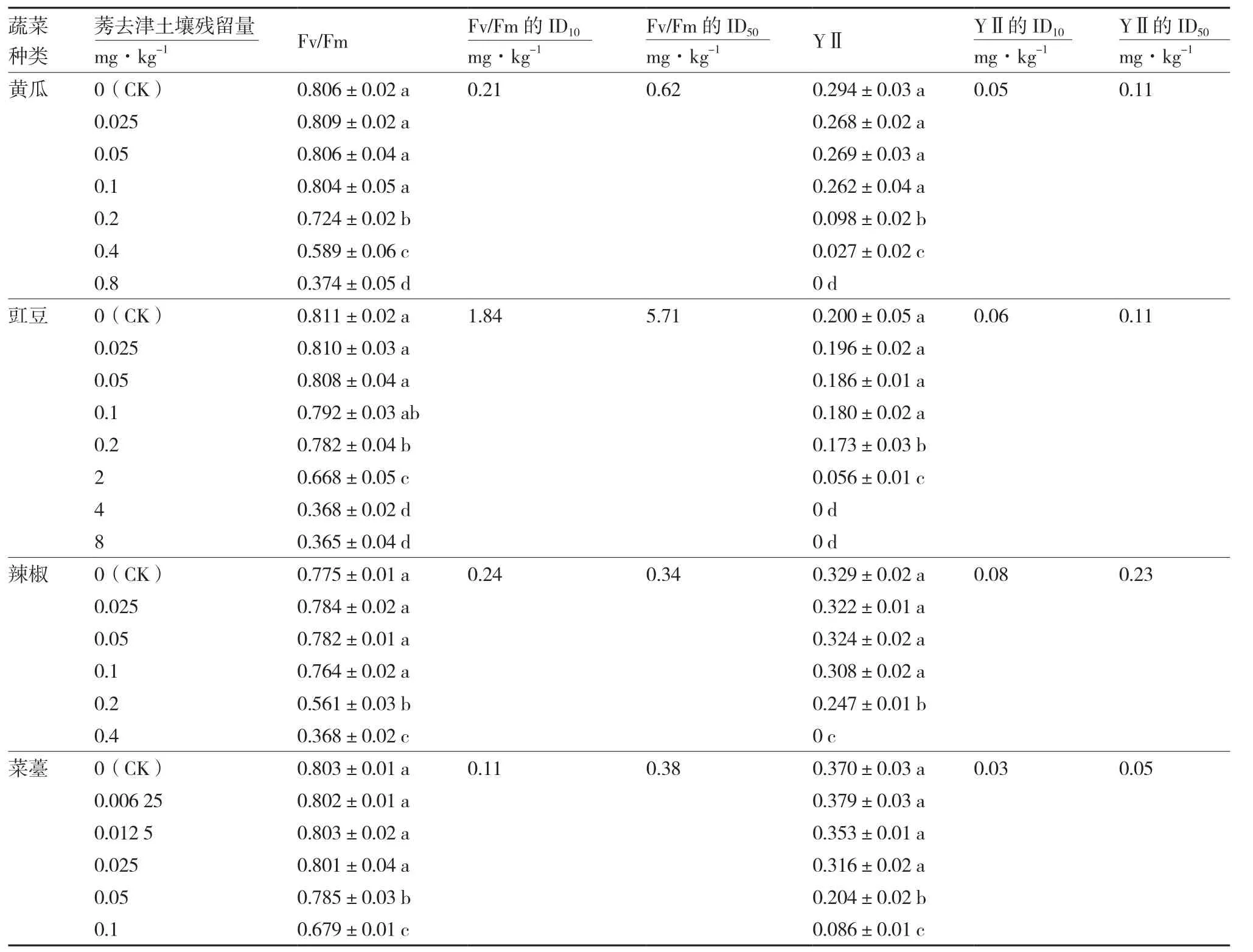
表3 莠去津不同土壤残留量对4种蔬菜叶绿素荧光参数的影响
从表2可以看出,当土壤中莠去津残留量为0.017、0.023、0.057、0.018 mg·kg-1时,分别对菜薹、黄瓜、辣椒和豇豆单株鲜质量的抑制率达10%;而当莠去津残留量升高为0.103、0.169、0.218、1.744 mg·kg-1时,对菜薹、黄瓜、辣椒和豇豆单株鲜质量的抑制率达50%,严重影响蔬菜的正常生长。
2.2莠去津土壤残留对4种蔬菜叶绿素荧光参数的影响
由表3可知,土壤中莠去津残留量低于0.1 mg·kg-1时,黄瓜叶绿素荧光参数Fv/Fm和YⅡ与对照无显著差异;当莠去津残留量继续升高时,Fv/Fm和YⅡ均显著降低,且YⅡ下降趋势更明显;从图1可以看出,当莠去津残留量继续升高至0.4 mg·kg-1时,莠去津传导至茎部和叶基部,黄瓜植株受到严重药害。
对于豇豆,土壤中莠去津残留量为0.2 mg·kg-1时,与对照相比Fv/Fm和YⅡ缓慢下降;当莠去津残留量继续升高到2 mg·kg-1和4 mg·kg-1时,荧光参数值急剧下降(表3),莠去津传导至茎部和叶片中(图1),导致豇豆植株产生药害。
对于辣椒,土壤中莠去津残留量为0.2 mg·kg-1时,与对照相比Fv/Fm和YⅡ均显著下降;当莠去津残留量继续升高到0.4 mg·kg-1时,YⅡ急剧下降至0(表3)。
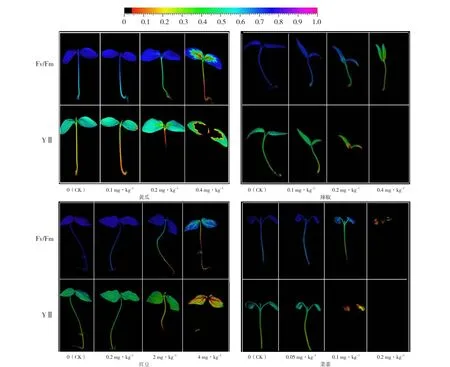
图1 4种蔬菜幼苗不同浓度莠去津处理的荧光成像结果彩色图片见《中国蔬菜》网站:www.cnveg.org。
菜薹对土壤莠去津残留敏感性较高,土壤中莠去津残留量为0.05 mg·kg-1时,Fv/Fm和YⅡ即呈现下降趋势;当莠去津残留量继续升高到0.1 mg·kg-1时,YⅡ急剧下降至0.086(表3)。
此外,莠去津在土壤中残留量达0.21、1.84、0.24、0.11 mg·kg-1时,黄瓜、豇豆、辣椒和菜薹叶片Fv/Fm降低10%;莠去津残留量达0.62、5.71、0.34、0.38 mg·kg-1时,导致4种蔬菜叶片Fv/Fm降低50%(表3)。
由图2可知,土壤中莠去津残留量在一定范围内(黄瓜,0~0.1 mg·kg-1;豇豆,0~0.2 mg· kg-1;辣椒,0~0.1 mg·kg-1;菜薹,0~0.05 mg·kg-1),4种蔬菜的电子传递速率变化趋势一致,且均随照射时间的延长基本呈上升趋势;当土壤中莠去津残留量分别继续升高至0.2、2、0.2、0.1 mg·kg-1时,黄瓜、豇豆、辣椒和菜薹的电子传递速率显著下降,且与引起4种蔬菜单株鲜质量下降50%及Fv/Fm下降10%的莠去津剂量均接近;当土壤中莠去津残留量继续升高,4种蔬菜的电子传递速率均趋于0,光合作用受到严重破坏。
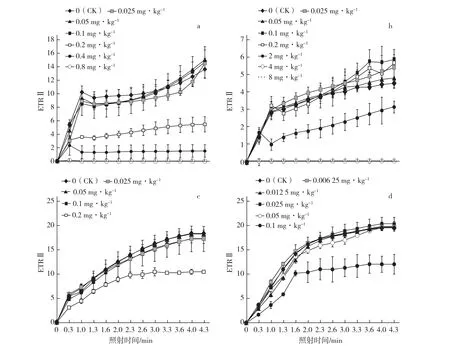
图2 莠去津不同土壤残留量对4种蔬菜PSⅡ电子传递速率(ETRⅡ)的影响a,黄瓜;b,豇豆;c,辣椒;d,菜薹;处理7 d后,高浓度莠去津处理的菜薹(0.2、0.4、0.8 mg·kg-1)和辣椒(0.4、0.8 mg·kg-1)发生严重药害,叶片无法展开,因此无法采用光纤型双通道PAM-100进行测量。
3 结论与讨论
莠去津是一种光合作用抑制型除草剂,其作用靶标主要是质体醌还原前的PSⅡ与PSⅠ之间QA 与PQ间的电子传递体β蛋白,莠去津与其结合后,改变蛋白质的氨基酸结构,抑制电子从质体醌QA向QB传递,从而影响光合电子传递(Hess,2000),最终导致植物体内氧自由基累积和PSⅡ反应中心光氧化损伤(Genty et al.,1989)。由于其具有高度的选择性和内吸性,是玉米田防除杂草的优选除草剂之一。华南地区由于特殊的气候条件,甜玉米一年种植多茬,因此同一田块一年内莠去津被多次使用,由于长期的除草剂选择压,导致田间一些难防恶性杂草逐年增多,土壤中杂草种子库大量富集,造成甜玉米产量和品质的下降,同时给田间管理也带来了一定的难度。为了缓解这种情况,近年来多采用甜玉米与其他蔬菜作物进行轮作。然而,农民均反映轮作蔬菜受药害严重,很难正常生长。
本试验发现,当土壤中莠去津残留量超过0.1 mg·kg-1时,明显抑制了菜薹的生长、削弱了其光合能力,此结果与在苜蓿和燕麦上的研究结果一致(Eagel,1978;Frank et al.,1983);当土壤中莠去津残留量为0.2 mg·kg-1时,会对黄瓜和辣椒的光合能力与生长产生影响,这与在大豆和番茄上的研究结果相似(Eagle,1978;Frank et al.,1983);豇豆对莠去津的耐受性最强,在高达2 mg·kg-1的残留剂量下仅受到轻微药害,远远高于90%莠去津水分散粒剂的田间推荐剂量0.9 mg·kg-1。豇豆之所以对莠去津具有较高耐受性,可能是因为于其地上组织对除草剂有一定的代谢能力,也可能是因为与其他蔬菜相比莠去津更不容易穿透豇豆叶片细胞壁(Frank et al.,1983;Schwarzschild et al.,1994)。综上,当频繁使用莠去津对农田造成污染时,可以选择豇豆作为轮作作物。
针对各种逆境胁迫下植株叶绿素荧光特性和光合器官功能、结构发生变化的研究已有很多(Shaw et al.,2008;Palombi et al.,2011;Iriel et al.,2014)。本试验结果表明,莠去津土壤残留导致4种蔬菜Fv/Fm抑制率达到10%的剂量,与导致ETRⅡ值显著下降的剂量一致,即黄瓜为0.2 mg·kg-1、豇豆为2 mg·kg-1、辣椒为0.2 mg·kg-1、菜薹为0.1 mg·kg-1。说明在相应莠去津剂量处理下,相应蔬菜正常生长过程中电子传递链被阻断,光合作用受到影响。当蔬菜植株受到土壤中残留莠去津的胁迫后,Fv/Fm的降低与光合效力、碳代谢、生产率以及作物生长量(如单株鲜质量)存在直接关系(Scarlett et al.,1999;Ralph et al.,2007)。另外,莠去津在光合作用电子传输中阻断电子传递链,降低了NADPH和ATP的生成,从而影响了碳固定,并最终抑制蔬菜正常生长。当土壤中的莠去津含量导致Fv/Fm抑制率达到10%时对4种蔬菜单株鲜质量的抑制率达到50%。叶绿素荧光参数Fv/Fm和YⅡ能在肉眼观察到植株药害症状之前较准确地指示出蔬菜受莠去津残留所致的潜在伤害,且敏感性顺序与最终单株鲜质量测定结果一致,即菜薹最敏感,豇豆最不敏感。因此,叶绿素荧光参数Fv/Fm可以作为指示莠去津土壤残留对轮作蔬菜是否具有潜在药害的指标,当供试作物Fv/ Fm下降10%即表明其有可能受到莠去津残留药害的影响。
参考文献
罗军,万忠,谭俊,胡建广,尹艳.2014 .2013年广东甜玉米产业发展形势与对策建议.广东农业科学,(5):42-45.
苏少泉.2010.莠去津特性与使用中的问题.农药研究与应用,(14):1-5.
叶常明,雷志芳,殷兴军,阎海,李铁,弓爱君.1997.含莠去津和乙草胺河水灌溉对苗期水稻危害的研究.环境科学进展,(10):51-57.
叶常明,雷志芳,弓爱君,王杏君.1999 .阿特拉津生产废水排放对水稻危害的风险分析.环境科学,(3):82-84.
Anderson P C,Georgeson M.1989.Georgeson herbicide-tolerant mutants of corn.Genome,31:994-999.
Behki R M,Kahn S U.1986.Degradation of atrazine by pseudomonas:N-dealkylation and dehalogenation of atrazine and its metabolites.J Agric Food Chem,34:746-749.
Eagel D J.1978.Interpretation of soil analysis for herbicide residue.Proc Br Crop Protection Conf Weeds,17:241-245.
Flores F,Collier C J,Mercurio P,Negril A P.2013.Phytotoxicity of four photosystemⅡherbicides to tropical seagrasses.PLoS One,8:1-12.
Frank R,Sirons G J,Anderson G W.1983.Atrazine:the impact of persistent residues in soil on susceptible crop species.Can J Soil Sci,63:315-325.
Genty B,Briantais J M,Baker N R.1989.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophⅡfluorescence.Biochimca et Biophysica Acta,990:87-92.
Giardina M C,Giardi M T,Fialacchioni G.1980.4-amino-2-chlorol,3,5-triazine:a new metabolite of atrazine by a soil bacterium.Agric Biol Chem,44:2067-2072.
Giardina M C,Giardi M T,Fialacchioni G.1985.Chemical and biological degradation of primary metabolites of atrazine by a Nocardia strain.Agric Biol Chem,44:1551-1558.
Gojmerac T,Ostojic Z,Paukovic D,Zuric J P M.2006.Evaluation of surface water pollution with atrazine,an endocrine disruptor chemical,in agricultural areas of Turopolje.Croatia Bull Environ Contam Toxicol,76:490-496.
Heap I.2014.International survey of herbicide resistant weeds.http:// www.weedscience.com.
Hess F.2000.Light-dependent herbicides:an overview.Weed Sci,48:160-170.
Iriel A,Novo J M,Cordon G B,Lagorio M G.2014.Atrazine and methyl viologen effects on chlorophyⅡ-a-fluorescence revisitedimplications in photosystem emission and ecotoxicity assessment.Photochemistry and Photobiology,90:107-112.
Palombi L,Cecchi G,Lognoli D,Raimondi V,Toci G,Agati G.2011.A retrieval algorithm to evaluate the photosystem I and photosystemⅡspectral contributions to leaf chlorophyⅡ fluorescence at physiosogical temperatures.Photosynth Res,108:225-239.
Ralph P J,Smith R A,Macinnis-Ng C M O,Seery C R.2007.Use of fluorescence-based ecotoxicological bioassays in monitoring toxicantsand pollution in aquatic systems:review.Toxicol Environ Chem,89:589-607.
Scarlett A,Donkin P,Fileman T W,Evans S V,Donkin M E.1999.Risk posed by the antifouling agent Irgarol 1051 to the seagrass,Zostera marina.Aquat Toxicol,45:159-170.
Schreiber U,Bilger W,Neubauer C.1994.ChlorophyⅡ fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis//Schulze E D,Caldwell M M.Ecophysiology of Photosynthesis.Ecological Studies,3:49-70.
Schwarzschild A C,MacIntyre W G,Moore K A,Laurence L E.1994.Zostera marina L. growth response to atrazine in root-rhizome and whole plant exposure experiments.J Exp Mar Biol Ecol,183: 77-89.
· 信息 ·
Shaw C M,Lam P K S,Mueller J F.2008.PhotosystemⅡ herbicide pollution in Hong Kong and its potential photosynthetic effects on corals.Marine Pollution Bulletin,57:473-478.
Solomon K R,Baker D B,Richards R P,Dixon K R,Klaine S J,La P T W,Kendall R J,Weisskopf C P,Giddings J M,Giesy J P,Hall L W,Williams W M.1996.Ecological risk assessment of atrazine in North American surface waters.Environ Toxicol Chem,15:31-76.
Taylor A W.1995.The volatilization of pesticide residues//Roberts T R,Kearney P C,eds.Environmental behaviour of agrochemicals.UK:Wiley & Sons:257-306.
Effects of Atrazine Residues on Growth and ChlorophyⅡ Fluorescence Parameters of Four Vegetable Species
YANG Cai-hong,FENG Li,TIAN Xing-shan*
(Institute of Plant Protection,Guangdong Academy of Agricultural Sciences,Guangdong Provincial Key Laboratory of High Technology for Plant Protection,Guangzhou 510640,Guangdong,China)
Abstract:In order to understand the effect of atrazine residue in soil on the successive vegetable,this experiment add atrazine solution in soil to assay its affection on photosynthesis and growth of cucumber,cowpea,pepper and choy sum.Results showed that when the atrazine concentrations in soil reached 0.21,1.84,0.24,0.11 mg·kg-1,respectively for to cucumber,cowpea,pepper,and choy sum,the largest Fv/Fm would reduce 10%.When these 4 vegetables were under the dosages of 0.2,2,0.2,0.1 mg·kg-1,respectively,ETRⅡ of these 4 vegetables were significantly declined and finally resulted in inhibition of fresh weight growth by 50%.The sensitivity of these 4 vegetables to atrazine residue in soil was in the order of choy sum>cucumber>pepper>cowpea.The results of this study indicated that Fv/Fm could be a useful parameter for assessing the risk of injury caused by atrazine residues at early stage of plant growth,and ID10of Fv/Fm was a critical value telling weather the rotated vegetable crops were affected by atrazine residue.
Key words:Atrazine;Residue in soil;Vegetables growth;ChlorophyⅡ fluorescence parameters
基金项目:国家公益性行业(农业)科研专项(201203098),广东省公益研究与能力建设专项(2014B070706017)
收稿日期:2015-11-12;接受日期:2016-02-01
*通讯作者(
Corresponding author):田兴山,研究员,硕士生导师,主要从事杂草科学方面的研究,E-mail:xstian@tom.com
