抚仙金线鲃kisspeptin基因的克隆及组织表达特性
2016-04-13廖宗甄孙彩云王晓爱杨国坤潘晓赋杨君兴李文笙
廖宗甄, 孙彩云, 王晓爱, 杨国坤, 潘晓赋, 杨君兴*, 李文笙*
(1. 有害生物控制与资源利用国家重点实验室,广东省水生经济动物良种繁育重点实验室,中山大学深圳研究院,中山大学生命科学学院,广州510275; 2. 遗传资源与进化国家重点实验室,中国科学院昆明动物研究所,昆明650223)
抚仙金线鲃kisspeptin基因的克隆及组织表达特性
廖宗甄1, 孙彩云1, 王晓爱2, 杨国坤1, 潘晓赋2, 杨君兴2*, 李文笙1*
(1. 有害生物控制与资源利用国家重点实验室,广东省水生经济动物良种繁育重点实验室,中山大学深圳研究院,中山大学生命科学学院,广州510275; 2. 遗传资源与进化国家重点实验室,中国科学院昆明动物研究所,昆明650223)
抚仙金线鲃Sinocyclocheilustingi是云南抚仙湖的特有种,虽已突破其人工繁殖技术,但在塘养环境下不能自然繁衍。kiss1基因编码的神经多肽kisspeptin被认为是下丘脑-垂体-性腺轴的重要调节因子,通过调控促性腺激素释放激素、促性腺激素等激素的分泌参与到生殖调控中。本研究采用反转录PCR和cDNA末端快速扩增(RACE)技术在抚仙金线鲃中克隆出编码kisspeptin的2个基因kiss1和kiss2的cDNA,其中kiss1的开放阅读框长度为351 bp,编码116个氨基酸;kiss2的开放阅读框长度为369 bp,编码122个氨基酸。反转录PCR结果显示,kiss1在抚仙金线鲃雌雄个体中均是肠道的表达量最高;kiss2表达量最高的组织在雄性和雌性中不同,雄性为肠道,雌性则是下丘脑和全脑。为进一步探究kiss1和kiss2在中枢神经系统及垂体中的分布,本研究中将抚仙金线鲃的脑部分为8个部分进行反转录PCR,结果显示,雄性脊髓和垂体中的kiss1表达量较高,雌性垂体中的kiss1表达量最高,其次是视顶盖;kiss2在雌性和雄性中均在下丘脑的表达量最高。本研究的结果为抚仙金线鲃人工繁殖提供了更多探索的方向。
抚仙金线鲃;kisspeptin;kiss1;kiss2;克隆;组织表达特性
Kisspeptin是由KISS1/kiss1基因编码的神经多肽,最初是在人类黑色素瘤细胞中作为黑色素瘤转移抑制因子而被发现(Leeetal.,1996)。研究发现,kisspeptin不仅参与生殖调控(de Rouxetal.,2003;Gottschetal.,2004;Lapattoetal.,2007;Colledgeetal.,2009),并且对机体的代谢也有重要作用。Kisspeptin包括kisspeptin-145、kisspeptin-54、kisspeptin-14、kisspeptin-13、kisspeptin-10。热带爪蟾Xenopus(Silurana)tropicalis中主要为kisspeptin-14、kisspeptin-12、kisspeptin-10,硬骨鱼类中主要是kisspeptin-10(Akazomeetal.,2010)。哺乳动物中编码kisspeptin的kiss基因只有1种——kiss1,热带爪蟾有3种kiss基因,分别为kiss1a、kiss1b和kiss2,硬骨鱼类有kiss1和kiss2 两种基因,但并非所有硬骨鱼类都同时含有kiss1和kiss2,黑斑鲀Tetraodonnigroviridis和三棘鱼Gasterosteusaculeatus就只含有kiss2(Akazomeetal.,2010)。
哺乳动物中,kisspeptin的合成神经元主要分布在腹侧脑室旁核(the anteroventral periventricular nucleus, AVPV)和弓状核(the arcuate nucleus, ARC)(Lehmanetal.,2010)。硬骨鱼类中,kisspeptin主要分布在2个区域:松果体缰(habenula)和视前叶-下丘脑区(preoptic-hypothalamic)。与哺乳动物kisspeptin的作用相似,硬骨鱼类kisspeptin也与促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)的活动相关。成熟青鳉OryziaslatipesGnRH3神经元末端可能可以接收来自下丘脑或松果体缰的kiss1神经元突出的信号,从而调节自身的电活动(Zhaoetal.,2013)。在斑马鱼Daniorerio中发现kiss2-免疫反应阳性神经纤维和视前叶的GnRH3神经元有紧密联系(Servilietal.,2011)。kiss2在脑区广泛分布,表示kiss2可能存在调节GnRH以外的功能。金鱼Carassiusauratus的kiss1除了在脑区中表达外,在肠道、肾脏、脂肪、鳃中都有表达,其中在肠道中表达量最高(Yangetal.,2010)。
抚仙金线鲃Sinocyclocheilustingi隶属于鲤形目Cypriniformes鲤科Cyprinidae金线鲃属Sinocyclocheilus,是仅分布在云南省抚仙湖的一种季节性洞穴鱼类(杨君兴,陈银瑞,1995)。由于外来物种入侵和过度捕捞,其种群衰退严重,目前,湖体种群数量稀少,仅有少量个体存活在沿湖的龙潭中(杨君兴,陈银瑞,1995;潘晓赋等,2009;王伟营等,2011)。为保护这一珍稀物种,恢复其野生种群,探索其人工繁殖技术至关重要。至2009年,抚仙金线鲃人工繁殖取得成功,并获得了较高的苗种存活率(潘晓赋等,2009)。但抚仙金线鲃在塘养环境下仍不能实现自然繁衍,类似的现象也常见于其他鱼类,可能是其生殖功能紊乱所致。因此,本研究拟通过研究抚仙金线鲃生殖调控相关因子kisspeptin基因的克隆及表达特性,为进一步探索塘养环境对抚仙金线鲃生殖功能的影响及为抚仙金线鲃人工繁殖技术提供更多的研究思路。
1 材料和方法
1.1 材料
抚仙金线鲃由中国科学院昆明动物研究所珍稀鱼类保育研究基地提供。取样时间为7月。实验用鱼在光照、黑暗各12 h的循环水中驯养1周,健康且性成熟的雄鱼和雌鱼各6尾,体长12~15 cm,分为2组。实验时,抚仙金线鲃经丁香酚麻醉后断头处死,迅速取出相应组织,放入装有1.5 mL RNase free(Invitrogen)的EP管中,立即放入液氮,然后转至-80 ℃保存。
1.2 方法

1.2.2kiss1和kiss2基因的cDNA克隆 使用Trizol法(Invitrogen, Life Technologies)提取抚仙金线鲃的全脑总RNA,再使用M-MLV逆转录酶(Invitrogen, Life Technologies)进行cDNA第一条链的合成,分别用设计好的兼并引物扩增kiss1和kiss2的中间片段,PCR反应程序为94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min;4 ℃保存。根据中间片段克隆的结果,设计用于扩增3’端和5’端片段的特异性引物,并结合做cDNA末端快速扩增(RACE)所需的接头引物AP和AAP,进行kiss1和kiss2的3’-RACE和5’-RACE的扩增。用E.Z.N.A胶回收试剂盒(OMEGA, Bio-Tek)将产物回收后纯化。在Ligation High连接酶(TOYOBO)的作用下,把纯化得到的DNA片段连接到PCR2.1质粒(Invitrogen, Life Technologies)上进行测序分析。

表1 抚仙金线鲃kiss1和kiss2基因cDNA克隆和反转录PCR引物Table 1 Primers for Sinocyclocheilus tingi kiss1 and kiss2 cloning and reverse transcription PCR
1.2.3 RT-PCR法检测kiss1和kiss2基因的组织表达特性 表达特性分析包括组织分布和脑八分组织分布两部分,其中组织分布包括15个组织,分别为垂体、下丘脑、脑(不含垂体和下丘脑)、脊髓、鳃、心脏、肝、胃、肠道、脂肪、肌肉、肾、头肾、脾脏和性腺(雄性为精巢,雌性为卵巢);脑八分组织分布包括8个组织,分别为嗅球、端脑、视顶盖、小脑、延髓、脊髓、下丘、垂体。使用Trizol法提取各组织的RNA, M-MLV逆转录酶进行cDNA第一条链合成后,以 kiss1-QT-F和kiss1-QT-R,kiss2-QT-F和kiss2-QT-R为引物,各组织的反转录产物为模板,β-actin为内参基因,进行荧光定量PCR,PCR的程序为:95 ℃预变性1 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,40个循环。在每个PCR循环延伸阶段收集一次荧光,结束后进行熔解曲线分析,并根据目的基因和内参基因的Ct值,使用比较Ct法计算目的基因的表达水平。
1.2.4 数据分析 通过测序拼接得到kiss1和kiss2序列,再通过NCBI上的ORF finder确定开放阅读框(http://www.ncbi.nlm.nih.gov/projects/gorf/),使用Clustal W2对不同物种的kiss1和kiss2的氨基酸序列作同源性分析(http://www.ebi.ac.uk/Tools/msa/clustalw2/)。使用SignalP 4.1Server分析2种类型kisspeptin的信号肽(http://www.cbs.dtu.dk/services/SignalP/)。
2 结果
2.1kiss1和kiss2基因cDNA全长及氨基酸序列
将抚仙金线鲃kiss1和kiss2的序列提交至GenBank,登录号分别为KU500628和KU500629。kiss1基因cDNA全长466 bp,其中开放阅读框长度为351 bp,编码116个氨基酸的蛋白质,其中第1~15位氨基酸组成的多肽为信号肽,而第89~98位氨基酸序列为预测的核心序列YNLNSFGLRY-NH2。抚仙金线鲃kiss2基因cDNA全长528 bp,其中开放阅读框长度为369 bp,编码122个氨基酸的蛋白质,其中第1~19位的氨基酸组成的多肽为信号肽,第83~92位氨基酸序列为预测的核心序列FNYNPFGLRF-NH2。


表2 抚仙金线鲃kiss1氨基酸序列和其他物种的同源性比较Table 2 kiss1 amino acid sequences comparison ofSinocyclocheilus tingi with different species
2.2kiss1和kiss2基因表达特性
基因的组织表达分析结果显示,kiss1和kiss2基因主要在胃、肠道和中枢神经系统中表达。kiss1 基因在雄性和雌性肠道中的表达量最高,其次是胃。在抚仙金线鲃15个组织中,下丘脑、脑、脊髓、脾脏、脂肪中的kiss1基因表达量雌性高于雄性,在心脏、胃、肠道中雌性的表达量低于雄性,在其他组织中的表达量雌、雄差异不大(图1)。kiss1基因在脑区的表达水平普遍较高,雄性中最高的是脊髓,其次是垂体,而雌性中最高的是垂体,其次是视顶盖。除在嗅球、端脑和脊髓中kiss1基因的表达量雄性高于雌性外,其他脑组织中均是雌性高于雄性(图2)。
抚仙金线鲃15个组织中kiss2基因的表达分布结果显示,雄性中表达量最高的为肠道,其次为下丘脑;雌性中表达量较高的为下丘脑和脑,其次是脊髓和性腺。在脑、脊髓和性腺中kiss2基因的表达量雌性高于雄性,而在下丘脑、肝脏、脾脏、肠道和脂肪组织中,kiss2基因的表达量雌性均低于雄性,在其他组织中,雌、雄相差不大(图3)。在抚仙金线鲃脑八分组织中,kiss2基因的表达量均为雌性高于雄性(图4)。
总体来看,在性腺中kiss1基因的表达量较低,而kiss2基因的表达量相对较高,而这2个基因在鳃、头肾和肾中的表达水平都很低。
3 分析与讨论
kiss1和kiss2的氨基酸序列同源性分析显示,2个基因与鲤科鱼类的同源性较高,而与其他物种的同源性较低。kiss1和kiss2的核心序列在不同物种中都非常保守,青鳉和斑马鱼中kiss1编码的蛋白核心序列为YNLNSFGLRY-NH2,kiss2编码的蛋白核心序列为FNYNPFGLRF-NH2,它们共同的部分为-N-N-FGLR-。抚仙金线鲃的kiss1和kiss2基因预测的核心序列分别是YNLNSFGLRY-NH2和FNYNPFGLRF-NH2,从序列比对的结果可知,2个基因的核心序列都与斑马鱼的一致。kiss1编码的kisspeptin-10中的第3位氨基酸在哺乳动物和两栖动物中为W,而在鱼类中为L。目前只在鱼类和两栖动物中发现kiss2基因,序列比对可见kiss2的核心序列同样非常保守,在不同的鱼类和两栖动物中,只有第3位和第7位氨基酸略有不同,而同属鲤科的几种鱼类中,核心序列完全一致。从以上可知,kiss1和kiss2基因都比较保守。
Kisspeptin作为神经多肽多在脑区表达,硬骨鱼类的kisspeptin主要在松果体和视前叶-下丘脑中表达(Ogawaetal.,2013)。在本实验中,从RT-PCR结果来看,抚仙金线鲃kiss1和kiss2 mRNA在下丘脑、垂体、脑、脊髓这几个组织中的表达量都较高,而且在脑部各个分区都有一定程度的表达。作为被认为和生殖相关的kisspeptin,在抚仙金线鲃性腺中,kiss1相对表达量并不高,这与斑马鱼的结果一致。抚仙金线鲃精巢kiss1的表达量高于卵巢,这与在金鱼和斑马鱼中的结果一致(Yangetal., 2010)。除脑区的表达外,kiss1和kiss2都有一个非常明显的分布趋势,即这2个基因在肠道中的相对表达量非常高,在金鱼和斑马鱼中也发现kiss1在肠道中表达量最高,除肠道外,金鱼kiss1在肾和肝脏也有较高的表达量(Yangetal.,2010)。在本实验中使用的鱼正值繁殖期,其性腺成熟系数(GSI)>0.1%。而在金鱼的研究中使用GSI≤0.1%的鱼,如前所述,呈现相似的分布趋势。而且,在南亚野鲮Labeorohita中的研究显示,kiss1和kiss2在脑、垂体和性腺中的表达量可能与其性腺发展周期相关:在预备期、排卵前、排卵期和排卵后4个时期中,在雄性性腺中kiss1在减数分裂时期的表达量最高,而kiss2则是产卵后表达量最高。而雌性性腺中,kiss1在排卵期表达量最高,排卵后表达量下降,kiss2则没有出现明显的下降(Saha & Pradhan,2016)。因此,本实验结果只能反映kisspeptin在抚仙金线鲃繁殖期的表达水平。由kisspeptin在脑区和性腺分布的差异来看,可以推测kisspeptin主要在脑区起作用,而非直接在性腺起作用。目前关于kisspeptin的功能研究主要集中在生殖调控方面,但从kiss1和kiss2在肠道等组织的分布来看,kisspeptin还可能与消化系统的功能相关。
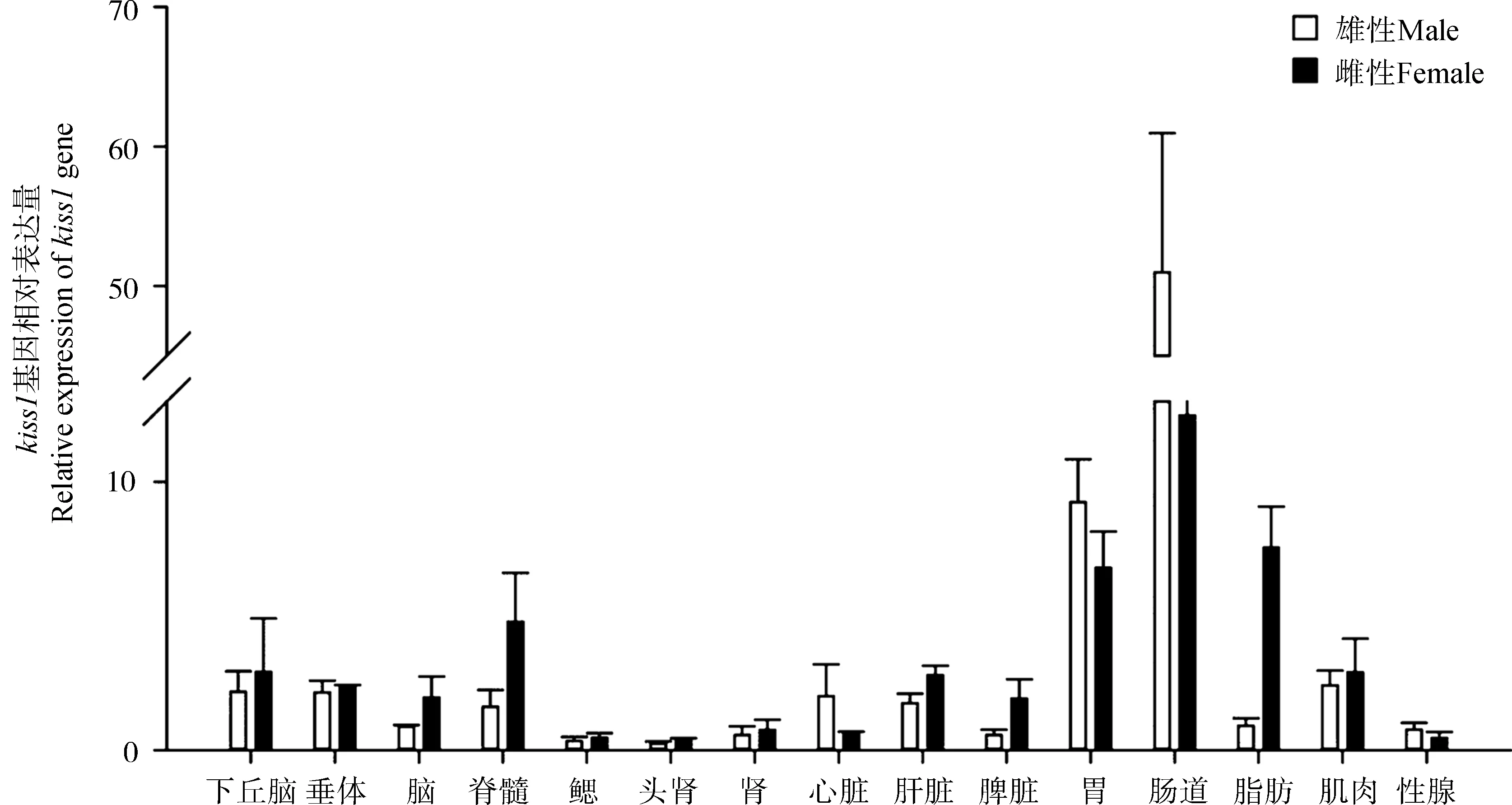
图1 抚仙金线鲃kiss1在不同组织中的表达情况Fig. 1 Tissue distribution analysis of Sinocyclocheilus tingi kiss1 by RT-PCR
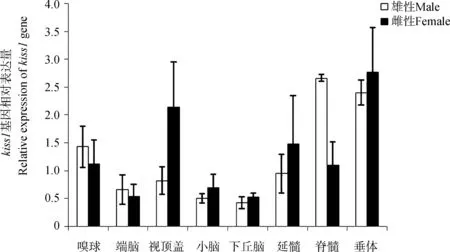
图2 抚仙金线鲃kiss1在中枢神经系统及垂体中的表达情况 (Mean±SE, n=3)Fig. 2 Central nervous system distribution analysis of Sinocyclocheilus tingi kiss1 by RT-PCR (Mean±SE, n=3)
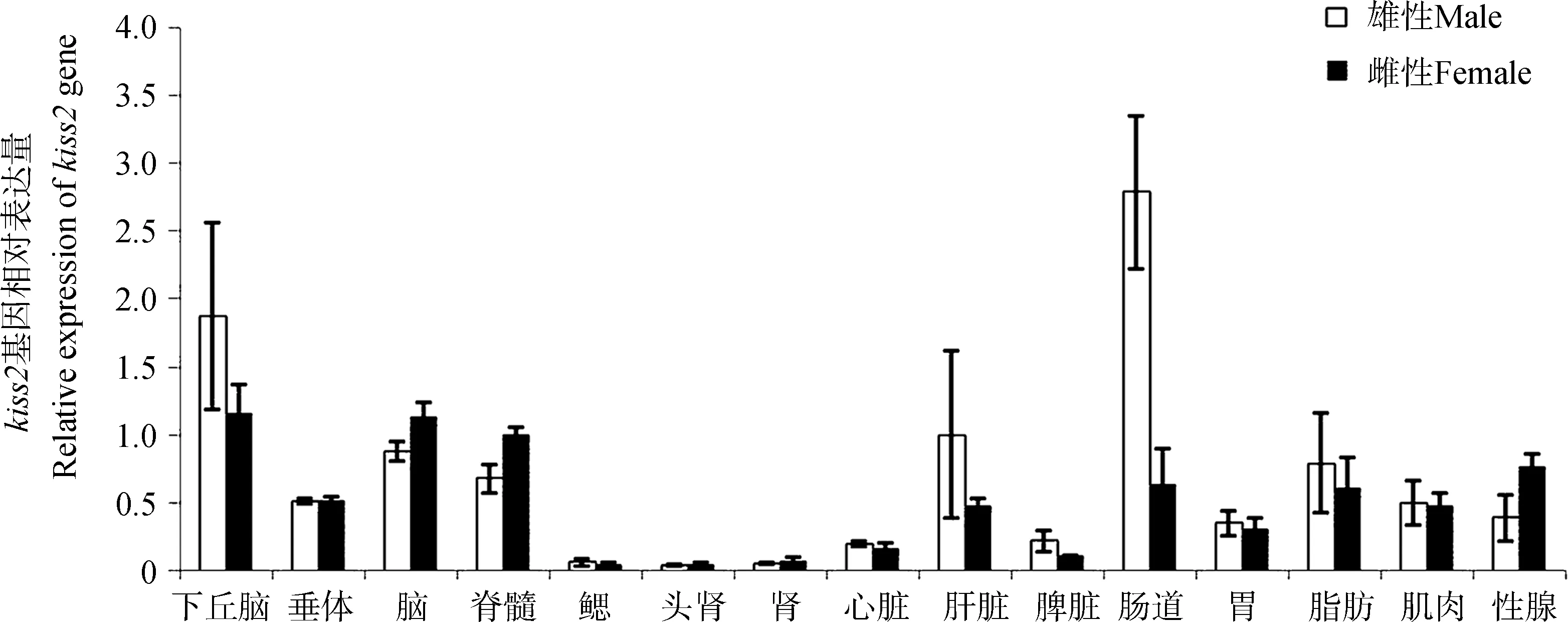
图3 抚仙金线鲃kiss2在不同组织中的表达情况 (Mean±SE, n=3)Fig. 3 Tissue distribution analysis of Sinocyclocheilus tingi kiss2 by RT-PCR (Mean±SE, n=3)
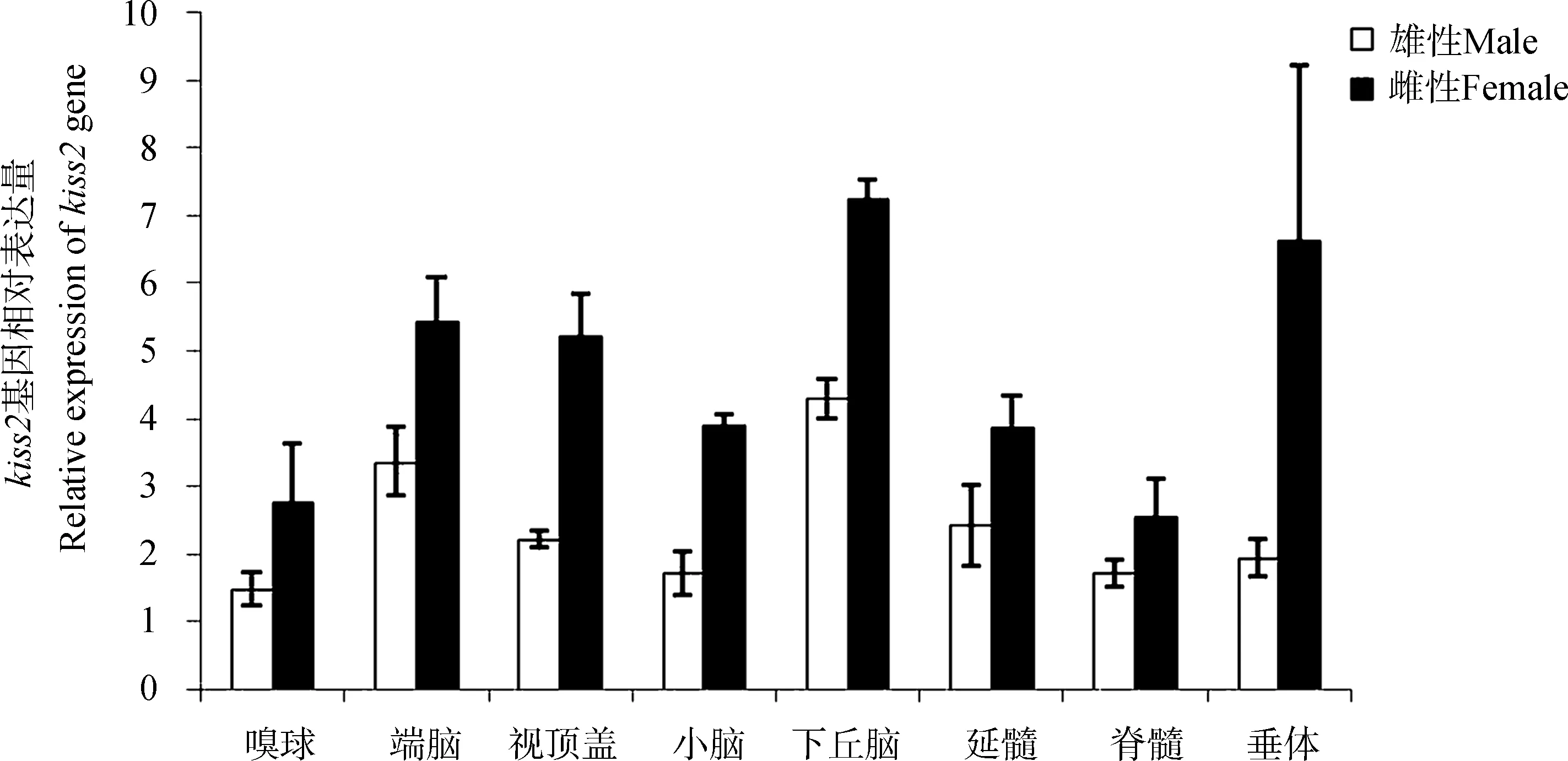
图4 抚仙金线鲃kiss2在中枢神经系统及垂体中的表达情况 (Mean±SE, n=3)Fig. 4 Central nervous system distribution analysis of Sinocyclocheilus tingi kiss2 by RT-PCR (Mean±SE, n=3)
此外,kiss1和kiss2在肝脏和肌肉中都有分布,尤其在雄性的肝脏中。由此推测kisspeptin还可能调节抚仙金线鲃的代谢活动。但在鱼类中,对kisspeptin的研究主要围绕其对生殖活动的作用进行,对其他功能的关注较少。在哺乳类中的研究发现,kiss1r不仅可以调控生殖活动,还可以影响体质量、能量消耗和葡萄糖的平衡(Tolsonetal.,2014),并且在代谢和生长方面也有一定作用,KISS1-10可以通过cAMP/PKA/PKC以及Ca2+离子信号通路调节垂体SLα的释放(Jiangetal., 2014)。对青春期大鼠短期禁食可以使下丘脑中kiss1基因的表达降低,在leptin缺陷的ob/ob小鼠中,下丘脑的kiss1基因表达水平显著降低,并且用Leptin对leptin缺陷的小鼠处理,可以使kiss1在下丘脑中表达水平恢复到正常水平(Smithetal.,2006)。最近的研究表明,Ⅱ型糖尿病人和糖尿病小鼠的肝脏和血液中kisspeptin1含量都会增加,在肝脏和胰腺对血糖调节的回路中,肝脏kisspeptin1可削弱胰岛素分泌(Songetal.,2014)。
对抚仙金线鲃kisspeptin基因的克隆发现,抚仙金线鲃的生殖关键基因kiss存在2种不同形式的基因序列,且在肠道中的表达量较高,在脑区的垂体和下丘脑中的表达量较高,这些结果为以后开展抚仙金线鲃kisspeptin对生殖和其他生理功能相关的研究奠定了基础。
潘晓赋, 刘淑伟, 李再云, 等. 2009. 抚仙金线鲃人工繁殖与鱼苗培育技术[J]. 动物学研究, 30(4): 463-467.
王伟营, 杨君兴, 陈小勇. 2011. 云南境内南盘江水系鱼类种质资源现状及保护对策[J]. 水生态学杂志, 32(5): 19-29.
杨君兴, 陈银瑞. 1995. 抚仙湖鱼类生物学和资源利用[M]. 昆明: 云南科技出版社.
Akazome Y, Kanda S, Okubo K,etal. 2010. Functional and evolutionary insights into vertebrate kisspeptin systems from studies of fish brain[J]. Journal of Fish Biology, 76(1): 161-182.
Colledge WH. 2009. Transgenic mouse models to study Gpr54/kisspeptin physiology[J]. Peptides, 30(1): 34-41.
de Roux N, Genin E, Carel JC,etal. 2003. Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54[J]. Proceedings of the National Academy of Sciences of the United States of America, 100(19): 10972-10976.
Gottsch ML, Cunningham MJ, Smith JT,etal. 2004. A role for kisspeptins in the regulation of gonadotropin secretion in the mouse[J]. Endocrinology, 145(9): 4073-4077.
Jiang Q, He M, Ko WK,etal. 2014. Kisspeptin induction of somatolactin-α release in goldfish pituitary cells: functional role of cAMP/PKA-, PLC/PKC-, and Ca2+/calmodulin-dependent cascades[J]. American Journal of Physiology-Endocrionlogy and Metabolism, 307(10): E872-884.
Lapatto R, Pallais JC, Zhang D,etal. 2007. Kiss1-/- mice exhibit more variable hypogonadism than Gpr54-/- mice[J]. Endocrinology, 148: 4927-4936.
Lee JH, Miele ME, Hicks DJ,etal. 1996. KiSS-1, a novel human malignant melanoma metastasis-suppressor gene[J]. Journal of the National Cancer Institute, 88(23): 1731-1737.
Lehman MN, Merkley CM, Coolen LM,etal. 2010. Anatomy of the kisspeptin neural network in mammals[J]. Brain Research, 1364(2): 90-102.
Ogawa S, Parhar IS. 2013. Anatomy of the kisspeptin systems in teleosts[J]. General and Comparative Endarinology, 181: 169-174.
Saha A, Pradhan A, Sengupta S,etal. 2016. Molecular characterization of two kiss genes and their expression in rohu (Labeorohita) during annual reproductive cycle[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 191: 135-145.
Servili A, Le Page Y, Leprince J,etal. 2011. Organization of two independent kisspeptin systems derived from evolutionary-ancient kiss genes in the brain of zebrafish[J]. Endocrinology, 152(4): 1527-1540.
Smith JT, Acohido BV, Clifton DK,etal. 2006. KiSS-1 neurones are direct targets for leptin in the ob/ob mouse[J]. Joumal of Neuroendecrinology, 18(4): 298-303.
Song WJ, Mondal P, Wolfe A,etal. 2014. Glucagon regulates hepatic kisspeptin to impair insulin secretion[J]. Cell Metabolism, 19(4): 667-681.
Tolson KP, Garcia C, Yen S,etal. 2014. Impaired kisspeptin signaling decreases metabolism and promotes glucose intolerance and obesity[J]. Journal of Clinical Investigation, 124(7): 3075-3079.
Yang B, Jiang Q, Chan T,etal. 2010. Goldfish kisspeptin: molecular cloning, tissue distribution of transcript expression, and stimulatory effects on prolactin, growth hormone and luteinizing hormone secretion and gene expression via direct actions at the pituitary level[J]. General and Comparative Endocrinology, 165(1): 60-71.
Zhao Y, Wayne NL. 2012. Effects of kisspeptin1 on electrical activity of an extrahypothalamic population of gonadotropin-releasing hormone neurons in medaka (Oryziaslatipes)[J]. PLoS ONE, 7(5): e37909.
Molecular Cloning and Tissue Distribution of Kisspeptin fromSinocyclocheilustingi
LIAO Zongzhen1, SUN Caiyun1, WANG Xiaoai2, YANG Guokun1, PAN Xiaofu2, YANG Junxing2*, LI Wensheng1*
(1. State Key Laboratory of Biocontrol, Institute of Aquatic Economic Animals and Guangdong Province Key Laboratory for Aquatic Economic Animals, Research Institute of Sun Yat-Sen University in Shenzhen, School of Life Sciences,Sun Yat-Sen University, Guangzhou 510275, China; 2. State Key Laboratory of Genetic Resources and Evolution,Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China)
Sinocyclocheilustingiis an endemic species of Fuxian Lake in Yunnan province. Even though its artificial reproduction is available right now, they can’t reproduce in fishponds. Kisspeptin encoded bykiss1 was considered as an important regulator of the hypothalamic-pituitary-gonadal axis and took part in reproduction by controlling the releasing of gonadotropin-releasing hormone, gonadotropin, and etc. In the present research we cloned the cDNA ofkiss1 andkiss2 ofS.tingiwith reverse transcription PCR and rapid amplification of cDNA ends (RACE). The open reading frame ofkiss1 was 351 bp and encoded a polypeptide of 116 amino acid and that ofkiss2 was 369 bp and encoded a 122-amino-acid polypeptide. Reverse transcription PCR analysis showed that the mRNA expression quantity ofkiss1 was the highest in intestine. Likely, the mRNA expression ofkiss2 was the highest in intestine in male and hypothalamus and brain in female. To explore the distribution ofkiss1 andkiss2 in brain, the brain was divided into eight parts for reverse transcription PCR analysis. The result showed that the highest expression ofkiss1 in male was observed in both the spinal cord and the pituitary, which in female was only in the pituitary and followed by the optic tectum. Meanwhile, thekiss2 mRNA got its highest expression in the hypothalamus.
Sinocyclocheilustingi; kisspeptin;kiss1;kiss2; clone; characteristics of tissue distribution
2015-09-08 接受日期:2016-05-11
中山大学高校基本科研业务费项目; 深圳市战略性新兴产业发展专项资金项目(NYSW20140401010064); 云南省应用基础研究面上项目(2012FB183); 中国科学院昆明动物研究所“一三五”重大专项(Y206B51181); 云南省生物多样性保护专项资金项目
廖宗甄(1993—), 硕士研究生, 研究方向:水生生物学, E-mail:237688797@qq.com
*通信作者Corresponding author, E-mail:yangjx@mail.kiz.ac.cn; lsslws@mail.sysu.edu.cn
10.11984/j.issn.1000-7083.20150273
Q959.4;Q78
A
1000-7083(2016)04-0496-07
