玉米穗行数基因的QTL定位与分析
2016-04-11翟立红周兰庭韩鹏腾峰
翟立红++周兰庭+++韩鹏++腾峰


摘要:对玉米中控制穗行数的QTL进行定位和分析,为分子标记辅助选择育种提供理论基础。在一套以综3为遗传背景携带衡白522置换片段的染色体片段置换系群体进行QTL初步定位的基础上,以穗行数明显减少的置换系SIL8为材料,构建置换片段内的F2次级分离群体和跨叠系进行了穗行数基因的QTL定位。在1.02~1.04 bin区段存在控制玉米穗行数的QTL,命名为qKRN1。2年的QTL定位及跨叠系分析结果将qKRN1锁定在分子标记HND9-umc1297之间,遗传距离为2.7cM,该穗行数QTL的鉴定,为进一步精细定位或克隆相应基因奠定了基础。
关键词:玉米;染色体片段置换系;穗行数;数量性状
中图分类号: S513.03文献标志码: A文章编号:1002-1302(2016)02-0069-04
收稿日期:2015-09-07
基金项目:国家自然科学基金(编号:31501320);襄阳市研究与开发计划(编号:[2014]12-33);湖北文理学院博士科研启动基金(编号:31#);湖北省教育厅科学研究计划中青年人才项目(编号:Q20152601)。
作者简介:翟立红(1983—),女,河北邢台人,讲师,主要从事玉米遗传育种研究。E-mail:zlh_0302@126.com。
通信作者:腾峰,博士,助理研究员,主要从事玉米育种研究。E-mail:tobenumberone@yeah.net。玉米产量是玉米育种学家和遗传学家共同关注的性状,穗行数是一个重要的产量组成因子,与产量显著正相关,探明穗行数形成的遗传机理有助于玉米产量性状形成的遗传机理的阐述,为开展分子设计育种提供理论指导。玉米穗行数是一个数量性状,受到多基因的控制。随着分子标记技术的发展和玉米基因组测序结果的出现,在玉米全基因组内检测控制产量相关QTL取得了一定进展。在20世纪80—90年代,Edwards等就使用同工酶和RFLP标记开展玉米数量性状基因的研究[1-2]。随后Veldboom等报道了利用RFLP标记对玉米形态和产量性状进行QTL定位,鉴定了23个控制形态性状、35个控制产量性状的QTL,其中,在1 S(bnl5.62,1.02 bin)、2 S、4 S和4 L上各鉴定了一个穗行数QTL[3]。bnl5.62附近的QTL也被Austin 等所鉴定到,另外他们在其邻近的umc157附近还检测到一个穗粗QTL[4]。杨俊品等以4822×5003 的166 个F2:3 家系作为定位群体,共检测出 59 个分布于10个连锁群的QTL,其中第1、3 连锁群较多;在第一染色体的bnlg1083(1.02 bin)、umc1035(1.06 bin)附近发现了2个穗行数QTL[5],这些QTL也与产量有关[6]。严建兵等分别利用综3×87-1的F2:3家系和RIL群体,发现umc1122~bnlg1558(1.06 bin)为一个产量、行数和行粒数QTL簇,umc1169~bnlg1811(1.04 bin)之间存在一个穗行数QTL,bnlg1811(1.04 bin)~umc1124(1.05 bin)之间存在一个百粒质量QTL[7],这些结果也为Li等在爆裂玉米群体中所检测[8]。汤继华等利用综3×87-1的441个永久F2群体,也在第一染色体的umc1122~bnlg1025(1.06 bin)、umc1774~phi26545(1.10~1.11 bin)区段定位了2个穗行数QTL,bnlg1614~bnlg1083(1.02 bin)检测到一个百粒质量的QTL[9]。Ma等在标记 bnlg2180(1.03 bin)~umc1169(1.04 bin)之间检测到了一个产量和穗行数的QTL[10]。Blanc等使用4个自交系杂交组配得到的6个F2群体及F2:3家系,在6个组合中均在bnlg1627(1.02 bin)~bnlg176(1.02 bin)之间检测到产量的QTL[11]。
白苇等利用玉米自交系综3为受体,衡白522为供体构建的染色体片段置换系群体,进行了玉米产量性状的定位研究,其中在第一条染色体的1.02~1.04 bin (bnlg1083~bnlg1811)之间定位到了穗行数、穗粗和单穗产量等性状,认为该区段所含的基因对玉米产量的形成有重大作用,可能是一个控制产量的基因簇[12]。本研究以白苇等定位到穗行数QTL的染色体置换系SIL8为材料,构建了定位区段内的分离群体和跨叠系进行了进一步的QTL鉴定和分析,为分子标记辅助育种提供重要理论依据。
1材料与方法
1.1材料
SIL8是一个穗行数为8~10行的玉米置换系,选自于本实验室构建的染色体片段置换系群体Z3HBILs,该群体的详细构建过程见王立秋等的文献[13]报道。综3是中国玉米育种中广泛使用的自交系。与综3相比,SIL8的遗传背景非常相似,仅在第一染色体的1.02~1.04 bin(bnlg1083和bnlg1811之间)具有遗传差异,在表现型上,SIL8的穗行数比综 3 减少了6~8行,该置换系作为在穗行数上与受体有显著差异的纯系来进行分离群体的构建和精细定位研究。
1.2群体构建和田间种植
以SIL8和综3杂交,得到区段内F1自交构建第一染色体的1.02~1.04 bin的F2分离群体,于2008年(253个单株)、2009年(593个单株)在河北农业大学(保定)试验田进行田间种植,行长3 m,行距60 cm,株距25 cm,单粒点播,每行13株,单株考察玉米果穗的穗行数。这2个群体主要用于遗传连锁图谱的构建、QTL的定位和QTL区段内跨叠系的构建。
1.3多态性标记的鉴定和开发
选择玉米公共遗传图谱 IBM Neighbors 2005上已公布的、位于bnlg1083~bnlg1811之间得的所有SSR标记,筛选在综3和衡白522间具有多态性的标记。由于公共遗传图谱上可供利用的标记有限,且多态性不足,利用已公布的玉米自交系B73基因组序列开发更多的、新的标记。SSR标记开发的具体方法如下:从公共网站上www.maizesequence.org上下载区段内的B73的基因组序列,利用网站www.gramene.org提供的SSRIT工具寻找序列中的简单重复序列,对所搜寻到的简单重复序列位点,逐个提取简单重复序列位点前后约 200 bp 的序列,软件Primer 5.0用于SSR分子标记的引物设计,选择扩增产物大小150~250 bp的引物,交由上海生工合成。新开发标记的引物以HND标示。
1.4QTL定位
利用在亲本间具有多态性的SSR分子标记鉴定分离群体的基因型,使用软件MAPMAKERNT、Kosambi函数,构建区段内遗传连锁图谱;将群体的基因型和穗行数的表型数据结合,利用软件WINQTLCART2.5,设置成排列测验1 000次,复合区间作图,进行QTL的定位和效应分析。
2结果与分析
2.1多态性标记的筛选与开发
研究利用的置换系SIL8的导入片段在第一染色体的分子标记bnlg1083和bnlg1811之间,将玉米公共图谱IBM Neighbors 2005上在这2个标记之间的所有SSR标记于亲本间筛选多态性。合成的SSR标记有45个,在亲本之间具有多态性的标记有19个,即多态性标记比率为42.20%。随后,利用玉米公共网站www.maizesequence.org上的序列信息,将初步定位区间的序列下载,其物理距离约为10 Mb,含有86个BACs。开发的标记数为119个,新开发的标记中在亲本间有多态性的36个,占总开发标记的30.25%,表明综3和衡白522这2个玉米自交系间的基因组差异较大,多态性标记的开发效率较高。在群体中有较好分离用于群体基因型检测的有12个,占总开发标记的10.08%。条带清晰、有多态性(图1-A)和无多态性(图1-B)的SSR分子标记检测见图1。
2.2遗传连锁图谱的构建
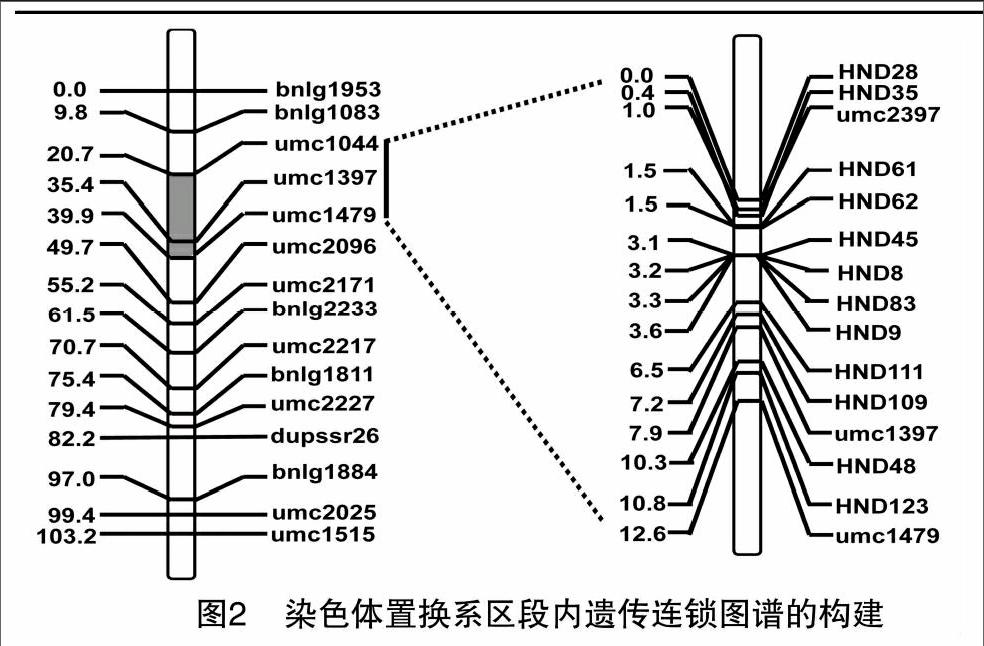
利用SIL8和综3杂交构建的区段(bnlg1083~bnlg1811)内F2次级分离群体,分子标记检测得到的单株基因型进行遗传连锁图谱的构建。2008年,利用保定种植的分离群体(BC4F2)253个单株基因型、15个标记来绘制区段的遗传连锁图谱见图2(左),遗传距离总长度为103.2 cM,2个标记最短间距为2.4 cM,最长间距为14.8 cM,平均间距为7.37 cM,标记分布较均匀。2009年,根据2008年初步定位结果,在缩小的区段内进行新的标记的开发和多态性的筛选,利用分离群体(BC5F2)577个单株基因型、15个标记来构建遗传连锁图谱。从图2(右)可知,遗传距离总长度为12.6 cM,最短间距达到0.1 cM,最长间距仅2.9 cM,平均间距为0.9 cM,标记密度比较高。
2.3穗行数QTL的定位
2008年,在保定种植分离群体材料,得到180个单株的穗行数表型值,结合群体基因型数据,利用WINQTLCART 2.5软件设置为步长2 cM,排列测验1 000次,复合区间作图法,进行了穗行数QTL的初步定位分析。根据定位结果(图3-A),在标记umc1044和umc2096之间有2个比较明显的峰,将目标区段由103.2 cM缩小到29 cM,LOD阈值为3.7,其中
左边峰的LOD值为4.8,右边的比较尖一点的峰的LOD值为5.2,贡献率(R2)达到11%,初步鉴定为主效的穗行数QTL,以加性效应为主。在穗行数QTL初步定位的基础上,开发定位区间内新的分子标记和筛选其在亲本间的多态性并选择在群体中分离较好的标记。2009年,种植较大的分离群体,最终得到577个单株的穗行数表型值,结合15个标记基因型,开展穗行数QTL的精细定位。定位软件WINQTLCART 2.5设置为步长0.5 cM,排列测验1 000次,复合区间作图法。
从图3-B看出,2009年穗行数QTL的定位结果在区间内同样出现明显的峰,与2008年定位结果相比,位置大致相同,定位区间进一步缩小。经排列测验得LOD阈值为2.0,第1个峰几乎与标记HND9所处位置相同,第2个峰在标记 HND109~umc1397之间,遗传距离为0.7 cM,LOD值为4.9,第3个峰处于标记HND123~umc1479之间,遗传距离为1.8 cM,LOD值为4.7,贡献率(R2)为7%,以加性效应为主。
与此同时,利用2008年分离群体中的交换单株,选择在定位区间内杂合的单株自交,于2009年标记筛选出了11个跨叠系的纯系材料(图4),并对纯系材料进行了穗行数的考察。构建的11个跨叠系结合各系穗行数表型值,可以看出,具有HND9~umc1397标记之间片段的纯系穗行数为8行或10行,不具有该片段的纯系穗行数为14行,该片段与2009年定位结果中的前2个峰所处位置一致。
3讨论
玉米产量性状为多基因控制的数量性状,基因之间存在着复杂的相互作用,并且受环境的影响较大。穗行数作为产量构成因子之一,相对于复杂的数量性状而言,穗行数表型数据的获得相对容易且受环境影响不大,是进行数量性状定位研究的理想模式性状之一。本研究在一套染色体片段置换系初步定位的基础上,选取穗行数显著减少的置换系SIL8为材料,构建定位区段内的次级分离群体和跨叠系进行穗行数基因的QTL定位与分析,将控制穗行数的qKRN1定位在第1染色体HND9~umc1397之间,2个标记之间的遗传距离为2.7 cM,在此基础上,利用玉米基因组序列信息对该区段的候选基因进行了初步预测与分析。本研究定位结果与前人研究结果比较发现,qKRN1与前人利用不同的群体定位到控制穗行数[5,7,10]、穗粗[14]、行粒数[14-15]、百粒质量[9]、穗长[15]、穗粒数[15]、单株籽粒质量[6]、产量[10-11,15]等QTL所在的区间相近,说明此区段可能是一个控制玉米产量及其构成因子的基因簇。然而,利用不同的群体进行产量及其相关性状QTL定位的结果不尽相同[16-20]。田宝华等对玉米产量相关性状的QTL进行整合分析,结果发现1号染色体上QTL最多,有174个,其中控制穗行数的有15个[21]。江培顺等收集并整合了1994—2012年文献发表的玉米穗行数、行粒数和粒质量QTL584个,确定了22个穗行数Meta-QTL,得出1.04 bin的粒质量QTL与水稻的GS3基因高度同源,并预测了候选基因[22]。张焕欣等对玉米穗行数进行了全基因组的关联分析,鉴定了9个与穗行数显著关联的SNP,其中1个SNP位于1.02 bin,并将1个含有F-box结构域的生长素受体蛋白为候选基因[23]。fea2编码一个富亮氨酸的受体蛋白,预测是通过控制花序分生组织来控制玉米穗行数[24]。Wang等对控制玉米68个性状的1 201个QTL进行了整合,发现了玉米QTL成簇分布的普遍性[25],进一步说明了玉米1号染色体1.02~1.04 bin可能存在着控制玉米产量及其构成因子的重要基因,为开展qKRN1的精细定位和克隆提供了重要的理论支撑。
在利用SIL8材料的同时,对该材料的遗传背景进行了检测,发现全基因组内的背景回复率为85.98%。本研究中定位到的穗行数QTL的贡献率不高,LOD值低,可能的原因:(1)该区段内控制穗行数的QTL可能不止1个且存在互作;(2)背景残留片段可能与区段内QTL存在互作。因此,为进一步精细定位和克隆qKRN1,需要将SIL8继续与综3回交并结合分子标记辅助选择,在减少背景干扰的基础上对HND9-umc1397区段的穗行数基因进行深入分析和研究。
参考文献:
[1]Edwards M D,Helentjaris T,Wright S,et al. Molecular-marker-facilitated investigations of quantitative trait loci in maize:4. Analysis based on genome saturation with isozyme and restriction fragment length polymorphism markers[J]. Theoretical and Applied Genetics,1992,83(6/7):765-774.
[2]Edwards M D,Stuber C W,Wendel J F. Molecular-marker-facilitated investigations of quantitative-trait loci in maize. Ⅰ. Numbers,genomic distribution and types of gene action[J]. Genetics,1987,116(1):113-125.
[3]Veldboom L R,Lee M. Molecular-marker-facilitated studies of morphological traits in maize:Ⅱ. Determination of QTLs for grain yield and yield components[J]. Theoretical and Applied Genetics,1994,89(4):451-458.
[4]Austin D F,lee M,Veldboom L R,et al. Genetic mapping in maize with hybrid progeny across testers and generations:grain yield and grain moisture[J]. Crop Science,2000,40:30-39.
[5]杨俊品,荣廷昭,向道权,等. 玉米数量性状基因定位[J]. 作物学报,2005,31(2):188-196.
[6]向道权,曹海河,曹永国,等. 玉米SSR遗传图谱的构建及产量性状基因定位[J]. 遗传学报,2001,28(8):778-784.
[7]严建兵,汤华,黄益勤,等. 玉米产量及构成因子主效和上位性QTL的全基因组扫描分析[J]. 科学通报,2006,51(12):1413-1421.
[8]Li Y L,Niu S Z,Dong Y B,et al. Identification of trait-improving quantitative trait loci for grain yield components from a dent corn inbred line in an advanced backcross BC2F2 population and comparison with its F2:3 population in popcorn[J]. Theoretical and Applied Genetics,2007,115(1):129-140.
[9]汤继华,严建兵,马西青,等. 利用“永久F2”群体剖析玉米产量及其相关性状的遗传机制[J]. 作物学报,2007,33(8):1299-1303.
[10]Ma X Q,Tang J H,Teng W T,et al. Epistatic interaction is an important genetic basis of grain yield and its components in maize[J]. Molecular Breeding,2007,20(1):41-51.
[11]Blanc G,Charcosset A,Mangin B,et al. Connected populations for detecting quantitative trait loci and testing for epistasis:an application in maize[J]. Theoretical and Applied Genetics,2006,113(2):206-224.
[12]Bai W,Zhang H,Zhang Z,et al. The evidence for non-additive effect as the main genetic component of plant height and ear height in maize using introgression line populations[J]. Plant Breed,2010,129:376-384.
[13]王立秋,赵永锋,薛亚东,等. 玉米衔接式单片段导入系群体的构建和评价[J]. 作物学报,2007,33(4):663-668.
[14]李卫华,王洪秋,袁亮,等. 利用单片段代换系群体定位玉米穗部性状的QTL[J]. 河南农业大学学报,2013,47(2):143-146,181.
[15]Lu M,Xie C X,Li X H,et al. Mapping of quantitative trait loci for kernel row number in maize across seven environments[J]. Molecular Breeding,2011,28(2):143-152.
[16]焦付超,李永祥,陈林,等. 特异玉米种质四路糯的穗行数遗传解析[J]. 中国农业科学,2014(7):1256-1264.
[17]贾波,管飞翔,谢庆春,等. 玉米产量性状QTL定位分析[J]. 西南农业学报,2013,26(1):22-25.
[18]彭勃,王阳,李永祥,等. 不同水分环境下玉米产量构成因子及籽粒相关性状的QTL分析[J]. 作物学报,2010,36(11):1832-1842.
[19]谭巍巍,王阳,李永祥,等. 不同环境下多个玉米穗部性状的QTL分析[J]. 中国农业科学,2011,44(2):233-244.
[20]谭巍巍,李永祥,王阳,等. 在干旱和正常水分条件下玉米穗部性状QTL分析[J]. 作物学报,2011,37(2):235-248.
[21]田宝华,王建华. 玉米产量相关性状QTL的整合及一致性QTL发掘[J]. 分子植物育种,2013(6):752-761.
[22]江培顺,张焕欣,吕香玲,等. 玉米产量相关性状Meta-QTL及候选基因分析[J]. 作物学报,2013,39(6):969-978.
[23]张焕欣,翁建峰,张晓聪,等. 玉米穗行数全基因组关联分析[J]. 作物学报,2014,40(1):1-6.
[24]Bommert P,Nagasawa N S,Jackson D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus[J]. Nature Genetics,2013,45(3):334-337.
[25]Wang Y,Yao J,Zhang Z F,et al. The comparative analysis based on maize integrated QTL map and meta-analysis of plant height QTLs[J]. Chinese Science Bulletin,2006,51(18):2219-2230.
