金属活动性顺序在解题中的应用
2016-04-07罗明奎敦玉
罗明奎++敦玉

小红博学多才,学习时善于思考,在同学之中享有“小博士”之美称。在学习了金属和金属材料后,针对同学们对金属活动性顺序表存在的疑惑,老师交给她一项任务:对有关金属活动性顺序的内容进行总结,以帮助同学们理解和掌握。小红经过一番努力,上交了一份满意的学习笔记,老师对其进行了整理,让我们一起来学习吧!
一、掌握顺序
金属活动性顺序是历年中考命题的热点,题目的难易程度不等,题型各异。因此,对金属活动性顺序表的正确理解和灵活运用是同学们学习的重要任务。全面认识金属活动性顺序的含义,要从以下几个方面对其进行理解:
1.掌握一个规律
金属活动性顺序揭示的一个规律:在金属活动性顺序中,金属的位置越靠前,它的活动性就越强。
2.记住两种应用
(1)判断金属与酸的反应。排在氢前面的金属能置换出酸中的氢,而排在氢后面的金属不能置换出酸中的氢。
(2)判断金属与盐的反应。排在前面的金属一般能把排在其后的金属从它的盐溶液里置换出来,但K、Ca、Na太活泼,易与水反应,不与酸、盐发生置换反应。
3.注意三个要点
(1)适用范围:金属活动性顺序仅适用于在水溶液中的反应,超出此范围则不一定适用。
(2)判断金属与酸反应时:①酸一般是指稀硫酸、稀盐酸等非氧化性强酸,不包括浓硫酸和硝酸等强氧化性酸;②铁与酸(如稀硫酸、稀盐酸)反应,生成的是+2价的亚铁盐。
(3)判断金属与盐反应时:①盐必须是可溶的,因为金属与盐的反应必须在溶液中进行; ②铁与盐反应,生成的是+2价的亚铁盐。
二、熟悉题型
1.金属与酸的反应
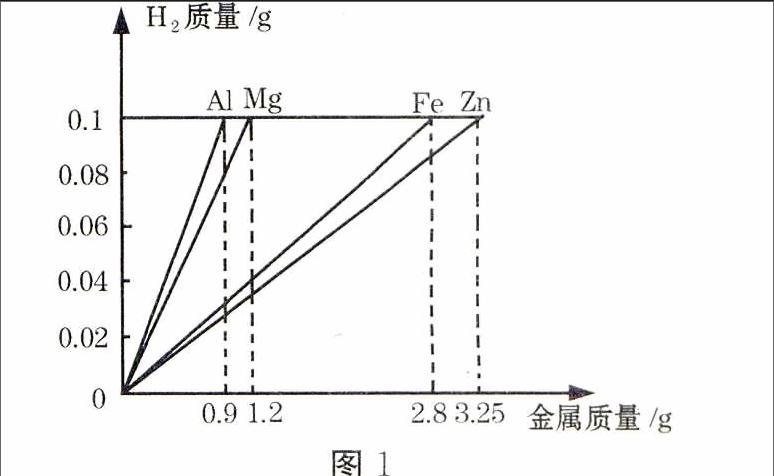
例1(2015·山东济宁)某实验小组在探究金属的化学性质时,得到金属与酸反应制取氢气的质量关系如图1所示。请根据图像信息判断,下列说法正确的是()
A.四种金属与酸反应的速率:Al>Mg>Fe>Zn
B.四种金属的活动性顺序:Mg>Al>Zn>Fe
C.同质量的四种金属与足量酸反应得到氢气的质量:Al>Mg>Fe>Zn
D.Al、Mg、Fe、Zn四种金属与酸反应得到氢气的质量比:127∶124∶156∶165
解析:金属的活动性越强,与酸反应的速率越快,四种金属与酸反应的速率应为Mg>Al>Zn>Fe,但根据图像信息则无法判断,故A、B两项错误;等质量的、相同价态的金属与足量的酸反应,金属的相对原子质量越小,生成的氢气质量越大,故C项正确;从图像看,四种金属与酸反应生成氢气的质量相等,故D项错误。
答案:C
点评:等质量的金属与足量的酸完全反应,产生氢气多少的顺序与金属的相对原子质量和化合价有关 (见图2);足量的Al、Mg、Fe、Zn与等量酸反应,产生氢气质量相等(见图3)。解答图像题的关键是将图像中完全反应的“点”找准,然后与题目中的数据结合解答。
2.金属与盐的反应
例2(2015·辽宁丹东)在氯化亚铁和氯化镁的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液。下列说法正确的是()
A.滤渣中一定含有铁,一定没有镁、锌
B.得到的滤液一定是无色的
C.滤渣中一定含有铁和锌,一定没有镁
D.滤液中一定含有锌离子和镁离子
解析:在金属活动性顺序表中,排在前面的金属能把排在其后的金属从它的盐溶液中置换出来。Fe、Mg、Zn三种金属的活动性顺序是Mg>Zn>Fe,在FeCl2和MgCl2的混合溶液中加入一定量的锌粉,Zn能置换出盐溶液中的Fe,而不能置换出盐溶液中的Mg,充分反应后过滤,滤渣中一定有置换出来的Fe,可能有剩余的Zn,一定没有Mg;滤液中一定有生成的ZnCl2和没有参加反应的MgCl2,可能有剩余的FeCl2,因而滤液中一定含有的金属离子是Zn2+和Mg2+,可能含有的金属离子是Fe2+。故正确答案为D项。
答案:D
点评:做此类试题我们首先要明白反应条件:盐是溶液,“前置后”。越活泼的金属,越先反应;越不活泼的金属,越先被置换。其次,认真分析题目,找出题目中的关键词,如例题中的“一定量”,排除所设置的雾点。然后,根据金属活动性顺序判断所发生的置换反应。最后,依次写出题目中所发生反应的化学方程式,解答试题。
3.探究金属的活动性强弱
例3(2015·山西)探究Mg、Fe、Cu三种金属的活动性顺序,下列试剂的选择方案不可行的是()
A.Mg、Cu、FeSO4溶液
B.Mg、Fe、Cu、稀硫酸
C.Fe、Cu、MgSO4溶液
D.Fe、MgSO4溶液、CuSO4溶液
解析:A项,Mg可以置换出FeSO4溶液中的Fe,证明Mg的金属活动性比Fe强,Cu和FeSO4溶液不反应,证明Fe的金属活动性比Cu强,因此,可以证明三种金属的活动性顺序,该方案可行;B项,Mg与稀硫酸反应置换出H2,说明活动性Mg>H,Fe与稀硫酸反应置换出H2,说明活动性Fe>H,根据Mg与稀硫酸的反应比Fe与稀硫酸的反应更剧烈,可得活动性Mg>Fe,Cu与稀硫酸不反应,说明活动性H>Cu,由此可得出三种金属的活动性顺序,该方案可行;C项,Fe、Cu与MgSO4溶液均不反应,说明活动性Mg>Fe、Mg>Cu,但无法确定Fe和Cu的活动性强弱,该方案不可行;D项,Fe与MgSO4溶液不反应,说明活动性Mg>Fe,Fe与CuSO4溶液反应置换出Cu,说明活动性Fe>Cu,由此可得出三种金属的活动性顺序,该方案可行。
答案:C
点评:探究金属的活动性顺序有两种方法:方法一,金属与酸溶液,能发生反应的金属活泼性在H之前,且反应越剧烈,金属越活泼,不能发生反应的金属活泼性在H之后;方法二,金属与其他金属盐溶液反应,能发生反应的金属比盐溶液中的金属活泼性强,不能发生反应的金属则比盐溶液中的金属活泼性弱。
总之,金属活动性顺序是人们通过金属与酸、盐溶液等反应的实验结果所总结出的一般规律,同学们只有充分认识、全面理解,并在解题的过程中实践运用,才能真正掌握这一重要规律。
