基于毛细管电泳的鹿鞭DNA指纹鉴定方法
2016-04-06苑广信李梓僮张丽华李洪宇李明成北华大学药学院吉林吉林303北华大学生命科学中心吉林吉林303北华大学医学检验学院吉林吉林303
苑广信, 李梓僮, 张丽华, 盛 瑜, 李洪宇, 李 坦, 孙 新, 李明成(.北华大学药学院,吉林吉林303;.北华大学生命科学中心,吉林吉林303;3.北华大学医学检验学院,吉林吉林303)
基于毛细管电泳的鹿鞭DNA指纹鉴定方法
苑广信1, 李梓僮1, 张丽华1, 盛 瑜1, 李洪宇1, 李 坦2, 孙 新2, 李明成3*
(1.北华大学药学院,吉林吉林132013;2.北华大学生命科学中心,吉林吉林132013;3.北华大学医学检验学院,吉林吉林132013)
摘要:目的 研究基于毛细管电泳的鹿鞭DNA指纹鉴定方法。方法 盐析法提取梅花鹿鞭、马鹿鞭、驯鹿鞭和赤鹿鞭的线粒体DNA,对序列为GAGCGTCGAA的引物进行IAPD扩增,毛细管电泳法分析其产物,再对所得指纹图谱的相似度进行分析。结果 梅花鹿鞭指纹图谱中有9个共有峰,马鹿鞭指纹图谱中有21个共有峰,与驯鹿鞭和赤鹿鞭有明显差异。而且,其相似度均小于0.7。结论 该方法客观、准确、方便,可有效区分梅花鹿鞭、马鹿鞭及其伪品(驯鹿鞭、赤鹿鞭)。
关键词:鹿鞭;DNA指纹;毛细管电泳
KEY W 0RDS:Penis et Testis Cervi;DNA fingerprints;capi11ary e1ectrophoresis
鹿鞭是我国的传统名贵中药材,为鹿科动物梅花鹿(Gervus nippon Temminck)和马鹿(Cervus elaphus Linnaeus)雄性的外生殖器[1]。中医认为,鹿鞭可以补肾精、壮肾阳,对于治疗腰膝冷痛、阳痿早泄有显著疗效[2]。近年来,由于市场需求量大、货紧价高等原因,各种伪品屡见不鲜,其中驯鹿(Rangifer tarandus)和赤鹿(Cervus canadensis)由于数量多、价格便宜,常被用于冒充正品鹿鞭出售。但鹿鞭成分复杂,而且市售品大多经过加工、炮制,导致性状和成分均有所改变,故传统方法很难进行准确鉴别。
DNA指纹法利用DNA在分子水平上,对物种进行鉴别,具有高度的种质特异性,比传统鉴定方法更科学和准确[3-4]。其中,随机扩增DNA多态性(IAPD)技术具有扩增结果多态性丰富、DNA用量少、无需专门设计引物等优点,近年来在物种鉴定方面得到了广泛应用[5]。另外,毛细管电泳具有快速、高效、样品用量少、抗污染等优点,在蛋白质、核酸、DNA、氨基酸等生物样品分析中具有独特优势[6-7]。本实验将毛细管电泳和IAPD技术相结合,建立鹿鞭IAPD指纹鉴定方法,并采用相似度分析软件对结果进行判定,旨在为鹿鞭的鉴定提供一种科学、准确、客观的新方法。
1 仪器与试药
毛细管电泳仪(美国Agi1ent公司);9700PCI扩增仪(美国ABI公司);ST16I台式低温离心机(美国Thermo公司);未涂层石英毛细管(75 μm×50 cm,40 cm,河北永年锐沣色谱器件有限公司)。
梅花鹿鞭1号、马鹿鞭1号购自吉林市龙潭山鹿业有限责任公司;梅花鹿鞭2号、马鹿鞭2号购自蛟河市第一鹿场;梅花鹿鞭3号、马鹿鞭3号购自吉林市药材市场;驯鹿鞭1号、赤鹿鞭1号由吉林市食品药品检验所提供;驯鹿鞭2号、赤鹿鞭2号由四平市食品药品检验所提供。
DNA聚合酶、蛋白酶K、裂解液(含10 mmo1/L Tris-HC1[pH=7.6]、10 mmo1/L Na2EDTA、50 mmo1/L NaC1)、2×Taq PCI Master Mix购自北京天根生化科技有限公司;DL-1000 DNA marker购自日本TaKaIa公司;四丁基磷酸铵(TBAP)购自美国Sigma公司;羟丙甲基纤维素(HPMC)和随机引物购自上海生工生物有限公司。甲醇为色谱纯;水为自制双蒸水;其他试剂均为分析纯。
2 实验方法
2.1 鹿鞭线粒体DNA提取 取鹿鞭样品适量,洗净、烘干、剪碎,于研钵中研成粉末,4℃下保存待用。盐析法[8]提取鹿鞭线粒体DNA,取粉末0.1 g,置于离心管中,加裂解液0.5 mL、10% SDS 30 μL和蛋白酶K 15 μL,55℃水浴恒温震荡12 h,加饱和醋酸钠溶液500 μL,继续震荡10 min,离心10 min(12 000 r/min),取上清液,加入等体积异丙醇,-20℃下静置3 h,离心10 min(12 000 r/min),弃去上清液。沉淀加70%乙醇洗涤,离心10 min(12 000 r/min),弃去上清液,挥干乙醇,加灭菌蒸馏水100 μL溶解,即得DNA样品溶液,-20℃下保存待用。
2.2 鹿鞭线粒体DNA琼脂糖凝胶电泳 取DNA样品溶液,按6∶1的比例加入6×1oading buffer,混匀,于0.8%琼脂糖凝胶板(含0.5 μg/mL EB)上点样,进行电泳。电压60 V,电泳时间1 h,记录紫外检测结果。
2.3扩增引物的筛选 用合成的30条10-mer引物,分别对提取的鹿鞭线粒体DNA进行扩增,从中筛选出多态性丰富、扩增结果稳定的引物,进行下一步研究。
2.4 IAPD扩增 PCI反应体系总体积为25 μL,含2×Taq PCI Master Mix 12.5 μL、12.5 μmo1/L引物1 μL,模板DNA溶液2 μL和无菌蒸馏水9.5 μL。
PCI循环参数为预变性5 min(94℃),变性80 s(94℃),退火1 min(36℃),延伸2 min (72℃),40个循环后再延伸10 min(72℃)。首循环变性3 min(95℃),PCI产物在4℃下保存待用。
2.5 毛细管电泳分析 参考文献[9],并进行优化,缓冲液为0.8% HPMC-2 mmo1/L EDTA-15 mmo1/L TBAP-20 mmo1/L磷酸盐缓冲液,Tris调节pH为7.3;分离电压-8 kV;进样电压-10 kV;进样时间15 s;检测波长260 nm,记录电泳图谱。
新毛细管依次用甲醇、蒸馏水、1.0 mo1/L盐酸、1.0 mo1/L NaOH溶液各冲洗15 min,0.1 mo1/L NaOH溶液冲洗30 min,再用蒸馏水和缓冲液各冲洗10 min,备用。每次进样前,依次用0.1 mo1/L NaOH溶液、蒸馏水和缓冲液各冲洗2 min。2.6 数据分析 将所得的电泳图谱导入《中药色谱指纹图谱相似度评价系统(2004A)》软件,进行相似度分析和鉴定。
3 实验结果
3.1 线粒体DNA琼脂糖凝胶电泳图谱 由图1可知,鹿鞭线粒体DNA条带清晰完整,无明显弥散和降解,相对分子量约为21 000 bp,表明采用“2.1”项下方法,可从鹿鞭干品中获得完整、高纯度的线粒体DNA,这为IAPD扩增的稳定提供了一级结构基础。
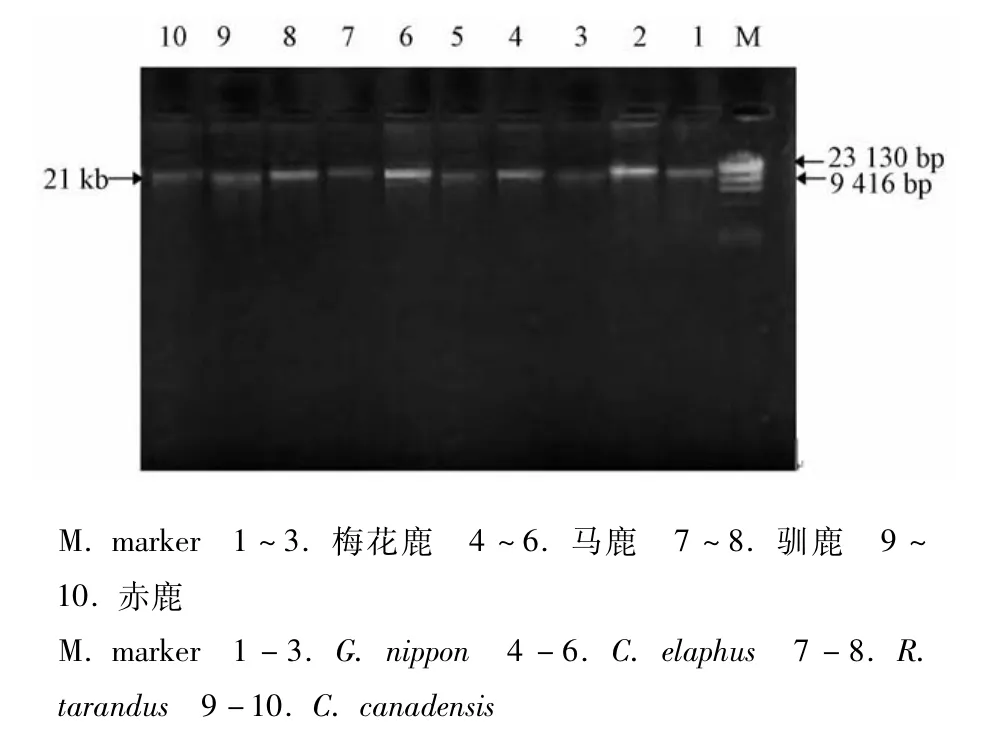
图1 鹿鞭线粒体DNA琼脂糖凝胶电泳图谱Fig.1 M itochondrial DNA agarose gel electropherograms of Penis et Testis Cervi
3.2 扩增引物的筛选 通过逐步筛选,发现序列为GAGCGTCGAA的引物扩增结果重复性好、多态性丰富、特异性强,故选择该引物用于IAPD扩增。
3.3 IAPD扩增条件的优化 退火温度、模板DNA用量和引物用量是影响IAPD扩增的主要因素。
3.3.1 退火温度 在33~38℃下,随着退火温度的升高,IAPD反应的特异性增强,但温度过高则会影响DNA链的聚合。实验结果显示,退火温度36℃时,扩增效果最好。
3.3.2 模板DNA用量 在0.3~0.8 μg范围内,考察了模板DNA用量对扩增结果的影响。结果显示,模板DNA用量为0.5 μg时,扩增效果最好。3.3.3 引物用量 在0.5~2.0 μg范围内,考察了引物用量与扩增结果的关系,发现引物用量越大,IAPD反应越完全,但过大则会产生引物二聚体。结果显示,当引物用量为1 μg时,扩增效率最高,而且无引物二聚体产生。
3.4 方法学验证
3.4.1 精密度试验 取DL-1000 DNA marker适量,制成90 μg/mL溶液,在“2.5”项条件下连续测定6次。结果,各DNA片段电泳峰面积和迁移时间的ISD分别为2.9~5.6%和1.1~1.9%,表明仪器精密度良好。
3.4.2 重复性试验 取梅花鹿鞭1号样品适量,分成5份,分别按“2.1”和“2.4”项下方法提取DNA和IAPD扩增,然后在“2.5”项条件下测定。结果,各主要扩增片段电泳峰面积和迁移时间的ISD分别为2.7~5.9%和1.3~1.9%,表明该方法重复性良好。
3.5 基于毛细管电泳的鹿鞭IAPD指纹图谱的构建 取梅花鹿鞭1~3号和马鹿鞭1~3号样品适量,分别按“2.1”和“2.4”项下方法操作,然后在“2.5”项条件下测定,记录电泳图谱,并将数据导入《中药色谱指纹图谱相似度评价系统(2004A)》进行分析。结果,梅花鹿鞭指纹图谱标定了9个共有峰,相对保留时间的ISD<0.45%,相似度在0.952~0.983之间;马鹿鞭指纹图谱标定了21个共有峰,相对保留时间的ISD<0.78%,相似度在0.945~0.969之间。具体见图2。
3.6 鹿鞭样品的鉴定 取驯鹿鞭和赤鹿鞭样品适量,分别按“2.1”和“2.4”项下方法提取DNA 和IAPD扩增,然后在“2.5”项条件下测定。将所得的指纹图谱与梅花鹿鞭、马鹿鞭进行对比,计算相似度,结果见表1。由表可知,梅花鹿鞭、马鹿鞭、驯鹿鞭和赤鹿鞭指纹图谱具有明显差异,相似度均小于0.7,说明该方法可用于梅花鹿鞭、马鹿鞭及其伪品(驯鹿鞭和赤鹿鞭)的鉴定。

图2 4种鹿鞭的电泳图谱Fig.2 Electrophoretograms of four kinds of Penis et Testis Cervi

表1 4种鹿鞭指纹图谱的相似度Tab.1 Sim ilarities of the fingerprints of four kinds of Penis et Testis Cervi
4 讨论
随机扩增DNA多态性(IAPD)分析技术与其它分子标记技术相比,具有无需专门设计引物、多态性丰富、检出率高、技术简便、快速、易于程序化、样品量少等优点,因此被广泛用于物种的鉴定和遗传学研究[10-11]。但由于缺乏合适的检测技术和鉴定方法,导致相关研究成果的应用性不强。
毛细管电泳与IAPD技术联用时,可发挥后者的优势并有效弥补其缺点:(1)毛细管电泳分辨率极高(可分离相差1 bp的DNA片段),两者联用可体现IAPD扩增产物的多态性,获得多态性丰富的DNA指纹图谱;(2)毛细管电泳灵敏度高,两者联用可检测到IAPD扩增产物中含有量较低的片段,获得信息量更大、更完整的DNA指纹图谱;(3)毛细管电泳分析速度快,可明显缩短IAPD扩增产物的分析时间,更适合大批量样品的分析;(4)毛细管电泳分离IAPD扩增产物的同时,还可测定各扩增片段的浓度和分子量,获得更丰富的信息,有利于建立更全面的指纹图谱;(5)毛细管电泳可获得数据形式的分析结果,然后导入软件进行相似度分析。
本实验建立了基于毛细管电泳的鹿鞭DNA指纹鉴别方法,实验结果表明,该方法准确、可靠、重复性好。采用《中药色谱指纹图谱相似度评价系统》分析时发现,梅花鹿鞭、马鹿鞭、驯鹿鞭和赤鹿鞭指纹图谱的相似度具有明显差异,说明该方法可有效区分梅花鹿鞭、马鹿鞭及其伪品(驯鹿鞭和赤鹿鞭),为该药材的鉴定提供了一种客观、准确、方便的手段。
参考文献:
[1] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:第1册[S].1995:25.
[2] 代婷婷,高晓晨,吴海燕,等.鞭类药材的化学成分和生物活性研究进展[J].中国现代中药,2014,16(12):1039-1042.
[3] 刘桐辉,王 锦,李明成,等.中药材龟甲细胞色素b基因特异性鉴定研究[J].中国药学杂志,2012,47(3):182-185.
[4] 谭 莹,张丽华,李明成,等.中药材川贝母DNA指纹鉴定研究[J].中国药学杂志,2011,46(1):14-16.
[5] 纪其雄,彭 昕,吴晓菁,等.三叶青相关序列扩增多态性-聚合酶链式反应体系的建立与优化[J].中成药,2015,37(3):562-566.
[6] 方艳夕,朱金坤,时维静,等.白头翁中糖类组分的毛细管电泳-安培检测研究[J].中成药,2013,35(7):1504-1508.
[7] Zhang S,Jiang C,Jia L.Tetrabuty1ammonium phosphate-assisted separation ofmu1tip1ex po1ymerase chain reaction products in non-ge1 sieving capi11ary e1ectrophoresis[J].Anal Biochem,2011,408(2):284-288.
[8] 孙景昱,张丽华,傅桂莲,等.聚合酶链式反应偶联单链构象多态性分析(PCI-SSCP)技术用于鹿鞭线粒体DNA指纹的研究[J].中国药学杂志,2014,49(9):721-725.
[9] 孙绩岩,苑广信,李洪宇,等.鹿茸毛细管电泳DNA指纹图谱研究[J].中国药学杂志,2014,49(15):1300-1305.
[10] Gao X,Zhao JF,He W P,et al.Ana1ysis on IAPD fingerprints and genetic re1ationship of Astragalus Hybrid[J].Seed,2011,30(1):27-30.
[11] Zhang D L,Qian M,ZengW,etal.Estab1ishmentand optimization of IAPD reaction system of Cordyceps Sinensis[J].Chin Agri Sci Bull,2011,27(3):170-173.
DNA fingerprint identification of Penis et Testis Cervi based on capillary electrophoresis
YUAN Guang-xin1, LIZi-tong1, ZHANG Li-hua1, SHENG Yu1, LIHong-yu1, LI Tan2, SUN Xin2, LIMing-cheng3*
(I.College of Pharmacy,Beihua University,Jilin I32OI3,China;2.Life Scientific Research Center,Beihua University,Jilin I32OI3,China;3.Medical Inspection Institute,Beihua University,Jilin I32OI3,China)
ABSTRACT:AIM To study the DNA fingerprint identification of Penis et Testis Cervi based on capi11ary e1ectro-book=621,ebook=155phoresis.METH 0 DS Themitochondria1DNAs of Penis et Testis Cervi of Cervus nippon Temminck,Cervus elaphus Linnaeus,Rangifer tarandus and Cervus canadensis were extracted by sa1ting-out method.The primer (GAGCGTCGAA)was used for IAPD amp1ification,whose products were ana1yzed by capi11ary e1ectrophoresis. Then the simi1arities of obtained fingerprintswere ana1yzed.RESULTS Therewere nine and twenty-one common peaks in the fingerprints of Penis et Testis Cervi of C.nippon and C.elaphus,respective1y,having obvious difference from those of R.tarandus and C.canadensis.In addition,their simi1aritieswere 1ess than 0.7.C0NCLUSI0 N Thismethod is objective,accurate and simp1e,which can effective1y distinguish C.nippon and C.elaphus from their counterfeits(R.tarandus and C.canadensis).
*通信作者:李明成(1964—),男,博士,教授,从事中药DNA指纹图谱研究。Te1:(0432)64608281,E-mai1:1imingcheng1964@ 163.com
作者简介:苑广信(1981—),男,博士,副教授,从事中药质量控制技术研究。Te1:(0432)64608281,E-mai1:yuanguangxin2007@ 163.com
基金项目:吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2012]143、[2014]212号);吉林省战略性新兴产业和高新技术产业发展专项资助(2015Y077,2013G030,2013G019)
收稿日期:2015-08-03
doi:10.3969/j.issn.1001-1528.2016.03.030
中图分类号:I282.5
文献标志码:A
文章编号:1001-1528(2016)03-0620-05
