热分析技术和HPLC法研究荷叶炒炭工艺
2016-04-06马俊楠孟祥龙薛非非王明芳张朔生山西中医学院山西太原030619
马俊楠, 孟祥龙, 薛非非, 张 欣, 李 坤, 王明芳, 张朔生(山西中医学院,山西太原030619)
热分析技术和HPLC法研究荷叶炒炭工艺
马俊楠, 孟祥龙, 薛非非, 张 欣, 李 坤, 王明芳, 张朔生*
(山西中医学院,山西太原030619)
摘要:目的 采用热分析技术和HPLC法,研究荷叶的炒炭工艺。方法 应用热重-微商热重(TG-DTG)技术,探讨最佳炮制温度。基于热分析数据,采用HPLC法对不同炒炭工艺下荷叶中槲皮素的含有量进行测定。结果 最佳条件为荷叶10 g,投料温度200℃,炮制温度(280±10)℃,翻炒8 min,槲皮素含有量2.568 mg/g。结论 热分析技术和HPLC法可应用于荷叶炒炭工艺。
关键词:荷叶;炒炭;槲皮素;热分析;HPLC
KEY W 0RDS:1otus 1eaves;carbonizing by stir-frying;quercetin;therma1ana1ysis;HPLC
热分析技术[1]是在程序温度(等速升温、降温、恒温)控制下,测量温度变化时物质物理变化的一类分析技术,主要包括热重法(TG)、微商热重法(DTG)、差热分析法(DTA)、热机械分析法(TMA)、动态热机械分析法(DMA)等,被广泛应用于建筑、化工、能源等各个领域,展现出良好的前景。近年来,学者将热分析技术应用到中医药研究领域中,在中药鉴定[2]、种类差异性[3]、药效评价[4]以及中药炮制[5]等各个方面都取得了较大的成效。本实验将该技术引入荷叶的炒炭工艺研究中,对相关过程进行模拟,探讨其炮制原理。
荷叶为睡莲科植物莲Nelumbo nucifera Gaertn.的干燥叶,具有清暑化湿、升发清阳、凉血止血功效,主治暑热烦渴、暑湿泄泻、脾虚泄泻、血热吐衄、便血崩漏[6]。荷叶炭为荷叶的加工炮制品,使用历史悠久,始载于唐代《外台秘要》中的“炙”,清代《得配本草》中明确指出,荷叶“活血生用,止血炒焦用”[7]。目前,各地对荷叶炭的炮制方法仍不统一,有炒炭和煅炭两种,其炮制工艺也不规范,《中国药典》、《全国中药炮制规范》及各省市中药炮制规范均未对荷叶炭的炮制时间和温度作出明确规定,成品质量均凭经验掌握,缺乏客观的工艺参数,导致各地炮制品质量相差很大。因此,应通过系统研究,使荷叶饮片炮制工艺规范化、质量标准科学化。
1 仪器与材料
1.1 试药 荷叶购自北京同仁堂大药房,经张朔生教授鉴定为正品。槲皮苷(批号111538-200403)、槲皮素(批号100081-201408)、金丝桃苷(批号11521-200303)对照品(中国药品生物制品检定所);异槲皮苷对照品(批号MUST-13072505,中国科学院成都生物研究所)。
1.2 试剂 AB-8大孔树脂。甲醇为色谱纯(天津市科密欧化学试剂有限公司);纯净水(杭州娃哈哈集团有限公司);其他试剂均为分析纯。
1.3 仪器 NETZSCH STA-409C多气氛热重-差热-热磁联用仪(德国Netzsch公司);IE-52AA旋转蒸发仪(上海亚荣生化仪器厂);AI 223CN分析天平(美国奥豪斯公司);Agi1ent 1260高效液相色谱仪(美国Agi1ent公司);电子分析天平(瑞士梅特勒-托利多公司);红外测温仪(深圳市欧普士电子技术有限公司)。
2 方法
2.1 热分析实验方法
2.1.1 荷叶样品制备 称取荷叶药材50 g,粉碎,过80目筛,备用。
2.1.2 荷叶浸出物样品制备[8]参照2010版《中国药典》,精密称取“2.1.1”项下荷叶粉末3 g,置于100 mL锥形瓶中,精密加入70%乙醇50 mL,密塞,称定重量,静置1 h,回流1 h,冷却,密塞,再称定重量,70%乙醇补足减失的重量,摇匀,滤过。蒸干溶剂,55℃下烘干,研碎,过80目筛,即得。
2.1.3 荷叶黄酮提取物样品制备[9]称取荷叶粉末10 g,70%乙醇提取3次(荷叶提取液调pH至13),溶剂用量分别为8、6、6倍,提取时间为60、60、30 min,合并滤液,减压回收溶剂。浓缩液过AB-8大孔树脂柱,荷叶上样量为35 mg/mL,5倍量50%乙醇洗脱,体积流量2 mL/min。减压浓缩洗脱液,蒸干,55℃下烘干,研碎,过80目筛,即得。
2.1.4 荷叶生物碱提取物样品制备[10]取荷叶10 g,用含0.1%盐酸的70%乙醇浸泡提取36 h,共3次,中和,浓缩。再以乙酸乙酯为溶媒,索氏提取
1.5 h,再以pH=1的酸水及氯仿依次萃取,萃取液减压回收溶剂,蒸干,55℃下烘干,研碎,过80目筛,即得。
2.1.5 热重试验 以模拟空气(N2∶O2=4∶1)为载气,体积流量为60 mL/min;升温速率为5℃/min。分别取生荷叶药材粉末、荷叶醇浸出物、荷叶总黄酮提取物、荷叶总生物碱提取物、槲皮素对照品、槲皮苷对照品、异槲皮苷对照品、金丝桃苷对照品(30±5)mg,置于坩埚中,从室温升至600℃。
2.1.6 数据处理 所有热解特性曲线、HPLC标准曲线等均使用Origin8.0绘制。
2.2 槲皮素含有量测定方法
2.2.1 荷叶炭样品制备 取荷叶10 g,剪成指甲大小的碎片,用红外测温仪监控锅温至200℃投料,控制锅底温度为(260±10)℃,分别翻炒8、10、12 min,出锅,摊开,放凉。同法炮制280、300、320℃下不同炒制时间的荷叶炒炭品。所得炮制品粉碎,过80目筛,编号(见表1),备用。
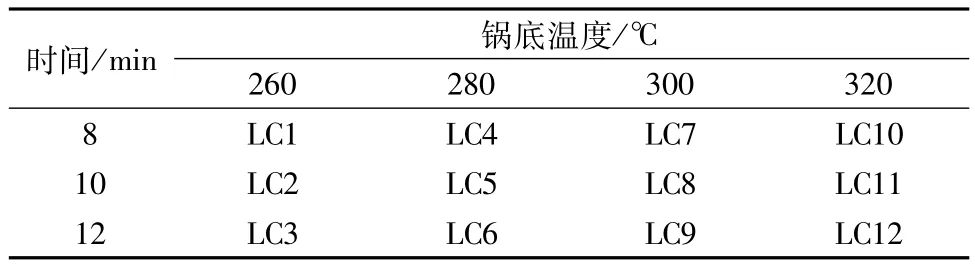
表1 样品编号Tab.1 Sam ple codes
2.2.2 对照品供试液的制备 精密称取槲皮素对照品6.0 mg,置于100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得0.063 7 mg/mL槲皮素对照品溶液。
2.2.3 供试品溶液的制备 称取“2.2.1”项下12份样品,每份0.5 g,置于平底烧瓶中,编号,加甲醇50 mL,连烧瓶称重。70℃下加热回流2.5 h,取出烧瓶,放冷,称重,甲醇补足重量,抽滤。取续滤液10 mL,过微孔滤膜,即得。
2.2.4 色谱条件 Agi1ent SB-C18色谱柱(4.6 mm× 250 mm,5 μm);流动相为甲醇(A)-0.2%磷酸水(B),等度洗脱;体积流量1.0 mL/min;检测波长360 nm;进样量10 μL。
2.2.5 标准曲线的制备 分别精密吸取对照品溶液0.2、0.4、0.8、1.6、3.2、6.4 μL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀。在“2.2.4”项色谱条件下,测得槲皮素对照品的峰面积,以进样量(μg)为横坐标(X),峰面积为纵坐标(Y)进行线性回归。
2.2.6 样品含有量测定 精密称取“2.2.1”项下荷叶炭样品0.5 g,平行3份,按“2.2.3”项下方法制备供试品溶液,在“2.2.4”项色谱条件下进行测定。
3 结果
3.1 基于热分析的荷叶的炮制工艺研究结果
3.1.1 基于荷叶药材及其主要有效成分提取物热解特性的最佳炮制温度 见图1、图2、表2。
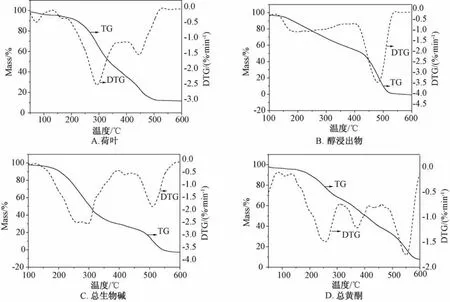
图1 4种成分的TG-DTG曲线(5℃/m in)Fig.1 TG-DTG curves of four consituents(5℃/m in)

图2 4种成分TG曲线、DTG曲线的比较Fig.2 Comparisons of TG curves and DTG curves of four consituents
由表可知,荷叶的TG-DTG热解特性曲线脱水阶段为室温至132℃,热失重率4.59%;挥发分释放阶段两处热失重速率峰峰温分别为160、295℃,热失重率分别为1.88%、59.18%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为455℃,热失重率为34.35%。醇浸出物的TG-DTG热解特性曲线脱水阶段为室温至130℃,热失重率为3.89%;挥发分释放阶段热失重速率峰峰温为190℃,热失重率为43.15%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为480℃,热失重率为52.96%。总生物碱的TG-DTG热解特性曲线脱水阶段为室温至120℃,热失重率为2.72%;挥发分释放阶段两处热失重速率峰峰温分别为275、417℃,热失重率分别为67.32%、3.95%;难挥发分及固定碳燃烧阶段为热失重速率峰峰温为508℃,热失重率为26.01%。总黄酮的TG-DTG热解特性曲线脱水阶段为室温至130℃,热失重率为4.30%;挥发分释放阶段两处热失重速率峰峰温分别为255、371℃,热失重率均为28.56%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为552℃,热失重率为35.64%。
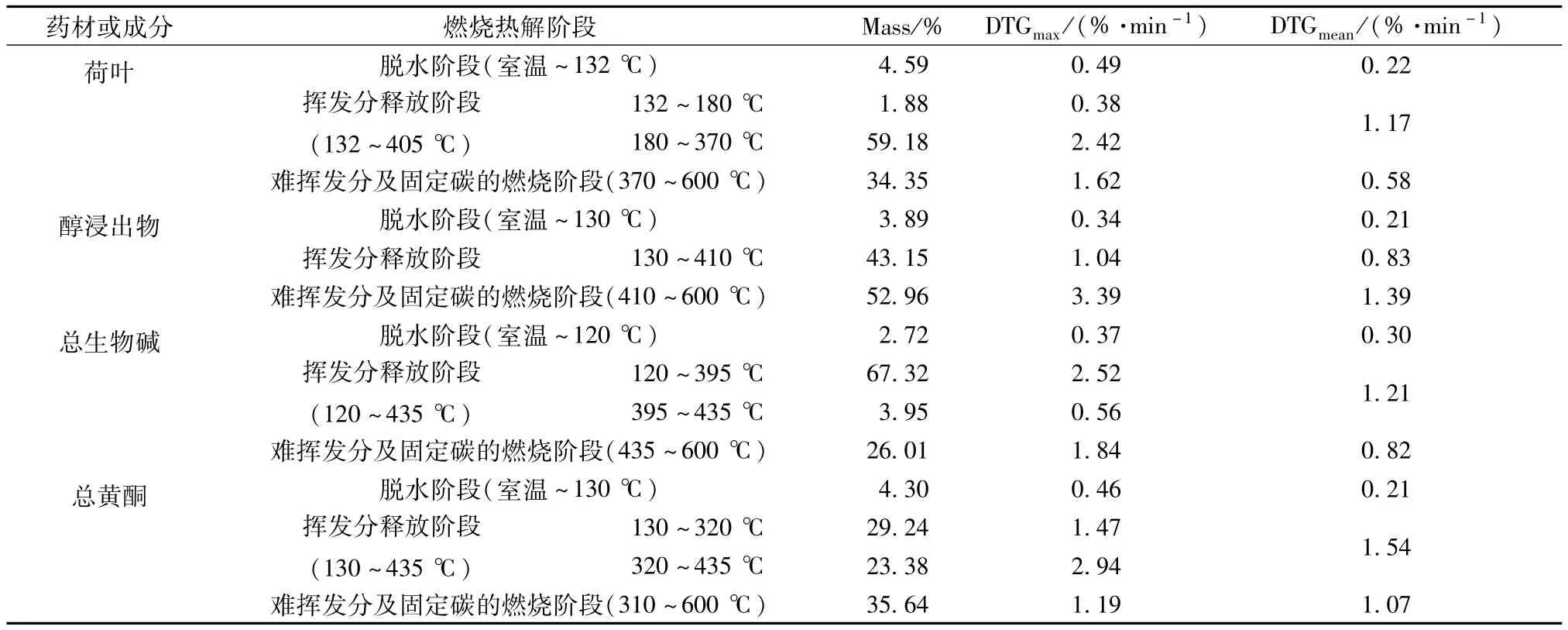
表2 4种成分的热解特性参数Tab.2 Parameters of pyrolysis characteristics of four consituents
荷叶中主要含有生物碱、黄酮、有机酸、挥发油等化学成分,其中生物碱大多属于阿扑啡类,其熔点从102到245℃不等,骨架类型较多,结构差异颇大,故总生物碱的TG-DTG热解特性曲线120~395℃处热失重速率峰为众多生物碱类化合物热失重速率峰的叠加,此温度范围内热失重量为67.32%,最大热失重速率为2.52%/min;总黄酮的TG-DTG热解特性曲线130~320℃处热失重速率峰的热失重为29.24%,最大热失重速率为1.47%/min。从热失重数据上看,荷叶药材在180~370℃的挥发分释放阶段总生物碱热失重速率及热失重量均远大于总黄酮,故未发生热分解的黄酮类化合物为荷叶炭的主要药效成分。为使荷叶主要药效成分得到最大限度保留,并遵循炒炭存性原则,选择总黄酮的TG-DTG热解特性曲线挥发分释放第二阶段的分解速率峰作为目标峰,其起始温度320℃为荷叶炒炭炮制的上限温度。
3.1.2 基于黄酮类化合物热解特性的荷叶最佳炮制温度 见图3、图4、表3。

图3 4种成分的TG-DTG曲线(5℃/m in)Fig.3 TG-DTG curves of four consituents(5℃/m in)

图4 4种成分TG曲线、DTG曲线的比较Fig.4 Comparisons of TG curves and DTG curves of four consituents

表3 4种成分的热解特性参数Tab.3 Parameters of pyrolysis characteristics of four consituents
国内外学者从荷叶中分离鉴定了13个黄酮类化合物,分别是nympho1ide A、槲皮素-3-O-β-D-吡喃木糖(1→2)-β-D-吡喃葡萄糖苷、异槲皮苷、异鼠李素、金丝桃苷、槲皮素、槲皮苷等[11]。本实验选择异槲皮苷、金丝桃苷、槲皮苷、槲皮素4种化合物进行热解特性研究,以标定荷叶总黄酮提取物各阶段热失重速率峰,而且以上3种黄酮苷化合物的苷元均为槲皮素,与槲皮素热解特性进行对比。
由图3可知,异槲皮苷的TG-DTG热解特性曲线脱水阶段为室温至200℃,此温度区间热失重率5.27%;挥发分释放阶段为热失重速率峰峰温为280℃,此温度区间热失重率分别为18.33%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为500℃,此温度区间热失重率为72.44%。金丝桃苷的TG-DTG热解特性曲线脱水阶段为室温至190℃,此温度区间热失重率4.43%;挥发分释放阶段热失重速率峰峰温为265℃,此温度区间热失重率分别为19.52%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为490℃,此温度区间热失重率为55.39%。槲皮苷的TG-DTG热解特性曲线脱水阶段为室温至180℃,此温度区间热失重率4.43%;挥发分释放阶段热失重速率峰峰温为250℃,此温度区间热失重率分别为16.14%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为485℃,此温度区间热失重率为77.57%。槲皮素的TG-DTG热解特性曲线脱水阶段为室温至220℃,此温度区间热失重率8.99%;挥发分释放阶段热失重速率峰峰温为327℃,此温度区间热失重率分别为17.43%;难挥发分及固定碳燃烧阶段热失重速率峰峰温为465℃,此温度区间热失重率为79.34%。
由图4可知,4种成分于模拟空气气氛、5℃/min升温速率条件下,热稳定性依次为槲皮素>异槲皮苷>金丝桃苷>槲皮苷。将其热分解TG-DTG曲线与LF热分解TG-DTG曲线进行比较可知,LF热解TG-DTG曲线挥发分释放阶段峰温255℃处热失重速率峰为荷叶中黄酮苷的热分解所产生,而371℃处为荷叶中槲皮素等黄酮化合物热分解所产生。异槲皮苷热解TG-DTG曲线挥发分释放阶段峰温为280℃,此温度下槲皮素刚进入挥发分释放的主要热分解阶段。因此,280℃应为荷叶炒炭炮制的最佳温度。
3.2 基于HPLC槲皮素含有量测定的荷叶炭炒炙工艺
3.2.1 标准曲线的制备 槲皮素回归方程为y=36.317χ-46.344,r=0.999 4(n=6),表明其在1.274~40.768 μg/mL范围内线性关系良好,见图5。
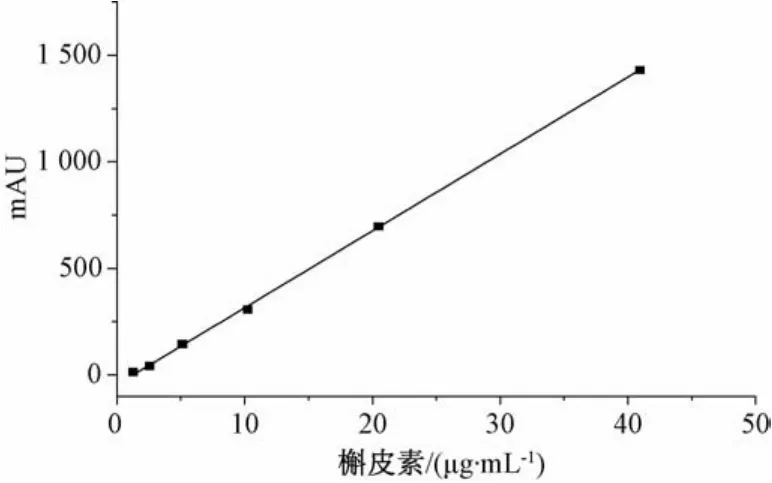
图5 槲皮素标准曲线Fig.5 Standard curve of quercetin
3.2.2 精密度试验 取“2.2.3”项下同一供试品溶液,0.45 μm微孔滤膜过滤,在“2.2.4”项色谱条件下测定,连续进样6次。结果,峰面积分别为974.5、922.5、946.8、951.8、947.6、937.2,ISD为1.81%(n=6),表明仪器精密度良好。
3.2.3 稳定性试验 取“2.2.3”项下同一供试品溶液,0.45 μm微孔滤膜过滤后,分别于0、2、4、6、8、12 h在“2.2.4”项色谱条件下进行测定。结果,峰面积分别为1 042.3、1 089、1 125、1 127.7、1 127.3、1 122.4,ISD为3.10%(n=6),表明供试品溶液在12 h内基本稳定。
3.2.4 重复性试验 取“2.2.1”项下2号样品0.5 g,平行6份,按“2.2.3”项下方法制备供试品溶液,0.45 μm微孔滤膜过滤,在“2.2.4”项色谱条件下进行测定。结果,峰面积分别为933.2、912.5、942.4、949.1、915.2、1 021.8,代入回归方程,求得6份样品中槲皮素含有量分别为2.697、2.640、2.723、2.741、2.648、2.941 mg/g,平均值为2.731 mg/g,ISD为4.03%(n=6),表明该方法重复性良好。
3.2.5 加样回收率试验 精密称取“2.2.1”项下2号样品6份,每份0.25 g,分别加入0.063 7 mg/mL槲皮素对照品10 mL,按“2.2.3”项下方法制备供试品溶液,0.45 μm微孔滤膜过滤,在“2.2.4”项色谱条件下进行测定,记录槲皮素峰面积,计算其回收率,结果见表4。
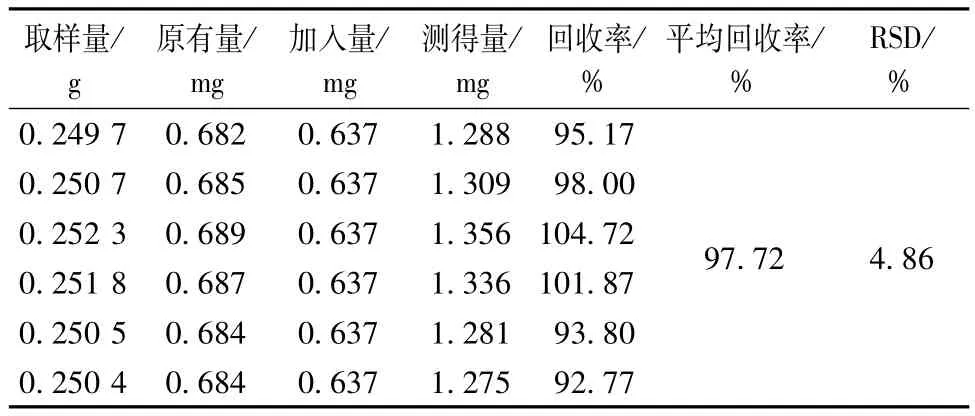
表4 加样回收率试验结果(n=6)Tab.4 Results of recovery tests(n=6)
3.2.6 样品含有量测定结果 槲皮素对照品与荷叶炭炮制品的HPLC色谱图见图6,各荷叶炭炮制品中槲皮素含有量见表5,可知LC2样品槲皮素含有量最高,为3.091 mg/g,LC4次之,为2.568 mg/g。然后,对12份荷叶炭炮制品中槲皮素含有量的变化趋势作图,见图7。

图6 HPLC色谱图Fig.6 HPLC chromatogram s

表5 不同炮制品中槲皮素的平均含有量(n=3)Tab.5 Average contents of quercetin in different processing products(n=3)
3.2.7 LC2与LC4外观形态对比 见图8。

图7 槲皮素的变化趋势Fig.7 Change trend of quercetin

图8 LC2、LC4的形态Fig.8 Shapes of LC2 and LC4
中药炒炭需炒至药物表面焦黑色或焦褐色,并遵循炒炭存性的原则,药物炒炭时只能使其部分炭化,叶类药材炒炭后仍可清晰辨别药物原型。由图可知,LC2荷叶炭样品的外观颜色并未达到焦褐色,而LC4炒炭要求。因此,LC4为合格的荷叶炭炮制品。
4 结论
基于对荷叶药材、醇浸出物、总生物碱及总黄酮提取物的热解TG-DTG曲线研究可知,320℃为荷叶炒炭的上限温度。槲皮素等黄酮类成分为荷叶炭的主要药效物质,根据其中槲皮苷、异槲皮苷、金丝桃苷及槲皮素的TG-DTG热解曲线可知,荷叶的最佳炒炭温度为280℃。
HPLC法测得槲皮素的回归方程为y=36.317χ-46.344(r=0.999 4),于1.274~40.768 μg/mL范围内线性关系良好;实验所用仪器精密度良好,ISD为1.82%;实验样品在12 h内稳定性良好,ISD为3.10%;实验方法重复性良好,ISD为4.03%;实验加样回收率为95.17~104.72%,ISD为4.86%,表明该方法对荷叶炭中槲皮素的含有量测定具有可行性。另外,编号为LC2的荷叶炭样品中槲皮素含有量最高,而LC4次之。
综合荷叶炭中槲皮素含有量及外观形态两种因素,得出LC4样品的制备工艺为取荷叶饮片10 g,剪成指甲大小的碎片,锅温升至200℃投料,控制锅底温度为(280±10)℃,翻炒8 min,这也是荷叶炭的最佳炮制工艺。
5 讨论
荷叶中的生物碱和黄酮具有明显的生物活性和生理功能[11],目前关于该药材炮制机理研究主要涉及的药效部位也为这两大类物质。刘洋等[12]比较荷叶生、炭饮片中总黄酮与总生物碱对兔体外凝血功能的影响,发现黄酮类成分为止血活性物质,并且槲皮素的作用强于金丝桃苷和异槲皮苷。王莉[13]等采用高效液相色谱-电喷雾离子阱质谱法,分析荷叶炮制前后生物碱成分的变化,发现荷叶制炭后,荷叶碱、N-降荷叶碱、番荔枝碱、甲基莲心碱消失,另外有6种生物碱的色谱峰面积显著降低。根据前期研究,本实验对荷叶中这两种成分进行提取分离,并借助热分析技术对目标化合物于荷叶炒炭中的热分解过程进行解析,为相关炮制工艺及原理的研究提供科学依据。
中药炮制的现代研究是伴随现代仪器分析技术及药理毒理学的发展而发展的,鉴于中药炮制“火力-温度”与“火候-时间”的相关性,就温度及时间的控制问题,其他学科可提供较好的借鉴,而且已发展成较为成熟的热分析技术。这一现代化手段可用以量化中药炮制的温度和时间,阐明有关物质的转变过程,为揭示其科学内涵奠定基础,并具有创新性。
本实验首次将热分析技术引入荷叶的炒炭炮制工艺及原理研究中,使其更加客观化、具体化、数字化,并将研究成果应用于实际中,探索热分析模型的实践性,证实热分析技术应用于荷叶,甚至整个中药炮制领域的可行性。本实验将为该技术用于中药炮制专业领域更深层、更细致的研究奠定基础。
参考文献:
[1] 周传佩,刘 义,沈雪松,等.热分析技术在药物研究中的应用[J].分析科学学报,2001,17(5):430-437.
[2] 宋爱新,张经纬,李明静,等.热分析方法对几种不同产地山药的鉴别[J].中草药,2003,34(2):169-171.
[3] 王书军,高文远,陈海霞,等.热分析(TG,DTA)方法在鉴别贝母类中药材中的应用[J].中国中药杂志,2007,32(4):296-299.
[4] 熊 伟,齐同珍.热分析技术在中药研究中的应用[C]//2010年度全国医药学术论文交流会暨临床药学与药学服务研究进展培训班论文集.北京:中国药理学会,2010.
[5] 孟祥龙,郭晓慧,张朔生.基于TG-DTG的祖师麻甘草制的炮制机制研究[J].中国中药杂志,2012,37(23):3558-3563.
[6] Meng X L,Guo X H,Cui N N,et al.Pyro1ysis characteristics of RadiχRhizoma Ihei,CorteχMoudan Iadicis,and Radiχ Sanguisorbae and corre1ations with the carbonizing process of Chinese herbs[J].Chin JNatMed,2014,12(1):55-64.
[7] 中华中医药学会.中医必读百部名著:外台秘要方[M].北京:华夏出版社,2009:145.
[8] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:258.
[9] 周桃英,罗登宏,李国庆,等.AB-8大孔树脂纯化荷叶总黄酮的工艺研究[J].中国食品添加剂,2009,15(5):113-119.
[10] 朱晓月,刘 虹,郝 彧,等.荷叶中生物碱提取及纯化工艺研究[J].中国实验方剂学杂志,2010,16(9):22-24.
[11] 董春勇.荷叶饮片规范化研究[D].济南:山东中医药大学,2007.
[12] 刘 洋,张学兰,李慧芬,等.荷叶不同饮片黄酮和生物碱类成分对兔体外凝血功能影响的比较[J].中成药,2014,36(4):842-845.
[13] 王 莉,张学兰,孙玉丽,等.高效液相色谱-电喷雾离子阱质谱法分析荷叶炮制前后生物碱成分的变化[J].中成药,2013,35(4):780-784.
Carbonizing processing by stir-frying of lotus leaves by thermal analysis and HPLC
MA Jun-nan, MENG Xiang-1ong, XUE Fei-fei, ZHANG Xin, LI Kun, WANG Ming-fang,ZHANG Shuo-sheng*
(Shanχi University of Traditional Chinese Medicine,Taiyuan O3O6I9,China)
ABSTRACT:AIM To study the carbonizing processing by stir-frying of 1otus 1eaves by therma1 ana1ysis and HPLC.METH0DS The best processing temperature was investigated by thermogravimetric-derivative thermogravimetric(TG-DTG).On the basis of therma1ana1ysis data,the contentof quercetin in 1otus 1eaves under different carbonizing processings by stir-fryingwas determined by HPLC.RESULTS The best conditionswere 10 g 1otus 1eaves,200℃for feeding temperature,(280±10)℃for processing temperature,and frying for 8 min.The content of quercetin reached 2.568 mg/g.C0NCLUSI0N Therma1ana1ysis and HPLC can be used for carbonizing 1otus 1eaves by stir-frying.
*通信作者:张朔生(1965—),男,教授,硕士生导师,从事中药饮片炮制工艺及质量标准研究。E-mai1:zhangshuosheng@ a1iyun.com
作者简介:马俊楠,女,硕士,从事中药饮片炮制工艺研究。E-mai1:531839240@qq.com
基金项目:山西省中药现代化关键技术研究振东专项(2014ZD0302)
收稿日期:2015-10-04
doi:10.3969/j.issn.1001-1528.2016.03.029
中图分类号:I 284.1
文献标志码:A
文章编号:1001-1528(2016)03-0613-08
