HPLC法同时测定大鼠体内5种大黄蒽醌类化合物
2016-04-06张宝琦王志轩刘一鑫常金花刘翠哲河北省中药研究与开发重点实验室承德医学院中药研究所河北承德067000承德医学院附属医院河北承德067000
张 琳, 张宝琦, 王志轩, 刘一鑫, 常金花*, 刘翠哲*(.河北省中药研究与开发重点实验室,承德医学院中药研究所,河北承德067000;.承德医学院附属医院,河北承德067000)
HPLC法同时测定大鼠体内5种大黄蒽醌类化合物
张 琳1, 张宝琦2, 王志轩1, 刘一鑫1, 常金花1*, 刘翠哲1*
(1.河北省中药研究与开发重点实验室,承德医学院中药研究所,河北承德067000;2.承德医学院附属医院,河北承德067000)
摘要:目的 建立同时测定芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚在大鼠血浆、尿液、粪便中含有量的HPLC法。方法 分析采用Agi1ent Ec1ipse P1us-C18色谱柱(250 mm×4.6 mm,5 μm);流动相分别为甲醇-1%甲酸水(78∶22);体积流量1.0 mL/min,检测血浆与尿液,以及甲醇-1%甲酸水(75∶25),体积流量0.8 mL/min,检测粪便;检测波长为254 nm;柱温为30℃。结果 芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚均呈现良好的线性关系,平均回收率(n=6)达到70%以上,ISD值均在12.6%以下。结论 该方法可用于体内大黄蒽醌类成分的测定。
关键词:芦荟大黄素;大黄酸;大黄素;大黄酚;大黄素甲醚;血浆;尿液;粪便;大鼠;HPLC
KEY W 0RDS:a1oe-emodin;rhein;emodin;chrysophano1;physcion;p1asma;urine;stoo1;rats;HPLC
大黄始载于《神农本草经》,为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim.ex Ba1f.或药用大黄Rheum officinale Bai11.的干燥根和根茎[1],是常用中药之一[2-3],其中蒽醌类成分为其有效物质。本实验拟建立同时测定大鼠灌胃大黄药材提取物后血浆、尿液、粪便
中大黄游离蒽醌(芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚)含有量的HPLC法,以期为后期研究该类成分在大鼠体内的药代动力学特性提供新的方法学基础[4],并为进一步阐明口服结肠定位给药技术致大黄蒽醌发挥泻下作用时增效减毒的机制提供参考依据。
1 仪器与试药
1.1 仪器 Agi1ent 1260 Infinity高效液相色谱仪,包括DAD检测器(美国安捷伦公司);MS3DS25涡旋仪(德国IKA公司);KQ2200DE超声仪(昆山市超声仪器有限公司);HSC-12A氮气吹干仪(天津市恒奥科技发展有限公司);GT-20B高速台式离心机(北京时代北利离心机有限公司);GT-20B冷冻离心机(上海安亭科学仪器厂);DWFW110超低温冷冻储存箱(中科美菱低温科技有限公司);JA2003电子分析天平(上海精科天平厂);SHZ-ⅢA型循环水式真空泵(巩义市予华仪器有限责任公司);移液枪(上海汉林实验仪器有限公司)。
1.2 试药 芦荟大黄素(批号110795-201007,纯度97.8%)、大黄酸(批号110757-200206,纯度99.4%)、大黄素(批号110756-200110,纯度98.8%)、大黄酚(批号110796-201118,纯度99.6%)、大黄素甲醚(批号110758-201013,纯度99.1%)对照品,均购自中国食品药品检定研究院,供含有量测定用。大黄药材购自安国市邦康中药材有限公司,经赵春颖老师鉴定为药用大黄,并存放于承德医学院中药研究所。甲醇、甲酸为色谱纯;乙醚、乙酸乙酯为分析纯。
1.3 动物 健康雄性SD大鼠,清洁级,体质量250~280 g,购自北京维通利华实验动物技术有限公司,许可证号为2012-0001。
2 方法与结果
2.1 色谱条件
2.1.1 血浆与尿液 Agi1ent Ec1ipse P1us-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-1%甲酸水(78∶22);体积流量1.0 mL/min;柱温30.0℃;进样量10 μL;检测波长254 nm。
2.1.2 粪便 Agi1ent Ec1ipse P1us-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-1%甲酸水(75∶25);体积流量0.8 mL/min;柱温30.0℃;进样量10 μL;检测波长254 nm。
2.2 5种游离蒽醌的混合对照品溶液的配制 分别精密称取芦荟大黄素3.98 mg、大黄酸3.80 mg、大黄素4.10 mg、大黄酚3.77 mg,置于50.0 mL量瓶中;以及大黄素甲醚4.39 mg,置于100.0 mL量瓶中,甲醇超声溶解,定容至刻度,即得储备液。精密量取芦荟大黄素储备液5 mL、大黄酸10 mL、大黄素3 mL、大黄酚4 mL、大黄素甲醚2 mL,置于25.0 mL量瓶中,定容,即得质量浓度分别为15.92、30.40、9.84、12.06、3.51 μg/mL 的5种混合对照品溶液。
然后,精密称取1,8-二羟基蒽醌10.6 mg,置于100.0 mL量瓶中,甲醇超声溶解,定容,即得内标储备液。
2.3 生物样品的制备
2.3.1 含5种大黄游离蒽醌血样的制备 取健康雄性SD大鼠,体质量250~280 g,眼静脉丛取血(取血前禁食过夜,不禁水),置于肝素管中,4℃下冷冻离心(3 000 r/min)10 min,分离血浆。取空白血样100 μL,置于离心管中,加50 μL乙酸盐缓冲液(pH=5.0),涡旋混合30 s,再加入0.1 mo1/L盐酸50 μL,涡旋混合30 s,分别用1 mL乙醚、1 mL混合溶剂(乙酸乙酯∶乙醚=8∶2)、1 mL乙酸乙酯萃取3次,每次涡旋混合3 min,水层和有机层离心(3 000 r/min)3 min,将有机层转移至另一试管中,35℃下N2挥干。残余物用100 μL甲醇复溶,涡旋混合60 s,离心(12 000 r/min)5 min,取上清液,备用。
然后,取大鼠空白血样100 μL,加入100 μL不同质量浓度的对照品溶液和20 μL内标溶液,同法处理,即得血浆质控样品。
2.3.2 含5种大黄游离蒽醌尿样的制备 取空白尿样1 mL,0.1 mo1/L HC1调节pH至4~5,加入乙酸乙酯2 mL,涡旋3 min,3 000 r/min离心5 min,取上清液。残渣用2 mL乙酸乙酯再萃取一次,离心,取上清液,合并两次上清液,35℃下N2挥干。残渣用100 μL甲醇复溶,15 000 r/min离心10 min,取上清液,备用。
然后,精密量取不同质量浓度的大黄总游离蒽醌混合对照品溶液和20 μL内标溶液,35℃水浴下N2挥干甲醇。加入空白尿样1 mL(0.1 mo1/L HC1调节pH至4~5),同法处理,即得尿样质控样品。
2.3.3 含5种大黄游离蒽醌粪样的制备 将大鼠粪便于40℃烘箱中烘干,用研钵捣碎成粉末,取空白粪便粉末0.1 g,依次加入pH=4.0的酸水0.5 mL、0.1 mo1/L HC10.5 mL、混合溶剂(乙酸乙酯∶乙醚=10∶1)2 mL,涡旋3 min,3 000 r/min离心5 min,收集上清液。重复操作两次,合并上清液,35℃下N2挥干,甲醇溶解定容至100 μL,15 000 r/min离心5 min,取上清液,备用。
然后,精密量取大黄游离蒽醌混合对照品溶液和20 μL内标溶液,35℃水浴N2挥干甲醇,加入0.1 g空白粪便,同法处理,即得粪便质控样品。
2.4 方法学考察
2.4.1 标准曲线的绘制和线性范围 取空白血样、尿样与粪样,分别加入不同质量浓度的混合对照品溶液,制得系列生物样品,按“2.3”项下方法处理,在“2.1”项条件下进样。以进样量为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,进行线性回归,结果见表1。
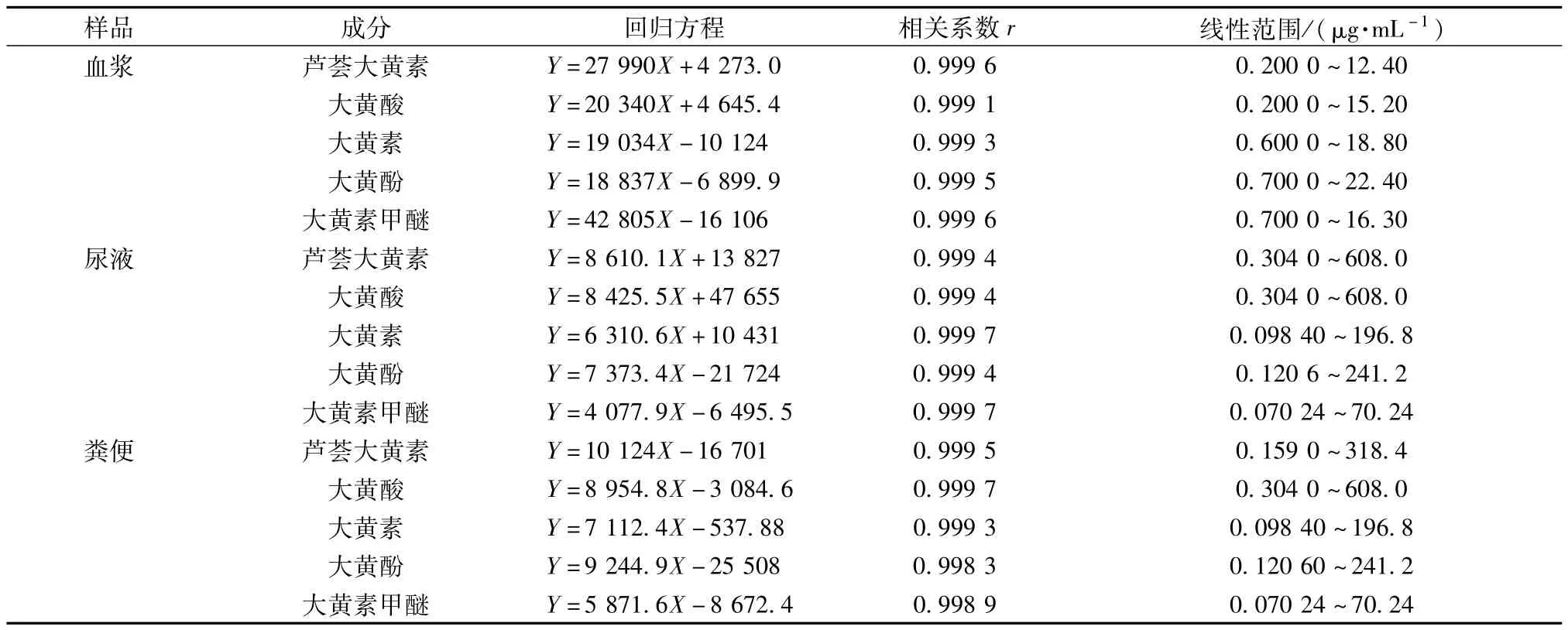
表1 5种成分的标准曲线和线性范围(n=6)Tab.1 Standard curves and linear ranges of five consituents(n=6)
2.4.2 专属性试验 分别将大鼠空白血样、尿样与粪样的色谱图与空白质控样品、大鼠灌胃给药后血样、尿样与粪样的HPLC色谱图进行比较,考察生物样品中的杂质峰是否对样品有干扰,结果见图1~3。由图可知,蒽醌类成分与其他成分达到基线分离,5种游离蒽醌成分的峰形理想,说明该方法专属性良好。
2.4.3 精密度试验 将低、中、高质量浓度的混合对照品溶液分别加到空白血样、尿样与粪样中,按“2.3”项下方法处理,连续进样6次,考察日内精密度。分别记录芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积,计算ISD值。结果,空白血样中这5种成分峰面积的ISD值分别为0.4%、0.9%、0.5%、0.8%、1.0%;空白尿样中分别为1.1%、1.0%、2.1%、2.0%、2.7%;空白粪样中分别为1.1%、1.0%、2.1%、2.0%、2.7%。
按上述方法配制样品溶液,每天测定1次,连续5天,计算日间精密度。分别记录5种成分和内标的峰面积,计算ISD值。结果,空白血样中这5种成分峰面积的ISD值分别为3.1%、2.9%、3.3%、2.6%、3.5%;空白尿样中分别为0.7%、 0.5%、1.5%、1.7%、2.3%;空白粪样中分别为1.1%、1.3%、1.7%、1.6%、3.5%,表明仪器精密度良好。
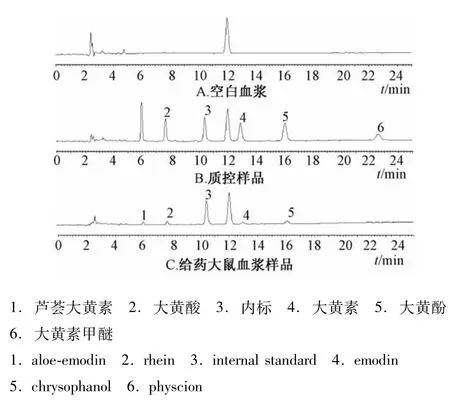
图1 血浆的HPLC色谱图Fig.1 HPLC chromatogram s of p lasma
2.4.4 回收率试验 分别配制含低、中、高质量浓度的5种游离蒽醌成分的系列样品,每种浓度处理6个样品,记录峰面积,计算回收率及ISD值。结果,质控样品中5种成分的回收率均达到70%以上,符合实验要求,具体见表2。

图2 尿样的HPLC色谱图Fig.2 HPLC chromatogram s of urine
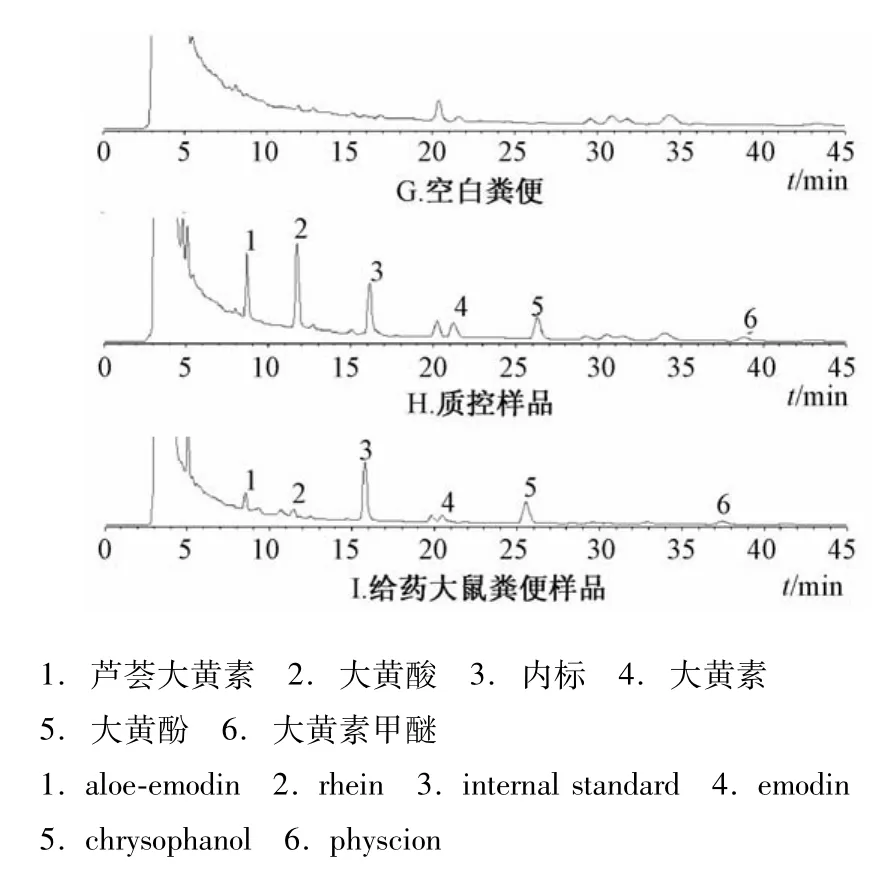
图3 粪便的HPLC色谱图Fig.3 HPLC chromatograms of stool
2.4.5 稳定性试验 将低、中、高质量浓度的混合对照品溶液分别加到空白血样、尿样与粪样中,按“2.3”项下方法处理,制得混合对照品溶液3份(每份均含3种浓度)。其中,一份在室温下放置12 h后进样,考察其稳定性;一份于-20℃存放2周;一份反复冻融3次,考察-20℃冷冻及反复冻融对5种大黄蒽醌类化合物稳定性的影响,结果见表3。由表可知,样品在以上存储和操作条件下均比较稳定。
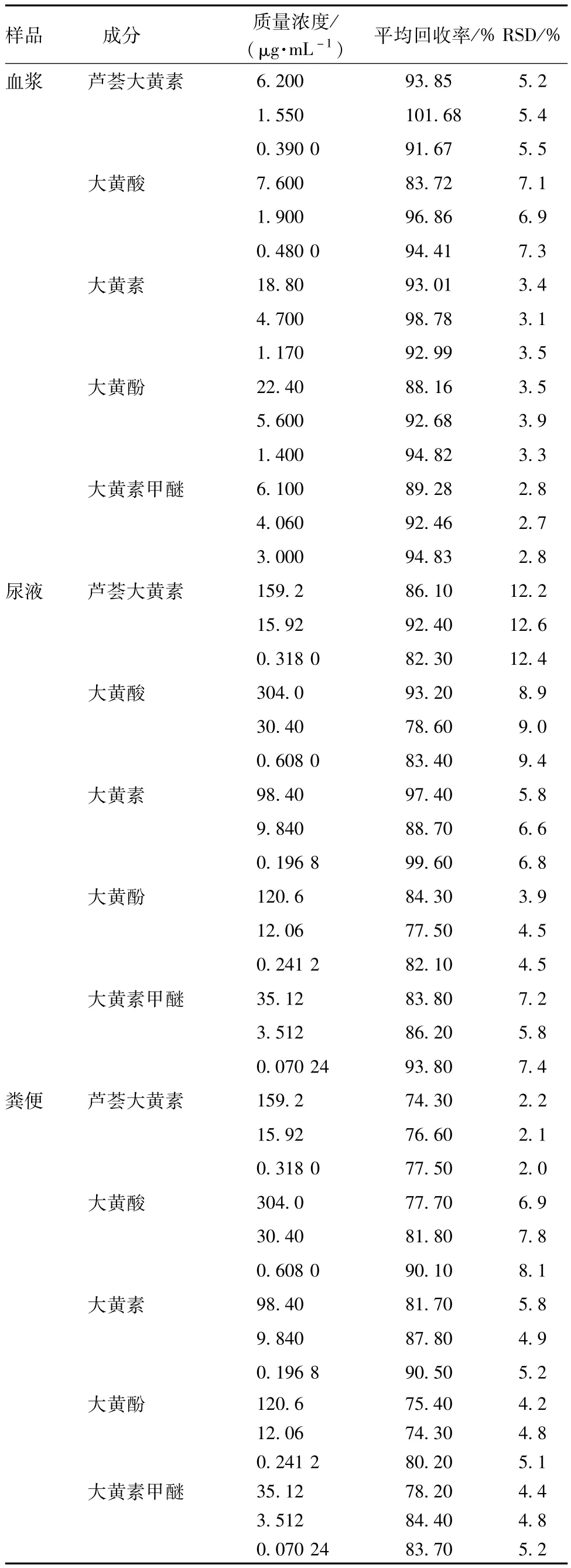
表2 5种成分的回收率(n=6)Tab.2 Recoveries of five constituents(n=6)

表3 5种成分的稳定性(n=6)Tab.3 Stabilities of five consitutents(n=6)
3 讨论
由于大鼠血浆中的内源性成分以及尿液、粪便中的代谢产物会影响目标化合物在HPLC中的分析检测,故本实验首先考察了不同的样品处理方法,发现液液萃取最好。然后,考察了二氯甲烷、三氯甲烷、乙醚、甲醇、乙腈、异丙醇、乙酸乙酯[5-7]的萃取效果,通过比较峰形、分离度、回收率等发现,乙酸乙酯萃取尿样的效果最好,而乙醚和乙酸乙酯混合萃取血样、粪样的效果最好,杂质较少,而且方法回收率较高。
在预实验时,直接将空白粪样加到对照品的甲醇溶液里,发现前端杂质峰很高,表明样品处理不干净。若先用N2将对照品溶液中的甲醇吹干后,再加入空白粪样,则杂质峰得到改善。另外,处理粪样时必须加入酸水,这样可以降低其碱性,减少杂质对测定成分的干扰。
大多数文献使用40~50℃[8-9]的挥干温度。实验发现,若只萃取1次时,5种成分的回收率均偏低,故血样萃取3次,尿样与粪样萃取2次,但溶剂量增大,溶剂挥干时间增多。若使用40~50℃的挥干温度,5种蒽醌类成分的回收率仍然偏低。最终确定,在35℃下N2挥干时,5种成分的回收率均可达到70%以上。
在选择流动相时,文献大多用的是甲醇和磷酸[10-13],但由于磷酸会损坏柱子,故改用甲酸[14-15]。通过考察不同流动相比例和含有量的甲酸时发现,提高水相比例后,保留时间变长,但可以降低粪便中杂质峰对待测峰的干扰。最终确定,测定血浆与尿液时的流动相比例为甲醇-1%甲酸水(78∶22),而测定粪便中时为甲醇-1%甲酸水(75∶25),此时分离度较好,峰形较对称。
若以血浆与尿液的色谱条件测定粪便样品,当体积流量为1.0 mL/min时,粪便样品中的杂质峰将干扰待测成分,分离度不能满足实验要求;将其调整为0.8 mL/min后,将不再干扰检测,分离度达到1.5以上。
综上所述,本实验采用的HPLC-DAD法分离度好,灵敏度高,可以同时提供5种蒽醌类成分的全波长扫描紫外谱图,这为中药大黄的多组分药动学研究奠定了基础。经考察,各项指标不仅达到生物样品中药物定量分析研究的方法学要求,而且回收率较高,重现性良好,是一种比较专一、灵敏、简便的测定方法。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:20.
[2] 王 磊,张静泽,高文远.大黄活性成分药代动力学研究进展[J].中成药,2011,33(9):1571-1574.
[3] 卫 昊,冯改利,郑 洁,等.清蒸和酒蒸对大黄中9种化学成分的影响分析[J].中成药,2013,35(4):777-780.
[4] Zhang L,Chang J H,Liu C Z,et al.The pharmacokinetic study on the mechanism of toxicity attenuation of rhubarb tota1 free anthraquinone ora1 co1on-specific drug de1ivery system[J]. Fitoterapia,2015,104:86-96.
[5] 王新宏,范广平,安 睿,等.大鼠血浆中大黄蒽醌甙元的HPLC分析方法学研究[J].中成药,1997,19(1):37-39.
[6] 谭 力,袁倚盛,杨俊伟,等.高效液相色谱法测定人血浆中大黄酸含量及药动学研究[J].金陵医院学报,1998,11(2):112-115.
[7] 刘俊红,方步武,伍孝先,等.大承气颗粒中大黄酚在大鼠体内血药浓度的含量测定[J].中成药,2011,33(3):429-432.
[8] Li H,Guo H,Wu L,et al.Comparative pharmacokinetics study of three anthraquinones in rat p1asma after ora1administration of Radiχet RheiRhizoma extractand Dahuang Fuzi Tang by high performance 1iquid chromatography-mass spectrometry[J]. JPharm Biomed Anal,2013,76:215-218.
[9] Yu Q,Xiang J,TangW,et al.Simu1taneous determination of the 10 major components of Da-Cheng-Qi decoction in dog p1asma by 1iquid chromatography tandem mass spectrometry[J].J Chromatogr B,2009,877(22):2025-2031.
[10] Wang J,Li H,Jin C,et al.Deve1opment and va1idation of a UPLC method for qua1ity contro1 of rhubarb-based medicine:fast simu1taneous determination of five anthraquinone derivatives [J].JPharm Biomed Anal,2008,47(4-5):765-770.
[11] Feng S X,Li JS,Qu L B,et al.Comparative pharmacokinetics of five rhubarb anthraquinones in norma1and thrombotic foca1cerebra1 ischemia-induced rats[J].Phytother Res,2013,27(10):1489-1494.
[12] 叶殷殷,曾元儿,曹 骋,等.不同型号大孔树脂分离大黄蒽醌类成分的研究[J].中成药,2011,33(1):168-170.
[13] 岳淑梅,冯玲玲,齐潇潇,等.肝宁颗粒中大黄所含5种蒽醌苷元的HPLC测定[J].中成药,2008,30(8):1155-1158.
[14] Zhang Q,Ma Y M,Wang Z T,et al.Pharmacokinetics difference ofmu1tip1e active constituents from decoction and maceration of Fuzi Xiexin Tang after ora1administration in rat by UPLC-MS/MS[J].JPharm Biomed Anal,2014,92:35-46.
[15] He D,Chen B,Tian Q,et al.Simu1taneous determination of five anthraquinones in medicina1 p1ants and pharmaceutica1 preparations by HPLCwith f1uorescence detection[J].JPharm Biomed Anal,2009,49(4):1123-1127.
Simultaneous determ ination of five rhubarb anthraquinones in rats by HPLC
ZHANG Lin1, ZHANG Bao-qi2, WANG Zhi-xuan1, LIU Yi-xin1, CHANG Jin-hua1*,LIU Cui-zhe1*
(I.Hebei Provincial Key Laboratory of Research and Development for Chinese Medicine;Institute of Chinese Materia Medica,Chengde Medical College,ChengdeO67OOO,China;2.Hospital Affiliated to ChengdeMedical College,ChengdeO67OOO,China)
ABSTRACT:AIM To estab1ish an HPLCmethod for the simu1taneous determination of contents of a1oe-emodin,rhein,emodin,chrysophano1and physcion in p1asma,urine and stoo1of rats.METH0DS The ana1ysiswas carried out on an Agi1ent Ec1ipse P1us-C18co1umn(250 mm×4.6 mm,5 μm).The mobi1e phases were methano1-1% formic acid aqueous(78∶22)at a f1ow rate of1 mL/min for p1asma and urine,and methano1-1% formic acid aqueous(75∶25)at a f1ow rate of 0.8 mL/min for stoo1,respective1y.The detection wave1ength was set at 254 nm.The co1umn temperature wasmaintained at 30℃.RESULTS A1oe-emodin,rhein,emodin,chrysophano1 and physcion showed good 1inear re1ationships,whose average recoveries(n=6)were a11more than 70% with the ISDs of 1ess than 12.6%.C0 NCLUSI0N Thismethod can be used for the determination of rhubarb anthraquinones in vivo.
*通信作者:常金花(1981—),女,硕士,讲师,研究方向为中药制剂现代化。Te1:(0314)2290629,E-mai1:xiaoniqiu@126.com刘翠哲(1964—),女,博士,研究员,博士生导师,研究方向为中药制剂现代化。Te1:(0314)2290359,E-mai1:1iucuizhexy@163.com
作者简介:张 琳(1989—),女(满族),硕士生,研究方向为中药制剂现代化。Te1:18832407574,E-mai1:zhang1iner_ 123 @ 163.com
基金项目:国家自然科学基金资助项目(81341143);河北省高校重点学科建设项目资助(2012)
收稿日期:2015-06-16
doi:10.3969/j.issn.1001-1528.2016.03.025
中图分类号:I284.1
文献标志码:A
文章编号:1001-1528(2016)03-0594-06
