环黄芪醇-单葡萄糖苷固体分散体的制备及溶出特性的研究
2016-04-06赵娜夏夏广萍韩英梅天津市新药设计与发现重点实验室天津药物研究院有限公司天津300193
赵娜夏, 夏广萍, 韩英梅(天津市新药设计与发现重点实验室,天津药物研究院有限公司,天津300193)
环黄芪醇-单葡萄糖苷固体分散体的制备及溶出特性的研究
赵娜夏, 夏广萍, 韩英梅*
(天津市新药设计与发现重点实验室,天津药物研究院有限公司,天津300193)
摘要:目的 制备环黄芪醇-单葡萄糖苷(AMG)固体分散体,并研究其体外溶出度和溶出速率。方法 采用溶剂-熔融法,以聚乙二醇6000(PEG6000)为载体,制备AMG固体分散体。体外溶出实验评价其溶出速率,红外光谱、X射线粉末衍射和差示扫描量热分析法研究其性质。结果 在固体分散体中,AMG以无定形的状态存在,其与PEG6000的最佳比例为1∶3。结论 固体分散体的制备能有效改善AMG的溶出特性。
关键词:环黄芪醇-单葡萄糖苷(AMG);固体分散体;溶出度;溶出速率
KEY W 0RDS:cyc1oastrageno1-6-O-monog1ucoside(AMG);so1id dispersion;disso1ution;disso1ution rate
环黄芪醇-单葡萄糖苷(cyc1oastrageno1-6-O-monog1ucoside,AMG,结构见图1)是黄芪中皂苷类指标性成分黄芪甲苷的衍生化产物,具有改善心脏功能和缓解心肌肥厚的作用,但其溶解性较差,口服生物利用度低,影响药效的发挥。固体分散技术应用于难溶性药物的固体制剂时,可以增加其溶解度和溶出速率,提高生物利用度和稳定性[1],为评价该技术在AMG固体口服制剂开发中的应用可行性,本实验制备AMG-PEG6000的固体分散体,并考察了其体外溶出特性。
1 材料
515高效液相色谱仪,包括717p1us自动进样器(美国Waters公司);A11tech 2000蒸发光散射检测器(美国A11tech公司);ZIS-8G智能溶出试验仪(天大天发科技公司);PTC-10A TG-DTA分析仪、D/max-2500X射线衍射仪(日本理学公司);MAGNA-560傅里叶变换红外光谱仪(美国Nico1et公司)。
AMG(自制,纯度>99%)。聚乙二醇6000 (PEG6000,天津市光复精细化工研究所,分析纯)。乙腈为优级纯;水为纯净水;其他试剂均为分析纯。
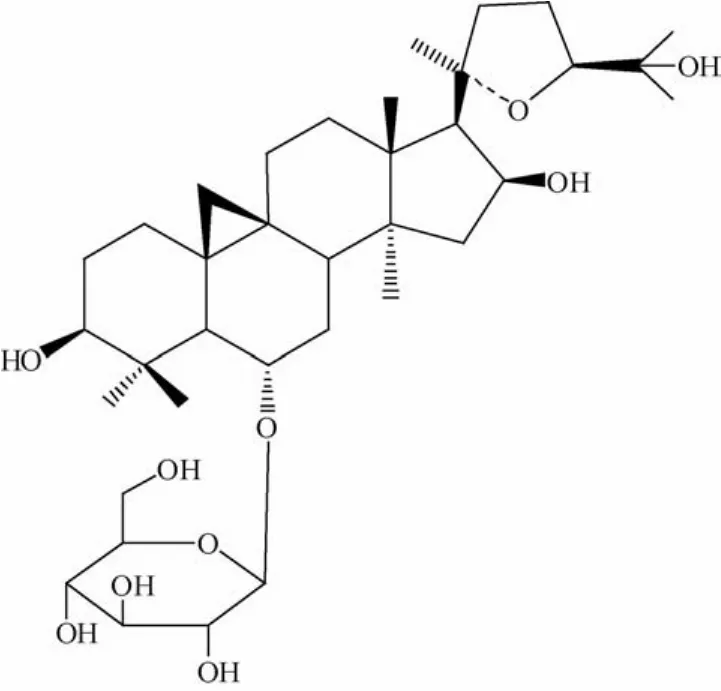
图1 环黄芪醇-单葡萄糖苷的结构Fig.1 Structure of cycloastragenol-6-O-monoglucoside
2 方法
2.1 样品的制备
2.1.1 AMG-PEG6000固体分散体的制备 采用溶剂-熔融法,制备AMG-PEG6000固体分散体。按照质量比1∶3、1∶6、1∶9,分别称取AMG和PEG6000。将后者置于蒸发皿中,85℃水浴加热至完全熔融,另取前者溶于适量无水乙醇中,滴入熔融态的后者,不断搅拌至乙醇完全挥去,迅速涂布于预冷钢板上,置冰箱冷冻24 h。取出,过80目筛粉碎,干燥器中常温保存[2]。
2.1.2 AMG物理混合物的制备 按照处方配比,称取AMG和PEG6000,于乳钵中研磨均匀,过80目筛,干燥器中常温保存。
2.2 AMG的测定
2.2.1 HPLC色谱条件[3]Phenomenex Luna C18色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈-水(4∶6);体积流量1.0 mL/min;柱温25℃;漂移管温度105℃;气体体积流量2.6 L/min。
2.2.2 标准曲线及线性范围 精密称取AMG对照品适量,加甲醇制成0.2 mg/mL的对照品溶液。分别精密吸取上述溶液2、5、10、15、20 μL,注入液相色谱仪,测定峰面积,以峰面积的对数值为纵坐标(Y),进样量的对数值为横坐标(X)进行线性回归,得回归方程Y=5.801 1+1.337 64X,r=0.999 9。结果表明,AMG在0.4~4.0 μg范围内与峰面积呈良好的线性关系。
2.2.3 精密度试验 取AMG对照品溶液10 μL,注入液相色谱仪,连续进样5次,测定峰面积。结果,峰面积ISD为0.46%,表明仪器精密度良好。2.2.4 AMG样品含有量的测定 精密称取AMG理论含有量约为5.0 mg的固体分散体及物理混合物,置于25 mL量瓶中,甲醇溶解并稀释至刻度,混匀,滤过。分别吸取10 μL,注入液相色谱仪,测定峰面积,标准曲线法计算AMG含有量。
2.2.5 AMG样品的体外溶出试验[4-5]参照《中华人民共和国药典》2010年版二部附录XC溶出度测定法第二法(桨法)[6],以水为溶出介质,介质温度37℃,介质体积500 mL,转速75 r/min。精密称取AMG原料、固体分散体及物理混合物(含AMG约30.0 mg),均匀散布于介质液面,从样品粉末开始接触液面时开始记时搅拌,分别于5、10、20、40、60、90及120 min取样2 mL,补加同体积溶出介质,溶液用0.8 μm滤膜滤过。取续滤液50 μL,注入液相色谱仪,测定峰面积,标准曲线法计算出AMG含有量,进而计算出累积溶出率,并对时间作图。
2.3 AMG样品的DSC分析 以A12O3为参比物;升温速度10℃/min;温度范围为室温~250℃;保护气为空气。分别对AMG原料、PEG6000及比例为1∶3的AMG-PEG6000物理混合物和固体分散体进行DSC分析。
2.4 AMG样品的X-射线粉末衍射分析 工作条件为Cu靶;管电压40 kV;管电流100 mA。分别对AMG原料、PEG6000及比例为1∶3的AMGPEG6000物理混合物和固体分散体进行分析。
2.5 AMG样品的红外光谱分析 KBr压片制备样品,分辨率4 cm-1,扫描次数20,扫描范围400~4 000 cm-1。分别对AMG原料、PEG6000及原-辅料比为1∶3的AMG-PEG6000物理混合物和固体分散体进行分析。
3 结果
3.1 体外累积溶出曲线(图2) 由图可知,各比例固体分散体在各时间点的溶出度均高于AMG原料,而由于PEG6000本身具有助溶作用,故物理混合物的溶出度也高于原料药。在溶出5 min时,各分散体间的溶出差异不大;随着溶出时间的延长,比例为1∶3的固体分散体显示出明显的优势,在40 min时已达到91.95%的溶出度,而1∶6和1∶9的在120 min时,溶出度只有80%左右。
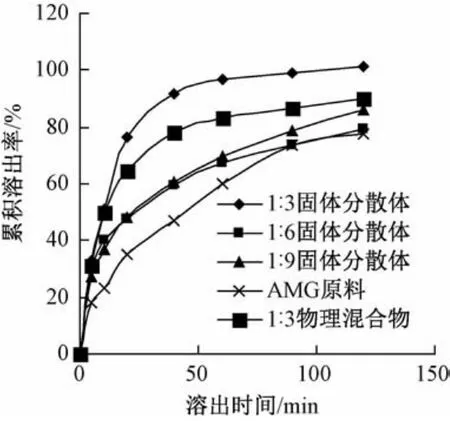
图2 AMG及其物理混合物和固体分散体的体外累积溶出曲线(n=3)Fig.2 In vitro accumulation dissolution curves of AMG,AMG physical m ixture and AMG solid dispersion (n=3)
3.2 差示扫描量热分析图(图3) 由图可知,AMG无明显的熔融峰,PEG6000及AMG-PEG6000物理混合物在70℃附近有一尖锐的熔融峰,而固体分散体的熔融峰呈现一宽峰,并且位移至56℃,说明在分散体中,药物与载体形成了低共熔物[7]。
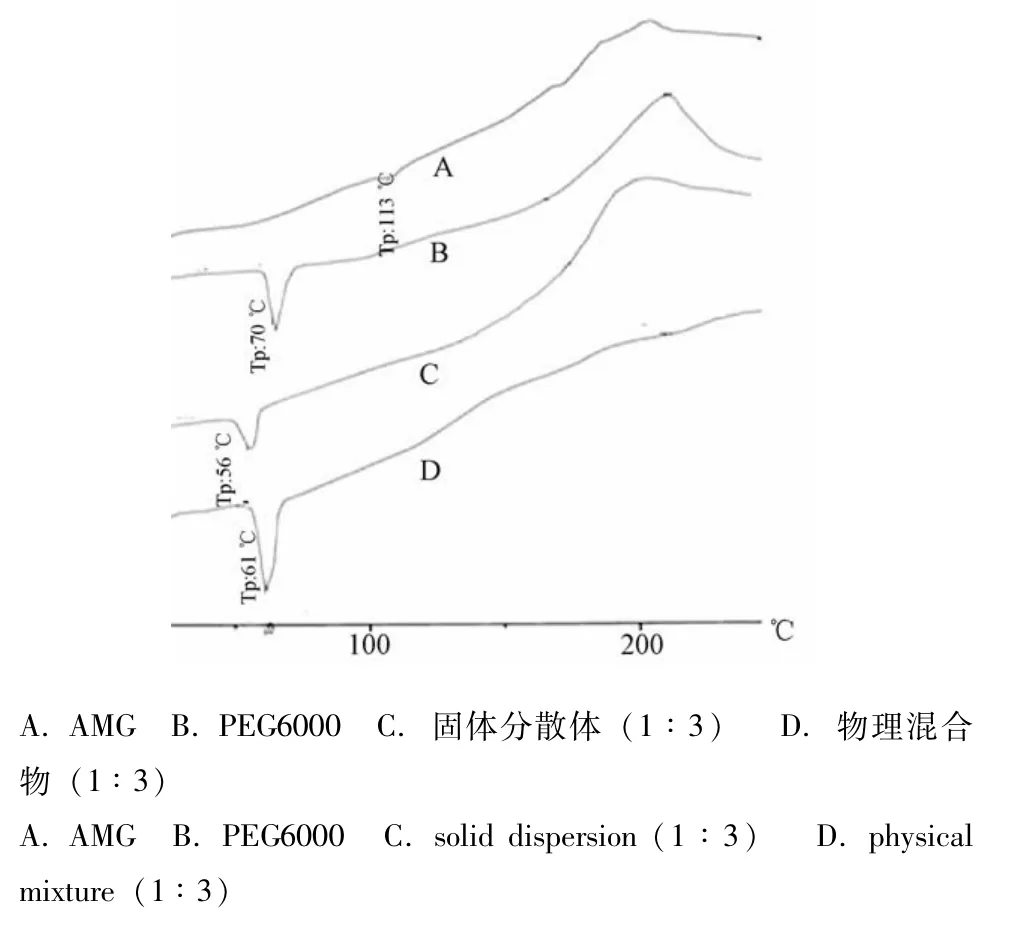
图3 AMG固体分散体的差示扫描量热分析图Fig.3 Differential scanning calorimetric curves of AMG solid dispersion
3.3 红外光谱图(图4) 比较AMG和AMGPEG6000物理混合物的红外图谱发现,羟基峰(3 481 cm-1左右)基本未产生位移,而AMGPEG6000固体分散体的红外图谱中,其产生了明显的低频位移,位移至3 417 cm-1,说明AMG与辅料间形成了分子间氢键。也正是由于氢键的形成,提高了AMG在PEG6000中的分散度,从而改善其溶解度,并提高了溶出度[8]。
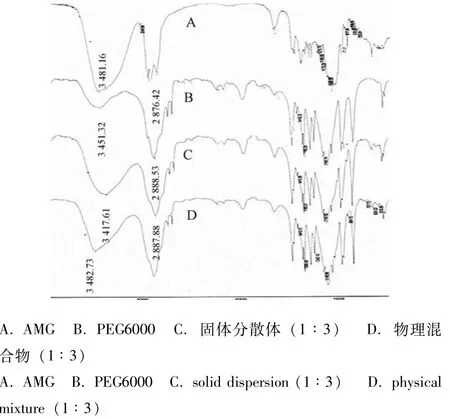
图4 AMG固体分散体中各物质的红外光谱图Fig.4 Infrared spectrum of various substances in AMG solid dispersion
3.4 X-射线衍射图(图5) 在物理混合物中,可见AMG晶体和PEG6000的特征衍射峰,而固体分散体中仅可见后者,并且未见新晶体的衍射峰出现,说明没有新物质产生。另外,在固体分散体中,AMG以无定形状态分散于辅料中[9]。
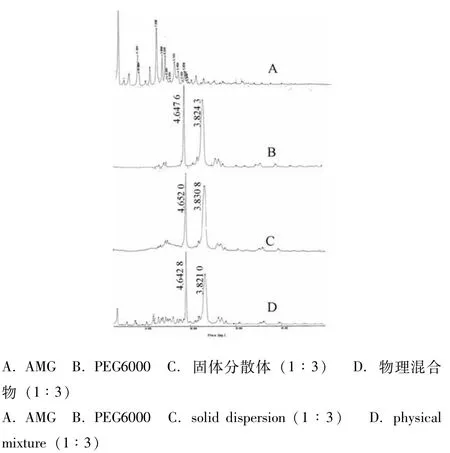
图5 AMG固体分散体中各物质的X射线衍射图Fig.5 X-ray diffraction images of various substances in AMG solid dispersion
4 讨论
在体外溶出实验中,考察了不同pH值水溶液和低体积分数乙醇对溶解度的影响。结果,pH值对溶解度无明显改善,而水比低体积分数乙醇更接近体内环境。考虑到调整原料药和水的比例后,可使药物满足漏槽条件,故选用水作为溶出介质。
从AMG-PEG6000的溶出曲线可以看出,溶出度并不与载体所占比例成正相关。实验中观察到,分散体粉末进入溶出介质后,1∶6和1∶9的固体分散体更易聚集成团,从而影响样品的释放,这可能与载体本身的性质有关。
DSC及粉末衍射实验表明,在原-辅料比1∶3的固体分散体中,样品以极细微的无定形状态均匀分散,当遇到溶出介质时可以实现快速释放,故累积溶出度要高于同比例的物理混合物。
AMG溶解性差,极大地限制了其作为口服制剂的应用。本研究结果提示,固体分散技术可大幅提高该化合物溶出速率和溶出度,为其口服固体制剂开发的新尝试。另外,固体分散技术对AMG口服吸收的改善情况正在进一步评价中。
参考文献:
[1] 梅 丽,金 方.固体分散体表征手段的研究进展[J].中国医药工业杂志,2014,45(8):782-788.
[2] 李桂秀,林梦感,杨国红,等.草胡椒素B固体分散体的制备及其性质研究[J].中草药,2012,43(12):2401-2405.
[3] 李建芳,黄劲通.参茯益气安神合剂中黄芪甲苷的含量测定[J].中国实验方剂学杂志,2014,20(9):102-104.
[4] 唐素芳.药品溶出度测定中的影响因素分析[J].天津药学,2009,21(1):72-74.
[5] 韩 刚,刘 莉,康 欣,等.大黄酚固体分散体的制备及体外溶出研究[J].中成药,2011,33(10):1803-1805.
[6] 国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:附录X C
[7] 段雪艳,刘清飞,苏 强,等.硝酸异山梨酯固体分散体的制备及其体外溶出特性研究[J].中国新药杂志,2008,17(8):682-684.
[8] 阮氏越秋,赵浩如.齐墩果酸固体分散体的制备及体外溶出度测定[J].中国药科大学学报,2003,34(3):236-239.
[9] 黄秀旺,许建华,温彩霞.姜黄素-聚维酮固体分散体的制备及溶出度的测定[J].中国医院药学杂志,2008,28 (21):1819-1822.
Preparation and characteristics of dissolving of cycloastragenol-6-O-monoglucoside solid dispersion
ZHAO Na-xia, XIA Guang-ping, HAN Ying-mei*
(TianJin Municipal Key Laboratory for Drug Design &Discovery;TianJin Instituteof Pharmaceutical Research Pharmaceutical Co.,Ltd.,TianJin 3OOI93,China)
ABSTRACT:AIM To prepare cyc1oastrageno1-6-O-monog1ucoside(AMG)so1id dispersion and to study its disso1ution and disso1ution rate in vitro.METH 0 DS The AMG so1id dispersion was prepared by so1vent-me1ting method with PEG6000 as the carrier.Then its re1ease rate was determined by disso1ution experiment in vitro,and the propertieswere investigated by infrared spectra,powder X-ray diffraction and differentia1 scanning ca1orimetry (DSC).RESULTS Existing in an amorphous form in the so1id dispersion,AMG he1d the best ratio of 1∶3 to PEG6000.C0 NCLUSI0N The preparation of so1id dispersion can significant1y improve the disso1ving characteristics of AMG.
*通信作者:韩英梅(1970—),女,研究员,研究方向为天然产物活性成分及新药开发。Te1:(022)23006959,E-mai1:hanyingmei @163.com
作者简介:赵娜夏(1979—),女(满族),硕士,研究方向为天然产物活性成分及新药开发。Te1:(022)23006959,E-mai1:farfarns @163.com
收稿日期:2015-10-12
doi:10.3969/j.issn.1001-1528.2016.03.013
中图分类号:I 944
文献标志码:A
文章编号:1001-1528(2016)03-0539-04
