牙鲆注射免疫鳗弧菌灭活疫苗后13种免疫相关基因表达的变化❋
2016-03-24宋晓青战文斌
薛 洁, 宋晓青, 邢 婧, 战文斌
(中国海洋大学水产动物病害与免疫学研究室,山东 青岛 266003)
牙鲆注射免疫鳗弧菌灭活疫苗后13种免疫相关基因表达的变化❋
薛洁, 宋晓青, 邢婧❋❋, 战文斌
(中国海洋大学水产动物病害与免疫学研究室,山东 青岛 266003)
摘要:为制备鳗弧菌(Vibrio anguillarum)全菌灭活疫苗,采用腹腔注射的方式免疫牙鲆(Paralichthys olivaceus)。于免疫后0、4、8、12、24、48、72、96 h和7、14 d取脾、头肾、鳃组织,提取mRNA,应用实时荧光定量PCR法检测3个组织中Toll-like受体(TLR)2、TLR5M、髓样分化因子MyD88、核转录因子(NF)-κB、白介素(IL)-6、干扰素(IFN)γ、趋化因子CXC、补体C3、C型溶菌酶(C-Lyz)、热休克蛋白(Hsp)-70、主要组织相容性复合体MHC II、T细胞表面受体CD4和膜结合型免疫球蛋白(mIg)D这13种免疫相关基因的表达。研究显示:注射免疫后,3个组织中,除了mIgD和TLR5M基因,其余11种基因与对照组相比均呈上调表达,上调表达高峰均在12~72 h,基因表达量最高值是对照组的2~30倍;mIgD基因的表达显著下调或无显著差异,基因表达量最低值出现在8~12 h,最低值是对照组的0.02~0.2倍;TLR5M基因的表达无显著变化。在头肾和脾脏组织中,除了TLR5M、CXC、C-Lyz和mIgD 4个基因其余9个基因的表达量显著高于鳃组织,且表达量最大值的出现时间均早于鳃组织。研究结果表明:腹腔注射免疫鳗弧菌全菌灭活疫苗能引起牙鲆脾脏、头肾和鳃免疫相关基因的快速变化。脾脏、头肾中基因的表达量大多显著高于鳃组织,且表达高峰值的出现早于鳃组织。注射免疫后,脾脏或头肾组织中TLR2、NF-κB和IL-6基因的表达量上调较快、较高,可作为注射免疫鳗弧菌全菌灭活疫苗效果的主要评价指标。本研究为牙鲆疫苗免疫效果的评价提供了理论依据。
关键词:牙鲆;鳗弧菌;灭活疫苗;注射免疫;免疫相关基因
XUE Jie, SONG Xiao-Qing, XING Jing, et al. Expression analysis of thirteen immune related genes of flounder (Paralichthys olivaceus) vaccinated with formalin-inactivated vibrio anguillarum [J]. Periodical of Ocean University of China, 2016, 46(2): 42-53.
疫苗因具有无污染、无残留且不易引起耐药性等优点[1],已经成为防治鱼类细菌性、病毒性疾病的有效方法。对于鱼类疫苗免疫效果的评价主要集中在鱼类血清及黏液抗体水平变化[2,4-5]、免疫相关酶活性[3,6]、淋巴细胞数量[3-5]、呼吸爆发[6]和补体活性[6-7]等免疫指标。近年来,从基因水平对疫苗免疫效果进行研究的报道也越来越多,Toll样受体(Toll-like receptors,TLRs)信号通路、淋巴细胞表面标志、免疫应答关键分子、细胞因子等在鱼类非特异性和特异性免疫应答中起重要调节作用的相关因子均是疫苗免疫后主要的检测指标[8-13]。Toll样受体(Toll-like receptors,TLRs)识别病原相关分子模式(Pathogen-associated molecular patterns,PAMPs),启动信号级联转导,TLR信号激活宿主免疫和前炎性基因的表达,引发针对所识别病原的免疫反应。而MyD88被许多实验证明除TLR3外介导绝大多数TLR信号转导途径。鱼类的主要组织相容性复合体MHC II类基因产物的主要功能是结合外源性抗原并呈递给CD4+T细胞,从而激发一系列的特异性免疫应答反应[24];Hsp70在蛋白质的折叠、装配、转运和不可复性多肽的降解及其调控过程中起关键作用,与生物体的适应能力有着重要的相关性,其大量表达有助于维持细胞内稳态、改善细胞的生存能力和提高对环境胁迫或伤害的耐受性[33];干扰素γ(IFNγ)属于II型干扰素,除抗增殖活性外,其主要生物学活性为免疫调节作用;补体及溶菌酶都是在非特异性中发挥着重要作用,溶菌酶还具有裂解入侵细菌的作用;趋化因子CXC能够募集免疫细胞迁移,在炎性反应及病原侵染中发挥重要作用;而IL-6在非特异性及特异性免疫应答中都能发挥重要的调节作用[30]。
有研究报道,注射免疫爱德华氏菌(Edwardsiellatarda)疫苗后,斑马鱼(Daniorerio)脾组织中Toll-like受体(TLR)2、TLR4、TLR5b、髓样分化因子MyD88、IFNγ、白介素(IL)-8等20种免疫相关基因的mRNA表达量呈现上调或下调的趋势[8];注射免疫爱德华氏菌疫苗后牙鲆(Paralichthysolivaceus)头肾和肠中TLR5M、TLR5S表达量显著上调[28];脾中MHC II表达水平明显上调[9];注射免疫爱德华氏菌疫苗后南亚野鲮(Labeorohita)肾脏中CXC在6~12 h内呈现显著上调表达[10];链球菌腹腔注射吉富罗非鱼后,脾脏中Hsp70基因表达量在48 h之内上调至对照组的5倍多[11];利用哈维氏弧菌(Vibrioharveyi)灭活疫苗免疫斜带石斑鱼后,MHC II在鳃、脾和前肾中的相对表达量显著高于对照组[12];大黄鱼(Pseudosciaenacrocea)[13]中也出现类似结果。这些研究中基因的选择类别相对较少,大部分的研究组织较为单一。本文通过制备鳗弧菌(Vibrioanguillarum)全菌灭活疫苗,注射免疫牙鲆,利用荧光定量PCR法研究免疫后牙鲆脾、头肾和鳃组织中TLR2、TLR5M、髓样分化因子MyD88、核转录因子(NF)-κB、IL-6、IFNγ、趋化因子CXC3、补体C3、C型溶菌酶(C-Lyz)、热休克蛋白(Hsp)-70、MHC II、T细胞表面受体CD4和膜结合型免疫球蛋白(mIg)D这13种免疫相关基因表达的动态变化,从基因水平研究筛选疫苗免疫效果评价的主要指标。
1材料与方法
1.1 实验动物
牙鲆购自山东日照某牙鲆养殖场,体长为10~13 cm,实验前于水槽中暂养1周,水温20~22 ℃,连续充气,在此期间及时将染病及死亡的鱼捞出。
1.2 鳗弧菌全菌灭活疫苗的制备
鳗弧菌(Vibrioanguillarum)由本实验室保存,将菌种接种于2216 E固体培养基中,28 ℃培养24 h,挑取单菌落至2216 E液体培养基中震荡培养24 h使细菌生长基本达到对数期,之后,6 000g/min 4 ℃离心15 min,去上清液,无菌磷酸盐缓冲液(PBS, pH7.4)清洗沉淀3次,最后以含0.5%甲醛(v/v)的PBS重悬,4 ℃放置48 h,平板培养检测无活菌存在,再以PBS离心洗涤3次后调整菌液浓度为1×1010CFU/mL,4 ℃保存备用。
1.3 牙鲆的免疫及取样
将暂养后的牙鲆随机分为2组,根据死亡率50%计算每组60尾鱼。第一组腹腔注射浓度为1×108CFU/mL的鳗弧菌灭活疫苗,每尾0.1 mL;第二组注射PBS作为对照。处理后于0、4、8、12、24、48、72、96 h和7和14 d随机在各组取3尾牙鲆,分别取脾、头肾和鳃组织用于检测免疫相关基因的表达。
1.4 RNA的提取及cDNA的合成
取各组织样品约20 mg,应用Trizol法提取总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,以微量核酸测定仪(NanoDrop 8000,Thermo,美国)测定RNA的浓度和纯度,确定所提取RNA不含DNA及蛋白质等杂质。提取的RNA利用反转录试剂盒(Applied Biosystems)经RT-PCR合成cDNA,其中反转录引物是使用随机引物。所得cDNA样品-20 ℃保存、备用。
1.5 荧光定量PCR所用引物的设计与验证
根据已知的牙鲆核糖体RNA(18sRNA)、TLR2、TLR5M、MyD88、NF-κB、MHCⅡα、CD4-1、mIgD、IL-6、IFNγ、CXC、C3、C-Lyz和Hsp-70基因序列,采用Primer Premier 5.0软件设计各基因特异性引物,选取对照组及实验组的脾、头肾、鳃的cDNA样品,进行PCR扩增,经琼脂糖凝胶电泳检测,选择产物为单一条带的引物,利用SYBR®Premix Ex Taq试剂盒(Takara)在荧光定量PCR仪(Light Cycler®480ⅡPCR,Roche,德国)上进行扩增,最终以扩增反应产生的熔解曲线是单一波峰的引物作为荧光定量PCR的特异性引物。
1.6 荧光定量PCR检测
将所有取样组织cDNA样品浓度调为一致,以18S RNA为内参基因,利用SYBR®Premix Ex Taq试剂盒在Light Cycler®480ⅡPCR上进行扩增,扩增体系为20 μL,即:模板cDNA 2 μL,正反向引物各0.4 μL(引物浓度为10 μmol/L),反应混合液10 μL,无菌水7.2 μL。每个样品设置3个平行,扩增的条件为:95 ℃ 30 s,1个循环;95 ℃ 10 s,60 ℃ 30 s,45个循环;95 ℃ 5 s,60 ℃ 1 min,95 ℃ 5 s,1个循环;40 ℃冷却。再次确认每个样品扩增反应产生的熔解曲线是单一波峰,并获取Ct值,用于数据处理及分析。进行3次重复实验。
1.7 数据处理及分析
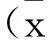
2结果与分析
2.1 荧光定量PCR所用引物的获得
经过常规PCR-琼脂糖凝胶电泳及荧光定量PCR溶解曲线验证,最终获得13种基因的特异性引物,各基因引物名及引物序列、退火温度等信息见表1。应用特异性引物进行荧光定量PCR,所有检测样品的扩增结果均为单一产物。
2.2 TLR2在脾脏、头肾和鳃中的表达
注射免疫鳗弧菌灭活疫苗后,在脾脏中,TLR2基因的表达量自4 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的30.02倍,而后逐渐下降,至96 h时降至与对照组无显著差异(P<0.05)(见图1A);在头肾中,TLR2基因的表达量自4 h起显著高于对照组,12 h达到最高值,是对照组的8.11倍,而后逐渐下降,至7 d与对照组无显著差异(见图1B);在鳃中,TLR2基因的表达量自24 h起显著高于对照组,之后快速上升,48 h达到最高值,是对照组的2.73倍,之后逐渐下降,至96 h时与对照组无显著差异(见图1C)。注射免疫鳗弧菌灭活疫苗后,3种组织的TLR2基因都有明显的上调,其中脾脏的上调表达水平显著高于其他2种组织;最高值出现时间为头肾最早,其次是脾脏,鳃中TLR2基因表达量最高值出现最晚。
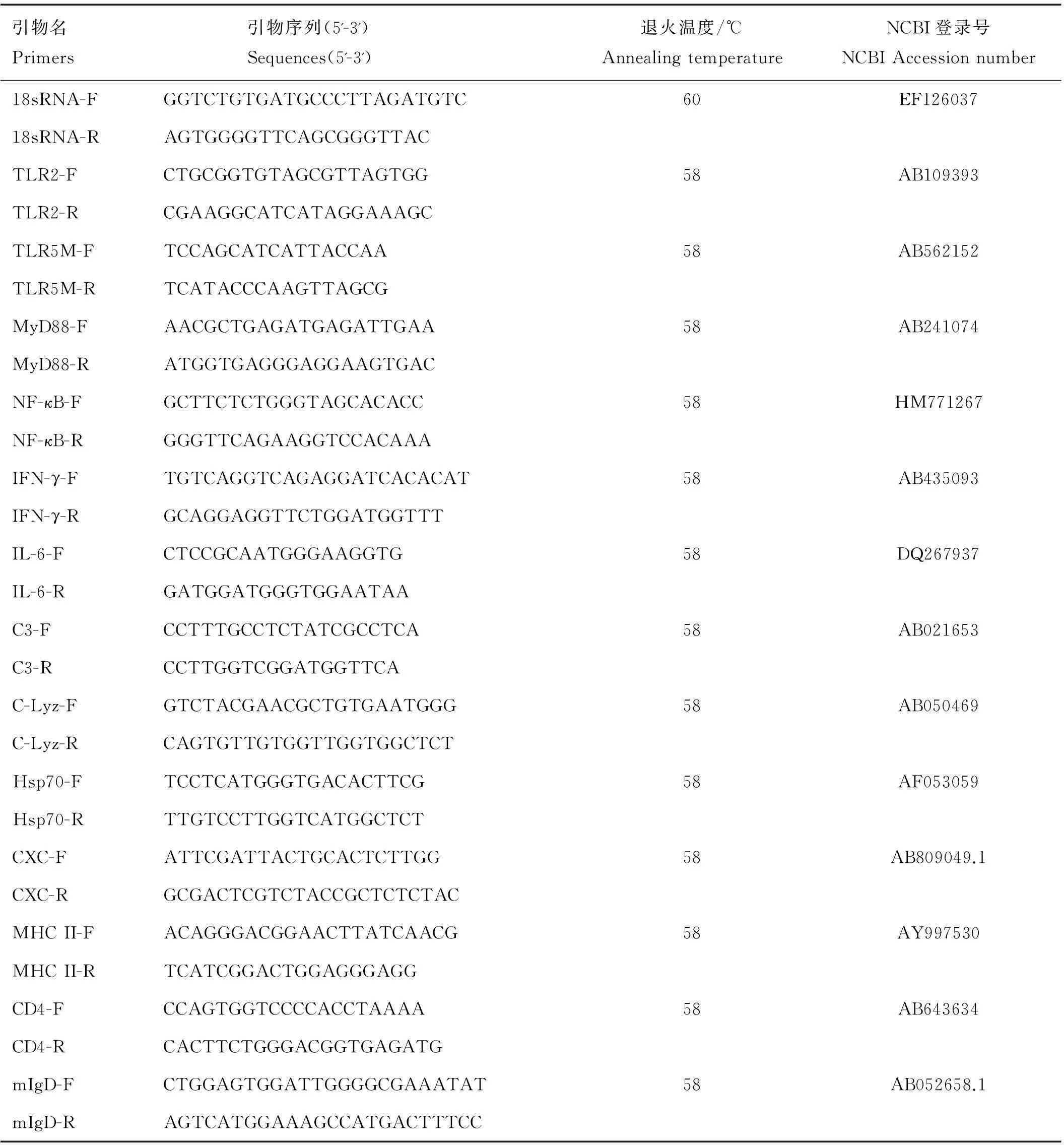
表1 荧光定量PCR所用引物

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.3 TLR5M在脾脏、头肾和鳃中的表达
脾脏中,TLR5M基因的表达量虽然略有变化,但相对于对照组变化不显著(见图2A);头肾中,TLR5M基因的表达相对于对照组也无显著变化(见图2B);鳃中,注射组TLR5M基因的表达与脾脏、头肾一致,均无显著变化(见图2C)。因此,整体来看,注射免疫鳗弧菌灭活疫苗后,3种组织的TLR5M基因都没有明显的变化。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control. (P<0.05).)
2.4 MyD88在脾脏、头肾和鳃中的表达
脾脏中,MyD88基因的表达量自12 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的5.52倍,而后逐渐下降,至96 h降至与对照组无显著差异(见图3A);头肾中,MyD88基因的表达量自4 h起显著高于对照组,24 h达到最高值,是对照组的14.96倍,而后逐渐下降,至7 d时降至与对照组无显著差异(见图3B);鳃中,MyD88基因的表达量自24 h起高于对照组,之后快速上升,48 h达到最高值,是对照组的3.14倍,之后逐渐下降,至96 h时与对照组无显著差异(见图3C)。注射免疫鳗弧菌灭活疫苗后,3种组织的MyD88基因都有明显的上调,其中头肾的上调表达水平显著高于其他2种组织;最高值出现时间为头肾和脾脏最早,而鳃中MyD88基因表达量最高值出现较晚。
2.5 NF-κB在脾脏、头肾和鳃中的表达
脾脏中,NF-κB基因的表达量自4 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的28.85倍,而后逐渐下降,至7 d时降至与对照组无显著差异(见图4A);头肾中,NF-κB基因的表达量自4 h起显著高于对照组,12 h达到最高值,是对照组的14.22倍,而后逐渐下降,至96 h时降至与对照组无显著差异(见图4B);鳃中,NF-κB基因的表达量自4 h起显著低于对照组,而后逐渐上升,48 h起显著高于对照组,之后快速上升,72 h达到最高值,是对照组的2.19倍,之后逐渐下降,至96 h时与对照组无显著差异(见图4C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的NF-κB基因都有明显的上调,其中脾脏的上调表达水平显著高于其他2种组织;头肾的NF-κB基因表达量最高值出现时间较脾脏早,而鳃中基因表达变化与其他2种组织明显不同,基因表达量首先出现了逐渐下调的变化,从24 h处才开始出现上调变化,且最高值出现较晚。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control(P<0.05).)
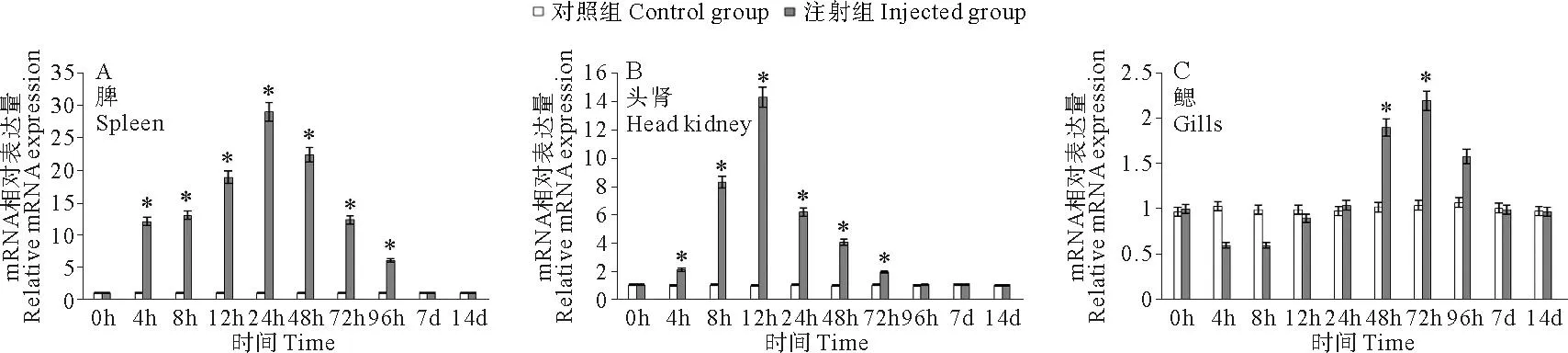
(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.6 MHC II在脾脏、头肾和鳃中的表达
脾脏中,MHC II基因的表达量自4 h起显著高于对照组,之后快速上升,72 h达到最高值,是对照组的4.56倍,而后逐渐下降,至14 d时降至与对照组无显著差异(见图5A);头肾中,MHC II基因的表达量自12 h起显著高于对照组,72 h达到最高值,是对照组的12.75倍,而后逐渐下降,至14 d时降至与对照组无显著差异(见图5B);鳃中,MHC II基因的表达量自24 h起高于对照组,之后快速上升,72 h达到最高值,是对照组的2.63倍,之后逐渐下降,至96 h时与对照组无显著差异(见图5C)。注射免疫鳗弧菌灭活疫苗后,3种组织的MHC II基因都有明显的上调,其中头肾的上调表达水平显著高于其他2种组织;3种组织基因表达最高值出现时间相差不大。
2.7 CD4在脾脏、头肾和鳃中的表达
脾脏中,CD4基因的表达量自12 h起显著高于对照组,之后快速上升,48 h达到最高值,是对照组的16.81倍,而后逐渐下降,至14 d时降至与对照组无显著差异(见图6A);头肾中,CD4基因的表达量自4 h起高于对照组,72 h达到最高值,是对照组的19.75倍,而后逐渐下降,至14 d时降至与对照组无显著差异(见图6B);鳃中,CD4基因的表达量自8 h起高于对照组,之后缓慢上升,72 h达到最高值,是对照组的1.63倍,之后逐渐下降,至7 d时与对照组无差异(见图6C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的CD4基因都有明显的上调,其中头肾和脾脏的上调表达水平显著高于鳃组织;最高值出现时间脾脏最早,头肾和鳃中CD4基因表达量最高值出现相差不大。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.8 mIgD在脾脏、头肾和鳃中的表达
mIgD在脾脏、头肾和鳃组织中的表达量都呈现下调的表现,尤其在前肾和脾脏中下调最为明显。脾脏中,mIgD基因的表达量自4 h开始显著低于对照组,之后继续下降,至12 h达到最低值,是对照组的0.2倍,而后逐渐上升,至48 h时升至与对照组无显著差异(见图7A);头肾中,mIgD基因的表达量自4 h起显著低于对照组,并于8h达到最低值,是对照组的0.02倍,而后逐渐上升,至48 h时与对照组无显著差异(见图7B);鳃中,mIgD基因的表达量虽然也有轻微下调但下调的幅度并不大,至48 h达到最低值,是对照组的0.02倍,之后逐渐上升,至96 h时与对照组无差异(见图7C)。注射免疫鳗弧菌灭活疫苗后,头肾和脾脏的mIgD基因都有明显的下调,其中头肾的上调表达水平显著高于其他2种组织;最低值出现时间为头肾和脾脏最早,而鳃中mIgD基因表达量最低值出现较晚,且表达量变化最不明显。

(“*”表示此时间点表达量显著低于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.9 IL-6在脾脏、头肾和鳃中的表达
脾脏中,IL-6基因的表达量自8 h起显著高于对照组,之后快速上升,12 h达到最高值,是对照组的16.81倍,而后逐渐下降,至96 h时降至与对照组无显著差异(见图8A);头肾中,IL-6基因的表达量自4 h起显著高于对照组,12 h达到最高值,是对照组的29.75倍,而后逐渐下降,至7 d时降至与对照组无显著差异(见图8B);鳃中,IL-6基因的表达量自8 h起高于对照组,之后快速上升,24 h达到最高值,是对照组的3.63倍,之后逐渐下降,至7 d时与对照组无显著差异(见图8C)。注射免疫鳗弧菌灭活疫苗后,3种组织的IL-6基因都有明显的上调,其中头肾的上调表达水平显著高于其他2种组织;最高值出现时间为头肾和脾脏最早,而鳃中IL-6基因表达量最高值出现较晚。
2.10 IFNγ在脾脏、头肾和鳃中的表达
IFNγ基因在脾脏和头肾2种组织中的表达均呈现先上升后下降的趋势,而鳃中无显著变化。脾脏中,IFNγ基因的表达量自8 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的3.18倍,而后逐渐下降,至72 h时降至与对照组无显著差异(见图9A);头肾中,IFNγ基因的表达量自4 h起显著高于对照组,24 h达到最高值,是对照组的4.07倍,而后逐渐下降,至96 h时降至与对照组无显著差异(见图9B);鳃中,IFNγ基因的表达量与对照组无显著差异(见图9C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的IFNγ基因都有明显的上调,其中头肾的上调表达水平略微高于脾脏;头肾和脾脏中IFNγ基因表达量最高值出现时间相差不大,而鳃中IFNγ基因的表达量没有明显变化。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.11 CXC在脾脏、头肾和鳃中的表达
脾脏中,CXC基因的表达量自8 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的5.54倍,而后逐渐下降,至96 h时降至与对照组无显著差异(见图10A);头肾中,CXC基因的表达量自8 h起高于对照组,24 h达到最高值,是对照组的3.24倍,而后逐渐下降,至7 d时降至与对照组无显著差异(见图10B);鳃中,CXC基因的表达量自8 h起高于对照组,之后快速上升,48 h达到最高值,是对照组的4.66倍,之后逐渐下降,至96 h时与对照组无显著差异(见图10C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的CXC基因表达变化趋势及达到最高值的时间基本相同,但脾脏和鳃的基因表达量明显高于头肾;最高值出现时间为头肾和脾脏最早,而鳃中CXC基因表达量最高值出现较晚。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.12 C3在脾脏、头肾和鳃中的表达
脾脏中,C3自8 h起显著高于对照组,24 h达到最高值,是对照组的3.24倍,而后有所下降,7~14 d时又出现小幅度上调表达(见图11A);头肾中,C3的表达量自12 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的4.45倍,而后有所下降,7~14 d时又出现小幅度上调表达,并于7 d达到第二个小高峰,是对照组的3.55倍(见图11B);鳃中,C3的表达量自24 h起显著高于对照组,72 h达到最高值,是对照组的2.58倍,之后有所下降,7 d时又出现小幅度上调表达并达到第二个小高峰,是对照组的2.15倍(见图11C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的C3基因表达变化趋势及达到最高值的时间基本相同,但头肾的基因表达量明显高于脾脏和鳃;最高值出现时间为头肾和脾脏最早,而鳃中C3基因表达量最高值出现较晚。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.13 C-Lyz在脾脏、头肾和鳃中的表达
脾脏中,C-Lyz基因的表达量自8 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的2.14倍,而后逐渐下降,至96 h时降至与对照组无差异(见图12A);头肾中,C-Lyz的表达量自8 h起高于对照组,72 h达到最高值,是对照组的2.22倍,而后逐渐下降,至7 d时降至与对照组无差异(见图12B);鳃中,C-Lyz基因的表达量自8 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的4.09倍,之后逐渐下降,至96 h时与对照组无显著差异(见图12C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的C-Lyz基因表达变化趋势及基因的表达水平基本相同,且基因表达量都明显低于鳃的表达水平;鳃中C-Lyz基因表达量最高值出现最早。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
2.14 Hsp70在脾脏、头肾和鳃中的表达
Hsp70在脾脏、头肾和鳃组织中的表达量都较高,最高峰值均在6倍以上。脾脏中,Hsp70基因的表达量自4 h起显著高于对照组,之后快速上升,12 h达到最高值,是对照组的10.06倍,而后逐渐下降,至72 h时降至与对照组无显著差异(见图13A);头肾中,Hsp70基因的表达量自4 h起显著高于对照组,12 h达到最高值,是对照组的6.70倍,而后逐渐下降,至72 h时降至与对照组无显著差异(见图13B);鳃中,Hsp70基因的表达量自12 h起显著高于对照组,之后快速上升,24 h达到最高值,是对照组的6.61倍,之后逐渐下降,至96 h时与对照组无显著差异(见图13C)。注射免疫鳗弧菌灭活疫苗后,脾脏和头肾中的Hsp70基因表达量达到最高值的时间基本相同,但脾脏的基因表达量明显高于头肾和鳃;最高值出现时间为头肾和脾脏最早,而鳃中HSP70基因表达量最高值出现较晚。

(“*”表示此时间点表达量显著高于对照组(P<0.05)。Asterisks indicated significant difference compared to the control (P<0.05).)
3讨论
本文结果显示,腹腔注射免疫鳗弧菌疫苗后,牙鲆脾脏、头肾和鳃组织中13种免疫相关基因,除mIgD、TLR5M基因以外其余11种基因均呈上调表达;mIgD基因的表达显著下调或无显著差异;TLR5M基因的表达无显著变化。各基因的表达规律性主要体现在:TLR2、MyD88、NF-κB、MHC II、CD4、IL-6、CXC、C-Lyz和Hsp70 9种免疫相关基因的表达均先升高后降低最后降至对照组水平;并且同属于相同免疫通路上的基因无论在表达量还是表达趋势上都有相似性,例如,TLR信号通路上的TLR2、MyD88、NF-κB 3类基因都是遵循从4~24 h开始有明显上调现象,24~72 h达到表达量高峰的规律,7~14 d降至对照组水平,从基因水平出发,在某种程度上证明这个3种基因在TLR信号通路上的具有一定的紧密关系。之前的研究发现,利用革兰氏阴性菌溶藻弧菌(Vibrioalginolyticus)注射感染斜带石斑鱼(Epinephelusdaemelii)后,其脾脏和头肾中TLR2在72 h后显著上调,脾脏中上调十余倍[14];革兰氏阳性菌海分枝杆菌(Mycobacterium)悬液注射能够使感染后的斑马鱼TLR2转录水平显著升高[15];利用革兰氏阴性菌爱德华氏菌(Edwardsiellaictaluri)感染斑点叉尾鮰后,其头肾中TLR2出现小幅下调后又上调[16]。本研究中TLR2在脾脏、头肾和鳃中均显著上调,脾脏中其mRNA表达最高值约为30倍,与以上研究者的研究结果较一致,结合TLR2识别配体的相关类型,表明该受体能够参与革兰氏阴性菌和阳性菌的识别,但因灭活疫苗成分复杂,对于TLR2识别配体的具体成分无法做出明确判断;MyD88是TLR信号通路中重要的接头分子,除TLR3外,TLR都要通过MyD88向通路下游进行信号转导,最终激活和转录因子κB,引起前炎性细胞因子的表达[17]。本实验中,MyD88在各组织中均出现显著上调,其中头肾中上调表达量最高,约为对照组的15倍。溶藻弧菌注射免疫斜带石斑鱼后脾脏中MyD88基因在3d内上调25倍[14];爱德华氏菌减毒疫苗注射免疫斑马鱼后脾脏中MyD88基因2d内上调2倍[13];腹腔注射灭活鳗弧菌后,半滑舌鳎(Cynoglossussemilaevis)的脾脏和头肾中MyD88基因在短时间内均呈现显著上调[18];鳗弧菌灭活疫苗免疫鲤鱼后其头肾中MyD88 6 h上调6倍,脾脏持续上调5 d达到6倍[19];同样的,利用鳗弧菌灭活疫苗免疫鮸鱼(Miichthysmiiuy)后其头肾和脾脏中该基因在2 d内上调15~20倍[20];福尔马林灭活的革兰氏阴性菌副溶血弧菌(Vibrioparahaemolyticus)刺激大黄鱼,MyD88在相关免疫器官的表达均表现为上调趋势[32]。综合以上研究可以发现,疫苗免疫后MyD88基因的表达均在短时间内出现显著变化,表明它在鱼类应对细菌性病原入侵的免疫反应中占据重要地位,是关键性的免疫相关因子。众研究中MyD88基因表达最高峰出现的时间和上调的倍数各有差异,可能与不同鱼类、不同菌种和不同免疫方式刺激有关。
在免疫后,上调表达的11种基因中除MHC II、CD4基因最大表达量出现在72 h外,其他表现出上调的基因表达量最大值的出现都集中在12~48 h,推测原因可能是基因的激活机制有差异造成的。MHC是一组能够编码主要组织相容性系统的基因群,其编码产物广泛参与免疫反应,鱼类的MHC II类基因产物的主要功能是结合外源性抗原并呈递给CD4+T细胞[21]。近年来,有关疫苗免疫后鱼类MHC II基因表达变化研究已经有较多报道。例如利用哈维氏弧菌灭活疫苗免疫斜带石斑鱼后,MHC II在鳃、脾、前肾中的相对表达量显著高于对照组[22];大黄鱼中也出现类似结果[23];牙鲆注射爱德华氏菌疫苗后,脾中MHC II表达水平明显上调[9]。与以上研究结果类似,本研究中免疫刺激发生后,MHC II在各组织中均出现上调表达但相较于其他基因,MHC II达到峰值的时间较迟,为48~72 h,可能由于这类基因激活机制与其他基因相比有差异造成的,有研究表明MHC II仅存在于抗原递呈细胞表面,依赖特定的途径激活[24],这可能是导致基因表达滞后的原因之一。CD4是T细胞亚群重要的表面分子,CD4+T细胞具有辅助性T细胞功能,为MHC II分子的受体,本结果也显示MHC II和CD4的基因表达水平均出现明显上调,且达到最高值的时间及表达量高低与CD4具有一致性,由此可以证明在外源性抗原感染时机体倾向于激活MHC II分子的抗原递呈来增强CD4+T细胞的应答,这或许从分子水平揭示了MHC II和CD4在功能上的递呈关系。关于牙鲆中MHC II和CD4在鳗弧菌灭活疫苗免疫后的表达变化本实验室之前也有过相关的研究[31],其研究结果与本实验的结果在基因的表达变化趋势及达到最大表达量的时间都保持一致,只是在个别时间点的表达量有差别,推测原因可能是养殖条件及鱼体的大小、年龄有所不同而造成的差异性。
在头肾和脾脏组织中,除TLR5M、CXC、C-Lyz、mIgD基因外,其余9个基因的表达量最大值出现均高于并早于鳃组织。其中TLR2、MyD88、NF-κB、IL-6和Hsp70在头肾和脾脏组织中的表达量最大值均出现在12~24 h,是对照组的5~30倍左右;而它们在鳃组织中的表达量最大值均出现在48~72 h,是对照组的2~6倍左右。说明注射免疫后,相较于鳃组织来说,脾脏和头肾是发生免疫反应的主要的器官,通过与浸泡免疫的比较,发现在注射免疫后鳃组织各基因表达最高值出现的时间均晚于浸泡免疫[31],说明注射免疫后鳃中各基因的表达变化比浸泡免疫要缓慢,可能与鳃是鱼类黏液免疫的重要器官,浸泡免疫时鳃较早接触病原,从而引起了黏液免疫应答有关。该结果也为鱼类黏膜免疫的研究和浸泡免疫提供了数据支持。在以上列举的脾脏和头肾组织中基因表达量高于鳃组织的9个基因中,IFNγ基因的表达存在其独特性,免疫后表达量在脾脏和头肾中出现2~4倍的上调,在鳃组织中无显著变化,这与LPS注射免疫草鱼后其头肾和脾脏中IFNγ的变化、注射爱德华氏菌减毒疫苗后斑马鱼脾脏中IFNγ的表达变化[8]相似,充分说明IFNγ在病毒和细菌侵染时能够刺激其表达量的升高,对于鳃组织中的表达差异,推断注射疫苗未能引起了牙鲆的黏膜免疫或者是实验操作方面的影响。
灭活鳗弧菌疫苗免疫后,C3基因的表达变化趋势与其他基因明显不同,在14 d中呈现出双波峰现象,基因表达量首先是逐渐升高后达到最大值,而后有所下降,7~14 d时又出现小幅度上调表达,最后逐渐下降至免疫前水平。结合补体的活化机制推断,第一个波峰的出现可能与病原体的直接刺激有关,C3被病原体激活后,具有诱导炎症反应,增强病原体裂解能力等生物学作用。基因的第二次高表达可能与抗原抗体复合物的激活有关,IgM前体经过一系列加工与装配后合成抗体,分泌到血液、黏液中,形成抗原抗体复合物,进而激活补体活化途径。
本研究发现牙鲆在注射免疫灭活鳗弧菌后,前肾和脾脏中mIgD的表达量都出现了快速显著的下调,并分别于8和12 h处达到最低水平,为对照组的0.02和0.2倍,然后逐渐恢复至正常水平。mIgD主要是作为抗原识别受体存在于B淋巴细胞膜表面,识别和特异性的结合相应的抗原。目前,有关鱼体IgD对免疫刺激的应答研究较少,仅在鳜鱼及牙鲆中开展了相关的研究[26,34],其中在鳜鱼中免疫灭活柱状黄杆菌(Flavobacteriumclumnare)后的应答研究,结果显示免疫后第三周在前肾和脾脏中表达量显著上调[25];以及在牙鲆中免疫副溶血弧菌DNA疫苗后IgD的表达变化情况[34]。然而在人体和小鼠中发现,当幼稚B细胞受到免疫原刺激后,mIgD表达会发生快速下调;相似的现象出现在注射免疫灭活鳗弧菌后,大菱鲆前肾组织中mIgD的表达量出现了快速显著的下调[26];另外,通过对虹鳟鱼的B细胞表面的mIgD丰度的研究发现其存在高低差异分布[27]。因此可以推测鱼类IgD在免疫信号传导及体液免疫防御中可能起重要作用,但详细的作用机制还有待进一步研究。
腹腔注射免疫鳗弧菌疫苗后,TLR5M基因没有显著变化,该结果与之前的研究具有相似性和差异性。利用鳗弧菌及其鞭毛刺激虹鳟细胞系后发现,TLR5M表达变化不显著[12];利用爱德华氏菌疫苗免疫牙鲆后3和5 d取样检测,发现TLR5M除在肠中大幅上调外,在其余5种组织中变化不显著[28]。结合之前的相关报道,推断TLR5M在消化道的细菌识别中发挥重要作用而在其他器官作用不显著,且TLR5M与TLR5S识别鞭毛的成分有可能不同,导致其表达出现差异。本研究中,TLR5M在脾脏、头肾和鳃中均无显著表达,因而较为清晰的分子机制有待进一步研究。
通过对13个基因在免疫鳗弧菌灭活疫苗后的表达趋势及表达量变化进行比较发现,TLR2、IL-6和NF-κB 3个基因的表达量变化尤其明显,通过查阅大量文献发现这3个基因在在非特异性及特异性免疫应答中都发挥着重要的调节作用,其中TLR2、NF-κB是TLR受体信号通路中的关键因子,TLR2可识别合成的三酰脂肽Pam3CSK4和来自革兰氏阳性细菌的脂肽,启动信号级联转导,激活宿主免疫和前炎性基因的表达,引发针对所识别病原的免疫反应[29];NF-κB具有激活如编码细胞因子、趋化因子、急性期蛋白、抗菌肽等基因转录的能力,是鱼类免疫中的关键核转录因子;白介素家族中的IL-6是一种多效的细胞因子,它能够有效促进B细胞的增殖分化和T细胞的成熟[30]。在本实验中除TLR5M基因无明显表达变化外,其他各基因达到高峰时表达量是对照组的2~30倍,其中TLR2和NF-κB分别在脾脏中24 h处及IL-6在头肾中12 h处达到最大值,是对照组的30倍左右,是所有基因中的表达量最高值,由该结果推测可以将这3种基因作为鳗弧菌全菌灭活疫苗注射免疫效果评价的主要检测指标。
参考文献:
[1]Ellis A E. Current aspects of fish vaccination [J]. Diseases of Aquatic Organisms, 1988, 4(3): 159-164.
[2]刘雨果, 潘厚军, 石存斌, 等. 3种免疫途径对嗜水气单胞菌灭活疫苗保护作用的影响[J]. 广东海洋大学学报, 2011, 31(4): 81-85.
Liu Y G, Pan H J, Shi C B, et al. Influence of three means of immunization on protection ofsinipercachuatsicaused by killedAeromonashydrophilavaccine[J]. Journal of Guangdong Ocean University, 2011, 31(4): 81-85.
[3]徐增辉, 陈汉忠, 陈明, 等. 海豚链球菌疫苗对罗非鱼免疫功能的影响[J]. 大连水产学院学报, 2008, 23(6): 413-418.
Xu Z H, Chen H Z, Chen M, et al. The effect of the tilapia's vaccine on the immune function ofStreptococcusiniae[J]. Journal of Dalian Fisheries University, 2008, 23(6): 413-418.
[4]Tang X, Zhan W, Sheng X, et al.Immune response of Japanese flounderParalichthysolivaceusto outer membrane protein ofEdwardsiellatarda[J]. Fish Shellfish Immunol, 2010, 28(2): 333-343.
[5]Xu G, Sheng X, Xing J, et al. Effect of temperature on immune response of Japanese flounder (Paralichthysolivaceus)to inactivated lymphocystis disease virus(LCDV)[J]. Fish Shellfish Immunol, 2010, 30(2): 525-531.
[6]Xue M Zhang T, Li Y. Immune response and immune-related gene expression profile in orange-spotted grouper after immunization withCryptocaryonirritansvaccine[J]. Fish Shellfish Immunol, 2013, 34(3): 885-891.
[7]Cuesta A, Munoz P, Rodriguez A, et al. Gilthead seabream (SparusaurataL.) innate defence against the parasiteEnteromyxumleei(Myxozoa)[J]. Parasitology, 2006, 132(2): 95-104.
[8]Yang D, Liu Q, Ni C H, et al. Gene expression profiling in live attenuatedEdwardsiellatardavaccine immunized and challenged zebrafish: Insights into the basic mechanisms of protection seen in immunized fish [J]. Developmental and Comparative Immunology, 2013, 40(2): 132-141.
[9]Xu D, Cheng S H, Hu Y, et al. Comparative study of the effects of aluminum adjuvants and Freund’s incomplete adjuvant on the immune response to anEdwardsiellatardamajor antigen [J]. Vaccine, 2010, 28(7): 1832-1837.
[10]Mohanty B R, Sahoo P K. Immune responses and expression profiles of some immune-related genes in Indian major carp,LabeorohitatoEdwardsiellatardainfection [J]. Fish & Shellfish Immunology, 2010, 28: 613-621.
[11]王瑞, 黄艳华, 陈明, 等. 罗非鱼感染链球菌后hsp70基因表达研究[J]. 广西农业科学, 2010, 41(4): 371-377.
Wang R, Huang Y H, Chen M, et al. Analysis of hsp70 mRNA expression of tilapia infected with Streptococcus[J]. Guangxi Agricultural Sciences, 2010, 41(4): 371-377.
[12]王庆, 吴光辉, 巩华. 斜带石斑鱼浸泡免疫哈维氏弧菌灭活疫苗后MHC-II类分子的表达变化[J]. 广东农业科学, 2010, 12: 136-139.
Wang Q, Wu G H, Gong H. Expression of MHC class II molecules ofEpinepheluscoioidesvaccinated with killedVibrioharveyi[J]. Guangdong Agricultural Sciences, 2010, 12: 136-139.
[13]Yu S H, Ao J, Chen X. Molecular characterization and expression analysis of MHC class IIα andβgenes in large yellow croaker (Pseudosciaenacrocea) [J]. Molec Biol Rep, 2010, 37(3): 1295-1307.
[14]You Chuan Wei, Ting Shuang Pan, Ming Xian Chang, et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouperEpinepheluscoioides[J]. Veterinary Immunology and Immunopathology, 2011, 141(3-4): 173-182.
[15]Meijer A H, Gabby Krens SF, Medina Rodriguez IA, et al. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish [J]. Mol Immunol, 2004, 40: 773-783.
[16]Puttharat Baoprasertkul, Eric Peatman, Jason Abernathy, et al. Structural characterisation and expression analysis of Toll-like receptor 2 gene from catfish [J]. Fish & Shellfish Immunology, 2007, 22(4): 418-426.
[17]Kawai T, Akira S. The role of Pattern-recognition receptors in innate immunity: update on Toll-like reeeptors [J]. Nat Immunol, 2010, 11: 373-384.
[18]Yan Yu, Qiwang Zhong, Quanqi Zhang, et al. Full-length sequence and expression analysis of a myeloid differentiation factor 88 (MyD88) in half-smooth tongue soleCynoglossussemilaevis[J]. International Journal of Immunogenetics, 2009, 36(3): 173-182.
[19]郑琳琳. 鲤鱼 MyD88 基因的分子克隆及功能研究[D]. 济南: 山东师范大学, 2010.
Zheng L L. Molecular cloning and characterization of MyD88 in common carp,CyprinuscarpioL[D]. Jinan: Shandong Normal University Master Thesi, 2010.
[20]Da Tang, Yunhang Gao, Rixin Wang, et al. Characterization, genomic organization, and expression profiles of MyD88, a key adaptor molecule in the TLR signaling pathways in miiuy croaker (Miichthysmiiuy) [J]. Fish Physiol Biochem, 2012, 38: 1667-1677.
[21]Xu T J, Chen S L, Ji X S, et al. Molecular cloning, genomic structure, polymorphism and expression analysis of major histocompatibility complex class II A and II B genes of half-smooth tongue sole (Cynoglossussemilaevis) [J]. Fish Shellfish Immunol, 2009, 27(2): 192-201.
[22]王庆, 吴光辉, 巩华. 斜带石斑鱼浸泡免疫哈维氏弧菌灭活疫苗后MHC-II 类分子的表达变化[J]. 广东农业科学, 2010, 12: 136-139.
Wang Q, Wu G H, Gong H. Expression of MHC class II molecules ofEpinepheluscoioidesvaccinated with killed Vibrio harveyi[J]. Guangdong Agricultural Sciences, 2010, 12: 136-139.
[23]Yu S H, Ao J, Chen X. Molecular characterization and expression analysis of MHC class II α and β genes in large yellow croaker (Pseudosciaenacrocea) [J]. Molec Biol Rep, 2010, 37(3): 1295-1307.
[24]Wei Y, Pan T, Chang M, et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouperEpinepheluscoioides[J]. Veterin Immunol Immunopathol, 2011, 141(3-4): 173-182.
[25]Tian J Y, Sun B J, Luo Y P. Distribution of IgM, IgD and IgZ in mandarin fish,Sinipercachuatsilymphoid tissues and their transcriptional changes afterFlavobacteriumcolumnarestimulation[J]. Aquaculture, 2009, 288:14-21.
[26]陈孔茂, 唐小千, 绳秀珍, 等. 大菱鲆mIgD重链基因的克隆与表达分析[J]. 中国海洋大学学报(自然科学版), 2014, 44(3): 26-33.
Chen K M, Tang X Q, Sheng X Z, et al. Cloning and expression analysis of immunoglobulin D heavy chain gene ofScophthalmusmaximus[J]. Journal of Ocean University of China. 2014, 44(3): 26-33.
[27]Francisco R G, Greene W, Rego K, et al. Discovery and characterization of secretory IgD in rainbow trout: Secretory IgD is produced through a novel splicing mechanism [J]. The Journal of Immunology, 2012, 188: 1341-1349.
[28]Seong Don Hwang, Takashi Asahi, Hidehiro Kondo, et al. Molecular cloning and expression study on Toll-like receptor 5 paralogs in Japanese flounder,Paralichthysolivaceus[J]. Fish & Shellfish Immunology, 2010, 29: 630-638.
[29]Ribeiro C M S, Hermsen T, Taverne-Thiele A J, et al. Evolution of recognition of ligands from Gram-positive bacteria: Similarities and differences in the TLR2-mediated response between mammalianb vertebrates and teleost fish[J]. J Immunol, 2010, 184(5): 2355-2368.
[30]Yanhua Pan, Wei Wei, Hongyan Xu, et al. Differential gene expression in Japanese flounder (Paralichthysolivaceus) induced by live attenuatedVibrioanguillarum[J]. Aquaculture Research, 2011, 42: 1042-1049.
[31]宋晓青, 邢婧, 战文斌. 牙鲆经注射和浸泡免疫鳗弧菌灭活疫苗后7 种免疫相关基因表达的变化[J]. 中国水产科学, 2014, 21(4): 747-758.
Song X Q, Xing J, Zhan W B.Variations of seven immune related genes expression in flounder (Paralichthysolivaceus) injected with inactivatedVibrioanguillarum[J]. Journal of Fishery Sciences of China, 2014, 21(4): 747-758.
[32]Yao C L, Kong P, Wang Z Y, et al. Molecular cloning and expression of MyD88 in large yellow croaker,Pseudosciaenacrocea[J]. Fish & Shellfish Immunology, 2009, 26: 249-255.
[33]Cui M, Zhang Q Z, Yao Z J, et al. Molecular cloning and expression analysis of heat-shock protein 70 in orange-spotted grouperEpinepheluscoioidesfollowing heat shock andVibrioalginolyticuschallenge[J]. Journal of Fish Biology, 2011, 79(2): 486-501.
[34]Hu Yong-hua, Sun Li. A bivalent Vibrio harveyi DNA vaccine induces strong protection in Japanese flounder (Paralichthysolivaceus)[J]. Vaccine, 2011, 29: 4328-4333.
责任编辑朱宝象
Expression Analysis of Thirteen Immune Related Genes of Flounder(Paralichthysolivaceus) Vaccinated with Formalin-InactivatedVibrioanguillarum
XUE Jie, SONG Xiao-Qing, XING Jing, ZHAN Wen-Bin
(Laboratory of Pathology and Immunology of Aquatic Animals, Ocean University of China, Qingdao 266003, China)
Abstract:Vaccination is an effective method of controlling bacterial diseases of fish. At present, researchers have paid more attention to the variation of immune related gene expression to evaluate the immune effect of vaccine, then to the changes of antibody level of serum and mucus, enzyme activity, number of lymphocytes, respiratory burst, and complement activity among others. For studying the influence of vaccine immune ways on the expression of immune related genes, Paralichthys olivaceus was intraperi toneally injected with inactivated Vibrio anguillarum vaccine in this study. The spleen, head kidney and gill were taken at 0, 4, 8, 12, 24, 48, 72, 96 h and 7, 14 d after immunization, respectively, and then total mRNA was extracted and reversely transcribed into cDNA. The expression of 13 immune related genes including the toll-like receptor (TLR) 2, TLR5M, myeloid differentiation factor 88 (MyD88), nuclear transcription factor (NF)-κB, interleukin-6 (IL-6), Interferon (IFN)γ, chemokines, C-type lysozyme, heat shock protein (HSP)70, major histocompatibility complex class II (MHC II), T cell surface receptor CD4 and immunoglobulin D (mIgD) genes was analyzed with quantitative real-time polymerase chain reaction (qRT-PCR) using 18sRNA as internal reference. The results showed that, the expression of all the tested gene except for TLR5M and mIgD was up-regulated significantly. The expression of TLR2, MyD88, NF-κB, MHC II, CD4, IL-6, IFNγ, CXC, C3, C-Lyz and HSP70 genes maximized between 12 h and 72 h, 2~30 folds higher than that of control. The expression of mIgD gene was down-regulated but not significantly different from that of control, peaked between 8 h and 12 h with the maximum 0.2~0.02 fold higher than that of control. The expression of TLR5M gene was similar in all three tissues. Our findings indicated that, the abundance of TLR2, MyD88, NF-κB, MHC II, CD4, IL-6, IFNγ, C3, and HSP70 gene transcripts in spleen and head kidney was higher than that of these genes in gills. In addition, the highest expression reached earlier in spleen than in gill. After being injected with formalin-inactivated V. anguillarum, the expression of TLR2、NF-κB、IL-6 gene was higher and maximized earlier in spleen and head kidney than other genes. Such difference may serve as the key candidate indices of vaccine efficiency.
Key words:Paralichthys olivaceus; Vibrio anguillarum; inactivated vaccine; injection; immune related gene
DOI:10.16441/j.cnki.hdxb.20150022
中图法分类号:S917
文献标志码:A
文章编号:1672-5174(2016)02-042-12
作者简介:薛洁(1989-), 女, 硕士生, 研究方向为水产动物病害与免疫。E-mail: joycexuejie@126.com❋❋通讯作者:E-mail: xingjing@ouc.edu.cn
收稿日期:2015-01-28;
修订日期:2015-04-24
基金项目:❋国家重点基础研究发展计划(2012CB114406);国家科技支撑计划(2012BAD17B02);国家自然科学基金项目(31172429;31302216);泰山学者工程专项经费项目资助
引用格式:薛洁, 宋晓青, 邢婧, 等. 牙鲆注射免疫鳗弧菌灭活疫苗后13种免疫相关基因表达的变化[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 42-53.
Supported by The National Basic Research Program of China (2012CB114406);The National Key Technology Support Program(2012BAD17B02);The National Natural Science Fund(31172429;31302216);The Taishan Scholar Program of Shandong Province
