SD胚鼠心脏成纤维细胞的原代培养及鉴定
2016-03-07沈俊袁平唐俊明杨建业李兴元张蕾赵继先张焕鑫薛仕珍冯怡王家宁
沈俊,袁平,唐俊明,杨建业,李兴元,张蕾,赵继先,张焕鑫,薛仕珍,冯怡,王家宁
· 论著 ·
SD胚鼠心脏成纤维细胞的原代培养及鉴定
沈俊1,2,袁平1,唐俊明2,杨建业2,李兴元2,张蕾2,赵继先1,张焕鑫1,薛仕珍1,冯怡1,王家宁1,2
目的建立适用于胚胎大鼠心脏成纤维细胞体外分离、培养及鉴定的技术方法。方法从SD孕19 d大鼠子宫中分离出胚胎鼠,再从胎鼠中分离出心脏,将心脏剪成肉糜状,用胰蛋白酶加上Ⅱ型、Ⅳ胶原酶联合消化法分离心脏成纤维细胞,再通过差速贴壁分离法分别收集、 培养胚胎大鼠心脏成纤维细胞。在光学显微镜下观察心脏成纤维细胞形态特征的变化,用第2代心脏成纤维细胞用波形蛋白(vimentin)、结蛋白(desmin)、血管性血友病因子(vWF)、平滑肌肌动蛋白(α-SMA)免疫荧光鉴定。结果差速贴壁法分离的心脏成纤维细胞原代培养120 min已经完全贴壁,培养第3~5代细胞生长良好,24 h心脏成纤维细胞波形蛋白免疫荧光鉴定纯度高达97%,培养2~3 d时心脏成纤维细胞增殖活力最强。结论差速贴壁分离法结合免疫荧光鉴定可分离胚胎大鼠心脏成纤维细胞,此种方法可得到产量大,纯度高,活力好的心脏成纤维细胞,适用于细胞水平上的心血管疾病发病机制的研究。
心脏成纤维细胞;原代培养;胚鼠;鉴定
体外培养的心脏成纤维细胞,作为一种体外实验研究模型,已用于多种心血管疾病的研究,如心肌梗死后心脏纤维化、缺血缺氧再灌注模型等,是心血管疾病基础研究的基本方法之一,应用前景广阔[1-3]。但目前体外培养的心脏成纤维细胞,随着传代次数的增多存在增殖能力下降、表型转换的现象[4-7]。目前关于心脏成纤维细胞的原代培养方法较多,但大多数都是从成年鼠或乳鼠心脏中分离培养[8-14],而从胚胎大鼠心脏中分离培养心脏成纤维细胞的方法未见报道,本实验借鉴前人的经验基础上,采用胎鼠心脏组织块酶消化法结合差速贴壁能够分离出纯度较高、活力较强的心脏成纤维细胞,现将具体实验方法和经验予以报道。
1 材料与方法
1.1 材料
1.1.1 实验动物Sprague-Dawley(SD)孕19 d大鼠,SPF级,体重(380±3.2)g,湖北医药学院实验动物中心提供。
1.1.2 主要试剂DMEM高糖培养基(Gibco公司),胎牛血清(杭州四季青公司),0.1%胰蛋白酶(将胰蛋白酶溶于PBS缓冲液(pH 7.3)中配制),PBS液(pH 7.3),0.08%Ⅱ型胶原酶(Sigma公司),Ⅳ胶原酶(Sigma公司),细胞增殖-毒性检测试剂盒(CCK-8)(Dojindo公司),波形蛋白(Vimentin)抗体、结蛋白(Desmin)抗体、血管性血友病因子(vWF)抗体、平滑肌肌动蛋白(α-SMA)抗体,荧光二抗(均为Abcom公司)。细胞培养板、 离心管、培养皿等、移液管耗材购自美国Thermo公司。
1.1.3 主要仪器CO2细胞培养箱(RORMA3111,美国Thermo公司),高性能超净工作台(上海瑞仰净化装备有限公司),倒置相差显微镜(1× 200),Eppendorf 5804R低温离心机。
1.2 方法
1.2.1 取材将SD孕鼠脱颈处死后头部以下置于75%酒精缸中浸泡5 min,转移到超净台中。75%酒精棉球擦洗泡沫板,用针头将孕鼠仰面固定在泡沫板上。用外科剪自盆腔处沿腹中线向上剪开皮肤至剑突下停止。用2把止血钳夹取两侧皮肤,充分撕开,暴露下腹部,用大头针将腹腔两侧皮肤固定在泡沫板上。用镊子夹起盆腔处肌肉,用无菌外科剪自盆腔处沿腹中线向上剪开肌肉至剑突下停止。用止血钳夹住腹腔两侧肌肉,充分撕开,暴露子宫。用镊子挑起呈串珠状子宫,分离周围组织后,将子宫置于装有20 ml左右预冷PBS的培养皿中。分离胎盘,将剥离的胚胎大鼠置于新的预冷PBS培养皿中,依次逐一剥离子宫中的胚鼠置于培养皿中。将胚鼠于预冷PBS液中清洗3次。充分消毒双手,左手将胚鼠仰面固定于指尖,眼科剪在剑突处正中线稍偏左向上开胸后用,用食指和拇指轻轻挤压使心脏自然跳出,用弯镊子勾住心脏根部,取出心脏 , 置于盛预冷PBS液的培养皿中,依次逐一取出胚鼠的心脏置于培养皿中。将胚心于预冷PBS液中清洗3次。夹取心脏逐一转移到无菌青霉素瓶中,充分剪碎心脏至肉糜状。
1.2.2 酶消化分离培养吸取5 ml胰蛋白酶冲洗眼科剪,青霉素瓶静止1~2 min后用弯头吸管吸取上清液弃掉,在加入5 ml胰蛋白酶及100 μlⅡ型和100 μl Ⅳ胶原酶,转移至15 ml无菌离心管中,封口后于37℃恒温水浴锅中充分震荡摇晃6~8 min,离心管静置1~2 min后用弯头吸管吸取上清液转移至装有20 ml预冷培养基的50 ml离心管中止消化。在未消化的组织液中再加入5 ml胰蛋白酶及100 μl胶原酶Ⅱ型和100 μl胶原酶Ⅳ,同法消化3~5次。
1.2.3 细胞培养将分次收集的上清细胞悬液离心(1000 rpm,5 min)。弃掉上清液,加入10 ml 20%胎牛血清高糖DMEM重悬细胞,接种到培养皿中。装移到置体积分数5%CO2、37℃培养箱中培养,2 h后弃掉细胞悬液,补充10 ml 20%胎牛血清高糖DMEM培养基置于细胞培养箱中培养。用0.15%胰蛋白酶消化传代(1:3),第二代细胞用于实验。
1.3 心脏成纤维细胞的鉴定
1.3.1 形态学鉴定在心脏成纤维细胞培养过程中,将细胞置于不同倍数倒置相差显微镜下观察细胞形态学变化。
1.3.2 免疫荧光鉴定取第二代心脏成纤维细胞接种于12孔板中,均匀接种3个孔中,每孔1 ml细胞悬液,第2 d用PBS液轻轻洗3遍,用4%多聚甲醛固定15 min,再用PBS液洗3遍,5%羊血清+0.3%Tritorx-100封闭30 min,再用PBS液洗3遍,3个孔对应加入波形蛋白、结蛋白、血管性血友病因子、平滑肌肌动蛋白的一抗4℃孵育过夜,再用PBS液洗3遍,各孔加入对应的荧光二抗室温下孵育2 h,再用PBS液洗3遍,加入DAPI染核15 min,置于荧光显微镜下观察拍照。
1.3.3 增殖活力检测待生长状态良好的第二代细胞80~90%融合时,消化后,按照每孔约2×103个细胞等量接种于96孔板中,置于细胞培养箱内培养。每隔24 h向其中12孔加入CCK8溶液10 μl,置于细胞培养箱中1 h后,用酶标仪在 450 nm波长处测定各孔的光密度值(D450 nm),每日测12孔, 连续测4 d。同时测空白对照孔(只加培养液,不加细胞)光密度值(D450 nm)。
1.4 统计学分析使用 SPSS 19.0进行统计分析。计量资料采用均数±标准差(s)表示,两组间均数的比较采用独立样本t检验,组内不同时间点的比较采用重复测量设计资料的方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态利用酶消化法结合差速贴壁法,刚分离的心脏混合细胞呈圆球状,在细胞培养箱中培养2 h后,心脏成纤维细胞最先贴壁,镜下可见长梭形,胞体较大,胞质透明;细胞核清晰且较大,呈椭圆形,通常含1~3个核,无自发性搏动。胚鼠心脏成纤维生长迅速,24 h即可铺满整个培养皿(图1)。细胞生长达到80%~90%进行传代培养,6代之后会出现明显衰老。
2.2 细胞免疫荧光鉴定在倒置荧光显微镜下观察,培养的胚鼠心脏成纤维细胞波形蛋白抗原表达呈阳性反应(图2A), 阳性细胞率98%,说明细胞来源于间充质;结蛋白抗原表达呈阴性反应(图2B),基本可排除血管平滑肌细胞;血管性血友病因子抗原表达呈阴性反应(图2C),基本可排除内皮细胞;α-SMA抗原表达呈阴性(图2D),基本可排除心脏肌成纤维细胞。细胞免疫荧光鉴定的结果说明利用该方法可得到理想的心脏成纤维细胞。
2.3 心脏成纤维细胞增殖活力测定原代培养的心脏成纤维细胞利用CCK-8试剂盒检测其增殖活力,在用酶标仪在450 nm波长处测定各孔的光密度值(D450 nm),如表1。在培养第48 h及72 h可见细胞增殖活力最强,在第4 d增殖活力有所下降。
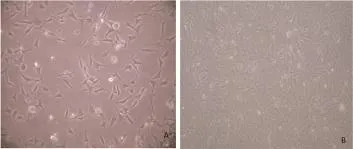
图1 普通光学显微镜下心脏成纤维细胞形态(100×) [A:培养2 h后的心脏成纤维细;B:培养24 h后的心脏心脏成纤维细胞]
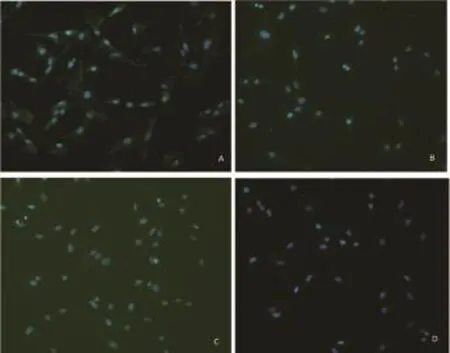
图2 心脏成纤维细胞免疫荧光染色后荧光显微镜下结果(100×)[A:Vementin在胚鼠心脏成纤维细胞中表达阳性;B:Dismin在胚鼠心脏成纤维细胞中表达阴性;C:vWF在胚鼠成纤维细胞中表达阴性;D:α-SMA在胚鼠心脏成纤维细胞中表达阴性]
3 讨论
3.1 心脏成纤维细胞的原代培养临床上,心肌纤维化是心脏重塑的关键,心肌纤维化后正常的心肌组织中胶原纤维异常积聚、胶原浓度明显升高或胶原成分发生改变[1-4,16]。其基础源于心脏成纤维细胞的异常增殖,研究心脏成纤维细胞对于探讨心脏重塑具有重要意义。因为心脏成纤维细胞有一定的增殖分化能力,反复多次传代后易向心脏肌成纤维细胞表型转换[4-6],关于纯度较高的心脏成纤维细胞代数,国内外报道不一[7-15],在分离的胚鼠心脏成纤维细胞中,我们发现在6代以后细胞形态由长梭型变宽变扁,在前6代细胞免疫荧光鉴定的结果和细胞形态学相吻合,因此,获得纯度高的心脏成纤维细胞培养模型对实验研究的科学性及结果的可靠性具有重要意义。
3.2 胚胎大鼠心脏酶消化及差速贴壁法本实验采用胰蛋白酶加上Ⅱ型、Ⅳ胶原酶联合消化法分离心脏成纤维细胞,再通过差速贴壁分别收集、培养胚胎大鼠心脏成纤维细胞。为提高胚鼠心脏成纤维细胞的活力,胚鼠心脏组织块要尽量剪碎,酶消化组织块时要严格控制时间,过短,细胞消化不下来,过长,会增加细胞死亡的概率。同时用短时间多次消化组织块也可较好的保持心脏成纤维细胞的活力。另外,心脏成纤维细胞是贴壁型细胞,接皿培养2 h左右即完全贴壁,而未贴壁的多为心肌细胞。选用的胚鼠胎龄太小,不利于剥离心脏,一般选取胎龄19 d左右的胎鼠可以较好的剥离胎心,在剥离胎鼠、分离胎心、剪碎组织块及酶消化时,尽量要快,避免污染。
表1 胚鼠心脏成纤维原代培养不同时间点增值情况(n=12,s)
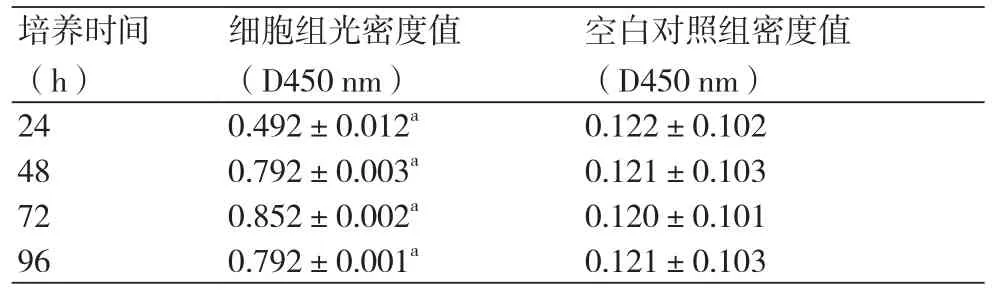
表1 胚鼠心脏成纤维原代培养不同时间点增值情况(n=12,s)
注:与同时间点空白对照组相比,aP<0.05
培养时间(h)空白对照组密度值(D450 nm)24 0.492±0.012a0.122±0.102 48 0.792±0.003a0.121±0.103 72 0.852±0.002a0.120±0.101 96 0.792±0.001a0.121±0.103细胞组光密度值(D450 nm)
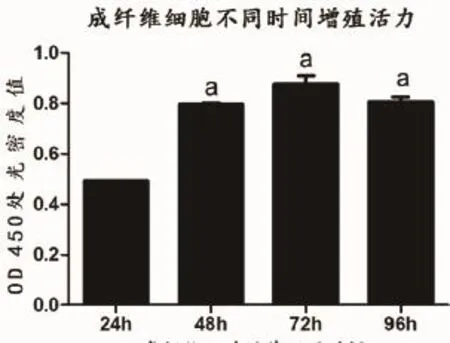
图3 成纤维细胞培养不同时间注:与24 h比较,aP<0.05
3.3 胚鼠心脏成纤维细胞的鉴定形态学上可见从胎鼠分离的心脏成纤维细胞,接皿2 h已经生长40%~60%左右,光镜下可见典型的长梭型;成纤维细胞中间丝的结构蛋白是波形蛋白,不同于内皮细胞的血管内皮生长因子,也不同于血管平滑肌细胞的结蛋白及肌成纤维细胞的平滑肌肌动蛋白,可利用免疫荧光进行鉴定。本研究免疫荧光结果提示波形蛋白染色阳性表达,而结蛋白、平滑肌肌动蛋白,血管性血友病因子染色阴性,从而表明分离培养的细胞为心脏成纤维细胞[17-20]。从成纤维细胞增殖活力测定可看出,从胚鼠分离培养的心脏成纤维细胞增殖活力旺盛。
总之,本研究通过反复实验证实,通过胰蛋白酶与胶原酶联合应用、多次消化胚鼠心脏组织,利用差速贴壁2 h、20%FCS的高糖DMEM培养基的使用,并通过特异性免疫荧光鉴定及CCK8进行活力鉴定,所获得的心脏成纤维细胞分裂增殖能力强,传代周期短,易培养,纯度高等特点,建立了一种比较理想的胚鼠心脏成纤维细胞的原代分离培养模型,为心血管疾病的细胞水平研究提供了基础。
[1] Baudino TA,Carver W,Giles W,et al. Cardiac fibroblasts:Friend or foe?[J]. Am J Physiol Heart Circ Physiol,2006,291(3):H1015-26.
[2] Itoh N,Ornitz DM. Fibroblast growth factors:from molecular evolution to roles in development,metabolism and disease[J]. J Biochem,2011, 149(2):121-30.
[3] Nguyen PD,Hsiao ST,Sivakumaran P,et al. Enrichment of neonatal rat cardiomyocytes in primary culture facilitates long-term maintenance of contractility in vitro[J]. Am J Physiol Cell Physiol,2012,303(12): C1220-8.
[4] Tolstonog GV,Belichenko-Weitzmann IV,Lu JP,et al. Spontaneously immortalized mouse embryo fibroblasts:growth behavior of wild-type and vimentin-deficient cells in relation to mitochondrial structure and activity[J]. DNA Cell Biol,2005,24(11):680-709.
[5] Miki A,Narushima M,Okitsu T,et al. Maintenance of mouse, rat,and pig pancreatic islet functions by coculture with human islet-derived fibroblasts[J].Cell Transplant,2006,15(4):325-34.
[6] Simpson P,Savion S. Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells. Cross-striations, ultrastructure, and chronotropic response to isoproterenol[J]. Cir Res,1982,50(1):101-16.
[7] Bannikova S,Zorov DB,Shoeman RL,et al. Stability and association with the cytomatrix of mitochondrial DNA in spontaneously immortalized mouse embryo fibroblasts containing or lacking the intermediate filament protein vimentin[J]. DNA Cell Biol,2005,24(11):710-35.
[8] 辛毅,许秀芳,黄益民,等. 乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定[J]. 新乡医学院学报,2011,28(05):541-7.
[9] 胡金莲,郑怡文,谷晓蕾,等. 新生小鼠心脏细胞体外共培养体系的建立及其在心肌细胞增殖研究中的应用[J]. 北京医学,2015,37(05):476-9.
[10] 王宁,李应东. 乳鼠心肌细胞原代培养方法的改进[J]. 中国心血管病研究杂志, 2007, 5(12):920-2.
[11] Weber KT. Cardiac interstitium in health and disease: the fibrillar collagen network[J]. Journal of the American College of Cardiology, 1989,13(7):1637-52.
[12] 张怡,赵连三,汪成孝,等. 小鼠胚胎成纤维细胞的分离与培养[J].四川大学学报(医学版),2003,34(02):344-6.
[13] 商爱民,吴靖芳,薛刚,等. 大鼠胚胎成纤维细胞的分离培养及生物学特性[J]. 河北北方学院学报:医学版,2010,27(3):17-20.
[14] 张乃菊,陈天平,祝晓光. 乳鼠心肌细胞和心脏成纤维细胞的原代培养[J]. 蚌埠医学院学报,2010,35(06):558-61.
[15] 薛庆善. 体外培养的原理与技术[M].科学出版社,2001.
[16] Rudolph AM,Heyman MA. Fetal and neonatal circulation and respiration[J]. Annu Rev Physiol,1974,36(36):187-207.
[17] Giddings JC,Hogg S,Legg IR,et al. The relationship between von Willebrand factor antigen and fibronectin in human plasma,endothelial cells and fibroblasts in culture[J]. Thromb Res,1986,44(3):291-301.
[18] Evans MJ,Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos[J]. Nature,1981,292(5819):154-6.
[19] Genbacev O,Krtolica A,Zdravkovic TE,et al. Serum-free derivation of human embryonic stem cell lines on human placental fibroblast feeders[J]. Fertil Steril,2005,83(5):1517-29.
[20] Zhen YS,Hui RT. Recent progress in heart regeneration[J]. Hereditas, 2011,33(11):1159-63.
本文编辑:刘畅,田国祥
Primary culture and identification of embryonic rat cardiac fibroblasts
SHEN Jun*, YUAN Ping, TANG Jun-ming, YANG Jian-ye, LI Xing-yuan, ZHANG Lei, ZHAO Ji-xian, ZHANG Huan-xin, XUE Shi-zhen, FENG Yi, WANG Jia-ning.*Department of Cardiology and Institute of Clinical Medicine , Renmin Hospital, Hubei University of Medicine, Shiyan, Hubei 442000, China.
WANG Jia-ning, E-mail: rywjn@vip.163.com
ObjectiveTo establish a suitable method for the isolation, culture and identification of embryonic rat cardiac fibroblasts in vitro.MethodsEmbryos of pregnant SD rats (19 days) were taken to get its heart, then the heart were cut into meat paste and digested with trypsinase plus collagenase Ⅱ/Ⅳ to isolate cardiac fibroblasts. Cardiac fibroblasts from embryonic rat hearts were harvested by differential adherent separation. The morphological changes of cardiac fibroblasts were observed under light microscope. The second generation of cardiac fibroblasts was identified by immunofluorescence with vimentin, desmin, von Willebrand factor (vWF) and smooth muscle actin (α-SMA).ResultsThe primary culture of cardiac fibroblasts isolated by differential adherence method was completely adherent for 120 min, and the cells were cultured well in the third to fifth passage. The purity of cardiac fibroblast vimentin immunofluorescence was up to 97% after 24 hours. Cultured for 2 to 3 days, the proliferation of cardiac fibroblasts was the strongest.ConclusionDifferential adherence assay combined with immunofluorescence assay can be used to separate embryonic rat cardiac fibroblasts. A great quantity, purity and high survival rate of cardiac fibroblasts can be effectively cultured by this method. And it is useful to explore the pathologic mechanisms of cardiovascular disease in cellular level.
Cardiac fibroblasts; Primary culture; Embryonic rat; Identification
R322.1
A
1674-4055(2016)12-1441-04
国家自然科学基金(81270221)
1442000 十堰,湖北医药学院附属人民医院心内科1病区;2442000 十堰,湖北医药学院附属人民医院临床医学研究所
王家宁,E-mail:rywjn@vip.163.com
10.3969/j.issn.1674-4055.2016.12.08
