不同载体-宿主菌组合对重组蛋白表达量的影响
2016-02-27杨刚刚白海静杨亚娟徐存拴
杨刚刚,王 泽,白海静,杨亚娟,徐存拴
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.河南新乡华星药厂,河南 新乡 453007;3.河南省-科技部共建细胞分化国家重点实验室培育基地和河南省生物工程重点实验室,河南 新乡 453007)
不同载体-宿主菌组合对重组蛋白表达量的影响
杨刚刚1,3,王泽2,白海静1,3,杨亚娟1,3,徐存拴1,3
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.河南新乡华星药厂,河南 新乡 453007;3.河南省-科技部共建细胞分化国家重点实验室培育基地和河南省生物工程重点实验室,河南 新乡 453007)
摘要:研究了不同载体-宿主菌组合对毕赤酵母重组蛋白表达量的影响。以豹蛙抗瘤酶(onconase,ONC)、IL-1α、IL-1β、IL-1Ra、人血清白蛋白(human serum albumin,HSA)与ONC的融合蛋白即HSA-(Gly4Ser1)3-ONC(简称HSA-ONC)等5种重组蛋白为报告蛋白,设计并合成了5种基因。分别插入3种酵母表达载体pPIC9、pPIC9K和pPICZα-A中,转化3种毕赤酵母受体菌X-33、GS115和SMD1168。筛选得到7种载体-宿主菌组合,在摇瓶规模进行诱导并定量。研究结果表明:5种外源蛋白在pPICZα-A/X-33组合中表达量最高,在pPIC9/SMD1168组合中最低。从重组蛋白表达量来说,pPICZα-A/X-33组合优于其他6种载体-宿主菌组合。
关键词:载体;宿主菌;载体-宿主菌组合;重组蛋白;表达量
0引言
巴斯德毕赤酵母(Pichiapastoris)系统是近30年来表现优秀、应用广泛的表达系统之一[1-4],目前,已有1 000余种重组蛋白在该表达系统中成功得到表达[5]。随着酵母基因组测序工作的完成,该系统已发展成为理想的重组蛋白表达系统[6]。
现有毕赤酵母宿主都是由原始菌株巴氏毕赤酵母 NRRLY-11430衍变而来的[7],主要有3种类型:野生型(X-33)[8]、组氨酸缺陷型 (GS115、KM71和MC100-3)以及SMD系列蛋白酶缺陷型(SMD1163、SMD1165和SMD1168)。毕赤酵母表达载体与酵母基因组整合后可稳定遗传[9-10],常见的表达载体分为两种:胞内表达载体和分泌型表达载体。常见的胞内表达载体有pPICZ、pGAPZ、pHIL-2、pPIC3K和PAO815,胞内载体表达的蛋白无法运输至胞外,不利于后期表达纯化。常见的分泌型表达载体包括pPIC9(原核氨苄青霉素抗性,真核无抗性)、pPIC9K(原核卡那霉素抗性,真核G418抗性)和pPICZα系列(原核和真核均为Zeocin抗性)[11]。
重组蛋白的表达量受基因自身性质、表达载体、宿主菌以及培养条件等多种因素的影响[12-13]。本文从载体与宿主菌角度考察多种重组蛋白在毕赤酵母中的表达情况,包括rIL-1α、rIL-1β、rIL-1Ra、rONC和rHSA-ONC等。将含有柔性连接肽(Gly4Ser1)3的HSA-ONC融合基因构建至3类常见分泌型表达载体(pPIC9、pPIC9K和pPICZα-A),分别转化至3种酵母宿主(X-33、GS115和SMD1168),考察不同载体-宿主组合对重组蛋白表达量的影响。
1材料与方法
1.1 材料
(1)菌株、质粒和基因。大肠杆菌(Escherichiacoli) DH5α菌株购自武汉晶赛生物工程技术有限公司;分泌型酵母表达载体(pPIC9、pPIC9K、pPICZα-A)以及毕赤酵母(X-33、GS115、SMD1168)菌株均购自Invitrogen公司;豹蛙抗瘤酶(onconase,ONC)基因委托上海捷瑞生物工程有限公司合成;白细胞介素IL-1(α、β、Ra)和人血清白蛋白-豹蛙抗瘤酶(HSA-ONC)融合基因委托上海生工生物工程有限公司合成。
(2)试剂和工具酶。质粒快速提取试剂盒购自北京鼎国生物技术有限公司;酵母基因组快速提取试剂盒购自北京博迈德科技发展有限公司;限制性内切酶PmeI、BamH I、EcoR I、SacI购自MBI公司;Protein Ladder购自上海赛默飞世尔科技有限公司;其他试剂为国产分析纯。
(3)培养基及培养条件。常用培养基:LB培养基(Luria-Bertani 培养基)、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)、最小缓冲甘油培养基(buffered minimal glycerol-complex medium,BMGY)等参考Invitrogen公司的酵母表达手册。培养条件:温度28 ℃,培养转速300 r/min,诱导转速200 r/min,rIL-1(α、β和Ra)诱导4 d,rONC诱导7 d,rHSA-ONC诱导10 d。
(4)主要仪器。高速低温离心机(Multifuge 3SR+)和紫外分光光度计(NANO Drop 2000)购自上海赛默飞世尔科技公司。全温振荡培养箱(211B)购自上海智城分析仪器制造有限公司。细胞电转化仪(Electroporator Ⅱ)购自Invitrogen公司。Typhoon FLA 7000 IP激光扫描成像仪购自美国GE公司。
1.2 方法
(1)HSA-ONC基因的序列优化与载体构建。通过GenBank查询ONC基因序列 (AF332139.1)和HSA基因序列(NM_000477.5),于两个基因间插入连接肽(Gly4Ser1)3,简称HSA-ONC (全长2 187 bp)。融合蛋白信号肽为HSA的信号肽,序列经密码子优化后由上海生工生物工程有限公司进行合成,分别构建至pPIC9、pPIC9K和pPICZα-A。
(2)工程酵母菌的制备与筛选。提取pPIC9/HSA-ONC、pPIC9K/HSA-ONC和pPICZα-A/HSA-ONC重组质粒,PmeI分别线性化后转化至酵母感受态,即将pPIC9/HSA-ONC、pPIC9K/HSA-ONC和pPICZα-A/HSA-ONC分别转化至X-33、GS115和SMD1168。其中:含抗性载体为pPIC9K(G418)和pPICZα-A(Zeocin);组氨酸缺陷型宿主菌为GS115和SMD1168。载体与宿主菌株组合后需要筛选标记方可进行阳性克隆筛选,去掉pPIC9/X-33(无抗性)和pPIC9K/X-33(G418用于筛选多拷贝且费用高)共得到7种载体-宿主菌组合。转化方法参考Invitrogen公司的毕赤酵母表达手册。转化菌液涂布平板后于28 ℃倒置培养3 d。挑取单克隆提取酵母基因组,使用AOX通用引物进行聚合酶链式反应(polymerase chain reaction,PCR),产物送苏州金唯智生物科技有限公司测序。

1~4.重组质粒pPIC9/HSA-ONC的鉴定:1.重组质粒pPIC9/HSA-ONC;2.Pme I单酶切;3.BamH I和EcoR I双酶切;4.PCR。5~8.重组质粒pPIC9K/HSA-ONC的鉴定:5.重组质粒pPIC9K/HSA-ONC;6.Pme I单酶切;7.BamH I和EcoR I双酶切;8.PCR。9~12.重组质粒pPICZα-A/HSA-ONC的鉴定:9.重组质粒pPIC9K/HSA-ONC;10.Pme I单酶切;11.BstB I和EcoR I双酶切;12.PCR。M.DNA maker DL 10 000。图1 重组表达质粒的鉴定
(3)筛选最佳载体-宿主菌组合及蛋白定量。随机挑选7个组合(每种组合至少挑选10株以上)中鉴定正确的菌种,在平板上活化,挑取少许活化后菌落接种至含10 mL YPD培养基的50 mL三角瓶,于28 ℃、250 r/min培养18~24 h。当菌体密度(OD600)达到10时,取1 mL培养液接种至含100 mL BMGY培养基的1 L三角瓶中,28 ℃、280 r/min培养24 h后开始诱导。每12 h补加1次甲醇,补加量为发酵液体积的1%,培养条件改为23 ℃、200 r/min。诱导10 d后,取50 μL发酵上清进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,蛋白条带经Typhoon FLA 7000 IP激光扫描成像系统灰度扫描后,定量并进行统计学分析。
2结果
2.1 重组表达质粒的鉴定
pPIC9/HSA-ONC、pPIC9K/HSA-ONC和pPICZα-A/HSA-ONC重组质粒用PmeⅠ进行单酶切、双酶切和PCR鉴定,结果如图1所示。
2.2 重组菌株的鉴定
载体与宿主菌株进行组合后,至少具有抗性或筛选标记方可进行阳性克隆筛选,本文载体-宿主组合如表1所示。
以得到的7种组合单克隆的基因组为模板进行PCR,产物经琼脂糖凝胶电泳验证,引物为AOX通用引物,结果如图2所示。由图2可看出:重组菌株均能扩增出2 400 bp左右的特异条带(信号肽+HSA-ONC)和2 200 bp的酵母自身条带。测序结果表明基因序列与预期一致。
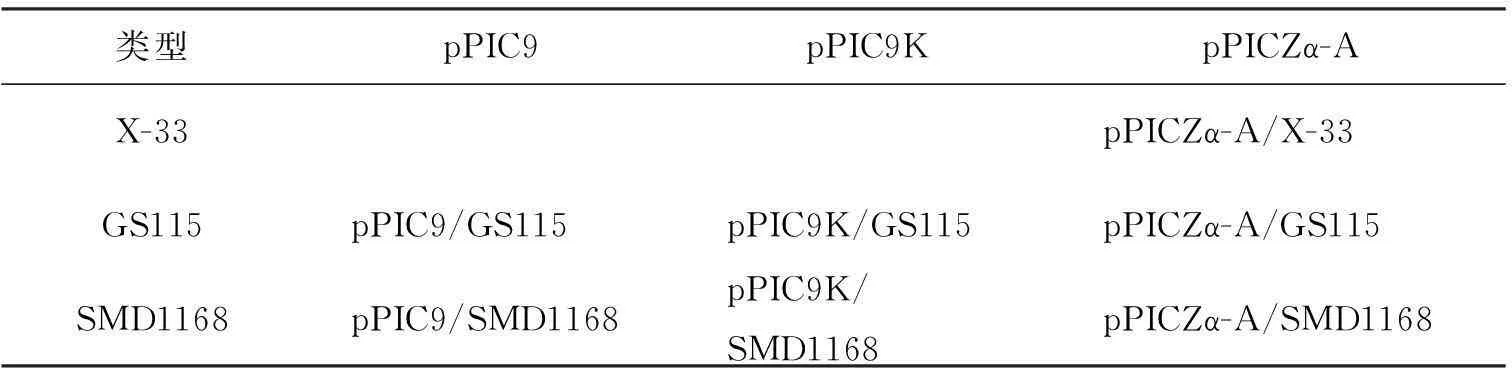
表1 不同载体-宿主组合汇总表
2.3 重组蛋白的诱导表达
随机挑取鉴定正确的单克隆进行诱导(每个组合最少挑选10株以上),取诱导10 d发酵上清液进行SDS-PAGE,结果见图3。由图3可见:在77.3 kD左右均有蛋白条带高表达,最高表达量组合为pPICZα-A/X-33。另外,还有一条66 kD左右的降解条带。

M.DNAmakerDL3000;1.pPIC9/SMD1168组合;2.pPIC9K/SMD1168组合;3.pPICZα-A/SMD1168组合;4.pPIC9/GS115组合;5.pPIC9K/GS115组合;6.pPICZα-A/GS115组合;7.pPICZα-A/X-33组合。图2 重组菌落的基因组PCR鉴定图3 不同载体-宿主组合rHSA-ONC表达量的比较
2.4 不同载体-宿主组合对不同重组蛋白表达量的影响
重组蛋白rONC、rIL-1α、rIL-1β和rIL-1Ra的表达、构建、筛选、诱导和定量方法同rHSA-ONC,不同外源重组蛋白的表达结果如表2所示。rHSA-ONC、rONC、rIL-1α、rIL-1β和rIL-1Ra从高到低的载体-宿主组合顺序相同,依次为:pPICZα-A/X-33、pPICZα-A/GS115、pPIC9K/GS115、pPIC9/GS115、pPICZα-A/SMD1168、pPIC9K/SMD1168和pPIC9/SMD1168。

表2 不同载体-宿主组合对重组蛋白表达量的影响 mg/L
注:均数±标准误差。
3讨论
3.1 不同载体-宿主菌组合对rHSA-ONC表达量的影响
研究发现:rHSA-ONC在pPIC9载体的表达量最低,pPIC9K载体和pPICZα-A载体的表达差异不明显。推测其原因可能是pPIC9载体为单拷贝型载体,与酵母染色体整合时缺乏优势,在表达量上较pPIC9K载体和pPICZα-A载体低;而pPICZα-A载体长度仅为pPIC9K载体长度的1/3,在电转化时可能更利于多拷贝的形成,本试验中最佳的表达载体为pPICZα-A。
同时,研究发现:rHSA-ONC在3种宿主菌株中均可正常表达,从同一载体的不同宿主角度进行比较,SMD1168菌株的表达水平最低,X-33菌株的表达水平远高于SMD1168菌株,也高于GS115菌株,而3种菌株表达的总蛋白无明显差异。由此推测X-33菌株作为表达宿主时对外源蛋白的表达效率更高。可能与X-33菌株是野生型的酵母菌株,具有更强的分泌能力,对外源蛋白适应能力更强有关[14]。SMD1168菌株作为his4位点有突变的毕赤酵母,同时也是Pep4蛋白酶的缺陷型,SMD1168菌株细胞的生长能力受到一定影响,生长速率和代谢活性与正常菌株相比更弱[5]。在本研究中,虽然融合蛋白在表达过程中有较严重的降解(图3中除目标条带外,有一条66 kD左右的降解条带),但采用SMD1168宿主表达的蛋白降解程度并没有明显改善(可能与敲除的蛋白酶基因不合适有关),研究结果表明:重组蛋白表达时采用X-33菌株要优于GS115和SMD1168宿主菌[15]。
3.2 不同载体-宿主菌组合对其他重组蛋白表达量的影响
本文还利用其他4种重组蛋白:rONC、rIL-1α、rIL-1β和rIL-1Ra进行了不同载体-宿主组合的筛选。试验结果表明:rONC、rIL-1α、rIL-1β和rIL-1Ra的表达水平与载体和宿主有关,这4种重组蛋白在pPICZα-A/X-33组合的表达水平均高于其他载体-宿主组合。虽然不同重组蛋白在自身表达量上有一定差异,但在不同载体-宿主组合中表达量趋势基本一致,即pPICZα-A/X-33组合表达量高于GS115的3种组合(pPIC9/GS115、pPIC9K/GS115和pPICZα-A/GS115),明显高于SMD1168的3种组合(pPIC9/SMD1168、pPIC9K/SMD1168和pPICZα-A/SMD1168)。
4结论
本文通过5种重组蛋白在不同载体-宿主组合条件下进行筛选,并建立其表达体系,最终得出5种重组蛋白在pPICZα-A/X-33组合中表达量明显高于其他组合。设计重组蛋白的表达时,对不同载体-宿主组合的筛选是十分必要的,可优先考虑pPICZα-A/X-33组合。本结论对其他重组蛋白选择载体和宿主菌具有指导意义。
参考文献:
[1]KURTZMAN C P.Biotechnological strains ofKomagataella(Pichia)pastorisareKomagataellaPhaffiias determined from multigene sequence analysis[J].Journal of industrial microbiology & biotechnology,2009,36(11):1435-1438.
[2]HOLLENBERG C P,GELLISSEN G.Production of recombinant proteins by methylotrophic yeasts[J].Current opinion in biotechnology,1997,8(5):554-560.
[3]CREGG J M,BARRINGER K J,HESSLER A Y,et al.Pichiapastorisas a host system for transformations[J].Molecular and cellular biology,1985,5(12):3376-3385.
[4]CREGG J M,CEREGHINO J L,SHI J Y,et al.Recombinant protein expression inPichiapastoris[J].Molecular biotechnology,2000,16(1):23-52.
[5]CEREGHION J L,CREGG J M.Heterologous protein expression in the methylotrophic yeastPichiapastoris[J].FEMS microbiolgy reviews,2000,24(1):45-66.
[6]MATTANOVICH D,CALLEWAERT N,ROUZE P,et al.Open access to sequence:browsing thePichiapastorisgenome[J].Microbial cell factories,2009(8):53.
[7]BARR K A,HOPKINS S A,SREEKRISHNA K.Protocol for efficient secretion of HSA developed fromPichiapastoris[J].Pharmaceutical engineering,1992(12):48-51.
[8]陈富超,孙万邦,封建凯,等.重组hIL-10在毕赤酵母X-33的表达及其生物活性鉴定[J].中国免疫学杂志,2011,27(8):691-695.
[9]SHI X,KARKUT T,CHAMANKHAH M,et al.Optimal conditions for the expression of a single-chain antibody (scFv) gene inPichiapastoris[J].Protein expression and purification,2003,28(2):321-330.
[10]UCHIMA C A,ARIOKA M.Expression and one-step purification of recombinant proteins using an alternative episomal vector for the expression of N-tagged heterologous proteins inPichiapastoris[J].Bioscience biotechnology and biochemistry,2012,76(2):368-371.
[11]DALY R,HEARN M T.Expression of heterologous proteins inPichiapastoris:a useful experimental tool in protein engineering and production[J].Journal of molecular recognition,2005,18(2):119-138.
[12]CELIK E,CALIK P.Production of recombinant proteins by yeast cells[J].Biotechnology advances,2012,30(5):1108-1118.
[13]闵兆升,郭会明,颜旭,等.巴斯德毕赤酵母(P.pastoris)高密度发酵研究进展[J].生物技术通报,2014,30(3):42-49.
[14]曹慕琛,徐健勇,罗立超,等.黑曲霉糖化酶基因的克隆及其在毕赤酵母X33中的表达[J].安徽农业科学,2011,39(14):8226-8230,8306.
[15]陈富超,曹明燕,罗军敏,等.重组人IL-10在毕赤酵母X-33及SMD1168中表达效率的比较[J].遵义医学院学报,2011,34(4):351-353.
文献标志码:A
中图分类号:Q815
DOI:10.15926/j.cnki.issn1672-6871.2016.02.016
文章编号:1672-6871(2016)02-0078-04
收稿日期:2015-01-29
作者简介:杨刚刚(1987-),男,河南洛阳人,博士生;徐存拴(1958-),男,通信作者,河南安阳人,教授,博士,博士生导师,主要从事肝再生及药物研发方面的研究.
基金项目:国家“973”前期研究专项基金项目(2012CB722304);河南省自然科学基金项目(142300413212,132300413208);河南省重大科技攻关基金项目(111100910600)
