HPLC法测定大鼠血液中H2S的含量
2016-02-18李金芳马雪红宋百灵李新霞
李金芳,马雪红,宋百灵,,李新霞,3,陈 坚
(1新疆医科大学药学院,乌鲁木齐 830011;2新疆埃乐欣药业有限公司, 乌鲁木齐 830013;3新疆医科大学中心实验室, 乌鲁木齐 830011)
HPLC法测定大鼠血液中H2S的含量
李金芳1,马雪红1,宋百灵1,2,李新霞1,3,陈坚2
(1新疆医科大学药学院,乌鲁木齐830011;2新疆埃乐欣药业有限公司, 乌鲁木齐830013;3新疆医科大学中心实验室, 乌鲁木齐830011)
摘要:目的建立测定大鼠血液中H2S含量的高效液相色谱法(HPLC法)。方法采用HPLC法,以乙腈-0.3%三乙胺=31∶69(磷酸调pH=2.07)为流动相,检测波长为664 nm。将大蒜辣素(Allicin)加入大鼠血细胞中,37℃孵育10 min后,测定Allicin进入血细胞后释放的H2S含量。结果HPLC法专属性符合要求,H2S的线性范围为0.8~80 μmol/L,定量限和检测限分别为0.8 μmol/L和0.4 μmol/L。将大蒜辣素加入大鼠血细胞中孵育后有H2S产生,测得大蒜辣素产生的H2S含量为3.23 μmol/L。结论HPLC法可用于生物样品中H2S的含量测定,检测限满足内源性H2S测定要求。H2S是大蒜辣素在血细胞中孵育后的产物,大蒜辣素有望成为H2S的供体。
关键词:大蒜辣素; HPLC; 亚甲蓝法; H2S; 前药
20世纪90年代,H2S被证实是存在于体内的第3种气体信号分子[1]。H2S对神经系统有调节作用,还可舒张血管平滑肌,降低血压[2]。研究表明内源性H2S在脑内的浓度为50~160 μmol/L[3],在大鼠的血清浓度约为46 μmol/L[4],在人血液中的H2S浓度为10~100 μmol/L[5]。内源性H2S可通过酶途径和非酶途径产生。酶途径有3个转硫化作用关键酶,即胱硫醚-β-合成酶(tathionine-p-synthase,CBS)、胱硫醚-γ-裂解酶(stathionine-ylyase,CSE)和巯基丙酮酸转硫酶(sulphurtransferase,MPST)。其中CBS分布于心脑血管和肾脏;CSE分布于心脑血管和肝脏;MPST分布于线粒体和细胞质中。在哺乳动物细胞内,3种酶以半胱氨酸等含硫化合物为底物产生H2S[6-7]。非酶途径的H2S是从细胞内“酸-不稳定硫储库(acid-labile sulfur pool)”中释放,如硫烷硫(sulfanesulfur)[8]。
由于H2S的理化性质,需寻找适当化合物使之进入机体后释放H2S,该化合物被称为H2S供体或前药。目前开发的前药主要有植物衍生的天然产物、基于水解的H2S的前药和控制H2S释放的前药[9]。以大蒜为代表的葱属植物,富含含硫化合物,含硫化合物可进入血液红细胞,在酶作用下释放H2S而发挥活性作用。目前公认的大蒜活性成分是蒜氨酸(Alliin)经蒜酶(Alliinase)催化裂解产生的大蒜辣素(Allicin),因此Allicin有可能是H2S的前药[10]。
本研究采用柱前衍生H2S为稳定亚甲蓝,HPLC法测定大鼠血浆中H2S的含量;将Allicin加入大鼠血细胞孵育后,测定是否有H2S的产生,并进行含量测定,为进一步阐明大蒜活性成分在体内的作用机制奠定基础。
1仪器与试药
1.1仪器高效液相色谱仪(e2695,Waters),分析天平(AB135-S,Mettler-Teledo),紫外-可见分光光度仪(UV2550,日本岛津),低温离心机(Multifugex-3R,赛默飞世尔科技公司),超低有机物超纯水机(Milli-Q Reference,上海密理博贸易有限公司)。
1.2试剂与药品蒜氨酸(新疆埃乐欣药业公司,纯度92.0%,批号20081201),蒜酶(新疆埃乐欣药业公司,活力≥1 000 IU/g,批号20091201),Na2S·9H2O(天津市福晨化学试剂厂,批号20111009),(CH3COO)2Zn·2H2O(天津市福晨化学试剂厂,批号20110103);N,N-二甲基对苯二胺盐酸盐(天津市福晨化学试剂厂,批号20120602),FeC13·6H2O(天津市盛奥化学试剂有限公司,批号20120702);亚甲基蓝(天津永晟精细化工有限公司,批号20120725),去离子水(Milli-Q超纯水制水机制得),乙腈(Sigma-Aldrich公司,批号WXBB6450v),甲醇(Sigma-Aldrich公司,批号WXBB6406v)。
2方法与结果
2.1溶液的配制
2.1.1大蒜辣素溶液的配制[11]分别取蒜氨酸0.079 4 g、蒜酶0.081 5 g,置10 mL量瓶中,加水溶解,25℃水浴反应30 min,0℃、12 000 r/min离心10 min,超滤法除蛋白,取滤液适量,HPLC法测定Allicin浓度为0.017 4 mol/L。
2.1.2硫化钠储备液配制取Na2S·9H2O 0.048 0 g,置25 mL量瓶中,加水溶解并定容至刻度(C=0.008 mol/L)。
2.1.3醋酸锌溶液配制取乙酸锌10.976 0 g,置100 mL量瓶中,加冰醋酸2 mL溶解后,加水定容至刻度,摇匀,用时取5.00 mL加水稀释至25.00 mL。
2.1.4N,N-二甲基对苯二胺盐酸盐储备液配制取N,N-二甲基对苯二胺盐酸盐0.111 7 g,置25 mL量瓶中,加盐酸1 mL溶解后,加水定容至刻度。
2.1.5三氯化铁溶液的配制取三氯化铁4.508 0 g,置100 mL量瓶中,加1.2 mol/L的盐酸溶解并定容至刻度,混匀,用时取5.00 mL用1.2 mol/L盐酸稀释至25 mL。
2.1.6亚甲基蓝储备液配制取亚甲蓝0.012 0 g,置10 mL量瓶中,加水溶解并定容至刻度(C=3.209 4×10-3mol/L)。
2.2色谱条件色谱柱Agilent ZORBAX Bonus-RP(250 mm×4.6 mm,5 μm),流动相为乙腈∶0.3%三乙胺(用磷酸调pH=2.07)=31∶69,流速1.0 mL/min,柱温40℃,检测波长为664 nm,进样量20 μL。
2.3样品前处理取供试品100 μL,加乙腈200 μL,涡旋混匀2 min,0℃、12 000 r/min离心10 min,取上清液100 μL,依次加醋酸锌溶液、N,N-二甲基对苯二胺盐酸盐溶液和三氯化铁溶液各100 μL,涡旋1 min,室温静置60 min,0℃、12 000 r/min离心10 min,取上清液,备用。
2.4方法学考察
2.4.1大鼠血液中H2S的专属性分别取Na2S+大鼠血细胞+衍生化试剂、Allicin、Allicin+衍生化试剂、Allicin+大鼠血浆+衍生化试剂、Allicin+大鼠血细胞+衍生化试剂;按“2.3”项下方法操作处理样品,进行HPLC测定。专属性考察结果显示,Na2S与衍生化试剂反应后生成的亚甲蓝在3.75 min出峰(峰1);Allicin加入大鼠血细胞中孵育10 min,加入衍生化试剂,在(3.75±0.01)min出峰,说明有H2S释放生成亚甲蓝。大蒜辣素、大蒜辣素+衍生化试剂及大蒜辣素+衍生化试剂+血浆,均未见在相同时间出峰,说明本法专属性良好,见图1。
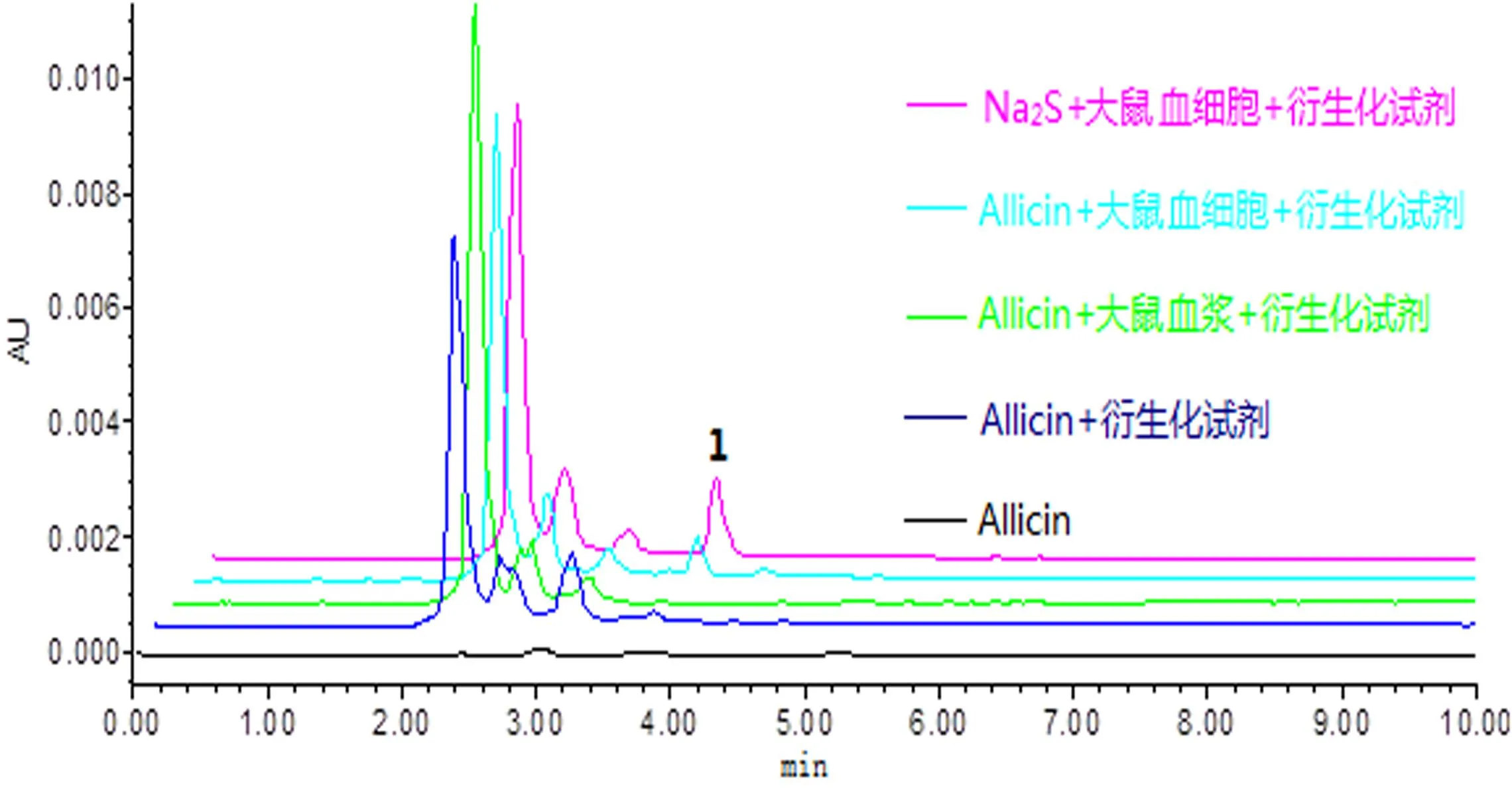
图1 Allicin专属性考察色谱图
2.4.2H2S的线性与范围分别精密吸取硫化钠(C=8.00×10-4mol/L)0.00、0.10、1.00、2.00、4.00、6.00、8.00、10.00 mL置10 mL量瓶中,加水稀释至刻度。取大鼠血浆90 μL,依次加入上述系列浓度硫化钠溶液10 μL,得浓度为0.8、8.0、16.0、32.0、48.0、64.0、80.0 μmol/L的溶液,按“2.3”项下方法操作处理样品,进行HPLC分析。以平均峰面积()对硫化钠浓度(C)进行回归,得回归方程=368.23C+1 580,r=0.999 5(n=5),表明硫化氢在0.8~80.0 μmol/L浓度范围内线性关系良好。
2.4.3方法的定量限与检测限取硫化钠溶液适量,用大鼠血浆逐级稀释后,按“2.3”项下方法操作处理样品,进行HPLC分析,信噪比S/N=3,测得H2S的检测限为0.4 μmol/L;标准曲线最低浓度0.8 μmol/L为定量限。
2.4.4准确度考察取大鼠血浆90 μL,依次加入低、中、高(80.0、320.0、640.0 μmol/L)3个浓度的硫化钠溶液10 μL,按“2.3”项下方法操作处理样品,进行HPLC分析,计算各浓度RSD值和相对回收率。结果相对回收率分别为83.76%、97.25%、92.68%。相对回收率的RSD值分别为3.29%、1.97%、1.01%(n=5),相对回收率值均在80%~120%范围内,符合生物样品分析方法要求。
2.4.5精密度考察取大鼠血浆90 μL,依次加入低、中、高(80.0、320.0、640.0 μmol/L)3个浓度的硫化钠溶液10 μL,按“2.3”项下方法操作处理样品,进行HPLC分析。1 d内连续测定5次,考察日内精密度,计算得低、中、高浓度样品的RSD分别为2.0%、2.1%和0.5%(n=5)。连续测定5 d,考察日间精密度,结果低、中、高浓度样品的RSD分别为3.1%、1.3%和0.5%(n=5)。RSD值均<15%,符合生物样品分析方法要求。
2.4.6提取回收率考察取大鼠血浆90 μL,依次加入低、中、高(80.0、320.0、640.0 μmol/L)3个浓度的硫化钠溶液10 μL,按“2.3”项下方法操作处理样品,进行HPLC分析,计算平均样品浓度(1)。
另取大鼠血浆90 μL,加乙腈180 μL,涡旋混匀2 min,0℃、12 000 r/min离心15 min,取上清液90 μL,依次加入上述3个浓度的硫化钠溶液各10 μL,同法衍生,摇匀,室温静置,0℃、12 000 r/min离心10 min,取上清液,进行HPLC分析,计算平均样品浓度(2)。计算提取回收率(1/2×100%)(n=5)。结果低、中、高3个浓度的提取回收率分别为87.7%、90.0%、90.1%,提取回收率的RSD值分别为2.1%、1.7%、1.2%,RSD值均<15%,符合生物样品分析方法要求。
2.4.7稳定性考察取大鼠血浆90 μL,依次加入低、中、高(80.0、320.0、640.0 μmol/L)3个浓度的硫化钠溶液10 μL,按“2.3”项下方法操作处理样品,置于室温0、2、4、8、12、24 h,进行HPLC分析。结果低、中、高浓度样品的RSD值分别为4.8%、3.7%和1.1%(n=5),说明硫化钠溶液在室温放置,24 h内稳定。
2.5样品中H2S的含量测定取大鼠血细胞0.5 mL,加入Allicin(C=0.017 4 mol/L)0.30 mL,生理盐水稀释至1.00 mL,37℃孵育10 min,加水0.50 mL,涡旋2 min,静置5 min后0℃、3 000 r/min离心10 min,取上清液100 μL,按“2.3”项下方法操作处理样品,进行HPLC分析,计算大蒜辣素经血细胞孵育后生成H2S的含量。结果表明,大蒜辣素经大鼠血细胞孵育后有H2S生成,含量为3.23 μmol/L。
3讨论
目前生物样品中H2S检测方法主要有紫外分光光度法[12],即在三氯化铁存在的情况下,H2S与醋酸锌、N,N-二甲基对苯二胺盐酸盐形成稳定的亚甲基蓝(氯化-3.7-双(二甲胺基)吩噻咛-5-鎓三水化合物),在650~670nm波长处进行检测。但测定时生物样品中其他成分可能有干扰,专属性较差,H2S的测定检测限大于10 μmol/L;其他还有荧光分光光度法[13]、HPLC法[14-17]、敏感硫电极法[16]、气相色谱法[19]、极谱法[20]、滴定法[21]和HS-电极法等。
本研究建立了HPLC-亚甲蓝法测定大蒜辣素经大鼠血细胞孵育后释放的H2S的含量,结果表明待测成分能与血细胞中其他成分达到良好分离,线性范围为0.8~80 μmol/L,定量限和检测限分别为0.8 μmol/L和0.4 μmol/L。本研究与文献[14-17]报道的HPLC-亚甲蓝法相比,采用等度洗脱,方
法专属性好,可满足内源性H2S测定的灵敏度要求。本研究曾尝试HPLC-硫堇荧光法测H2S,结果发现生成物荧光不稳定,重现性较差,后续可进一步筛选合适的荧光衍生化条件,提高方法的灵敏度。本实验将Allicin加入大鼠血细胞中可检测到H2S,而加入血浆中未检测到,单独Allicin及其与衍生化试剂,不加血细胞时均检测不到H2S,说明血细胞中酶将Allicin转化为H2S,Allicin在体内活性作用是经H2S介导产生的。但Allicin是不是红细胞中CBS、CSE和MPST的最佳底物,还需在建立HPLC方法的基础上进一步探讨,并研究3种酶对Allicin的催化动力学。
参考文献:
[1]唐小用,杨春涛,冯鉴强.第三种气体信号分子硫化氢的神经保护作用研究进展[J].中南医学科学杂志,2012,40(1):1-4.
[2]杨荫.硫化氢的测定方法研究进展[J].四川生理科学杂志,2013,35(4):181-182.
[3]Lee M, Schwab C, Yu S,et al.Astrocytes produce the antiinflammatory and neuroprotective agent hydrogen sulfide[J].Neurobiol Aging,2009,30(10):1523-1534.
[4]金红芳,杜军保,唐朝枢.“废气不废”:气体信号分子硫化氢的研究进展[J].生理学报,2010,62(6): 495-504.
[5]Peng HJ, Cheng YF, Dai CF, et al. A fluorescent probe for fast and quantitative detection of hydrogen sulfide in blood[J].Fluorescent Probes,2011,50(41):9672-9675.
[6]谭华炳,李金科.气体信号分子硫化氢与肝硬化关系研究进展[J].西南国防医药,2011,21(1):109-111.
[7]Du JB, Hui Y, Chen YF, et al. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J].Heart vessels,2004,19(2):75-80.
[8]Kennedy SH, Eisfeld BS.Hydrogensulphide and its therapeutic potential[J].Nat Rev Drug Discovery,2007,6(11):917-935.
[9]Zheng YQ, Ji XY, Ji K,et al. Hydrogen sulfide prodrugsa review[J].ActaPharmaceuticaSinica B,2015,5(5):367-377.
[10]马丽娜,李峰杰,陈坚,等.大蒜主要活性成分及药理作用研究进展[J].中国药理学通报,2014,30(6):760-762.
[11]The European Pharmacopoeia Commission.European Pharmacopoeia[S].Council of Europe:European Directorate for the Quality of Medicines and Healthcare,2010:1133.
[12]郑扬,廖锋,杜军保.改良亚甲蓝法测定血浆硫化氢[J].生理学报,2012,64(6):6891-6896.
[13]Xuan WM,Sheng CQ,CaoYT,et al.Fluorescent probes for the detection of hydrogen sulfide in biological systems[J].Fluorescent Probes,2012,51(10):2282-2284.
[14]罗巧林,刘长碧.高效液相色谱法测定血浆中苯妥英药物浓度[J].川北医学院学报,1999,4(12):41-42.
[15]Savage JC,Gould DH.Determination of sulfide in brain tissue and rumen fluid by ion-interaction reversed-phase high-performance liquid chromatography[J].J Chromatogr B,1990,526(2):540-545.
[16]Ogasawara Y, Ishii K, TogawaNT,et al. Determination of trace amounts of sulfide in human red blood cells by High-Performance Liquid Chromatography with fluorometricdetection after derivatizationwith phenylenediamine and Iron(iii)[J].Analyst,1991, 116(12):1359-1362.
[17]Shen XG, Pattillo CB, Pardue S, et al. Measurement of plasma hydrogen sulfide in vivo and in vitro[J]. Free Radic Biol Med,2011,50(9):1021-1031.
[18]耿彬,杜军保,唐朝枢.敏感硫电极法在测定心血管组织细胞及血浆胱硫醚-γ-裂解酶/硫化氢的应用[J].北京大学学报,2005,37(5):545-548.
[19]Berube PR, Parkinson PD, Hall ER.Measurement of reduced sulphur compounds contained in aqueous matrices by direct injection into a gas chromatograph with a flame photometric detector[J]. J Chromatogr A,1999,830(830):485-489.
[20]Doeller JE, Scott Isbell T, Benavides G, et al.Polaro graphic measurement of hydrogen sulfide production and consumption by man malian tissues[J].Analytica lBiochemistry,2005, 341(1):40-51.
[21]SarwarM ,Elihi M, Anwar M,et al.A rapid method for the microdetermination of sulfide using N-bromosuccinimide[J].Microchimica Acta,1970,58(5):846-849.
(本文编辑施洋)
·临床医学研究·
Development and validation of a HPLC method for determination of H2S in rat blood
LI Jinfang1, MA Xuehong1, SONG Bailing1,2, LI Xinxia1,3, CHEN Jian2
(1SchoolofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China;2XinjiangAilexin
PharmaceuticalCo.Ltd.,Urumqi830013,China;3Centrallaboratory,XinjiangMedicalUniversity,
Urumqi830011,China)
Abstract:ObjectiveTo set up a HPLC method for the determination of H2S in rat blood. MethodsUsing a HPLC method, acetonitrile: 0.3% trimethylamine (pH adjusted by phosphate to 2.07) =31∶69 as mobile phase, and the detection wavelength was 664nm. Allicin was added in rat blood cells and after incubation at 37℃ for 10 min, measuring the concentration of H2S, which was released by Allicin. ResultsHPLC method specificity met the determination of H2S, a good linear relationship was obtained in the concentration range from 0.8 μmol/L to 80 μmol/L. The lowest limit of quantification (LLOQ) was 0.8 μmol/L, and the lowest limit of detection (LLOD) was 0.4μmol/L. H2S can be detected after adding Allicin in rat blood cells and the concentration of H2S was 3.23 μmol/L. ConclusionThis method was successfully applied to the determination of H2S inbiological samples. The detection limits met the determination of endogenous H2S. The results showed that H2S was the product of allicin in the blood, which was expected to become the donor of H2S.
Keywords:Allicin; HPLC; Methylene blue; H2S; Prodrug
通信作者:孙学斌,男,硕士,副主任医师, 研究方向:骨病及运动损伤,E-mail: sunxuebin666@sina.com。 刘大鹏,男,博士,教授,主任医师,硕士生导师,研究方向:骨外科,E-mail:2238443094@qq.com。
作者简介:陈慕芝(1982-),女,硕士,主治医师,研究方向:中西医结合风湿病研究。 赵凯(1987-),男,在读硕士,研究方向:骨外科。
基金项目:新疆维吾尔自治区自然科学基金(2014211C021) 新疆维吾尔自治区医学联合基金(2014211C121)
[收稿日期:2015-10-21]
doi:10.3969/j.issn.1009-5551.2016.01.012
中图分类号:R914
文献标识码:A
文章编号:1009-5551(2016)01-0056-04
