异常黑胆质成熟剂对慢性应激抑郁模型大鼠海马G蛋白α亚型Gαi、Gαo和Gαq表达的影响
2016-02-18维妮拉乌斯曼麦合苏木艾克木玉苏甫江台外库力麦提喀斯木尼扎木丁
维妮拉·乌斯曼, 麦合苏木·艾克木, 玉苏甫江·台外库力, 麦提喀斯木·尼扎木丁,
阿不都热依木·玉苏甫1
(新疆医科大学1维吾尔医学院,2基础医学院, 乌鲁木齐 830011)
异常黑胆质成熟剂对慢性应激抑郁模型大鼠海马G蛋白α亚型Gαi、Gαo和Gαq表达的影响
维妮拉·乌斯曼1, 麦合苏木·艾克木1, 玉苏甫江·台外库力1, 麦提喀斯木·尼扎木丁2,
阿不都热依木·玉苏甫1
(新疆医科大学1维吾尔医学院,2基础医学院, 乌鲁木齐830011)
摘要:目的探讨异常黑胆质成熟剂(ASMq)对慢性应激抑郁模型大鼠海马G蛋白α亚型Gαi、Gαo和Gαq表达的影响。方法选取60只雄性SD大鼠,进行21 d慢性不可预见性温和应激(CUMS)诱导建立抑郁症大鼠模型(接受应激组),并通过体质量测量、糖水消耗实验、矿场实验进行宏观评价。造模成功后,将接受应激组大鼠随机分为5组:ASMq高、中、低剂量组(给药剂量分别为6.0、3.0、1.5 g/kg体质量)及阳性对照组(氟西汀 3.5 g/kg体质量),模型对照组(生理盐水 1.5 mL/100 g体质量),每组12只。另设正常对照组(12只,不接受任何应激,正常饲养)。末次给药1 h后颈椎脱臼处死大鼠,迅速分离海马并冻存备用。采用免疫印迹法(western blotting)检测各组大鼠海马Gαi、Gαo和Gαq表达量。结果与正常对照组相比,接受应激组大鼠给予应激后的体质量、糖水摄入量、跨越格数及抬腿次数明显降低,处于抑郁状态;ASMq高、中、低剂量组及阳性对照组大鼠给药后的体质量明显高于抑郁模型对照组,差异有统计学意义(P<0.01);与正常对照组相比,抑郁模型对照组大鼠海马Gαo、Gαi表达量明显升高,差异有统计学意义(P<0.05),而Gαq表达量差异无统计学意义(P>0.05)。与抑郁模型对照组相比,ASMq高、中、低剂量组及阳性对照组Gαo和Gαi表达量明显降低,差异有统计学意义(P<0.01)。结论ASMq可能通过调节G蛋白α亚型Gαo、Gαi表达来发挥抗抑郁作用。
关键词:异常黑胆质成熟剂(ASMq); 抑郁模型; G蛋白α亚型Gαi、Gαo、Gαq
抑郁症是一种长期困扰人类健康的精神、心理疾患,是人们最早认识的精神科疾病,被称为精神疾病的“ 普遍感冒”。至今其病因尚未完全阐明,刘艳梅等[1]报道,细胞内信号转导与抑郁症发生密切相关,其从信号转导水平阐明抗抑郁药的作用机制,即抗抑郁药在分子水平上通过三磷酸鸟苷酸(GTP)结合蛋白(G蛋白)将神经递质受体信号跨膜转导,并产生功能蛋白磷酸化、神经营养因子增加、神经发生增多等相关效应,从而发挥抗抑郁作用。异常黑胆质证方药——异常黑胆质成熟剂(ASMq)是预防和治疗异常黑胆质病症的首选药物[2]。本课题组前期研究发现ASMq可能通过上调海马脑源性神经营养因子(Bdnf)、5-羟色胺1A mRNA(5-HTIAmRNA)表达[3]、调节腺苷酸环化酶-cAMP-蛋白激酶A信号通路(cAMP-PKA 信号通路)[4]、上调细胞外信号调控激酶信号转导通路(Ras/RSK/ERK信号转导通路) 起到抗抑郁作用[5]。但至今尚未见ASMq对G蛋白的影响的报道,因此本研究拟采用慢性不可预见性温和应激(CUMS)诱导建立抑郁症大鼠动物模型,通过免疫印迹法(western blotting)观察ASMq对大鼠海马G蛋白α亚型Gαi、Gαo和Gαq表达的影响,旨在探讨ASMq可能的抗抑郁作用。
1材料与方法
1.1实验动物选取2月龄雄性清洁级SD大鼠72只,体质量180~220 g,由新疆医科大学实验动物中心提供(许可证号:SCXK新2003-2001)。
1.2药物按照本项目组发明的中华人民共和国发明专利(专利号:ZL 02130082.8)制备ASMq(成分同异黑成熟颗粒),由新疆奇康哈博维药有限公司生产提供(批号:121011)。 盐酸氟西汀胶囊(国药准字J20130010,苏州制药有限公司),普通蔗糖。
1.3试剂与仪器RIPA裂解液, BCA蛋白定量试剂盒,SDS-PAGE凝胶制备试剂盒,western blot试剂盒,4×蛋白上样缓冲液,蛋白MARKER,Gαi、Gαo、Gαq 一抗,二抗,BCIP/NBT 显色试剂盒(invitrogen);高速冷冻离心机,X-mark 型酶标仪,STE-2 型脱色摇床,凝胶成像仪。
1.4动物模型的建立及评价
1.4.1造模选取72只清洁级SD大鼠(体质量180~200 g)室温下正常饲养,从中选取60只大鼠,采用CUMS诱导建立大鼠抑郁症模型(接受应激组),具体造模方法如下:大鼠接受不同的应激,包括电击足底(电压36 V,每隔1 min电击1次,1次持续10 s,共20次)、冰水游泳(4℃冷水,水深15 cm,持续5 min)、热水游泳(45 ℃热水,水深15 cm,持续5 min)、夹尾(夹住距尾根部1 cm处,持续1 min)、摇晃(频率160次/ min,持续3 min)、昼夜颠倒、禁食(24 h)、禁水(24 h)。21 d后,采用体质量测量、糖水消耗实验、矿场实验综合评价模型建立是否成功。将12只大鼠设为正常对照组,不接受任何应激,正常饲养。
1.4.2大鼠体质量测量分别测量记录大鼠应激前后的体质量,然后计算比较各组大鼠体质增加量。
1.4.3糖水实验(sucrose intake test)实验前48 h,训练大鼠适应 1%蔗糖水 ,然后断水12 h, 测1 h内糖水摄入量 ,在实验第21天,再测1次。
1.4.4矿场实验(open field test)准备开口的黑色木盒(内部场地大小为100 cm×80 cm),盒底漆成纵横各3条白线(宽3 mm),从而形成16个等大的方格。将大鼠面朝墙放入4个拐角方格之一,并让其自由探索环境3 min。分别记录跨越格数(水平得分, crossing)和后肢站立次数(垂直得分,rearing)。每只大鼠接受1次测试。
1.5分组及给药将接受应激组大鼠分为5组(每组12只):ASMq高、中、低剂量组、阳性对照组及模型对照组,另设正常对照组(12只,不接受任何应激,正常饲养)。从造模成功第1天开始,阳性对照组经口灌胃氟西汀3.5 mg/kg体质量;ASMq大剂量组经口灌ASMq(6.0 g/kg体质量) 给药剂量为2 mL/100 g体质量;ASMq中剂量组经口灌胃ASMq (3.0 g/kg体质量) 给药剂量为2 mL/100 g体质量;ASMq小剂量组经口灌胃ASMq(1.5 g/kg体质量) 给药剂量为2 mL/100 g体质量;模型对照组经口灌胃生理盐水1.5 mL/100 g体质量,各组连续给药21 d,灌胃1次/d。
1.6标本采集末次给药结束1 h后,将各组大鼠颈椎脱臼处死,迅速剥离大脑,进行海马的分离,将分离出来的海马放在-80℃冰箱保存备用。
1.7Western blotting测定Gαi、Gαo、Gαq的表达样品处理:取海马组织用加有蛋白酶抑制剂的RIPA裂解液进行匀浆,4℃、12 000 r/min离心10 min,取上清液用BCA法测定蛋白浓度。Western blotting测定:给待测样品加4×蛋白上样缓冲液配成配成蛋白含量为20 μg/μL的溶液,进行SDS-PAGE凝胶(电泳浓度为10%~12%) 60 mA电泳30 min,120 V转膜90 min,5%脱脂奶粉封闭1 h,4℃一抗孵育(分别孵育Gαi、Gαo、Gαq)过夜,稀释比例为1∶1 000。次日取出加二抗孵育1 h,显色,用 Bio- Rad 凝胶成像仪拍照,结果用Image J2x医学影像处理应用程序进行条带分析,测定目的条带的积分光密度值,作为代表样本蛋白含量的统计变量。
1.8统计学处理采用SPSS 21.0统计软件进行统计学分析。计量资料以均数±标准差(-x±s)表示,行为学指标检测结果用重复测量的方差分析和t检验,Gαi、Gαo及Gαq含量用单因素方差分析(ANOVA)检验,各组间比较用最小显著差法 (LSD),检验水准α=0.05。
2结果
2.1CUMS对大鼠体质量、糖水摄入量及自主行为的影响实验前各组大鼠体质量差异无统计学意义(P>0.05)。持续21 d的应激刺激后,接受应激组大鼠体质量显著下降(P<0.01),应激前后的糖水摄入量差异有统计学意义(P<0.01),与正常对照组相比,接受应激组大鼠的糖水摄入量明显降低(P<0.01),而正常对照组糖水摄入量差异无统计学意义(P>0.05)。接受应激组大鼠的跨越格数及抬腿次数明显低于正常对照组,差异有统计学意义(P<0.01),见表1。

表1 CUMS对大鼠体质量、糖水摄入量及自主行为的影响()
注:与正常对照组比较,*P<0.01。
2.2ASMq对各组大鼠体质量的影响与给药前相比,给药后各组大鼠体质量明显增加(P<0.01),而模型对照组大鼠体质量差异无统计学意义(P>O.05)。给药后,正常对照组及各给药组大鼠体质量明显高于模型对照组(P<0.01),而阳性对照组与ASMq高、中、低剂量组大鼠体质量差异无统计学意义(P>0.05),见表2。

表2 各组大鼠体质量变化比较(g,)
注:与给药前比较,*P<0.01; 与模型对照组比较,ΔP<0.01。
2.3各组大鼠海马G蛋白3种亚型表达水平与正常对照组相比, 模型对照组大鼠海马组织中的Gαo和Gαi表达量明显升高,差异有统计学意义(P<0.05),而Gαq表达量差异无统计学意义(P>0.05);与模型对照组相比,ASMq高、中、低剂量组及阳性对照组Gαo和Gαi表达量明显降低,差异有统计学意义(P<0.01),而Gαq表达量差异无统计学意义(P>0.05);与阳性对照组比较,ASMq高、中、低剂量组Gαo、Gαi及Gαq表达量差异无统计学意义(P>0.05),见表3和图1。
3讨论
抑郁症是一种常见的也是自杀率最高的精神疾病。随着社会的发展,人们在享受越来越丰富的物质文明的同时,也感受到越来越大的心理、精神等方面的压力,导致了抑郁症的发病率显著增加,对人类与社会造成严重的负担及损失。目前认为,抑郁的发生和受体多与G蛋白相偶联密切相关[6],G蛋白作为膜外信息向膜内传递的中介,也是抗抑郁药物的重要作用靶点。G蛋白将激素、神经递质、神经调质等所携带的细胞外信息传递给细胞内,在抑郁症的发病和治疗中起着重要的作用。Gao蛋白亚型作为一个在哺乳动物中枢神经系统中表达量非常高的G蛋白,参与多种神经递质和激素类的跨膜信号转导[7]。Gαi在生物体内无处不在, 主要抑制AC的活性,影响第二信使cAMP的产生。Gαq可激活细胞膜上的磷脂酶C(PLC),使 4, 5-二磷酸磷脂酰肌醇水解为 1, 4, 5-三磷酸肌醇(IP3)和甘油二酯(DAG)[8]。

表3 各组大鼠海马G蛋白3种亚型表达水平 ()
注: LSD检验,与模型对照组比较,*P<0.01 ,**P<0.05。


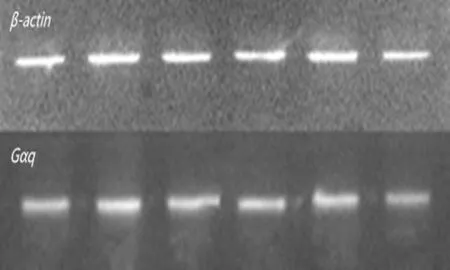
A: 大鼠海马Gαo表达 B: 大鼠海马 Gαi 表达 C: 大鼠海马Gαq表达
1: ASMq高剂量组; 2: ASMq中剂量组; 3: ASMq低剂量组; 4:阳性对照组; 5:模型对照组; 6:正常对照组
图1各组大鼠大鼠海马 G蛋白表达
传统维吾尔医学认为,抑郁症属于“麻利胡利亚”范畴,是由于长期大量服用干寒型的饮食和药物、情志失常及长期过度从事脑力和体力劳动而使体内正常体液(黑胆质、血液质、黏液质、胆液质)“燃烧”生成异常黑胆质,导致异常黑胆质体液的凝结沉淀,损坏脑部,从而发生异常黑胆质型抑郁症。异常黑胆质成熟剂是异常黑胆质证方药,由破布木实、铁线蕨、地锦草、香青兰、甘草根、薰衣草等单味药组成的维吾尔药复方制剂,可使体内异常体液“成熟”,即对体内异常体液进行调剂和堆积,达到气质复原、体液平衡的健康状态。
慢性不可预见性温和应激(CUMS)模型基本符合抑郁模型的要求,具有高度有效性,是目前国内外已广泛应用于抑郁症基础研究和药物筛选的一种有效的抑郁模型[9-10],其通过长时间使动物接受温和应激刺激,模拟在日常生活中的种种压力及困难,模拟出人类抑郁症的重要特征、症状及表现,即缺乏快感。异常黑胆质导致异常黑胆质型抑郁症的病理过程与CUMS模型不谋而合。本课题组前期有关异常黑胆质成熟对慢性应激抑郁模型大鼠的影响研究发现,异常黑胆质成熟剂促进慢性应激抑郁模型大鼠体质量增加[11];通过降低促肾上腺皮质激素(ACTH)、皮质醇(CORT)含量纠正下丘脑—垂体—肾上腺轴 (HPA轴)亢进,升高去甲肾上腺素(NE)、5-羟色胺(5-HT)、多巴胺(DA)、肾上腺素(AD)及β-内啡肽(β-EP)和脑源性神经营养因子(BDNF)含量,改善抑郁症模型大鼠血液中的单胺类神经递质含量而起到抗抑郁作用[12]。
本研究结果显示,持续21 d的应激刺激后,接受应激组大鼠体质量显著下降(P<0.01),应激前后的糖水摄入量差异有统计学意义(P<0.01),与正常对照组相比,接受应激组大鼠的糖水摄入量、跨越格数及抬腿次数明显降低,差异具有统计学意义(P<0.01),说明造模成功。药物干预后,与模型对照组相比,ASMq高、中、低剂量组及阳性对照组大鼠体质量均明显增加。模型对照组大鼠海马的Gαo、Gαi蛋白含量显著高于正常对照组,而Gαq差异无统计学意义。提示,慢性应激处理对海马的Gαo、Gαi蛋白亚型的表达有一定的影响。给药干预后,ASMq高、中、低剂量组及阳性对照组的Gαo、Gαi蛋白含量较模型对照组明显降低,而Gαq差异无统计学意义。提示,ASMq可能通过降低Gαo、Gαi蛋白α亚型表达量提高cAMP通路的信号传递,导致CREB、PKA及BDNF等发生变化而产生抗抑郁作用。
参考文献:
[1]刘艳梅, 祁 红, 陈红专.抗抑郁药的信号转导机制 [J].中国临床药理学与治疗学,2004, 9(12):1321-1325.
[2]依沙克江·马合穆德,阿不都热依木·卡地尔.中国医学百科全书:维吾尔医学[M]. 上海: 上海科学技术出版社,2005:26-28,89-94.
[3]哈木拉提·吾甫尔,阿不都热依木·卡地尔. 维吾尔医气质、体液论及其现代研究[M]. 乌鲁木齐:新疆科学技术出版社,2003: 14-15.
[4]吐尔逊阿依·卡米力,哈力旦木·吾加不都,哈木拉提· 吾甫尔,等. 异常黑胆质成熟剂对抑郁症模型大鼠海马cAM P-PKA信号通路的影响[J]. 中药药理与临床, 2013, 29 (5): 109-113.
[5]哈力旦木·吾加不都,古孜力努尔·依马木,阿不都热衣木·肉孜,等 . 异常黑胆质成熟剂对抑郁症模型大鼠海马细胞外信号调控激酶信号转导通路的影响[J] . 新疆医科大学学报, 2015, 38 (1): 26-29.
[6]Avissar S, Nechamidn Y, Roltman G, et al. Differential G proteins measures in mononuclear leukocytes of patients with bipolar mood disorder are state dependent[J]. J Affect Disorder , 1997, 43 (2): 85-93.
[7]Jiang MS,Bajpayee NS.Molecular mechanisms of Go signaling [J].Neurosignals,2009 , 17(1):23-41.
[8]宋煜青,周东丰,范建华,等 .电针、氟西汀治疗抑郁症前后血小板膜鸟苷酸结合蛋白含量的变化 [J] . 中国心理卫生杂志 ,2004,18(11):783-786.
[9]Reid L, Forbes NF, Stewart C, et al. Chronic mild stress and depressive disorder: a useful new model [J]. Psychopharmacology,1997,134(4):365-367.
[10]Vry LD, Schreiber R. The chronic mild stress depression model: future developments from a drug discovery perspective[J]. Psychopharmacology, 1997,134(4):349-350.
[11]阿不力皮孜·哈力甫,古孜力努尔·依马木,阿不都热依木·玉苏甫.异黑成熟颗粒对抑郁症模型大鼠生物表征的影响[J].新疆医科大学学报,2011,34(12):1305-1310.
[12]阿不都热依木·玉苏甫,阿不力皮孜·哈力甫,古孜力努尔·依马木,等. 异黑成熟颗粒对抑郁症模型大鼠血清神经内分泌递质含量的影响[J]. 新疆医科大学学报,2011,34(12):1311-1315.
(本文编辑周芳)
The effect of Abnormal Savda Munziq on expression of G protein α subunits:
Gαi, Gαo and Gαq in the hippocampus of depression Rat models
Weinila Wusiman1, Maihesumu Aikemu1, Yusufujiang Taiwaikuli1, Maitikasimu Nizhamuding2,
Abudureyimu Yusupu1
(1SchoolofTraditionalUyghurMedicine,2SchoolofPre-clinicalMedicine,
XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo observe the effect of Abnormal Savda Munziq (ASMq) on expression of G protein α subunits: Gαi、Gαo and Gαq in the hippocampus of depression rat models. MethodsThe 60 SD rats were treated with chronic unpredictable mild stress (CUMS) for 21d to build up the depression models, vs 12 SD rats as normal control group. Their behavioral status of rats was evaluated by Open-field test and sugar consumption experiment. After modelizing, the rats were randomly divided into 5 groups with 12 in each group: depression model group, low, middle and high dose group of ASMq (1.5, 3.0 and 6.0 g·kg-1·d-1, respectively), and positive control group (Fluoxetine, 3.5 mg·kg-1·d-1) administered with corresponding substances for 21 days. After the last administration in 1 h, all rats were executed and the hippocampuses were separated to cryo preserved for standby. The protein expression of Gαi, Gαo and Gαq in the hippocampuses of rats were measured by Western Blotting Protocol. ResultsAfter CUMS, the body weight gain, sugar consumption, horizontal crossing numbers and erection times of depression group were significantly decreased than normal control group (P<0.01), so the depression model group was successfully achieved with obvious depressive states. After administration, the weight of the three dose groups of ASMq and positive control group was higher than depression model group (P<0.01); compared with the normal control group, the contents of Gαo and Gαi protein expression in hippocampus of depression model group was significantly increased (P<0.05); the contents of Gαo and Gαi protein expression in hippocampus of the 3 dose groups of and positive control group were significantly lowered than model group (P<0.01). ConclusionThe anti-depression effect of ASMq may be related to regulating the Gαo and Gαi pathways in hippocampus.
Keywords:Abnormal Savda Munziq (ASMq); depression animal model; G protein α subunits of Gαi, Gαo and Gαq
[收稿日期:2015-09-25]
doi:10.3969/j.issn.1009-5551.2016.01.003
中图分类号:R291.5
文献标识码:A
文章编号:1009-5551(2016)01-0012-05
