发状念珠藻醛酮还原酶基因NfAKR的克隆与表达
2016-02-06岳思君李治学范红丽梁文裕
岳思君,李治学,范红丽,周 娟,梁文裕,郑 蕊*
发状念珠藻醛酮还原酶基因NfAKR的克隆与表达
岳思君1,李治学2,范红丽1,周 娟1,梁文裕1,郑 蕊1*
(1 宁夏大学 生命科学学院,西部特色生物资源保护与利用教育部重点实验室, 银川750021; 2 拉萨市第一中等职业技术学校,拉萨 850000)
以发状念珠藻细胞为试材,采用PCR技术克隆了醛酮还原酶基因的开放阅读框(ORF)序列,命名为NfAKR。对基因序列特征进行了生物信息学分析,根据其编码氨基酸序列预测了NfAKR蛋白的三维结构,同时探讨了PEG-6000胁迫下NfAKR的表达特性。结果表明:NfAKR基因的编码序列长912 bp,编码304个氨基酸,预测其编码蛋白的相对分子量为33.51 kD,理论等电点为4.94 ,具有醛酮还原酶超家族保守结构域。NfAKR蛋白主要由10个α-螺旋和11 β-折叠组成,中间形成一个疏水穴,作为酶的催化活性中心。NfAKR与点形念珠藻处在同一进化枝上,具有较近的亲缘关系。qRT-PCR分析显示,PEG-6000胁迫下NfAKR基因上调表达,当PEG-6000浓度为8%时,其相对表达量为5.66并达到峰值。依据NfAKR基因响应干旱胁迫上调表达的特性,推测醛酮还原酶可能参与发状念珠藻抵御干旱胁迫过程。
发状念珠藻,醛酮还原酶,基因克隆,干旱胁迫,表达分析
干旱是影响植物生长最主要的非生物胁迫之一,给植物的生长和产量等带来诸多不利的影响。干旱、盐和低温等非生物逆境会诱导超氧离子、过氧离子、羟自由基等活性氧的积累,导致细胞中膜脂不饱和脂肪酸的过氧化水平增高,破坏膜结构及膜的生理完整性,对植物产生伤害[1-2]。但它们同样会作为信号调控活性氧的清除过程和其他保护机制,其在胁迫响应过程中还可能会与其他响应机制结合,如 ABA 通路等。植物体内的抗氧化酶系统能有效清除活性氧,渗透调节物质能有效调节细胞渗透势,保护细胞免受伤害[3-4]。关于植物干旱胁迫下的生理响应及耐旱机制越来越受到人们的关注。
醛酮还原酶(Aldo-Keto Reductase,AKR)在生物中广泛存在,形成了一个具有40个成员的超家族,其功能是参与醛/酮代谢,消除细胞内的醛、酮毒害。AKR4 亚家族C(AKR4C)是植物中发现的一组AKR。一些双子叶植物的AKR4C能够催化活性醛代谢。在拟南芥中有 21 个该家族的基因[5],但对该类基因的功能研究较少。大豆GmCHR基因编码蛋白与 AKR类蛋白相似,其功能结构区具有质子供体位点、亚基结合位点以及核酸结合位点等。GmCHR基因在 NaCl 胁迫后期的上调表达可能参与盐胁迫引起的活性氧的清除和一些过氧化物有毒物质的清除,对胁迫后的细胞稳态修复有作用[6]。ALDH是一类依赖 NADPH 的醛酮还原酶,能特异性结合醛使其转化为羧酸,降低细胞内活性氧毒害。过表达 Ath-ALDH3 能降低脂质过氧化反应产生的乙醛含量,其持续过表达利于植物通过解毒机制提高对胁迫的耐受性[7]。
发状念珠藻(Nostocflagelliforme),亦称发状念珠蓝细菌,是生长在荒漠半荒漠地区的旱生蓝藻类低等植物,不仅具有很高的营养价值和药用价值,还在维持当地生态系统中发挥重要作用。由于生长环境恶劣,长期遭受干旱胁迫,使得发状念珠藻表现出很强的干旱适应性,但其耐旱机理尚不清楚。因此,从分子水平研究其耐逆及适应机制、寻找其生长发育规律以及实现发状念珠藻人工培养,多年来一直是研究者关注的热点[8-9]。
本研究的目的是通过发状念珠藻醛酮还原酶基因的克隆和初步的耐旱性验证,获得发状念珠藻耐旱基因的相关信息,从而为实现念珠藻耐旱材料的高效筛选和改良提供基础信息,并为创制耐旱转基因材料提供有效的基因,进一步充实和完善发状念珠藻干旱胁迫基因调控网络和机制的研究信息。
1 材料和方法
1.1 材 料
实验材料为发状念珠藻悬浮培养细胞,保存于宁夏大学生命科学学院应用微生物学实验室,培养条件为25 ℃、80 r/min光照培养,生长培养基为BG11培养基。8 000 r/min离心收集藻细胞,保存于-80 ℃冰箱备用。
1.2 方 法
1.2.1NfAKR基因开放阅读框的扩增 取50 mg发状念珠藻细胞,-80 ℃速冻,液氮研磨成粉末,采用CTAB法提取发状念珠藻基因组DNA。电泳检测DNA质量。
根据发状念珠藻基因组精细测序图中醛酮还原酶基因的ORF序列,设计上游引物AKR-F(5′-CGCGGATCCATGTCTGAGTTTTATAGTGG-3′,划线部分为BamH I酶切位点)和下游引物AKR-R(5′-CCCAAGCTTTCAACGGTTAACAGTACTCA-3′,划线部分为HindIII酶切位点)。以发状念珠藻总DNA 为模板,进行PCR 扩增。扩增条件为:94 ℃ 预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,35个循环,72 ℃ 10 min。目的片段经回收、检测并测序。
大肠杆菌(Escherichiacoli)DH5a感受态细胞、DNA Marker、Taq DNA 聚合酶、Protein MarkerIII、质粒小提试剂盒、琼脂糖凝胶回收试剂盒购自北京天根公司。pGEM-T Easy 载体、T4 DNA 连接酶购自美国Promaga 公司。限制性内切酶BamHI、HindIII购自美国Fermentas公司。引物合成及基因测序由上海生工生物工程公司完成。
1.2.2NfAKR基因的生物信息学分析 其他物种的 AKR 氨基酸序列均来自于NCBI(http://www.ncbi.nlm.nih.gov/)数据库,采用BLAST 进行序列比对。先用ClustalX2.1软件对序列进行多重比对,再用NJ法完成系统树的构建,并用MEGA5 对系统树进行测试和编辑,生成报告图形。使用ExPASy(http://www.expasy.org)网站相关软件完成蛋白质基本性质分析。通过SWISS-MODEL(http: //www.swissmodel. expasy.org/) 建立蛋白质空间结构模型。
1.2.3NfAKR基因qRT-PCR分析 以发状念珠藻RPL13基因为内参,进行qRT-PCR检测,分析NfGR基因的表达特性。NfAKR基因上下游引物分别为AKR-qF(5′-ATGTCTGAGTTTTATAGTG-3′)和AKR-qR(5′-GATACTGCTGATATGTA-3′)。RPL13基因上下游引物分别为RPL13-F(5′-TAGAGTTTGC CTGTATCAT-3′)和RPL13-R(5′-TCCGTGGTTTGTCATC-3′)。qRT-PCR扩增程序为:94 ℃预变性30 s;94 ℃变性5 s;50 ℃退火30 s;72 ℃延伸20 s,共45个循环。实验共设3个重复,利用2-ΔΔCt法计算目的基因相对表达量[10]。
2 结果与分析
2.1 NfAKR基因的开放阅读框(ORF)克隆
以发状念珠藻基因组DNA为模板,AKR-F 和AKR-R 为引物进行PCR扩增,经1.0%琼脂糖凝胶电泳检测,扩增到一条900 bp左右的特异条带(图1)。将回收的片段连接至pMD18-T载体, 转化大肠杆菌DH5α感受态细胞后进行菌落PCR鉴定。
回收NfAKR基因片段,连接到pGEM-T Easy载体并转化至DH5α感受态细胞,涂布、蓝白斑筛选,挑取阳性克隆转接后,37 ℃培养过夜。提质粒进行PCR和酶切验证,1%琼脂糖凝胶电泳检测目的条带,能够从质粒中扩增出900 bp左右的目的基因条带(图2),双酶切切出两条带,其中一条为900 bp左右的NfAKR基因条带(图3),与预期的扩增片段大小一致 。将阳性克隆送至上海生工生物技术有限公司测序,由测序结果可知,NfAKR基因的ORF长912 bp。
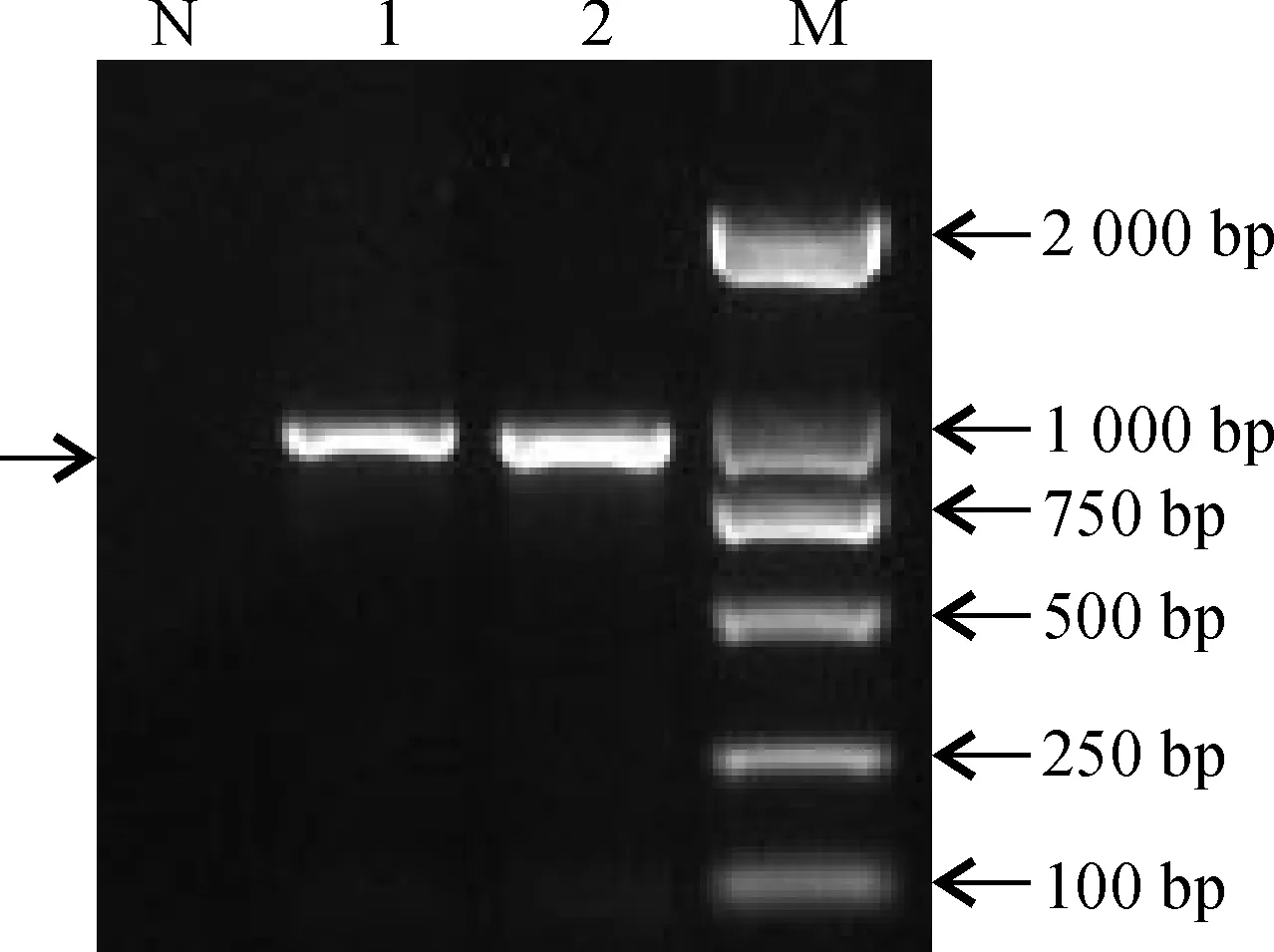
N.阴性对照;1~2. PCR产物;M. DL2000图1 NfAKR基因编码序列的克隆N. Negative control;1~2. PCR products;M. DL2000Fig.1 Cloning of the coding sequence of NfAKR
2.2 NfAKR基因编码蛋白的结构分析
氨基酸序列分析发现,NfAKR基因ORF可编码304个氨基酸残基,预测分子量为33.51 kD。NfAKR蛋白具有醛酮还原酶超家族(Aldo_ket_red_superfamliy)结构域(图4),此功能保守区的存在与醛酮还原酶的还原作用密切相关。
NfAKR基因编码蛋白是醛酮还原酶超基因家族中的一员,具有氧化还原活性。经检索发现,来源于侧生藻(Fisherallesp.)、弯曲单岐藻(Tolypothrixcampylonemoides)、单歧藻(Tolypothrixsp. PCC 7601)、聚球藻(Synechococcussp. PCC 7502)、发毛针藻(CrinaliumepipsammumPCC 9333)、单歧伪枝藻(ScytonematolypothrichoidesVB-61278)、微毛藻(Microchaetesp.PCC7113)和假鱼腥藻(PseudanabaenabicepsPCC 7429)等物种的AKR 蛋白与本研究克隆的NfAKR基因编码蛋白的相似性较高。用ClustalX2.1软件对这些物种的氨基酸序列进行比对,发现它们在保守位置具有25个活性位点,其中第32、34、57、102 位的Asp、Tyr、Lys 和His氨基酸残基为保守的具有催化活性的部位(图5)。
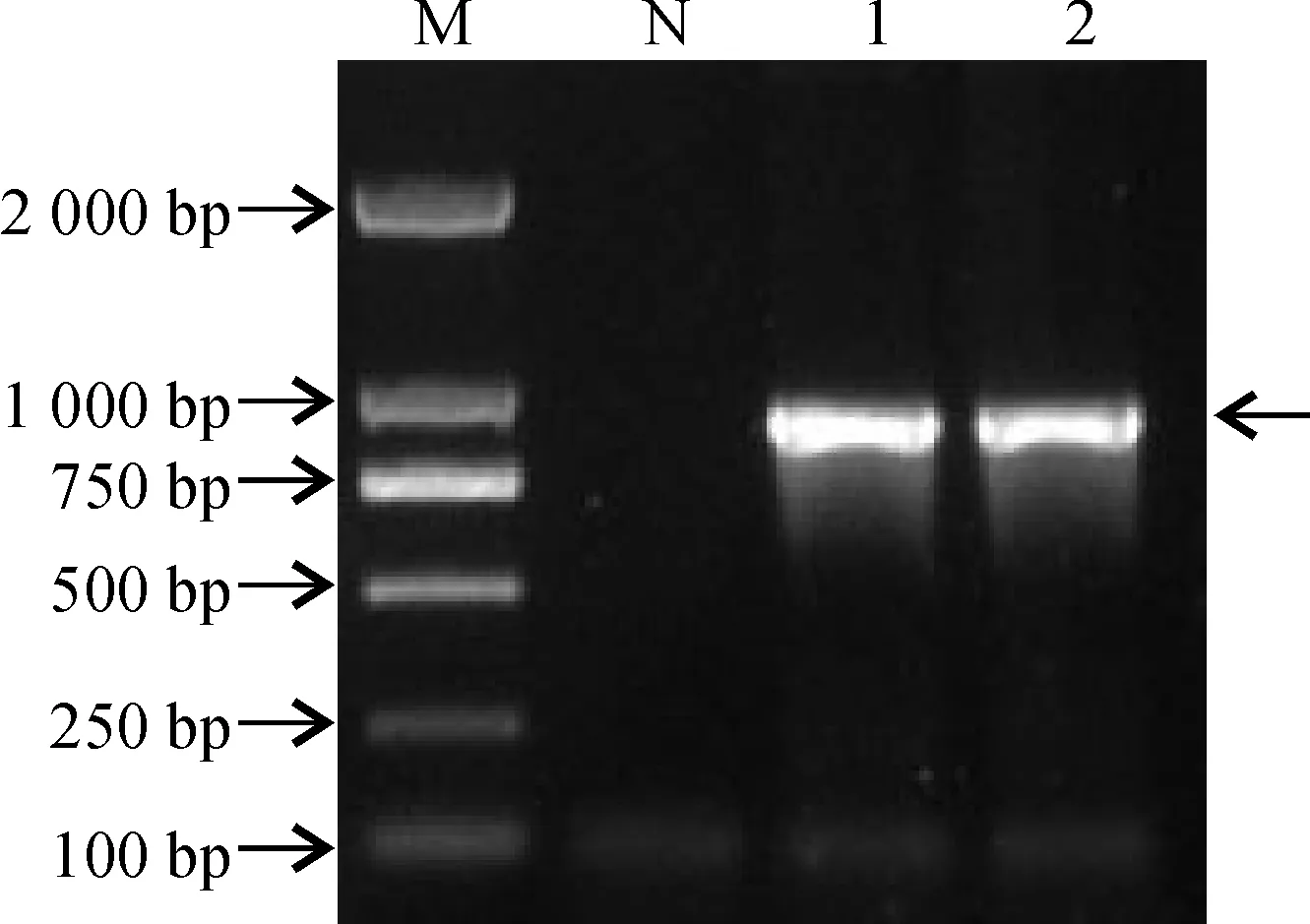
M. DL2000;N.阴性对照;1~2. PCR产物图2 NfAKR基因阳性质粒PCR验证M. DL2000; N. Negative control;1~2. PCR productsFig.2 PCR products from positive plasmid of NfAKR gene
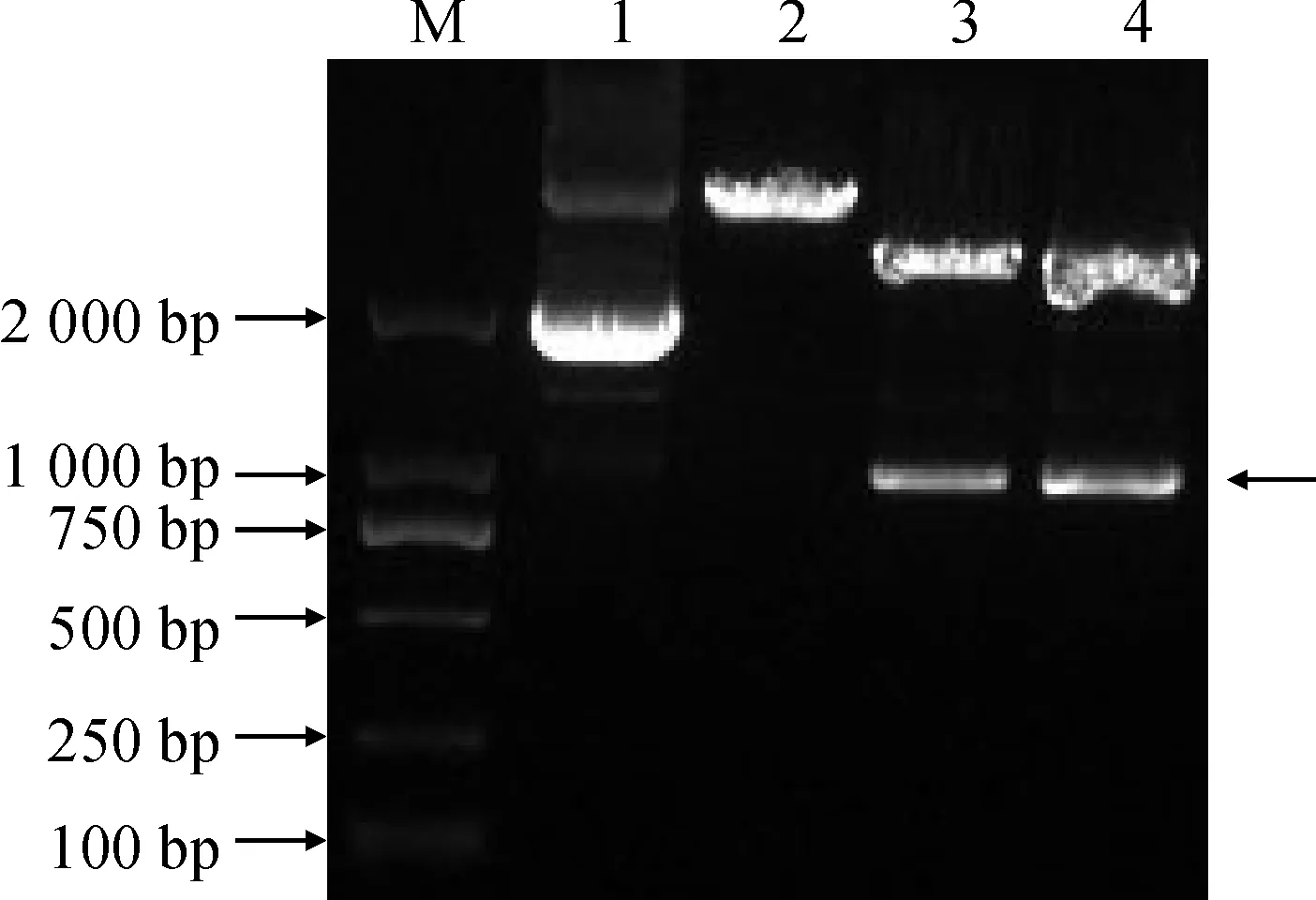
M. DL2000;N.阴性对照;1~2. PCR产物; M. DL2000;1. 未酶切质粒;2. HindⅢ 单酶切;3~4.BamHI/ HindⅢ双酶切图3 NfAKR基因阳性质粒酶切结果M. DL2000;1. Non-digested plasmid;2.HindⅢ digested plasmid;3~4. BamHI/ HindⅢdigested plasmidFig.3 Enzyme digestion of positive plasmid of NfAKR gene
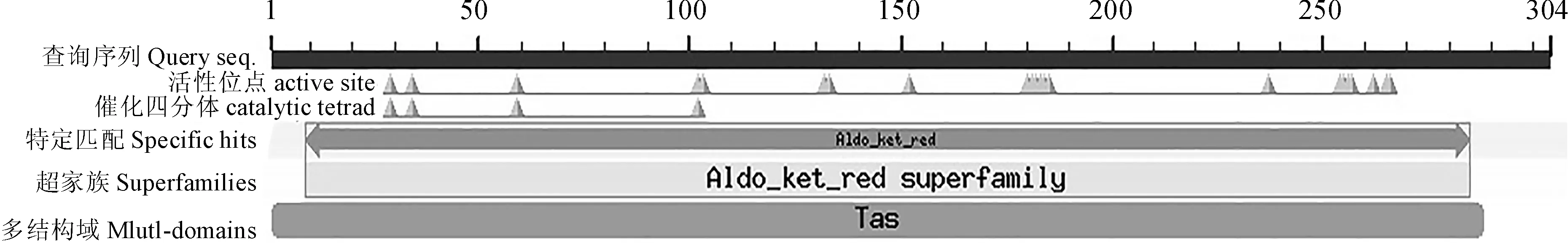
图4 NfAKR蛋白保守结构域Fig.4 Prediction of the conserved domain of NfAKR

黑色表示序列完全相同,灰色表示部分相同,下划线区为醛酮还原酶结构域序列;FspAKR、TspAKR、TcAKR、SspAKR、CeAKR、StAKR、PbAKR、MspAKR和NfAKR分别为侧生念珠藻、单歧藻、弯曲单岐藻、聚球藻、发毛针藻、单歧伪枝藻、假鱼腥藻、微毛藻和发状念珠藻AKR氨基酸序列图5 醛酮还原酶氨基酸序列的多重比对Black area donates the same sequence,gray area donates partial matching,the underline marks domain sequences in AKR proteins;FspAKR, TspAKR, TcAKR, SspAKR, CeAKR, StAKR, PbAKR, MspAKR and NfAKR represent amino acid sequence of AKR from Fischerella sp.PCC9605, Tolypothrix sp. PCC 7601, Tolypothrix campylonemoides, Synechococcus sp. PCC 7502, Crinalium epipsammum PCC 9333, Scytonema tolypothrichoides VB-61278, Pseudanabaena biceps PCC 7429,Microchaete sp.PCC7113 and Nostoc flaglliforme,respectivelyFig.5 Multiple alignment of the deduced amino acid sequences of AKRs
根据GOR4在线软件预测,NfAKR蛋白二级结构由45.07%的α-螺旋(alpha helix )、9.87% β-折叠(extended strand)和45.07% 无规则卷曲(random coil)组成。其中α-螺旋和无规则卷曲是NfAKR蛋白的主要组成部分,而β-折叠则散布在蛋白序列中。三维结构以印度蛇根草醛酮还原酶(PDB ID: 3v0u _A) 为模型,通过SWISS-MODEL 进行同源建模(图6)。整个蛋白由10个α-螺旋和11 条β-折叠组成。α-螺旋在外部,延伸主链在内部,中间形成1个疏水穴,构成酶的活性中心。
2.3 NfAKR基因的系统进化分析
为进一步分析发状念珠藻 NfAKR 蛋白与其他物种相关蛋白的进化关系,采用MEGA 5软件,对10种不同物种的AKR蛋白进行同源比对,构建进化树。结果显示,发状念珠藻与点形念珠藻(Nostocpunctiforme)、侧生藻(Fisherallesp.)、单岐藻(Tolypothrixcampylonemoides)、聚球藻(Synechococcussp.)和假鱼腥藻(Pseudomonasp.)聚为一支,与点形念珠藻亲缘关系最近。而蓝杆藻(Cyanothecesp.)金囊藻(Gloeocapsasp.)、单歧伪枝藻(Scytonematolypothrichoides)和微毛藻(Microchaetesp.)聚类为另外一支(图7)。

A. 二级结构预测; B. 利用SWISS-MODEL建立的三维结构图6 NfAKR蛋白的结构分析和建模A. Secondary structure prediction; B. Three-dimensional structure based on SWISS-MODELFig.6 Structural analysis and modeling of NfAKR

节点上的数值表示Bootstrap重复1 000次的置信度;标尺表示演化距离图7 NfAKR蛋白系统进化树分析Values at nodes show the confidence level of bootstrap replication 1 000;scaleplate represents the evolution distance of these algasFig.7 Phylogenetic analysis of NfAKR protein
2.4 PEG-6000胁迫下NfAKR基因表达
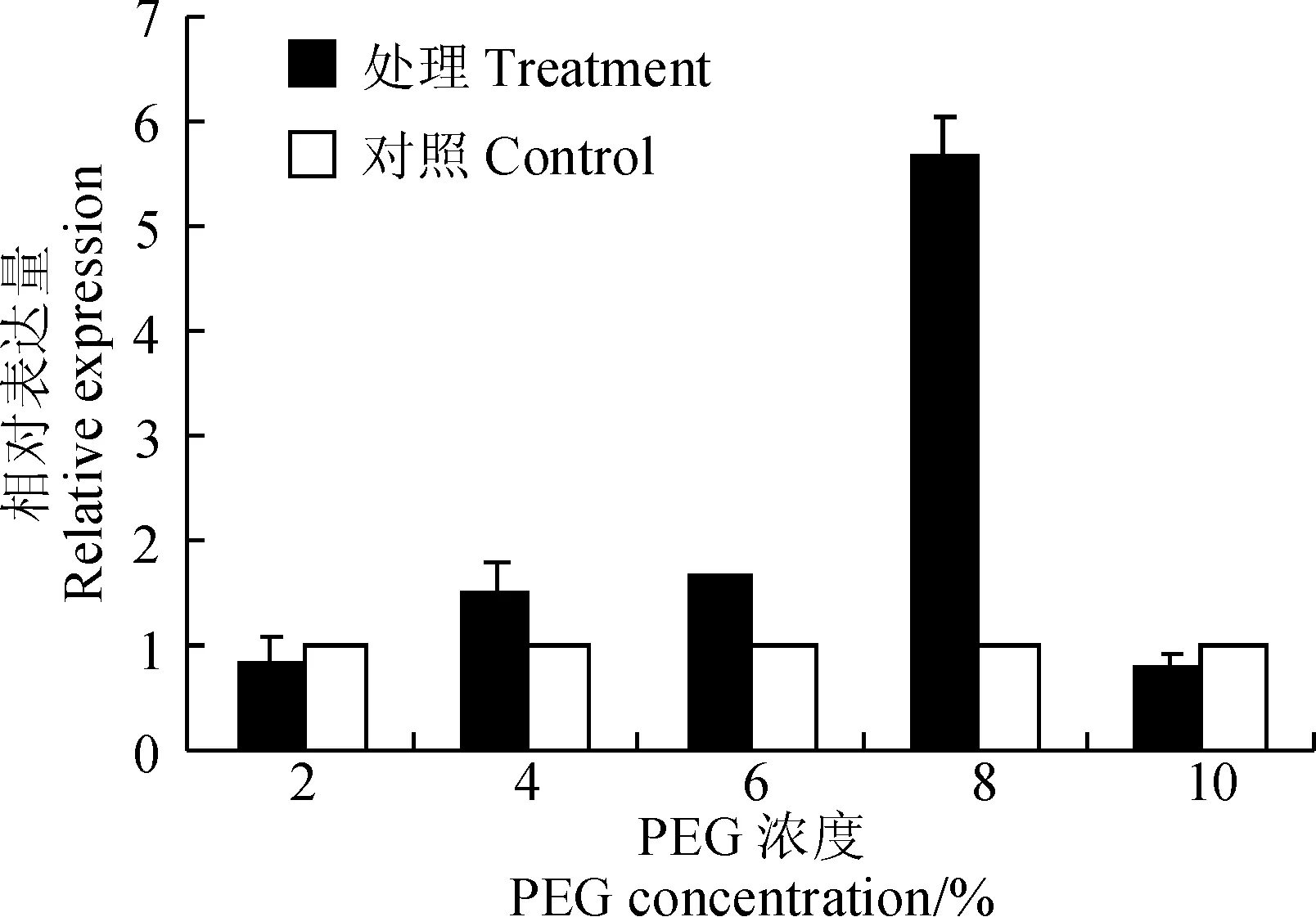
图8 PEG-6000胁迫下NfAKR基因的表达分析Fig.8 Expression analysis of NfAKR gene under PEG-6000 drought-stress
采用实时荧光定量RT-PCR技术分析了不同浓度PEG-6000模拟干旱处理下NfAKR的表达情况(图8)。在 PEG-6000胁迫处理下,发状念珠藻NfAKR基因随PEG-6000浓度的增加上调表达。在PEG-6000浓度为4% 时,NfAKR基因开始诱导表达,并持续上升。 PEG-6000浓度为8%时,基因的表达量出现峰值5.66。当PEG-6000浓度为10%时,NfAKR表达量下降。说明在高浓度PEG-6000胁迫下,细胞受到损伤严重,NfAKR基因的表达受到抑制。
3 讨 论
AKR是一类胞质蛋白,存在于原核及真核细胞中,大部分AKR家族成员都与细胞保护、肿瘤形成及诊断有关。AKR具有解毒功能,能够把有毒的醛或酮转变成醇,进而避免细胞受到醛、酮的毒害[11]。目前关于AKR的研究,大都集中在免疫及肿瘤方面。牛莹莹等[12]研究发现AKR1C3基因会抑制细胞的生长,损伤动物肝肾,可为癌症的诊断和治疗提供依据。同时也有研究发现,AKR2A在各种胁迫中起到调控胁迫蛋白的作用,当植物遭受盐胁迫和损伤时,AKR2A表达量呈现上升趋势[13]。这表明植物细胞中各细胞器能够协调抗胁迫防护的能力,在遭受非生物胁迫,如盐、氧化胁迫及损伤胁迫时。AKR可通过表达量的增加或活性的升高对缓解胁迫起积极作用。
本试验对分离到的发状念珠藻NfAKR基因编码氨基酸序列分析发现,该蛋白在保守位置有25个活性位点,这与醛酮还原酶超基因家族的成员特征相符[14-16]。在三维结构分析中发现,该蛋白由10个α-螺旋和11条β-折叠主链组成。α-螺旋在外部,β-折叠在内部,中间形成1 个疏水穴,形成酶的催化活性中心。通过进化分析发现,发状念珠藻与点形念珠藻、侧生藻、单岐藻等物种亲缘关系较高,从进化树中所处的位置看它们可能是从一个祖先分化而产生的多重分支。
发状念珠藻NfAKR基因受干旱胁迫诱导,随PEG-6000胁迫浓度增加,表达量增加并达到峰值。但随胁迫浓度继续增加,细胞相关组分受到干旱伤害,以致NfAKR基因表达量在高浓度PEG-6000模拟干旱胁迫时降低,这可能因为高浓度PEG-6000模拟干旱增加了细胞生长环境的干旱程度,细胞内成分因严重缺水而损伤,基因的表达呈下降趋势。这和本实验室研究的NfPrx[17]和NfGR基因受干旱胁迫时的表达特性一致。表明植物耐旱能力的形成是由多个基因协同参与形成的,耐逆性调节基因的上调表达在一定程度上提高了植物的耐逆能力。在抵御外界干旱环境过程中,NfAKR发挥一定作用。有关受逆境胁迫时, NfAKR与其他相关蛋白协同参与清除活性氧、参与跨膜运输和信号传导的具体的耐逆机制,需要进一步研究。
[1] 韩 刚, 党 青, 赵 忠. 干旱胁迫下沙生灌木花棒的抗氧化保护响应研究[J]. 西北植物学报, 2008, 28(5): 1 007-1 013.
HAN G, DANG Q, ZHAO Z. Response of antioxidation protection system ofHedysarumscopariumto drought stress[J].ActaBot.Boreali-OccidentaliaSinica, 2008, 28(5): 1 007-1 013.
[2] 张灿军, 冀天会, 等.小麦抗旱性鉴定方法及评价指标研究Ⅰ鉴定方法及评价指标[J]. 中国农学通报, 2007, 23(9): 226-230.
ZHANG C J, JI T H,etal. Study on resistance drought identify method and evaluation index of wheatⅠidentify method and evaluation index[J].ChineseAgriculturalScienceBulletin, 2007, 23(9): 226-230.
[3] NAOMI HM, KEN M,etal. Anti-oxidative stress system in cyanobacteria[J].BiologicalChemistry, 2005, 280(1): 840-846.
[4] 张显强, 李 超, 王世杰,等. 喀斯特石生穗枝赤齿藓抗氧化防御系统对干旱胁迫的响应[J]. 广西植物, 2015, 35(2):200-205.
ZHANG X Q, LI C, WANG S J,etal. Responses of antioxidant defense system ofErythrodoutiumjuluceumto drought stress in rocky desertification of karst areas[J].Guihaia, 2015, 35(2):200-205.
[5] SIMPSON PJ, TANTITADAPITAK C, REED AM,etal. Characterization of two novel aldo-keto reductases from Arabidopsis: expression patterns, broad substrate specificity, and an open active-site structure suggest a role in toxicant metabolism following stress[J].JournalofMolecularBiology, 2009, 392(2): 465-480.
[6] WANG WQ, LI L, HUANG S,etal. A secondary suppression subtractive hybridization method for isolation and identification of some salt-induced genes in soybean (GlycinemaxL. Merr)[J].AustralianJournalofCropScience, 2012, 6(1): 46-55.
[7] SUNKAR R, BARTELS D, KIRCH H H. Overexpression of a stress-inducible aldehyde dehydrogenase gene fromArabidopsisthalianain transgenic plants improves stress tolerance[J].ThePlantJournal, 2003, 35(4): 452-464.
[8] LIANG W Y, ZHOU Y W, WANG L X,etal. Ultrastructural, physiological and proteomic analysis ofNostocflagelliformein response to dehydration and rehydration[J].JournalofProteomics, 2012, 75:5 604-5 627.
[9] GAO X, YANGY W, CUI L J,etal. Preparation of desiccation-resistant aquatic-livingNostocflagelliforme(Cyanophyceae) for potential ecological application[J].MicrobialBiotechnology, 2015, (6):1 006-1 012.
[10] LIVAK KJ, SCHMITTGEN TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods, 2001, 25(4): 402-408.
[11] 李 丹, 张岐山, 初 阳. 表达醛酮还原酶AKR7A1 对巴豆醛致畸作用的影响[J]. 细胞与分子免疫学杂志, 2012, 28(10): 1 213 -1 215.
LI D, ZHANG Q S, CHU Y. Effect of AKR7A1 overexpression on crotonaldehyde-induced mutagenicity in V79-4 cells[J].ChineseJournalofCellularandMolecularImmunology, 2012, 28(10): 1 213-1 215.
[12] 牛莹莹,刘传志,李艳红.醛酮还原酶AKR1C3 基因的原核表达及其生物学活性[J].中国生物制品学杂志, 2015, 28(5): 461-467.
NIU Y Y, LIU C Z, LI Y H,etal. Prokaryotic expression and biological activity of aldehyde and ketone reductase AKR1C3[J].ChineseJournalofBiologicals, 2015, 28(5): 461-467.
[13] EUGENIA L, MARY S K, CAWAS E,etal. Expression profiling of ascorbic acid-related genes during tomato fruit development and ripening and in response to stress conditions[J].JournalofExperimentalBotany, 2009, 60: 663-678.
[14] HYNDMAN D, BAUMAN DR, HEREDIA VV,etal.The aldo-keto reductase superfamily homepage[J].Chemico-BiologicalInteractions,2003, 143/144: 621-631.
[15] MINDNICH RD, PENNING TM.Aldo-keto reductase(AKR) superfamily: genomics and annotation[J].HumanGenomics, 2009, 3(4): 362-370.
[16] PENNING TM,DRURY JE.Human aldo-keto reductases: function,gene regulation,and single nucleotide polymorphisms[J].ArchivesofBiochemistryandBiophysics,2007,464(2): 241-250.
[17] 岳思君, 周 娟, 郑 蕊,等.发状念珠藻过氧化物还原酶NfPrx基因的克隆与表达分析[J]. 植物生理学报2016, 52(8): 1 287-1 294.
YUE S J, ZHOU J, ZHENG R,etal.Cloning and expression analysis ofNfprxgene fromNostocflagelliforme[J].PlantPhysiologyJournal, 2016, 52(8): 1 287-1 294.
(编辑:宋亚珍)
Gene Cloning and Expression ofNfAKRfromNostocflagelliforme
YUE Sijun1, LI Zhixue2, FAN Hongli1, ZHOU Juan1, LIANG Wenyu1, ZHENG Rui1*
(1 College of Life Sciences, Ningxia University, Key Lab of Ministry of Education for Protection and Utilization of Special Biological Resources in Western China, Yinchuan 750021, China; 2 First Medium Occupation Technical School of Lhasa City,Lhasa 850000,China)
Full-length of open reading frame sequence encoding aldo-keto reductases was cloned fromNostocflagelliformecells with PCR. The gene was named asNfAKR. Sequence analysis showed that the complete open reading frame ofNfAKRwas 912 bp, which encoded 304 amino acids residues. The relative molecular mass of NfAKR was 33.51 kD, and its isoelectric point was 4.94. NfAKR protein had the aldo ket red superfamliy domain, and the three-dimension structure was composed by 10 α-helices and 11 β-sheets,among which there was a hydrophobic cavity as catalytic active site. Phylogenetic analysis showed that aldo-keto reductase fromN.flagelliformeandN.punctiformehad high similarity. Quantitative real-time PCR analysis showed that the expression ofNfAKRgene was up-regulated under drought stress of PEG-6000.When the concentration of PEG-6000 was 8%, the relative expression was 5.66, reaching the peak value. TheNfAKRexpression was upregulated, suggesting that aldo-keto reductase plays a certain role in the process of resisting drought stress inN.flagelliforme.
Nostocflagelliforme; aldo-keto reductase; gene cloning; drought stress; expression analysis
1000-4025(2016)12-2370-06
10.7606/j.issn.1000-4025.2016.12.2370
2016-07-11;修改稿收到日期:2016-10-10
国家自然科学基金(31360025,31360361,31360054);宁夏大学研究生创新项目(GIP201611)
岳思君(1972-),男,博士,副教授,硕士研究生导师,主要从事微生物学研究。E-mail: sijunyue@126.com
*通信作者:郑 蕊,博士,副教授,硕士研究生导师,主要从事植物生物技术研究。E-mail: xlzheng@126.com
Q785;Q786
A
