纳米氧化镍的制备及其氨分解制氢性能
2016-02-05邱书伟程群淑任铁真
邱书伟,程群淑,任铁真,2
(1. 巴音郭楞职业技术学院 石油化工学院,新疆 库尔勒 841000;2. 河北工业大学 化工学院,天津 300130)
纳米氧化镍的制备及其氨分解制氢性能
邱书伟1,程群淑1,任铁真1,2
(1. 巴音郭楞职业技术学院 石油化工学院,新疆 库尔勒 841000;2. 河北工业大学 化工学院,天津 300130)
以六水合硝酸镍和碳酸氢氨为原料、氨水为调节剂,采用水热沉淀法,在不同老化温度下制备了多孔纳米NiO材料;采用XRD、SEM、TEM和N2吸附-脱附等方法对催化剂进行了表征,并考察了催化剂在氨分解制氢反应中的性能。实验结果表明,在120 ℃老化温度下制备的NiO分散性良好,平均粒径10.8 nm、比表面积62.2 m2/g、孔体积0.112 cm3/g、孔径4.62 nm。在氨分解制氢反应中,120 ℃老化的NiO催化剂在700 ℃下的氢气产率为27.87 mmol/(g·min)、氨转化率为83.25%、计算得出的活化能为55.11 kJ /mol,具有良好的催化活性。多孔纳米NiO的合成过程易于操作,无需加入表面活性剂,对环境无污染。
水热沉淀法;纳米氧化镍催化剂;氨分解制氢
工业制氢的主要方法有电解水制氢、矿物燃料制氢和氨分解制氢。电解水制氢电耗较高,占总成本的80%;矿物燃料制氢在化工生产中应用较普遍,但产生的COx极易引起催化剂中毒和环境污染,成本也较大。氨不易燃烧、毒性较小,是一种清洁的高能量氢载体[1-3]。氨分解制氢技术由于成本低、设备操作简单、占地面积小、制氢纯度高、存储方便、无CO污染等优点[4-7],在新能源及环境保护等方面具有广阔的应用前景和较好的经济效益。在氨分解制氢技术中,催化剂起着至关重要的作用,目前研究较多的主要有铁系、钌系、镍系催化剂及各种复合催化剂,对氧化物催化剂的研究不多。Podila等[8]以Mg-X(X=Al,La,Ce)混合氧化物为催化剂,在500 ℃下氨转化率最高可达82.7%。Naoto等[9]以澳大利亚褐铁矿矿石(含90%(w)的α-FeOOH)为原料制得尺寸小于250 μm、比表面积为20 m2/g的催化剂,在750 ℃下氨转化率可达70%。Katsutoshi等[10]以Cs2O/Ru/Pr6O11为催化剂,在350 ℃下转化率达76%;以Ru/Cs2O/Pr6O11为催化剂,在350 ℃下转化率可达93%。Zhang等[11]制备了镍基复合催化剂Ce10-NiO-SiO2-350,在650 ℃下氨转化率为86.9%。单一氧化镍催化剂用于氨分解反应,因成本低、催化活性良好,日益引起人们的关注。综合目前的文献研究成果,氧化物催化剂用于氨分解反应的催化机理仍不完善,简化工艺操作和节省能源是未来发展的趋势。
本工作采用水热沉淀法,在不同老化温度下制备了多孔纳米NiO催化剂;采用XRD、SEM、TEM和N2吸附-脱附等方法对催化剂进行了表征,并通过氨分解制氢反应考察了催化剂的性能。
1 实验部分
1.1 催化剂的制备
称取2.4 g碳酸氢铵和4.4 g六水合硝酸镍分别溶于30 mL蒸馏水中,搅拌后混合,用25%(w)的氨水控制溶液pH=9~10,继续搅拌30~60 min,转入反应釜中,放入恒温干燥箱内老化2 h,得到固液混合物;取出过滤,用水和乙醇分别洗涤,在70 ℃的恒温干燥箱内干燥12 h,得到浅绿色前体;控制氮气流速20 mL/min,升温速率20 ℃/min,在马弗炉内400 ℃下焙烧2 h,得到黑色氧化镍粉体,记为t-NiO;其中,t为纳米NiO前体的老化温度,℃。
为了便于对比,选取一定浓度的六水合硝酸镍溶液与氨水在相同条件下反应,在120 ℃的恒温干燥箱内老化2 h,经过滤、洗涤、干燥后得到催化剂的前体,将前体置于在马弗炉内在400 ℃下焙烧2 h,得到黑色氧化镍粉体,记为NiO-H。
1.2 催化剂的表征
采用Bruker公司D8 Advance型X射线衍射仪分析催化剂的微观晶相,CuKα射线,波长0.154 1 nm,扫描速率3.5(°)/min,管电压40 kV,管电流40 mA,所得XRD谱图与JCPDS标准卡片相对应。采用日本电子公司JSM-6490LV型扫描电子显微镜进行SEM表征,试样经超声波分散在乙醇溶液里,然后滴加在碳膜覆盖的铜网上。采用FEI公司Tecnal G2 F20 200kV型透射电子显微镜进行TEM表征,电子束加速电压200 kV。采用Quantachrome Instruments公司NOVA2000e型比表面与孔隙度分析仪,在77 K液氮温度下,进行N2吸附-脱附实验,测试前试样在100 ℃下真空脱气24 h,采用BET法计算催化剂的比表面积、BJH法计算催化剂的孔分布和孔体积。
1.3 催化剂的活性评价
采用程序升温还原法测试催化剂对氨的分解作用,在0.1 MPa下,在内径为6 mm的石英反应器中进行氨分解反应。称取0.1 g催化剂放置在反应器的中心部分,在500 ℃下通氢气1 h,继续通入氢气自然冷却至300 ℃;以30 mL/min的流量通入氨气30 min;通过控温仪控制反应温度,温度低于550 ℃时,以50 ℃的间隔升温,高于550 ℃后以25 ℃间隔升温至700 ℃,稳定15 min后进行测量。采用山东鲁南瑞虹化工仪器有限公司SP-6800A6型气相色谱仪测定气体产物的组成,以N2作为载气,热导池的加热速率为10 ℃/min。氢气产率的计算见式(1)。
Y= (1.5XV/22.4)/m(1)
式中,Y表示氢气产率,mmol/(g·min);V表示氨的流量,mL/min;X表示氨的转化率,%;m表示催化剂的质量,g。
2 结果与讨论
2.1 催化剂的结构及形貌表征
不同老化温度下得到的NiO试样的XRD谱图见图1。

图1 不同老化温度下得到的NiO试样的XRD谱图Fig.1 XRD patterns of NiO aged at diferent temperature.t-NiO:NiO aged att℃ and calcinated in inert gas atmosphere;NiO-H:NiO aged at 120 ℃ and calcinated in O2atmosphere.
由图1可见,2θ=37.2°,43.2°,62.7°,76.5°,79.9°处出现较明显的NiO特征衍射峰,与标准图谱(JCPDS65-2901)对比,分别对应于(110),(200),(220),(311),(222)晶相,各衍射峰峰形完整且没有其他杂质峰;由于各谱峰较尖锐,表明其结晶度较高,产物为单一的立方晶系NiO。NiO-H试样的衍射峰峰形也很好地与NiO晶相相吻合。根据最高衍射峰((200)晶相),由Scherrer公式计算得到老化温度180,160,120 ℃下制得的NiO颗粒的平均粒径分别为11.7,12.6,10.8 nm。
不同老化温度下制得的NiO试样的N2吸附-脱附表征结果见图2和表1。由图2可见,试样均属于第Ⅳ类等温线,在相对压力0.42~0.50间出现一个回滞环,说明该方法制得的NiO试样的孔结构为介孔,且N2的吸附量较高,说明催化剂孔结构丰富;由孔分布可看出,不同老化温度下制得的NiO试样均在4.0~5.2 nm处获得孔径峰值。由表1可见,比表面积、孔体积、孔径随老化温度的升高呈增大趋势。老化温度的变化对孔体积和孔径的影响较小,对比表面积的影响较大。张帆等[12]以尿素为沉淀剂制得NiO,比表面积为134.4 m2/g、孔体积为0.35 cm3/g、孔径为4.42 nm。

图2 不同老化温度下制得的NiO试样的N2吸附-脱附等温线和孔分布曲线Fig.2 N2adsorption-desorption isotherms and pore size distribution curves of NiO aged at diferent temperature.▼ 120-NiO;● 160-NiO;■ 180-NiO
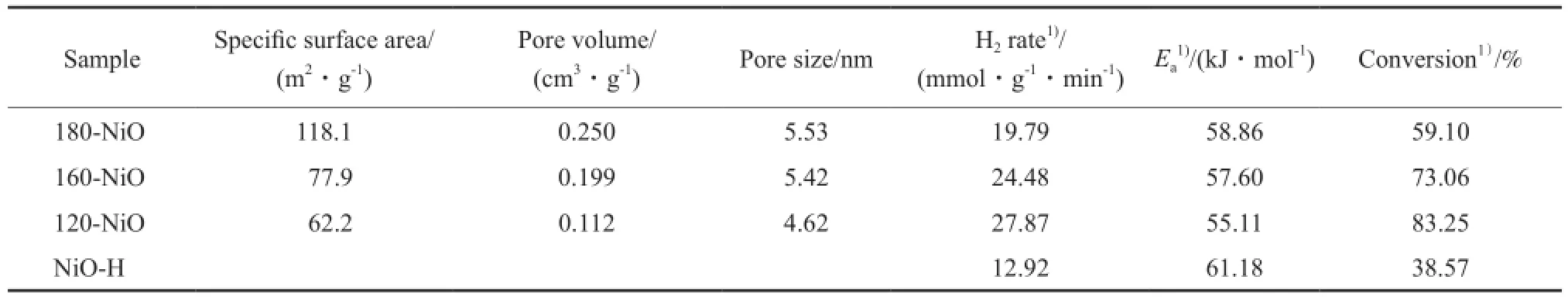
表1 试样的物理性质和催化活性参数Table 1 Properties and catalytic activities of the samples
Shi等[13]制得平均粒径约为7.5 nm、分散性好、纯度高的NiO粒子。吴东辉等[14]通过添加活性剂制得分布均匀、粒径为20 nm的NiO粒子,利用尿素缓释羟基的功能控制反应速度,不足之处在于实验的连续性较差,没有盐碱反应好控制,不适于连续生产,同时也不易于控制pH。
本实验通过控制水热温度,用氨水调节溶液的pH来控制产物具有规则有序的形貌;碳酸氢铵在水中发生水解,缓慢均匀地释放出构晶离子OH-,控制着晶粒的生长速度,避免了沉淀剂分布不均的现象,使实验易于控制[15]。实验机理如下:;3)400 ℃下焙烧,得到黑色纳米NiO粉体。
试样的SEM和TEM照片见图3和图4。由图3a~c能清晰地观察到三维网状结构,随老化温度的升高,NiO粒子逐渐增大。由图4a~c可见,180℃老化的NiO分散性好,晶粒大小为10~15 nm;160 ℃老化的NiO为片状,且分散性好,片层厚度为10~20 nm;120 ℃老化的NiO为颗粒状,分散性好,颗粒粒径约为10 nm,孔径为4.62 nm,上述结果均与XRD计算结果相符。由图3d和4d可见,NiO-H为片状,有一定的分散性,颗粒粒径分布不均匀,粒径较大,约为200 nm,这与制备过程中未加碳酸氢铵有关,未加碳酸氢铵导致生成前体的速度较快,发生了聚合现象。
催化剂的性能与其化学成分及制备方法有关。夏云生等[16]以硝酸镍和草酸为原料,采用固态热分解法制得高比表面积的蠕虫状介孔NiO纳米粒子,比表面积和孔体积分别达236 m2/g和0.42 cm3/g,在多相催化领域具有潜在的应用价值。吴春艳等[17]以金属硝酸盐为原料,通过高分子网络制备法,经450 ℃热处理,制备出粒径约为20 nm的纳米NiO超细粉。管小艳[18]运用配位均匀沉淀法以六水合硝酸镍、碳酸氢铵和氨水为原料制得纳米NiO,粒径控制在5~12 nm,通过加入表面活性剂解决团聚现象。邓建成等[19]采用同样的方法制备了长度100~200 nm、直径10~25 nm的针形纳米NiO以及粒径5~12 nm的颗粒状纳米NiO。与上述文献报道相比,本研究制备的纳米NiO颗粒均匀,分散良好。

图3 试样的SEM图片Fig.3 SEM images of the samples.(a) 180-NiO;(b) 160-NiO;(c) 120-NiO;(d) NiO-H

图4 试样的TEM图片Fig.4 TEM images of the samples.(a) 180-NiO;(b) 160-NiO;(c) 120-NiO;(d) NiO-H
2.2 催化剂的氨分解性能
2.2.1 NiO催化剂的氨转化率
不同反应温度下NiO催化剂的氨转化率见图5。常压下,反应温度控制在400~700 ℃。由图5可看出,随反应温度的升高,氨转化率增大,在较高的反应温度下,氨分解速率加快;老化温度高于120 ℃后,催化剂的活性降低。相同反应条件下,NiO-H的催化活性低,说明碳酸氢氨的加入是影响NiO活性的主要因素之一。由表1中不同NiO催化剂的氨转化率和氢气产率等参数可看出,老化温度是影响催化剂活性的重要因素,随老化温度的升高,催化剂的活性降低,氨转化率降低,120 ℃老化制得的NiO活性最高,700 ℃下氢气产率为27.87 mmol/(g·min)、氨转化率为83.25%。老化温度的升高导致催化剂颗粒聚集,形成的颗粒较大,影响了催化剂吸附-脱附气体的性能,导致催化剂活性降低,不利于氨的分解,这与XRD表征结果相符。
氨分解是一个受催化剂结构影响的反应[20-21],催化剂的孔体积、孔径及颗粒的分散度影响催化剂的活性。从SEM和TEM图片可看出,120 ℃老化的NiO颗粒分散度较好,颗粒粒径小且分布均匀,因而具有良好的催化性能。

图5 不同反应温度下NiO催化剂的氨转化率Fig.5 Conversion of ammonia over the NiO catalysts at diferent reaction temperature.Reaction conditions:0.1 MPa, NH3fowrate 30 mL /min.▼ NiO-H;▲ 120-NiO;■ 160-NiO;● 180-NiO
2.2.2 NiO催化剂的稳定性及温度与速率常数之间的关系
120-NiO催化剂的稳定性见图6。由图6可见,氨的转化速率在2 h内基本保持不变,在之后的7 h内呈下降趋势,但仍保有90%持有率,随后趋于稳定。这可能是由于在高温及氢气存在的情况下,既有氨分解反应也有氨合成反应发生[22-24]。
不同老化温度下制得的NiO催化剂在不同反应温度下的氨转化率也可通过动力学规律得到进一步验证,结合能斯特方程[25],得出NiO催化氨分解的温度与速率常数之间的关系(见图7),并计算出活化能(见表1)。为了避免物质转化平衡的影响,选取反应温度400~700 ℃。120,160,180 ℃下老化制备的NiO及NiO-H催化剂的活化能分别为55.11,57.60,58.86,61.18 kJ/mol。相比较而言,在120℃下老化制得的NiO催化剂活性最好,活化能最低,较其他金属氧化物或混合物催化剂,如7%(w)Ru-10%(w)Cs/石墨化碳纳米管(49.5 kJ/mol)催化剂[26]高,但较Ce10-NiO-SiO2-350[11]和15%-Ni/MRM[27]催化剂低,较其他氨分解催化剂[28-30]也低,这表明该催化剂用于氨分解制氢有明显的经济价值。
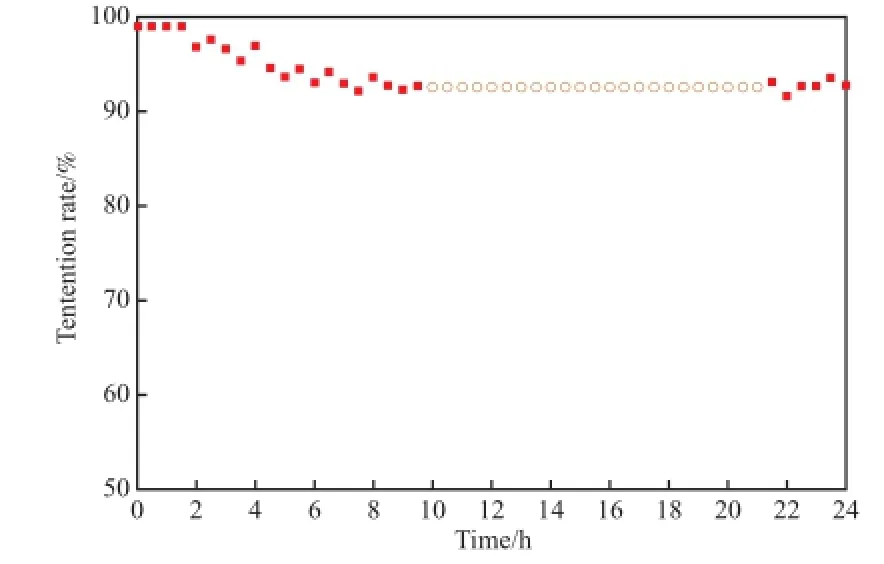
图6 700 ℃下120-NiO 催化剂的稳定性Fig.6 Stability of the 120-NiO catalyst at 700℃.Reaction conditions:0.1 MPa,NH3fowrate 30 mL/min.

图7 NiO催化剂催化氨分解的温度与反应速率常数之间的关系Fig.7 Temperature of the ammonia decomposition(T) over the NiO catalysts vs. the reaction rate constants(k).Reaction conditions:0.1 MPa,NH3fowrate 30 mL /min,400-700 ℃.● NiO-H;■ 120-NiO;▲ 160-NiO;▼ 180-NiO
3 结论
1)通过水热沉淀法制备了NiO前体,控制其老化温度,可得到比表面积和孔体积分别为62.2 m2/ g、0.112 m3/g的介孔纳米NiO材料。
2)氨分解制氢性能显示,纳米NiO具有良好的催化活性,120 ℃下老化制得的NiO催化剂活性最好,在700 ℃下氨转化率为83.25%、氢气产率为27.87 mmol/(g·min)、活化能为55.11 kJ /mol。
[1] Chein Reiyu,Chen Yencho,Chang Chiasan,et al. Numerical modeling of hydrogen production from ammonia decomposition for fuel cell applications[J]. Int J Hydrogen Energy,2010,35(2):589 - 597.
由本次研究结果可知,观察组心绞痛症状、心电图改善有效率均高于对照组。由此表明,对于冠心病心绞痛患者,给予麝香保心丸治疗,效果较好,具有较高的临床应用价值。麝香保心丸对心肌缺血具有改善作用,能够有效缓解心绞痛,降低血液黏稠度,从心电图上进行观察得知,患者心肌缺血症状得到显著好转,所以,麝香保心丸是一种用于治疗冠心病心绞痛的有效药。
[2] Lan R,Irvine J T S,Tao S. Ammonia and related chemicals aspotential indirect hydrogen storage materials[J]. Int J Hydrogen Energy,2012,37(2):1482 - 1494.
[3] Makepeace J W,Wood T J,Hunter H M A,et al. Ammonia decomposition catalysis using non-stoichiometric lithium imide[J]. Chem Sci,2015,6(7):3805 - 3815.
[4] Klerke A,Christensen C H,Nørskov J K,et al. Ammonia for hydrogen storage:Challenges and opportunities[J]. J Mater Chem,2008,18(20):2304 - 2310.
[5] Lu A H,Nitz J J,Comotti M,et al. Spatially and size selective synthesis of Fe-based nanoparticles on ordered mesoporous supports as highly active and stable catalysts for ammonia decomposition[J]. J Am Chem Soc,2010,132(40):14152 -14162.
[6] Li Yanxing,Yao Lianghong,Liu Shunqiang,et al. Cs-modifed iron nanoparticles encapsulated in microporous and mesoporous SiO2for COx-free H2production via ammonia decomposition[J]. Catal Today,2011,160(1):97 - 105.
[7] Christensen C H,Johannessen T,Sorensen R Z,et al. Towards an ammonia-mediated hydrogen economy[J]. Catal Today,2006,111(1/2):140 - 144.
[8] Podila S,Alhamed Y A,Al Zahrani A A,et al. Hydrogen production by ammonia decomposition using Co catalyst supported on Mg mixed oxide systems[J]. Int J Hydrogen Energy,2015,40(45):15411 - 15422.
[10] Katsutoshi Nagaoka,Takaaki Eboshi,Naruhiko Abe,et al. Infuence of basic dopants on the activity of Ru/Pr6O11for hydrogen production by ammonia decomposition[J]. Int J Hydrogen Energy,2014,39(35):20731 - 20735.
[11] Zhang Lingfeng,Li Min,Ren Tiezhen,et al. Ce-modified Ni nanoparticles encapsulated in SiO2for COx-free hydrogen production via ammonia decomposition[J]. Int J Hydrogen Energy,2015,40(6):2648 - 2656.
[12] 张帆,吴嵘,吴素芳. 水热沉淀法制备NiO-CaO/Al2O3复合催化剂及其在ReSER制氢中的应用[J]. 高校化学工程学报,2014,28(5):985 - 991.
[13] Shi Jinsong,Wu Erdong. A fast and facile synthesis of mesoporous nickel oxide[J]. Microporous Mesoporous Mater,2013,168(1):188 - 194.
[14] 吴东辉,章忠秀,汪信. 沉淀法制备氧化镍纳米晶[J]. 功能材料,2005,36(6):906 - 907.
[15] 谢红波. 沉淀法制备纳米氢氧化镍及其电化学性能研究[D]. 广州:广东工业大学,2008.
[16] 夏云生,刘婧婷,鲁奇林,等. 高比表面介孔氧化镍制备及表征[J]. 化学研究与应用,2015,27(2):127 - 132.
[17] 吴春艳,刘胜峰,吴飞,等. 纳米NiO超细粉的软化学合成[J]. 合肥工业大学学报:自然然科学版,2003,26(3):404 - 407.
[18] 管小艳. 配位均匀沉淀法合成纳米氢氧化镍及其应用研究[D]. 湘潭:湘潭大学,2006.
[19] 邓建成,邓晶晶,刘博,等. 不同纳米氧化镍的制备及其电容性研究[J]. 湘潭大学:自然科学学报,2009,31(1):47 - 52.
[20] Zhang Hui,Alhamed Yahia Abobakor,Kojima Yoshitsugu,et al. Structure and catalytic properties of Ni/MWCNTs and Ni/ AC catalysts for hydrogen production via ammonia decomposition[J]. Int J Hydrogen Energy,2014,39(1):277 - 287.
[21] Duan Xuezhi,Gang Qian,Zhou Xinggui,et al. Tuning the size and shape of Fe nanoparticles on carbon nanofibers for catalytic ammonia decomposition[J]. Appl Catal,B,2011,101(3/4):189 - 196.
[22] Li Xiukai,Ji Weijie,Zhao Jing,et al. Ammonia decomposition over Ru and Ni catalysts supported on fumed SiO2,MCM-41,and SBA-15[J]. J Catal,2005,236(2):181 -189.
[23] Ryo Watanabe,Yasushi Sekine,Masahiko Matsukata,et al. Efect of Ru loading and of Ru precursor in Ru/C catalysts for ammonia synthesis[J]. Appl Catal,A,2005,282(1/2):315 - 320.
[24] Shojaee Kambiz,Haynes B S,Montoya Alejandro. Molecular modelling of the decomposition of NH3over CoO(100)[J]. Mater Chem Phys,2015,156(6):141 - 149.
[25] Zhang Jian,Xu Hengyong,Li Wenzhao. Kinetic study of NH3decomposition over Ni nanoparticles:The role of La promoter,structure sensitivity and compensation efect[J]. Appl Catal,A,2005,296(2):257 - 267.
[26] Hill A K,Torrente-Murciano L. Low temperature H2production from ammonia using ruthenium-based catalysts:Synergetic effect of promoter and support[J]. Appl Catal,B,2015,172/173(2):129 - 135.
[27] Cao Jianliang,Yan Zhaoli,Deng Qingfang,et al. Homogeneous precipitation method preparation of modified red mud supported Ni mesoporous catalysts for ammonia decomposition[J]. Catal Sci Technol,2014,4(2):361 - 368.
[28] Chang Fei,Guo Jianping,Wu Guotao,et al. Covalent triazine-based framework as an efficient catalyst support for ammonia decomposition[J]. Royal Soc Chem,2015,5(5):3605 - 3610.
[29] Di Carlo A,Vecchione L,Del Prete Z. Ammonia decomposition over commercial Ru/Al2O3catalyst:An experimental evaluation at diferent operative pressures and temperatures[J]. Int J Hydrogen Energy,2014,39(2):808 - 814.
[30] Inokawa Hitoshi,Ichikawa Takayuki,Miyaoka Hiroki. Catalysis of nickel nanoparticles with high thermal stability for ammonia decomposition[J]. Appl Catal,A,2015,491(1):184 -188.
(编辑 王 萍)
Preparation and characterization of nano NiO catalysts for ammonia decomposition to hydrogen
Qiu Shuwei1,Cheng Qunshu1,Ren Tiezhen1,2
(1. Institute of Petrochemical Technology,Bayingol Vocational and Technology College,Korla Xinjiang 841000,China; 2. School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China)
Nano porous NiO catalysts were prepared from nickel nitrate hexahydrate and ammonium bicarbonate through hydrothermal precipitation with ammonia as conditioning agent at diferent aging temperature. The catalysts were characterized by means of XRD,SEM,TEM and N2adsorptiondesorption. The ammonia decomposition on the catalysts was investigated. It was showed that,the nano porous NiO particles prepared at the aging temperature of 120 ℃ had a narrow particle size distribution with the average particle size of 10.8 nm,specifc surface area of 62.2 m2/g,pore volume of 0.112 cm3/g and pore size of 4.62 nm. In the ammonia decomposition reaction over the NiO catalyst at 700 ℃,the ammonia conversion and the H2generation rate reached 83.25% and 27.87 mmol/(g· min),respectively. The calculated activation energy is 55.11 kJ/mol. This synthetic process is simple and environmentally friendly without the addition of surfactants .
hydrothermal precipitation;nano NiO catalyst;ammonia decomposition to hydrogen
1000 - 8144(2016)10 - 1180 - 06
TQ 426.8
A
10.3969/j.issn.1000-8144.2016.10.005
2016 - 03 - 17;[修改稿日期] 2016 - 07 - 07。
邱书伟(1971—),女,新疆维吾尔自治区库尔勒市人,硕士,副教授,电话 0996 - 6768690,电邮 qshwqq@163.com。
